Металлы с переменной валентностью
Обновлено: 02.07.2024
Соли металлов переменной валентности , таких как кобальт; [111, 112], меди [114] и других, ускоряют окисление. В присут ствии NaOH скорость реакции также возрастает [115], одна к в этом случае увеличение скорости наблюдается только в начал реакции, после чего процесс сильно замедляется; в продукта: окисления обычно отсутствует гидроперекись. [1]
Соли металлов переменной валентности широко применяются в качестве катализаторов окисления различных органических веществ. Благодаря тому, что перекисный радикал обладает свойствами окислителя, в определенных условиях становится возможным его взаимодействие с солью металла в состоянии низшей валентности. [2]
Соли металлов переменной валентности могут и ускорять и замедлять процесс окисления. Если в органическое соединение попадают соединения металлов переменной валентности ( Fe, Си, Сг и др.), то окисление развивается, как правило, ускоренно из-за распада гидропероксида на радикалы под действием катионов металлов. Этот процесс можно замедлить введением деактиваторов металлов, связывающих металлы в комплекс, неактивный по отношению к гидропероксиду. [3]
Соли металлов переменной валентности , являющиеся обычными катализаторами гомогенного окисления, разлагают гидропероксиды и поэтому не применяются, хотя в отдельных случаях их небольшие добавки ускоряют реакцию. Такой же эффект оказывает металлическая медь, если ее использовать в виде стружек или даже если она присутствует в материале аппаратуры. [5]
Хотя соли металлов переменной валентности и являются активными инициаторами окислительных радикальных превращений полимеров, они способны проявлять и некоторое ингибирующее действие. [6]
Растворы солей металлов переменной валентности , изоциана-тов и аминов в инертных растворителях могут применяться как модификаторы склеиваемых поверхностей. [7]
Активность соли металла переменной валентности зависит прежде всего от природы катиона. [8]
Окислы и соли металлов переменной валентности взаимодействуют с кислородом воздуха и превращают его в атомарный кислород, который окисляет целлюлозу и снижает ее молекулярный вес. Но так как эти соединения в щелочной среде практически нерастворимы, то действие их распределяется в массе набухшей целлюлозы неравномерно; окисление протекает интенсивно только вблизи окиси ( или гидроокиси) металла. [9]
Об участии солей металлов переменной валентности в низшем валентном состоянии в зарождении цепи прямых доказательств в литературе сравнительно мало. Установлена линейная зависимость между константами образования кислородсодержащих комплексов и легкостью окисления Со2 в Со3 в комплексах, не содержащих кислорода. [10]
Уменьшение количества соли металла переменной валентности устраняет опасность накопления производных этого металла в полимере. Следы таких соединений часто оказывают каталитическое влияние на процессы окислительной деструкции полимеров. [11]
Пассивирует действие солей металлов переменной валентности при процессах деструкции. Применение ограничивается из-за высокой растворимости в водных растворах кислот и летучести. [12]
Пассивирует действие солей металлов переменной валентности . [13]
В присутствии солей металлов переменной валентности скорость накопления гидроперекиси в начальный период значительно повышается, но максимальное количество гидроперекиси снижается. В настоящей работе поставлена задача более подробного изучения аутоокисления 1 1-дифенилэтана с точки зрения образования и накопления побочных продуктов и уяснения их влияния на ход процесса. [14]
Рассмотрена роль солей металлов переменной валентности в процессах распада перекисей и окислении углеводородов. [15]
Валентные возможности атомов
Атомы химических элементов и их валентные возможности
В начале прошлого века научная общественность была потрясена открытием британского физика Э. Резерфорда, который в своем докладе «Рассеяние α- и β-лучей и строение атома» говорил об открытии атомного ядра.
Данное открытие в тандеме со знанием о электронах сместило главенствующую тогда теорию о валентности, заменив ее на теорию о химических связях.
Однако понятие о валентности не пропало из научного мира. Вклад в научное развитие этого термина внесли Э. Франкленд, Ф. А. Кекуле и А. М. Бутлеров.
Согласно проделанным открытиям, атомы химических элементов состоят из:
- атомного ядра, включающего протоны p и нейтроны n;
- электронов e, находящихся на электронных уровнях.
Свойства атомов химических элементов определяет количество электронов на их последнем (внешнем) электронном слое. Именно они участвуют в образовании химических связей разных типов. Такие электроны называются валентными.
Валентность — количество связей образованных атомом при участии его валентных электронов.
Для определения валентных возможностей атома необходимо рассмотреть распределение электронов на его энергетических уровнях.
Только атомы образовавшие химические связи могут характеризоваться понятием валентности.
Валентность обозначают римскими цифрами от I до VIII.
Число валентных электронов или число общих электронных пар определяет валентность.
Понятие валентности сопряжено со степенью окисления и часто совпадает с его значением.
Молекула аммиака имеет формулу N H 3 . Атом азота связан химическими связями с тремя атомами водорода, эти связи одинарные, следовательно, валентность азота равна трем.
Чем определяются, какие факторы влияют
Валентность атома определяется количеством валентных электронов:
- атомы главных подгрупп содержат валентные электроны, расположенные на орбиталях s- и p-типов;
- атомы побочных подгрупп (помимо атомов лантаноидов и актиноидов), имеют валентные электроны на s-орбиталях внешнего и d-орбиталях предпоследнего слоев.
Атомы могут иметь основное и возбужденное состояние, из-за чего большинство химических элементов имеют переменную валентность.
В основном состоянии валентность зависит от неспаренных электронов последнего (иногда и предпоследнего) энергетических уровней. Обычное состояние фиксируется в Периодической таблице Менделеева.
Например, валентность углерода в основном состоянии равна II из-за двух неспаренных электронов на 2p-орбитали.
Дополнительная энергия, которую может получать атом, приводит его в возбужденное состояние. В таком случае уже соединенные электроны могут распариваться и участвовать в образовании новых связей. Валентность повышается.
Валентность углерода в возбужденном состоянии может повышаться до четырех, так как в таком состоянии у него распариваются 2s-электроны.
В формуле возбужденное состояние атома обозначается звездочкой.
Определение валентности элемента по электронно-графическим формулам
Для определения количества электронов на энергетических уровнях необходимо полагаться на номер и место химического элемента в Периодической системе Д. И. Менделеева.
Определив количество электронов, необходимо распределить их по свободным орбиталям в порядке заполнения по шкале энергии:
В одной ячейке или на одной орбитали могут располагаться либо 1 электрон, либо 2 электрона с противоположными спинами — разными направлениями вращения.
Орбитали разных уровней могу размещать в своих свободных ячейках разное количество электронов:
- s- орбиталь — 2 электрона;
- p- орбиталь — 6 электронов;
- d- орбиталь — 10 электронов;
- f- орбиталь — 14 электронов.
По количеству электронов, оставшихся неспаренными в ячейках, можно узнать валентность атомов химических элементов. Электронные формулы обычно записываются не полностью, а в кратком варианте, указывая только крайние электронные уровни каждого слоя.
Можно сформулировать следующие закономерности электронного строения атома:
- высшая валентность атома элемента соответствует номеру его группы;
- номер периода указывает на количество энергетических уровней;
- порядковый номер химического элемента — на количество его электронов.
Селен, углерод, фосфор, сера, азот, хлор и другие примеры
Рассмотрим заполнение электронных уровней на примерах.
Углерод С обладает номером 6 в Периодической системе химических элементов Д. И. Менделеева, соответственно, он обладает 6 электронами.
Они полностью заполняют уровни 1s / 2s и частично уровень 2р. В обычном состоянии углерод обладает валентностью II. Свободная орбиталь 2р подуровня позволяет орбитали 2s распариваться. Тогда валентность углерода может изменяться на IV.
Азот N обладает номером 7 в ПСХЭ Менделеева и 7 электронами.
Они полностью занимают уровни 1s / 2s и частично 2р. В обычном состоянии азот обладает валентностью III. Перейти в возбужденное состояние путем распаривания 2s-электронов атом не способен, так как относится ко второму периоду, а на втором энергетическом уровне больше нет свободных подуровней и орбиталей, способных принять распарившиеся электроны. Максимальная валентность азота равна IV (за счет образования связи, не только по обменному, но и по донорно-акцепторному механизму), валентность V — не достигается.
Особенностью азота является несоответствие его валентности номеру группы ПС. Азот не обладает валентностью равной V, однако обладает соответствующей степенью окисления +5. НЕсоответствие значений валентностей и степеней окисления атомов азота в некоторых его соединениях является еще одной особенностью этого элемента.
Кислород О обладает номером 8 в ПСХЭ Менделеева и 8 электронами. Возбужденного состояния у кислорода так же нет.
Электроны полностью занимают уровни 1s / 2s и частично 2р. Валентность кислорода равна II — постоянная валентность.
Фтор F обладает номером 9 в ПСХЭ Менделеева и 9 электронами. Они полностью занимают уровни 1s / 2s и частично 2р. Фтор обладает только валентностью I, которая не меняется.
Алюминий Al обладает номером 13 в ПСХЭ Менделеева и 13 электронами. Они полностью занимают уровни 1s / 2s, 2p / 3s и частично уровень 3р. Несмотря на электронную конфигурацию основного (стационарного) состояния атома, валентность I практически не встречается. У алюминия постоянная валентность III (из этого следует что энергия перехода в возбужденное состояние для этого элемента не высока и атомы алюминия всегда пребывают именно в возбужденном состояние).
Фосфор P обладает номером 15 в ПСХЭ Менделеева и 15 электронами.
Они полностью заполняют уровни 1s / 2s, 2p / 3s и частично уровень 3р. В обычном состоянии фосфор обладает валентностью III. Распаривание 3s электронов создает возбужденное состояние, в котором пять валентных электронов занимают 5 ячеек, и валентность в таком случае поднимается до V.
Сера S занимает 16 место в ПСХЭ Менделеева и обладает 16 электронами.
Они полностью занимают 1s / 2s, 2p / 3s и частично 3р. В обычном состоянии сера обладает валентностью II. Распаренные электроны могут занимать ячейки подуровня 3d, валентность поднимается до IV и VI.
Хлор Cl обладает номером 17 в ПСХЭ Менделеева и 17 электронами.
Они полностью занимают уровни 1s / 2s, 2p / 3s и частично 3р. В обычном состоянии валентность хлора равна I. В возбужденном состоянии хлор может повышать свою валентность до III, V или VII. Формально данный ХЭ может обладать валентностью IV и VI.
Селен Se обладает номер 34 в ПСХЭ Менделеева, соответственно, он обладает 34 электронами.
Они полностью заполняют уровни 1s / 2s, 2p / 3s, 3p / 4s, 3d, отдав 30 электронов. Еще 4 заполняют орбиталь 4р — (1 ячейка занята полностью, еще 2 содержат по одному электрону). Валентность селена в обычном состоянии равна II.
Однако селен относится к элементам с переменной валентностью, поэтому также может обладать значением валентности IV и VI.
Элементы, имеющие несколько значений валентности
Значение валентности зависит от состояния атома — обычного или возбужденного.
Не все атомы химических элементов могут переходить в возбужденное состояние. По этому признаку они делятся на химические элементы с переменной и постоянной валентностью.
Постоянная валентность наблюдается у щелочных, щелочноземельных металлов, водорода, кислорода, фтора и алюминия.
Все остальные химические элементы обладают переменной валентностью, обусловленными существованием как возбужденных, так и обычных (стационарных) состояний.
Что такое степень окисления
Степень окисления — условная величина электрического заряда атома, входящего в состав химического соединения. Расчет значений этой величины основывается на предположении, что при образовании химической связи происходит полная передача электрона от атома с меньшей электроотрицательностью к атому с большей электроотрицательностью. В результате таких представлений каждому атому можно приписать целочисленный электрический заряд. В неорганической химии степень окисления очень часто совпадает с валентностью.
Степень окисления зачастую не совпадает с реальным значением электрического заряда атома, (совпадение наблюдается только в случае ионных соединений). Она используется лишь для систематизации и классификации химических элементов. Степень окисления широко используется при составлении формул, международных названий элементов, объяснения их окислительно-восстановительных свойств.
Степень окисления указывается как заряд рядом с символом химического элемента, как правый верхний индекс. Сначала указывается знак заряда, затем число (в обозначение реального электрического заряда ионов наоборот). Она равна количеству электронов, которые атом отдает (тогда рядом со значением ставится +), либо присоединяет (тогда ставится знак -).
СО обозначается арабскими цифрами (валентность римскими).
В чем отличие валентности и степени окисления
Валентность и степень окисления не являются равнозначными понятиями, хоть их числовое значение может совпадать.
Валентность используется для определения числа химических связей атома, причем как полярных, так и неполярных.
Степень окисления используется для выражения значения электрического заряда, сосредоточенного на атоме.
Большая Энциклопедия Нефти и Газа
Металлы переменной валентности ( за исключением железа) оказывают незначительное влияние на окисление бутадиен-нит-рильного каучука [ 33, 37J, и медь в данном случае проявляет функции ингибитора процесса окисления. Это обстоятельство, а также ранее приведенные факты двойственного характера влияния меди на окисление полибутадиена [39] позволяют предположить, что возможен синтез стабилизаторов для синтетических каучуков, которые в своем составе содержат металлы переменной валентности. [1]
Металл переменной валентности теряет свою каталитическую активность, если его связать в прочный комплекс. Вещества, способные подавлять активность металлов, носят название деактиваторов. К деактиваторам металлов относятся соединения из класса шиффовых оснований, производные оксихннолина, салицилидены. Эти вещества применяются ь тех случаях, когда в ходе процесса окисляющаяся система находится в контакте с металлической поверхностью и, корродируя ее, образует солевые катализаторы. [2]
Металл переменной валентности , одновременно выполняющий функцию акцептора и донора электронов. [3]
Металлы переменной валентности оказывают сильное каталитическое действие на окисление каучуков и резин. Во многих случаях соединения Си, Fe, Co, Ni способствуют быстрому разрушению каучуков и резин. В особенности это относится к натуральному каучуку и резинам из него, для которых металлы переменной валентности являются ядами. [4]
Металлы переменной валентности ( Fe, Mn), окисляясь на аноде восстанавливаясь на катоде, вызывают саморазряд обоих электродов. [5]
Металлы переменной валентности , например железо, кобальт и марганец, являются катализаторами окислительной деструкции целлюлозы. Они повышают скорость процесса предсозревания алкалицеллюлозы, затрудняют его контроль и регулирование, ухудшают молекулярный состав алкалицеллюлозы. Влияние железа сказывается уже при его содержании 20 - 30 мг / кг целлюлозы, марганца 2 мг / кг. Железо, марганец и медь снижают также белизну полученного волокна. Алюминий, свинец и медь ингиби-руют окислительные процессы и, следовательно, тоже создают трудности при проведении процесса предсозревания. Кальций и магний образуют со многими веществами нерастворимые соединения, поэтому их присутствие сказывается в большинстве стадий производства вискозного волокна. Соли кальция затрудняют, в частности, фильтрацию вискозного раствора, вызывают закупорку фильер при прядении. Содержание кальция в вискозной целлюлозе для высокопрочного кордного волокна не должно превышать 50 - 100 мг / кг. Соединения кремния, в особенности силикаты, также ухудшают фильтрацию вискозы, причем вредное влияние становится заметным при содержании кремния более 50 мг / кг целлюлозы. Присутствие солей, являющихся сильными электролитами, отрицательно влияет на диэлектрические свойства целлюлозы, что имеет значение при использовании целлюлозы для производства, например, конденсаторной бумаги. [6]
Металлы переменной валентности впервые классифицированы Брилем и Индиктором [19] в зависимости от их способности катализировать передачу кислорода от гидроперекиси олефину. Лучшими катализаторами являются ацетилацетонаты хрома, ванадия и молибдена. [7]
Металлы переменной валентности обладают особенностями, отличающими их от других элементов. Ионы этих металлов могут вступать в окислительно-восстановительные реакции с другими частицами, передавая или принимая электрон. Это сопровождается изменением заряда иона и образованием свободного радикала. [8]
Металлы переменной валентности поступают в отбелку с целлюлозным волокном и водой. Собственно целлюлозная суспензия обладает хорошими катионообменными свойствами и имеет резко выраженное сродство к трехвалентным катионам ( Al Fe), меньшее сродство - к двухвалентным ( Мп, Си) и незначительное сродство - к щелочеземельным металлам. Присутствие в целлюлозной суспензии катионов металлов снижает белизну волокна, а также вызывает интенсивное разложение растворов пероксида водорода и, следовательно, перерасход белящих реагентов. Особенно опасно присутствие в массе ионов железа и марганца, поскольку их отрицательное влияние максимально проявляется в щелочной среде при рН 10 0 - 10 5, т.е. в условиях отбелки пероксидом водорода. [10]
Металлы переменной валентности реагируют с алкилперок-сидными радикалами только в состоянии низшей валентности. [11]
Такие металлы переменной валентности , как Си, Ni и другие, менее пригодны для указанной цели, так как продукты их окисления могут каталитически влиять на термическую деструкцию полимера. [12]
Соли металлов переменной валентности , таких как кобальт; [111, 112], меди [114] и других, ускоряют окисление. В присут ствии NaOH скорость реакции также возрастает [115], одна к в этом случае увеличение скорости наблюдается только в начал реакции, после чего процесс сильно замедляется; в продукта: окисления обычно отсутствует гидроперекись. [13]
Соли металлов переменной валентности широко применяются в качестве катализаторов окисления различных органических веществ. Благодаря тому, что перекисный радикал обладает свойствами окислителя, в определенных условиях становится возможным его взаимодействие с солью металла в состоянии низшей валентности. [14]
Соединения металлов переменной валентности обладают способностью каталитически ускорять окисление каучуков и резин. Особенную роль в этом процессе играет каталитический распад перекисей под влиянием иона металла. [2]
Соединения металлов переменной валентности , используемые в качестве компонентов каталитических композиций включают галогениды, оксигалогениды титана, циркония, ванадия, хрома и др. При смешении различных компонентов с углеводородными растворителями образуются растворимые или нерастворимые комплексные катализаторы. [3]
Добавление соединений металлов переменной валентности влияет на скорость окисления. [4]
Присутствие соединений металлов переменной валентности в каучуках регулярного строения ( изопреновых и бутадиеновых) также оказывает большое влияние на их стабильность. Если при содержании в каучуке 1 84 % золы индукционный период окисления 4 5 ч, то при уменьшении содержания золы до 0 22 % индукционный период увеличивается до 9 ч 45 мин. [5]
Из соединений металлов переменной валентности наиболее изучены и нашли практическое применение соединения на основе железа. Помимо описанных выше дитиокарбаматов и ацетилацето-ната, к ним относятся ферроцен и его производные, окись железа, коллоидные соединения железа и жирных кислот, а также различные комбинации этих соединений с другими веществами, в том числе и сенсибилизаторами. В последнем случае, будучи катализаторами окисления, они ускоряют окисление полимера в период действия сенсибилизатора, а после расходования последнего завершают деструкцию полимера. [7]
Ускоряющее действие соединений металлов переменной валентности на реакцию окисления обусловливается тем, что они повышают скорость образования свободных радикалов. Образующаяся надбензойная кислота окисляет двухвалентный кобальт в трехвалентный. Каждая реакция, протекающая с изменением валентности кобальта, сопровождается - образованием свободного радикала. [8]
Степень участия соединений металлов переменной валентности на стадии передачи цепи сильно варьирует в зависимости от полярных характеристик радикала Е, адденда и непредельного соединения. Если же редокс-инициатор, например FeCl3 или Fe ( CO) 5, взят в реакцию в концентрации 1 - 2 мол. [9]
Катализ окисления соединениями металлов переменной валентности связан с участием их в генерировании радикалов по окислительно-восстановительным реакциям. [10]
Известно, что соединения металлов переменной валентности в зависимости от валентного состояния могут присоединять или отдавать электроны при взаимодействиях с валентнонасыщенны-ми частицами. [11]
Катализаторы, например соединения металлов переменной валентности , могут оказывать влияние на любую из рассмотренных стадий процесса. [12]
В окисляющемся углеводороде соединения металлов переменной валентности реагируют не только с гидропероксидом, но и с другими соединениями, - в состоянии высшей валентности они окисляют спирты, кетоны, альдегиды. Подробно эти реакции изучены в водных растворах, где металл - окислитель находится в виде иона. [13]
Гидроперок-сиды легко разрушаются соединениями металлов переменной валентности , однако распад, как правило, протекает с образованием свободных радикалов; поэтому в присутствии кислорода эти катализаторы ускоряют окисление. Катализаторами гетеро-литического разложения ROOH являются кислоты Бренстеда. Гидропероксид кумила, в частности, распадается под действием кислоты на фенол и ацетон. [14]
Когда в углеводород попадают соединения металлов переменной валентности ( Си, Fe, Cr, Со и др.), они катализируют распад гидроперокси-да на радикалы и таким образом ускоряют окисление. Катализированное окисление удается замедлить, введя комплексообра-зователь-он образует с ионом металла комплекс, каталитически неактивный по отношению к гидропероксиду. Такими дезак-тиваторами металлов являются диамины, гидроксикислоты и другие бифункциональные соединения, образующие с металлами прочные комплексы. [15]
Урок 6. Валентность
В уроке 6 «Валентность» из курса «Химия для чайников» дадим определение валентности, научимся ее определять; рассмотрим элементы с постоянной и переменной валентностью, кроме того научимся составлять химические формулы по валентности. Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также выяснили различия химических формул веществ молекулярного и немолекулярного строения.

Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения?
Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:
Нетрудно заметить, что атом хлора связан с одним атомом водорода, атом кислорода — с двумя, атом азота — с тремя, а атом углерода — с четырьмя атомами водорода. В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами. Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Валентность — численная характеристика способности атомов данного элемента соединяться с другими атомами.
Поскольку один атом водорода может соединиться только с одним атомом другого элемента, валентность атома водорода принята равной единице. Иначе говорят, что атом водорода обладает одной единицей валентности, т. е. он одновалентен.
Валентность атома какого-либо другого элемента равна числу соединившихся с ним атомов водорода. Поэтому в молекуле HCl у атома хлора валентность равна единице, а в молекуле H2O у атома кислорода валентность равна двум. По той же причине в молекуле NH3 валентность атома азота равна трем, а в молекуле CH4 валентность атома углерода равна четырем. Если условно обозначить единицу валентности черточкой |, вышесказанное можно изобразить схематически:
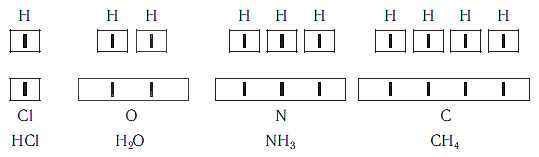
Следовательно, валентность атома любого элемента есть число, которое показывает, со сколькими атомами одновалентного элемента связан данный атом в химическом соединении.
Численные значения валентности обозначают римскими цифрами над символами химических элементов:
Определение валентности
Однако водород образует соединения далеко не со всеми элементами, а вот кислородные соединения есть почти у всех элементов. И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
Чтобы это сделать, необходимо соблюдать простое правило: в химической формуле вещества суммарные числа единиц валентности атомов каждого элемента должны быть одинаковыми.
Так, в молекуле воды H2O общее число единиц валентности двух атомов водорода равно произведению валентности одного атома на соответствующий числовой индекс в формуле:
Так же определяют число единиц валентности атома кислорода:
По величине валентности атомов одного элемента можно определить валентность атомов другого элемента. Например, определим валентность атома углерода в молекуле углекислого газа СО2:
Согласно вышеприведенному правилу х ·1 = II · 2 , откуда х = IV .
Существует и другое соединение углерода с кислородом — угарный газ СО, в молекуле которого атом углерода соединен только с одним атомом кислорода:
В этом веществе валентность углерода равна II , так как х ·1 = II · 1 , откуда х = II :
Постоянная и переменная валентность
Как видим, углерод соединяется с разным числом атомов кислорода, т. е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
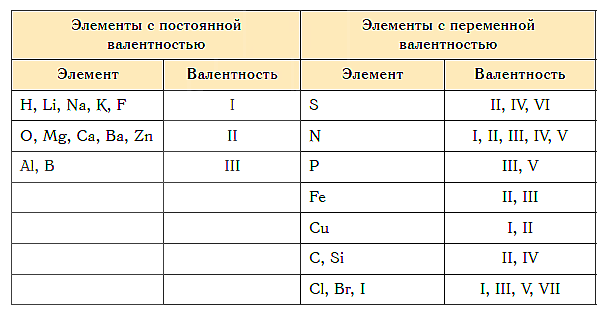
Составление химических формул по валентности
Зная валентность элементов, можно составлять формулы их бинарных соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков.

Еще один пример. Составим формулу соединения кремния с азотом, если валентность кремния равна IV , а азота — III .
Записываем рядом символы элементов в следующем виде:
Затем находим НОК валентностей обоих элементов. Оно равно 12 ( IV·III ).
Определяем индексы каждого элемента:
Записываем формулу соединения: Si3N4.
В дальнейшем при составлении формул веществ не обязательно указывать цифрами значения валентностей, а необходимые несложные вычисления можно выполнять в уме.
Краткие выводы урока:
- Численной характеристикой способности атомов данного элемента соединяться с другими атомами является валентность.
- Валентность водорода постоянна и равна единице. Валентность кислорода также постоянна и равна двум.
- Валентность большинства остальных элементов не является постоянной. Ее можно определить по формулам их бинарных соединений с водородом или кислородом.
Надеюсь урок 6 «Валентность» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Читайте также:
