Металлы светлое тело которое ковать можно
Обновлено: 06.05.2024
Презентация на тему: " Материаловедение. Металлы «Светлые тела, которые ковать можно» М.Ломоносов Черные имеют темно-серый цвет, большую плотность (кроме щелочноземельных), высокую." — Транскрипт:
1 Материаловедение. Металлы «Светлые тела, которые ковать можно» М.Ломоносов Черные имеют темно-серый цвет, большую плотность (кроме щелочноземельных), высокую температуру плавления, относительно высокую твердость
2 Материаловедение. Металлы Цветные имеют чаще всего характерную окраску: красную, желтую, белую, обладают большой пластичностью, малой твердостью, относительно низкой температурой плавления.
3 Материаловедение. Металлы Сплавы- вещества, получаемые сплавлением двух или более элементов. 1. Железоуглеродистые сплавы – сталь и чугун. Сталь, если в сплаве менее 2% углерода, чугун, если в сплаве более 2% углерода. 2. Углеродистые стали общего назначения выпускают в виде проката- прутки разного сечения, балки, листы, трубы. Нагартованная сталь- проволока и другие виды тонких сечений. 4. Автомобильная сталь- основной материал машиностроения.
4 Материаловедение. Металлы Легированные стали и сплавы: Конструкционная Инструментальная Высокопрочная Арматурная Пружинная Шарико-подшибниковая Жаростойкая и жаропрочная Коррозийностойкая Кислотостойкая Криогенные стали и сплавы Титан и его сплавы.
5 Материаловедение. Металлы Цветные металлы: Легкие= алюминий, медь, латунь. цинк Благородные- серебро, золото, металлы платиновой группы Легкоплавкие- цинк, ртуть, олово, свинец, висмут, сурьма
6 Природные каменные материалы Делят на камни и сыпучие материалы Камни- каменные породы. Залегающие в виде слоев, толщ или массивов, прорезанных системой естественных трещин Сыпучие материалы- рыхлые или слабоуплотненные скопления каменного материала
7 Природные каменные материалы Изверженные породы- глубинные (породы группы гранитов), излившиеся (породы группы базальтов), обломочные спекшиеся (вулканические туфы), обломочные рыхлые (пемзы, вулканические шлаки, пеплы и др.) Осадочные породы- химические осадки (гипс, доломит), обломочные сцементированные (конгломерат, песчаник), обломочные рыхлые (пески, песчано-гравийные материалы) Метаморфические породы- мраморы, кварциты
8 Природные каменные материалы Обработка поверхности камня: Распиливание блоков Фрезерование Профилирование Фактурная отделка
9 Искусственные каменные материалы Каменное литье – расплав при температуре ºС горных пород (главным образом базальта и диабаза) с последующей тепловой обработкой разлитого по формам расплава. Темное литье Светлое литье
10 Искусственные каменные материалы Эти материалы отличает: Высокая химическая стойкость Долговечность Атмосферостойкость Прочность Низкая истираемость Разнообразие расцветок
11 Изделия из стекла Стекло листовое – основная продукция стекольных заводов Стекло оконное – прозрачное неполированное толщиной от 2 до 6 мм Выпускают 3 сорта
12 Изделия из стекла Стекло полированное получают путем специальной обработки (шлифовки и полировки) листового стекла. Стекло витринное – неполированное и полированное применяют для остекления больших проемов. Армированное стекло – в процессе проката запрессовывается металлическая сетка из проволоки Д0,4-0,5 мм.
13 Изделия из стекла Закаленное стекло: Сталинит – плоское полированное или неполированное стекло обладающее высокой механической и термической прочностью, безопасен (дает осколки с нерезующими краями), не допускает резки, сверления и другой механической обработки.
14 Изделия из стекла Стемалит – закаленное неполированное стекло Д=6мм покрыто специальной эмалевой краской. Теплопоглощающее стекло зеленовато- голубоватого цвета уменьшает пропускание видимой части спектра, особенно инфракрасных лучей.
15 Изделия из стекла Контрастные стекла нейтрально-серого цвета ослабляет светопропускание видимой части спектра. При поглощении инфракрасных лучей нагревается, поэтому в конструкции находится в свободном состоянии.
16 Изделия из стекла Стекла с пленочными покрытиями: Теплозащитное наносят на стекло прозрачную пленку от серо-дымчатого до сине-фиолетового цвета. Теплоотражательное стекло снижает теплопотери, защищает от тепловой радиации. Получают путем нанесения пленки.
17 Изделия из стекла Узорчатое стекло – в процессе прокатки наносят рельефный рисунок Матовое, матово-узорчатое, «мороз» - оконное стекло подвергают пескоструйной обработке Волнистое стекло – прокатное стекло с волнистым профилем, армированное или неармированное
18 Изделия из стекла Цветное плоское стекло окрашено в разные цвета (кобальт – синий, окись марганца – фиолетовый, окись хрома – зеленый) Увиолевое стекло – высокопрозрачное, применяют в детских яслях, садах, лечебных учреждениях, оранжереях. Но со временем стареет, приобретает фиолетовую или желтую окраску
19 Изделия из стекла Рифленное стекло – в процессе вытягивания наносят рифление параллельно друг другу. Декоративный эффект, но ухудшает видимость. Для дверей и перегородок Цветной триплекс – два бесцветных оконных стекла, склеенных между собой цветной органической пленкой. Безопасно при разрушении
20 Изделия из стекла Призматическое стекло – с одной стороны гладкое, с другой – рифленное в виде призм Солнцезащитное стекло – на горячее стекло наносят соли различных металлов. В условиях заполярья стекло не замерзает Облицовочное стекло – марблит, плиткт эмалированные, коврово-мозаичные, смальта
21 Материаловедение. Пластмассы. Физические свойства разнообразны: жесткие, упругие, гибкие, кожеподобные, каучуковые Физические свойства разнообразны: жесткие, упругие, гибкие, кожеподобные, каучуковые Малая плотность Малая плотность Высокая стойкость к воде и многим химическим реактивам Высокая стойкость к воде и многим химическим реактивам Стойкость к коррозии Стойкость к коррозии Отличные диэлектрики Отличные диэлектрики
22 Материаловедение. Пластмассы Недостатки: Недостатки: Под действием кислорода воздуха, влаги, УФ- лучей пластмассы стареют. Снижается эластичность, повышается жесткость, хрупкость, водопроницаемость, появляются трещины Под действием кислорода воздуха, влаги, УФ- лучей пластмассы стареют. Снижается эластичность, повышается жесткость, хрупкость, водопроницаемость, появляются трещины Многие пластики теплостойки лишь до 100º Многие пластики теплостойки лишь до 100º Повышенная горючесть Повышенная горючесть Большой коэффициент термического расширения Большой коэффициент термического расширения Сильная электризуемость Сильная электризуемость
Материаловедение. Металлы «Светлые тела, которые ковать можно» М.Ломоносов Черные имеют темно-серый цвет, большую плотность (кроме щелочноземельных), высокую. - презентация
Отгадайте фамилию русского ученого, который сказал: «Металлом называется светлое тело, которое ковать можно». 1.Самый тугоплавкий. 2.Самый распространенный. - презентация
Презентация на тему: " Отгадайте фамилию русского ученого, который сказал: «Металлом называется светлое тело, которое ковать можно». 1.Самый тугоплавкий. 2.Самый распространенный." — Транскрипт:
2 Отгадайте фамилию русского ученого, который сказал: «Металлом называется светлое тело, которое ковать можно». 1.Самый тугоплавкий. 2.Самый распространенный на земле. 3.Самый легкий. 4.Самый электропроводный. 5.Самый твердый. 6.Самый пластичный. 7.Самый легкоплавкий. 8.Самый тяжелый. 9.Самый космический. ЛОМОНОСОВ AuOs CrHgLiWFeAlAg
3 Дать характеристику элементам IA группы по их положению в периодической системе химических элементов. На основе строения их атомов рассмотреть физические и химические свойства щелочных металлов. Указать области применения щелочных металлов
6 Li Na K Rb Cs Fr [223] 2s 1 3s 1 4s 1 5s 1 6s 1 7s 1 )) ))) )))) ))))) )))))) ))))))) Элемент АrАr Валентные электроны Число энергетических уровней Металлические свойства Восстановительные свойства R атома
7 каменная Глауберовасильвиниткарналлит NaCl –поваренная (каменная) соль Na 2 SO 4 10H 2 O – глауберова соль KCl NaCl – сильвинит KCl MgCl 2 · 6H 2 O – карналлит Na + Cl - NaCl Na + + Cl - 2NaCl 2Na + Cl 2
8 Вещества серебристо-белого цвета Электропроводны и теплопроводны Легкоплавкие. пластичные Li Na K Rb Cs t пл = 98 t пл = 98 t пл = 181 t пл = 181 t пл = 64 t пл = 28 t пл = 39
9 Реагируют с простыми веществами (с неметаллами) Реагируют со сложными веществами Почему щелочные металлы не используют для реакции с растворами кислот и солей? Li K Катионы щелочных металлов окрашивают пламя спиртовки Na РЯД АКТИВНОСТИ МЕТАЛЛОВ / ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H) Bi Cu Hg Ag Pt Au Li + O 2 Li 2 O Na + O 2 Na 2 O 2 2 Li + N 2 Li 3 N Li + H 2 LiH Li + H 2 O LiOH + H 2 Na + Na 2 O 2 Na 2 O 2 2 Li + Cl 2 LiCl2 2
10 Сколько воды и хлорида натрия нужно взять для приготовления физиологического раствора массой 0,5 кг? 4,5г соли 495,5 г воды Смесь хлорида и гидрокарбоната натрия массой 15 г обработали уксусной кислотой, при этом выделилось 2,8 л (н.у.) газа. Определите массовые доли в процентах компонентов смеси. 70% NaHCO 3 30% NaCl Хлорид калия - очень ценное минеральное удобрение. Рассчитайте массовую долю калия (%) в этом веществе. 52% Тривиальные названия солей: Поваренная соль ответ Раствор хлорида натрия (0,9%) применяется в медицине. Такой раствор называется физиологическим ответ Питьевая сода применяется в кулинарии, для выпечки кондитерских изделий. Хлорид натрия - как добавка к пище ответ Калийные удобрения играю важную роль в жизни растений. NaCl Кристалли- ческая сода Na 2 CO 3 *10H 2 O Питьевая сода NaHCO 3 поташ K 2 CO 3 Калийная селитра KNO 3 Глауберова соль Na 2 SO 4 *10H 2 O
11 Проверь себя: Вычеркните неверное суждение о щелочных металлах: Вычеркните неверное суждение о щелочных металлах: 1. Число электронов на внешнем энергетическом уровне щелочных металлов равно В реакциях щелочные металлы являются окислителями и восстановителями. 3. При взаимодействии натрия с кислородом образуется пероксид натрия 4. Щелочные металлы – это металлы IA группы Периодической системы химических элементов. 5. Щелочные металлы получают электролизом расплавов их солей. 6. Щелочные металлы не взаимодействуют с водой. 7. Качественной реакцией на ионы щелочных металлов является их взаимодействие с кислородом. 8. При переходе от лития к калию уменьшается радиус атома
12 1.§ Выполнить цепочку химических превращений: Na Na 2 O 2 Na 2 O Na 2 CO 3 NaOH NaCl
Урок 8. Общие свойства металлов

Известно, что все простые вещества условно можно разделить на простые вещества-металлы и простые вещества-неметаллы.
МЕТАЛЛЫ, по определению М. В. Ломоносова — это «светлые тела, которые ковать можно». Обычно это ковкие блестящие материалы, обладающие высокой тепло- и электропроводностью. Эти физические и многие химические свойства металлов связаны со способностью их атомов ОТДАВАТЬ электроны.
НЕМЕТАЛЛЫ, напротив, способны ПРИСОЕДИНЯТЬ электроны в химических процессах. Большинство неметаллов проявляют противоположные металлам свойства: не блестят, не проводят электрический ток, не куются. Являясь противоположными по свойствам, металлы и неметаллы легко реагируют друг с другом.
Эта часть Самоучителя посвящена краткому освещению свойств металлов и неметаллов. Описывая свойства элементов, желательно придерживаться следующей логической схемы:
1. Вначале описать строение атома (указать распределение валентных электронов), сделать вывод о принадлежности данного элемента к металлам или неметаллам, определить его валентные состояния (степени окисления) — см. урок 3;
2. Затем описать свойства простого вещества, составив уравнения реакций
- с кислородом;
- с водородом;
- с металлами (для неметаллов) или с неметаллами (для металлов);
- с водой;
- с кислотами или со щелочами (там, где это возможно);
- с растворами солей;
3. Затем нужно описать свойства важнейших соединений (водородных соединений, оксидов, гидроксидов, солей). При этом вначале следует определить характер (кислотный или основной) данного соединения, а затем, вспомнив свойства соединений этого класса, составить необходимые уравнения реакций;
4. И наконец нужно описать качественные реакции на катионы (анионы), содержащие этот элемент, способы получения простого вещества и важнейших соединений этого химического элемента, указать практическое применение изучаемых веществ этого элемента.
Так, если вы определите, что оксид кислотный, то он будет реагировать с водой, основными оксидами, основаниями (см. урок 2.1) и ему будет соответствовать кислотный гидроксид (кислота). При описании свойств этой кислоты также полезно заглядывать в соответствующий раздел: урок 2.2.
Внутреннее строение и физические свойства металлов
Металлы — это простые вещества, атомы которых могут только отдавать электроны. Такая особенность металлов связана с тем, что на внешнем уровне этих атомов мало электронов (чаще всего от 1 до 3) или внешние электроны расположены далеко от ядра. Чем меньше электронов на внешнем уровне атома и чем дальше они расположены от ядра, — тем активнее металл (ярче выражены его металлические свойства).
Задание 8.1. Какой металл активнее:
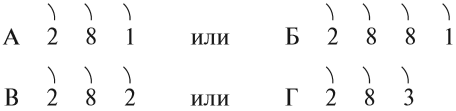
Назовите химические элементы А, Б, В, Г.
Металлы и неметаллы в Периодической системе химических элементов Менделеева (ПСМ) разделяет линия, проведённая от бора к астату. Выше этой линии в главных подгруппах находятся неметаллы (см. урок 3). Остальные химические элементы — металлы.
Задание 8.2. Какие из следующих элементов относятся к металлам: кремний, свинец, сурьма, мышьяк, селен, хром, полоний?
Вопрос. Как можно объяснить тот факт, что кремний — неметалл, а свинец — металл, хотя число внешних электронов у них одинаково?
Существенной особенностью атомов металлов является их большой радиус и наличие слабо связанных с ядром валентных электронов. Для таких атомов величина энергии ионизации* невелика.
* ЭНЕРГИЯ ИОНИЗАЦИИ равна работе, затрачиваемой на удаление одного внешнего электрона из атома (на ионизацию атома), находящегося в основном энергетическом состоянии.
Часть валентных электронов металлов, отрываясь от атомов, становятся «свободными». «Свободные» электроны легко перемещаются между атомами и ионами металлов в кристалле, образуя «электронный газ» (рис. 28).
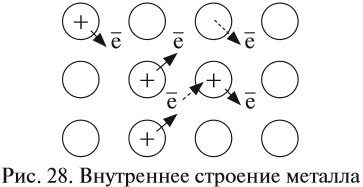
В последующий момент времени любой из «свободных» электронов может притянуться любым катионом, а любой атом металла может отдать электрон и превратиться в ион (эти процессы показаны на рис. 28 пунктирами).
Таким образом, внутреннее строение металла похоже на слоёный пирог, где положительно заряженные «слои» атомов и ионов металла чередуются с электронными «прослойками» и притягиваются к ним. Наилучшей моделью внутреннего строения металла является стопка стеклянных пластинок, смоченных водой: оторвать одну пластинку от другой очень трудно (металлы прочные), а сдвинуть одну пластинку относительно другой очень легко (металлы пластичные) (рис. 29).
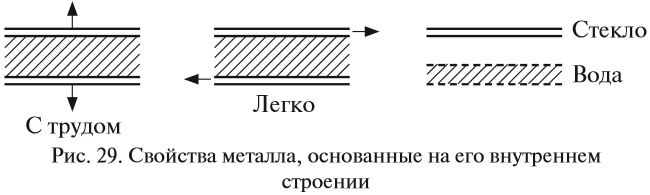
Задание 8.3. Сделайте такую «модель» металла и убедитесь в этих свойствах.
Химическая связь, осуществляемая за счёт «свободных» электронов, называется металлической связью.
«Свободные» электроны обеспечивают также такие физические свойства металлов, как электро- и теплопроводность, пластичность (ковкость), а также металлический блеск.
Задание 8.4. Найдите дома металлические предметы.
Выполняя это задание, вы легко найдёте на кухне металлическую посуду: кастрюли, сковородки, вилки, ложки. Из металлов и их сплавов делают станки, самолёты, автомобили, тепловозы, инструменты. Без металлов невозможна современная цивилизация, так как электрические провода также делают из металлов — Cu и Al. Только металлы годятся для получения антенн для радио- и телеприёмников, из металлов делают и лучшие зеркала. При этом чаще используют не чистые металлы, а их смеси (твёрдые растворы) — СПЛАВЫ.

Сплавы
Металлы легко образуют сплавы — материалы, имеющие металлические свойства и состоящие из двух или большего числа химических элементов (простых веществ), из которых хотя бы один является металлом. Многие металлические сплавы имеют один металл в качестве основы с малыми добавками других компонентов. В принципе, чёткую границу между металлами и сплавами трудно провести, так как даже в самых чистых металлах имеются «следовые» примеси других химических элементов.
Все перечисленные выше предметы — станки, самолёты, автомобили, сковородки, вилки, ложки, ювелирные изделия — делают из сплавов. Металлы-примеси (легирующие компоненты) очень часто изменяют свойства основного металла в лучшую, с точки зрения человека, сторону. Например, и железо и алюминий — довольно мягкие металлы. Но, соединяясь друг с другом или с другими компонентами, они превращаются в сталь, дуралюмин и другие прочные конструкционные материалы. Рассмотрим свойства самых распространённых сплавов.
Сталь — это сплавы железа с углеродом, содержащие последнего до 2 %. В состав легированных сталей входят и другие химические элементы — хром, ванадий, никель. Сталей производится гораздо больше, чем каких-либо других металлов и сплавов, и все виды их возможных применений трудно перечислить. Малоуглеродистая сталь (менее 0,25 % углерода) в больших количествах потребляется в качестве конструкционного материала, а сталь с более высоким содержанием углерода (более 0,55 %) идет на изготовление режущих инструментов: бритвенные лезвия, сверла и др.
Железо составляет основу чугуна. Чугуном называется сплав железа с 2–4 % углерода. Важным компонентом чугуна является также кремний. Из чугуна можно отливать самые разнообразные и очень полезные изделия, например крышки для люков, трубопроводную арматуру, блоки цилиндров двигателей и др.
Бронза — сплав меди, обычно с оловом как основным легирующим компонентом, а также с алюминием, кремнием, бериллием, свинцом и другими элементами, за исключением цинка. Оловянные бронзы знали и широко использовали ещё в древности. Большинство античных изделий из бронзы содержат 75–90 % меди и 25–10 % олова, что делает их внешне похожими на золотые, однако они более тугоплавкие. Это очень прочный сплав. Из него делали оружие до тех пор, пока не научились получать железные сплавы. С применением бронзы связана целая эпоха в истории человечества: Бронзовый век.
Латунь — это сплавы меди с Zn, Al, Mg. Это цветные сплавы с невысокой температурой плавления, их легко обрабатывать: резать, сваривать и паять.
Мельхиор — является сплавом меди с никелем, иногда с добавками железа и марганца. По внешним характеристикам мельхиор похож на серебро, но обладает большей механической прочностью. Сплав широко применяют для изготовления посуды и недорогих ювелирных изделий. Большинство современных монет серебристого цвета изготавливают из мельхиора (обычно 75 % меди и 25 % никеля с незначительными добавками марганца).
Дюралюминий, или дюраль — это сплав на основе алюминия с добавлением легирующих элементов — медь, марганец, магний и железо. Он характеризуется своей стальной прочностью и устойчивостью к возможным перегрузкам. Это основной конструкционный материал в авиации и космонавтике.

Химические свойства металлов
Металлы легко отдают электроны, т. е. являются восстановителями. Поэтому они легко реагируют с окислителями.
- Какие атомы являются окислителями?
- Как называются простые вещества, состоящие из атомов, которые способны принимать электроны?
Таким образом, металлы реагируют с неметаллами. В таких реакциях неметаллы, принимая электроны, приобретают обычно НИЗШУЮ степень окисления.
Рассмотрим пример. Пусть алюминий реагирует с серой:
Вопрос. Какой из этих химических элементов способен только отдавать электроны? Сколько электронов?
Алюминий — металл, имеющий на внешнем уровне 3 электрона (III группа!), поэтому он отдаёт 3 электрона:
Поскольку атом алюминия отдает электроны, атом серы принимает их.
Вопрос. Сколько электронов может принять атом серы до завершения внешнего уровня? Почему?
У атома серы на внешнем уровне 6 электронов (VI группа!), следовательно, этот атом принимает 2 электрона:
Таким образом, полученное соединение имеет состав:
В результате получаем уравнение реакции:

Задание 8.5. Составьте, рассуждая аналогично, уравнения реакций:
Составляя уравнения реакций, помните, что атом металла отдаёт все внешние электроны, а атом неметалла принимает столько электронов, сколько их не хватает до восьми.
Названия полученных в таких реакциях соединений всегда содержат суффикс ИД:
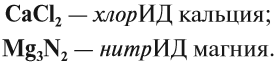
Корень слова в названии происходит от латинского названия неметалла (см. урок 2.4).
Металлы реагируют с растворами кислот (см. урок 2.2). При составлении уравнений подобных реакций и при определении возможности такой реакции следует пользоваться рядом напряжений (рядом активности) металлов:
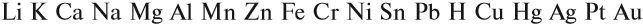
Металлы, стоящие в этом ряду до водорода, способны вытеснять водород из растворов кислот:
Задание 8.6. Составьте уравнения возможных реакций:
- магний + серная кислота;
- никель + соляная кислота;
- ртуть + соляная кислота.
Все эти металлы в полученных соединениях двухвалентны.
Реакция металла с кислотой возможна, если в результате её получается растворимая соль. Например, магний практически не реагирует с фосфорной кислотой, поскольку его поверхность быстро покрывается слоем нерастворимого фосфата:
Металлы, стоящие после водорода, могут реагировать с некоторыми кислотами, но водород в этих реакциях не выделяется:
Задание 8.7. Какой из металлов — Ва, Mg, Fе, Рb, Сu — может реагировать с раствором серной кислоты? Почему? Составьте уравнения возможных реакций.
Металлы реагируют с водой, если они активнее железа (железо также может реагировать с водой). При этом очень активные металлы (Li – Al) реагируют с водой при нормальных условиях или при небольшом нагревании по схеме:
где х — валентность металла.
Задание 8.8. Составьте уравнения реакций по этой схеме для К, Nа, Са. Какие ещё металлы могут реагировать с водой подобным образом?
Возникает вопрос: почему алюминий практически не реагирует с водой? Действительно, мы кипятим воду в алюминиевой посуде, — и… ничего! Дело, в том, что поверхность алюминия защищена оксидной пленкой (условно — Al2O3). Если её разрушить, то начнётся реакция алюминия с водой, причём довольно активная. Полезно знать, что эту плёнку разрушают ионы хлора Cl – . А поскольку ионы алюминия небезопасны для здоровья, следует выполнять правило: в алюминиевой посуде нельзя хранить сильно солёные продукты!
Вопрос. Можно ли хранить в алюминиевой посуде кислые щи, компот?
Менее активные металлы, которые стоят в ряду напряжений после алюминия, реагируют с водой в сильно измельчённом состоянии и при сильном нагревании (выше 100 °C) по схеме:
Металлы, менее активные, чем железо, с водой не реагируют!
Металлы реагируют с растворами солей. При этом более активные металлы вытесняют менее активный металл из раствора его соли:

Задание 8.9. Какие из следующих реакций возможны и почему:
- серебро + нитрат меди II;
- никель + нитрат свинца II;
- медь + нитрат ртути II;
- цинк + нитрат никеля II.
Составьте уравнения возможных реакций. Для невозможных поясните, почему они невозможны.
Следует отметить (!), что очень активные металлы, которые при нормальных условиях реагируют с водой, не вытесняют другие металлы из растворов их солей, поскольку они реагируют с водой, а не с солью:
А затем полученная щёлочь реагирует с солью:
Поэтому реакция между сульфатом железа и натрием НЕ сопровождается вытеснением менее активного металла:
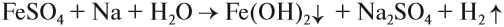

Коррозия металлов
Коррозия — самопроизвольный процесс окисления металла под действием факторов окружающей среды.
В природе практически не встречается металлов в свободном виде. Исключение составляют только «благородные», самые неактивные металлы, например золото, платина. Все остальные активно окисляются под действием кислорода, воды, кислот и др. Например, ржавчина образуется на любом незащищённом железном изделии именно в присутствии кислорода или воды. При этом окисляется железо:
а восстанавливаются компоненты атмосферной влаги:
В результате образуется гидроксид железа (II), который, окисляясь, превращается в ржавчину:
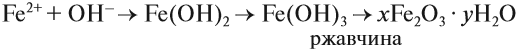
Подвергаться коррозии могут и другие металлы, правда, ржавчина на их поверхности не образуется. Так, нет на Земле металла алюминия — самого распространённого металла на планете. Но зато основу многих горных пород и почвы составляет глинозём Al2O3. Дело в том, что алюминий мгновенно окисляется на воздухе. Коррозия металлов наносит колоссальный ущерб, разрушая различные металлические конструкции.
Чтобы уменьшить потери от коррозии, следует устранить причины, которые её вызывают. В первую очередь, металлические предметы следует изолировать от влаги. Это можно сделать разными способами, например, хранить изделие в сухом месте, что далеко не всегда возможно. Кроме того, можно поверхность предмета покрасить, смазать водоотталкивающим составом, создать искусственную оксидную плёнку. В последнем случае в состав сплава вводят хром, который «любезно» распространяет собственную оксидную плёнку на поверхность всего металла. Сталь становится нержавеющей.
Изделия из нержавеющей стали дороги. Поэтому для защиты от коррозии используют тот факт, что менее активный металл не изменяется, т. е. не участвует в процессе. Поэтому если к сохраняемому изделию приварить более активный металл, то, пока он не разрушится, изделие корродировать не будет. Этот способ защиты называется протекторной защитой.

Выводы
Металлы — это простые вещества, которые всегда являются восстановителями. Восстановительная активность металла убывает в ряду напряжений от лития к золоту. По положению металла в ряду напряжений можно определить, как металл реагирует с растворами кислот, с водой, с растворами солей.
Металлы светлое тело которое ковать можно
Научный редактор
член-корреспондент АН СССР
И. Н. Плаксин
Советский народ строит коммунизм.
Страна охвачена пафосом созидания. Встают новые города, заводы, фабрики. Газеты сообщают о сооружаемых шахтах и рудниках, прокладываемых дорогах и газопроводах, пускаемых электростанциях и комбинатах. Это воплощаются в жизнь предначертания новой Программы Коммунистической партии Советского Союза. В точных, отчетливых, скупых формулировках партийного документа можно рассмотреть грандиозную картину — Советскую страну, какой она будет через двадцать лет, страну, вступившую в коммунизм.
Не менее чем в шесть раз увеличится за двадцать лет валовая продукция промышленности. Небывалый размах примет капитальное строительство, строительство жилых домов, предусмотрен бурный рост транспорта, связи. Нет буквально ни одной основной отрасли промышленности, которая не сделает в эти годы стремительного рывка вперед.
И везде решающим условием победы будет металл!
…Станкостроение. Сердцевиной индустрии называют его в народе. Партия будет всемерно форсировать производство автоматических линий, средств автоматики, электроники, точных приборов; бесчисленные умелые машины встанут в Цехах наших заводов за эти годы. Надо ли говорить, что развитие станкостроения невозможно без металла!
В новой Программе партии указано, что производство электроэнергии будет расти у нас такими темпами, которые опередят общий рост народного хозяйства. Уже к концу первого десятилетия, к 1970 году, выработка электроэнергии достигнет 900—1000 миллиардов киловатт-часов, а к 1980 году в нашей стране будет вырабатываться до 2700–3000 миллиардов киловатт-часов! Для этого будут построены многочисленные мощные электростанции; сотни тысяч километров высоковольтных, магистральных и распределительных сетей протянутся, образуя густую сеть во всех районах нашей страны. Будет создана Единая энергетическая система СССР, ветвями своими выходящая за границы нашей Родины, связанная с энергосистемами других социалистических стран.
Этот грандиозный план тоже потребует огромных количеств металла. И звонкой стали. И жаркой меди. И легкого алюминия.
А транспорт. Ведь будут стремительно развиваться все виды транспорта — от железнодорожного до воздушного, оснащенного реактивной техникой, и даже космического! Больше станет железных дорог, трубопроводов, морских и речных судов. И это все — тоже металл!
…Сельское хозяйство. И оно сегодня — важнейший потребитель металла.
За двадцать лет колхозы и совхозы страны должны получить бесчисленное количество машин. Ведь партия намечает организовать мощный подъем сельского хозяйства, приблизить его по технической вооруженности к уровню нашей промышленности. Сельскохозяйственный труд превратится в разновидность труда промышленного. И огромные количества металла будет потреблять оно, наше сельское хозяйство, совсем недавно располагавшее серпом, косой да — реже — железным лемехом плуга. Даже бороны и те в дореволюционной России были деревянными.
…Строительство. Огромные масштабы капитального строительства — жилых и промышленных зданий — потребуют быстрого развития строительной индустрии. Металла понадобится много, ибо сборный железобетон стал основой современной стройки.
Одним из фундаментов цивилизации назвал Владимир Ильич железо. Оно является и сегодня главным, основным металлом. Скупо приводит цифры Программа Коммунистической партии Советского Союза.
В ней названы лишь самые главные, и среди них — цифра выплавки стали. 250 млн. тонн стали намечается выплавить в 1980 году!
Трудно представить вещественно эту цифру. Ведь если отлить из этого металла колонну диаметром в 20 м, она поднимется в заоблачные дали ионосферы, на высоту 100 км, туда, где простирается область, принадлежащая спутникам.
Это — река металла! Ведь каждая минута 1980 года будет рождать у нас 475 тонн стали! Этого количества металла достаточно, чтобы изготовить более сотни тракторов. А выплавленного за сутки металла хватит для изготовления 150 тысяч тракторов. Помните, Владимир Ильич мечтал о 100 тысячах тракторов, чтобы русский крестьянин воочию мог убедиться в преимуществах коллективного механизированного сельского хозяйства?
Если всю эту сталь выпустить в виде рельсов, железную дорогу можно будет протянуть на расстояние в 2 млн. км. Она могла бы обвить земной шар по экватору 50 раз!
В 1913 году царская Россия давала лишь 6 процентов мирового производства металла. Только Испания из европейских государств стояла позади в списке стран, производящих черный металл. Сегодня мы занимаем второе место в мире. Ведь в 1960 году в нашей стране было выплавлено 65 млн. тонн стали. Только Соединенные Штаты Америки выплавляют пока больше нас. Но медленно растет там производство металла, а по временам вообще не растет, а падает. И нет сомнения, что уже в ближайшие годы Советская страна займет по производству металла первое место в мире.
Для этого у нас есть все возможности. Ведь наша Родина располагает 40 процентами разведанных железных руд мира; 38 млрд. тонн железных руд хранится в подземных кладовых природы на территории нашей страны. Это в 3,3 раза больше, чем запасы Англии, Франции и ФРГ, вместе взятых.
Есть и еще одна цифра, которую целесообразно напомнить для сравнения, В 1955 году весь капиталистический мир выплавил 202 млн. тонн стали. Это был высший достигнутый там уровень производства. Наша страна оставит в ходе грядущего двадцатилетия позади и эту цифру.
Вырастет в годы ближайшего двадцатилетия производство и других металлов. «Особенно ускорится производство легких, цветных и редких металлов, намного увеличится выпуск алюминия…» — записано в новой Программе нашей Коммунистической партии.
Борьба за металл в нашей стране — это борьба за построение материально-технической базы коммунизма, борьба за повышение жизненного уровня народа, борьба за безопасность Родины.
В этой борьбе принимает участие весь народ, ибо нет сейчас в нашей стране человека, который не имел бы дела с металлом.
Да, в первую очередь доменщики и сталевары, горняки и рабочие металлургических заводов дают стране металл. От их труда, их смекалки, их мастерства зависит выплавка стали мартеновскими печами и выход редкого металла иридия в сложнейшем процессе разделения самородной платины. Совершенствуя производство, повышая производительность труда, изобретая и рационализируя, они поднимают все круче вверх кривую производства металлов в нашей стране.
А рабочие машиностроительных заводов — разве их труд и изобретательность не могут сделать нашу Родину богаче металлом? Уменьшить потери в стружку, сократить допуск заготовки при ее кузнечной обработке — разве не больше металла пойдет в дело? Разве не получает страна за счет такой экономии лишние металлические изделия?
А разве шоферы и трактористы, электросварщики и линотиписты, представители буквально всех специальностей не могут принять участия во всенародной борьбе за металл? Лишние тысячи километров пробега автомашины, лишний сезон работы трактора, продление жизни станка, агрегата — это продление жизни металла. Сто тысяч километров — срок жизни автомобильного мотора до капитального ремонта. Если четыре водителя продлят его на 25 процентов каждый, это равноценно тому, что они выплавили металл, изготовили из него детали, собрали новый автомобильный мотор…
Читайте также:
