Металлы только в виде соединений
Обновлено: 17.05.2024
Щелочными металлами называются химические элементы-металлы \(IA\) группы Периодической системы Д. И. Менделеева: литий \(Li\), натрий \(Na\), калий \(K\), рубидий \(Rb\), цезий \(Cs\) и франций \(Fr\).
Электронное строение атомов. На внешнем энергетическом уровне атомы щелочных металлов имеют один электрон ns 1 . Поэтому для всех металлов группы \(IA\) характерна степень окисления \(+1\).
- увеличение радиуса атомов;
- усиление восстановительных, металлических свойств.
Нахождение в природе. Из щелочных металлов наиболее широко распространены в природе натрий и калий. Но из-за высокой химической активности они встречаются только в виде соединений.
- каменная соль (хлорид натрия \(NaCl\)),
- глауберова соль, или мирабилит — декагидрат сульфата натрия Na 2 SO 4 \(·\) 10 H 2 O ,
- сильвин — хлорид калия \(KCl\),
- сильвинит — двойной хлорид калия-натрия \(KCl\) \(·\)\(NaCl\) и др.
Соединения лития, рубидия и цезия в природе встречаются значительно реже, поэтому их относят к числу редких и рассеянных.
Физические свойства простых веществ. В твёрдом агрегатном состоянии атомы связаны металлической связью. Наличие металлической связи обусловливает общие физические свойства простых веществ-металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
В свободном виде простые вещества, образованные элементами \(IA\) группы — это легкоплавкие металлы серебристо-белого (литий, натрий, калий, рубидий) или золотисто-жёлтого (цезий) цвета, обладающие высокой мягкостью и пластичностью.


Наиболее твёрдым является литий, остальные щелочные металлы легко режутся ножом и могут быть раскатаны в фольгу.
Только у натрия плотность немного больше единицы ρ = 1,01 г / см 3 , у всех остальных металлов плотность меньше единицы.
Химические свойства. Щелочные металлы обладают высокой химической активностью, реагируя с кислородом и другими неметаллами.
Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. Они являются сильными восстановителями.
Взаимодействие натрия с водой протекает с выделением большого количества теплоты (т. е. реакция является экзотермической). Кусочек натрия, попав в воду, начинает быстро двигаться по её поверхности. Под действием выделяющейся теплоты он расплавляется, превращаясь в каплю, которая, взаимодействуя с водой, быстро уменьшается в размерах. Если задержать её, прижав стеклянной палочкой к стенке сосуда, капля воспламенится и сгорит ярко-жёлтым пламенем.
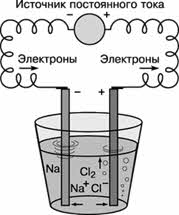
Получение. Металлический натрий в промышленности получают главным образом электролизом расплава хлорида натрия с инертными (графитовыми) электродами.
Какие металлы встречаются в природе только в виде соединений?
Какие металлы в природе встречаются только в виде соединений?
В Таблице Менделеева насчитывается более 90 металлов, около 60 из них встречаются в природе. Условно эти металлы можно разбить по крайней мере на три группы:
- металлы, которые встречаются только в виде соединений;
- металлы, которые встречаются в природе только в свободном виде;
- металлы, которые встречаются в природе, как в свободном виде, так и в виде соединений.
Только в виде соединений встречаются металлы, которые очень активны и взаимодействуют с кислородом воздуха и атмосферной влагой при нормальных условиях. К таким активным металлам относятся натрий, калий, магний, кальций, марганец, цинк, хром. Они встречаются в природе только в виде соединений с другими элементами.
Металлы в природе

Все металлы, кроме меди, серебра, золота, ртути и платиновых металлов, встречаются в природе только в виде соединений.
Мне кажется, что в основном название цветные металлы прилипло к ним по той причине, что они отличаются цветом от металлов черных. Нет какого-то особого определения для цветных металлов, кроме как отличия по физическим свойствам от железа и его сплавов. Например цветные металлы не магнитятся, они стойкие к коррозии и воздействию окружающей среды, многие из них хорошо проводят электричество. Наиболее часто при слове цветные металлы вспоминают алюминий и медь, а также их сплавы. Однако это также и свинец, никель, олово, титан, магний и многие другие металлы, потребность в которых велика и которые выпускаются промышленными объемами.
Самым распространенным металлом в земной коре является, как это не странно алюминий.
Если честно, до того момента, пока не полезла уточнить, всегда считала что это железо. Ну или медь. Но эти два металла, являясь довольно распространенными все-таки занимают не первую строчку. Так что в очередной раз БВ способствовал обучению, в очередной раз этому рада, тем более узнавать интересное всегда приятно.
Металлы делятся на три группы.
1 Драгоценные металлы.
2 Цветные металлы.
3 Чёрные металлы.
Было время, что я иногда сдавал металлолом и там узнал, что чёрными металлами обычно называются металлы, которые магнитятся магнитом. Ещё одно отличительное свойство - это то, что обычно они ржавеют, хотя это свойство второстепенное, так как не уверен, что все они ржавеющие или что среди цветных металлов нет ржавеющих.
А те, что не магнитятся, относятся к цветным металлам. Самые редкие из них и обладающие самыми ценными качествами относят к драгоценным металлам.
Чёрные металлы: железо, чугун и сталь.
Вообще-то многие металлы реагируют с водой..
Разница только в интенсивности..
Наиболее интенсивно, с выделением большого количества тепла реагируют с водой все щёлочные металлы:натрий, калий, литий,рубидий,цезий; щёлочноземельные: кальций, стронций, барий.
Реагирует с водой железо с водой - ржавление ( но здесь надо заметить, что чистое железо не ржавеет - ржавление происходит только в присутствии примесей)..
Стекло выбрасывали, а ртуть или проливалась вниз, и постепенно проникала в землю, либо доставалась детям и они с ней играли. Я сам неоднократно играл со ртутью. Одно из любимых занятий было натереть ртутью 3-копеечную монету. Она одинакового размера с 20-копеечной. Для тех, кто не застал, поясняю, что монеты достоинством в 1, 2, 3 и 5 копеек были из сплава желтого цвета ("медные"), а монеты достоинством в 10, 15, 20 (а позднее и в 50 копеек и в один рубль) были из сплава белого цвета, вернее не белого, а серебристого, по крайней мере, пока новые ("серебряные"). Так вот, натёртую ртутью 3-копеечную монету многие не разглядев, принимали за 20-копеечную. Конечно, потом мы говорили, что пошутили, во всяком случае цели мошенничества не было.
А вообще, я должен сказать, что в наши дни всё население по примеру американцев или европейцев заморочено "вредностью", и панически боятся всего "вредного". Реально же "вредность" ртути сильно переоценена. Все предыдущие поколения не были так заморочены, и прекрасно уживались со ртутью. Например, можно налить в какую-нибудь посуду несколько граммов ртути и держать её в открытом виде. Она конечно будет постепенно испаряться. Но 3-5 г ртути хватит (я в смысле, что если её не проливать, то она будет стоять в той посуде) и на Вашу жизнь, и на жизнь Ваших детей и внуков. И никто от этого не заболеет, не умрёт, а если заранее не знать, то даже не узнают, что всю жизнь прожили рядом со ртутью.
1. Общая характеристика элементов металлов
Из \(118\) известных на данный момент химических элементов \(96\) образуют простые вещества с металлическими свойствами, поэтому их называют металлическими элементами .
Металлические химические элементы в природе могут встречаться как в виде простых веществ, так и в виде соединений. То, в каком виде встречаются металлические элементы в природе, зависит от химической активности образуемых ими металлов.
Металлические элементы, образующие химически активные металлы ( Li–Mg ), в природе чаще всего встречаются в виде солей (хлоридов, фторидов, сульфатов, фосфатов и других).
Соли, образуемые этими металлами, являются главной составной частью распространённых в земной коре минералов и горных пород.


В растворённом виде соли натрия, кальция и магния содержатся в природных водах. Кроме того, соли активных металлов — важная составная часть живых организмов. Например, фосфат кальция Ca 3 ( P O 4 ) 2 является главной минеральной составной частью костной ткани.
Металлические химические элементы, образующие металлы средней активности ( Al–Pb ), в природе чаще всего встречаются в виде оксидов и сульфидов.


Металлические элементы, образующие химически неактивные металлы ( Cu–Au ), в природе чаще всего встречаются в виде простых веществ.
 |  |  |
| Рис. \(7\). Самородное золото Au | Рис. \(8\). Самородное серебро Ag | Рис. \(9\). Самородная платина Pt |
Исключение составляют медь и ртуть, которые в природе встречаются также в виде химических соединений.

В Периодической системе химических элементов металлы занимают левый нижний угол и находятся в главных (А) и побочных (Б) группах.
Рис. \(13\). Положение металлов в Периодической системе. Знаки металлических химических элементов расположены ниже ломаной линии B — Si — As — Te
В электронной оболочке атомов металлов на внешнем энергетическом уровне, как правило, содержится от \(1\) до \(3\) электронов. Исключение составляют только металлы \(IV\)А, \(V\)А и \(VI\)А группы, у которых на наружном энергетическом уровне находятся соответственно четыре, пять или шесть электронов.
В атомах металлов главных подгрупп валентные электроны располагаются на внешнем энергетическом уровне, а у металлов побочных подгрупп — ещё и на предвнешнем энергетическом уровне.
Радиусы атомов металлов больше, чем у атомов неметаллов того же периода. В силу отдалённости положительно заряженного ядра атомы металлов слабо удерживают свои валентные электроны.
Рис. \(14\). Характер изменения радиусов атомов химических элементов в периодах и в группах. Радиусы атомов металлов существенно больше, чем радиусы атомов неметаллов, находящихся в том же периоде
Главное отличительное свойство металлов — это их сравнительно невысокая электроотрицательность (ЭО) по сравнению с неметаллами.

Рис. \(15\). Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу). ОЭО металлических химических элементов уступает соответствующей величине неметаллических химических элементов
Атомы металлов, вступая в химические реакции, способны только отдавать электроны, то есть окисляться, следовательно, в ходе превращений могут проявлять себя в качестве восстановителей .
Металлы в природе. Способы получения металлов

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Металлы в природе. Способы получения металлов"
С металлами в свободном состоянии человек знаком с самой глубокой древности. Изначально человеку было известно только 7 металлов, так называемы «металлы древности».

За последние 250 лет открыто и получено в свободном виде 86 новых металлов.
Использовать металлы в свободном виде человек начал в древние века. Первыми металлами из них были золото, серебро, медь. Освоение выплавки железа в больших масштабах сделало огромный переворот в промышленности.

В природе металлы встречаются как в виде простых веществ (в свободном виде), а также в виде соединений. Малоактивные металлы: медь, золото, серебро, платина, палладий и др. в природе могут находиться как в свободном виде, так и в составе соединений. Активные металлы: натрий, калий, кальций, алюминий, магний и др. встречаются в природе только в виде соединений: оксидов, сульфидов, карбонатов и т.д.
Если металл в природных условиях находится в свободном состоянии, то для получения чистого металла нужно только избавиться от соответствующих смесей. Получение металлов из соединений – это задача металлургии.
Большинство металлов находится в природных условиях в виде соединений – руд. Руда – это природное минеральное образование, в котором атомы химических элементов находятся в окисленном состоянии. Для получения металла для этого необходимо провести процесс восстановления:
Для данного процесса используют восстановители, такие как, водород, более активные металлы, углерод (в виде кокса), оксид углерода (II), постоянный электрический ток.
Технологические процессы, лежащие в основе промышленных способов получения металлов из руд, можно разделить на пирометаллургические, гидрометаллургические, электрометаллургические.
Пирометаллургические способы получения металлов основаны на использовании различных восстановителей для получения металлов путем восстановления из руд при высокой температуре.
В гидрометаллургических методах процесс восстановления протекает в водном растворе.
В электрометаллургических процессах восстановителем является постоянный электрический ток.
Водород как восстановитель может использоваться для получения металлов со средней и малой химической активностью: например, меди, вольфрама, молибдена. В данном случае водород восстанавливает металл из его оксида при высокой температуре.
Восстановить металлы из их оксидов можно с помощью более активного металла, поэтому процесс восстановление металлами называется металлотермией. Если в роли восстановителя металла выступает алюминий, то данный процесс называется алюмотермией.

Так, алюминий используется для получения кальция из его оксида, а металлический кальций используют для получения цезия.
Ca + 2СsСl = CaCl2 + 2Cs
Углерод и оксид углерода (II) являются сильными восстановителями.
CuO + CO = Cu + CO2↑

Свободный углерод (в виде кокса) и оксид углерода (II) служат восстановителями при производстве железа в доменном процессе. В общем виде:
Постоянный электрический ток является самым сильным восстановителем. С помощью электрического тока получают многие активные металлы: натрий, калий, кальций и др. При этом процесс идёт не в водном растворе, а в расплаве при повышенной температуре.
Алюминий в промышленных масштабах получают путём электролиза раствора оксида алюминия в расплавленном криолите (Na3AlF6).
Таким образом, большинство металлов в природе находятся только в виде соединений, в самородном состоянии встречаются золото, медь, палладий и др. Получение металлов из соединений – это задача металлургии. В зависимости от способа получения металлов различают следующие методы: пирометаллургия, электрометаллургия и гидрометаллургия. В пирометаллургическом методе использую восстановители: водород, углерод, оксид углерода (II), более активные металлы.
Химия s-, р-элементов
В этом уроке изучается положение s-, р-элементов в Периодической системе химических элементов Д. И. Менделеева, особенности строения атомов и их свойства.

Конспект урока "Химия s-, р-элементов"
Элементы в периодической системе Менделеева делятся на эс, пэ, дэ и эф-элементы. Это разделение осуществляется на основе того, сколько энэргетических уровней имеет электронная оболочка атома и каким уровнем заканчивается заполнение электронной оболочки электронами.
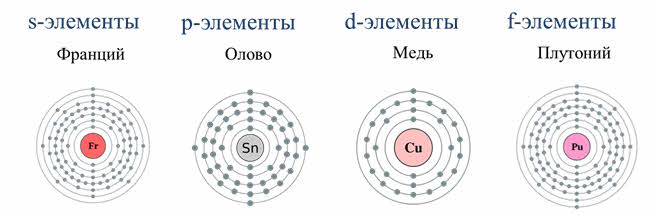
К s-элементам относятся элементы первой А группы – щелочные металлы. Электронная формула щелочных металлов эн-эс-один.
Поэтому для них характерна степень окисления плюс один. Элементы первой А группы обладают сходными свойствами из-за сходного строения электронной оболочки.
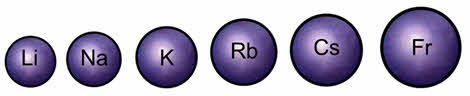
Но при увеличении радиуса в группе от лития к францию связь валентного электрона с ядром ослабевает и уменьшается энэргия ионизации. Атомы щелочных металлов легко отдают свой валентный электрон, поэтому они являются сильными восстановителями.
Из-за высокой химической активности щелочные металлы в природе встречаются только в виде соединений. Простые вещества, образованные элементами первой А группы, представляют собой серебристо-белые металлы, которые легко режутся ножом. Все щелочные металлы относятся к лёгким и легкоплавким металлам.
К эс-элементам относятся также элементы второй A группы, из них кальций, стронций, барий называют щелочноземельными металлами. На внешнем энэргетическом уровне у них по два электрона. Из-за своей высокой химической активности они встречаются в природе только в виде соединений. Металлы второй A группы имеют металлический блеск с различными оттенками: от серого до серебристого, температура плавления их выше, чем у щелочных металлов, плотность их меньше пяти грамм на сантиметр кубический, поэтому их относят к легкоплавким металлам.
К p-элементам относятся 30 элементов от третьей А до восьмой А группы периодической системы; пэ-элементы расположены во втором и третьем малых периодах, а также в четвертом, пятом и шестом больших периодах.
Элементы третьей А-группы имеют один электрон на пэ-орбитали. Начиная с четвёртой А и заканчивая восьмой А группой наблюдается заполнение пэ-подуровня до шести электронов. Общая электронная формула пэ-элементов эн-эс-два-эн-пэ-шесть.
В периодах при увеличении заряда ядра атомные радиусы и ионные радиусы пэ-элементов уменьшаются, энэргия ионизации и сродства к электрону возрастают, электроотрицательность увеличивается, неметаллические свойства элементов усиливаются.
Изменение свойств по периодам
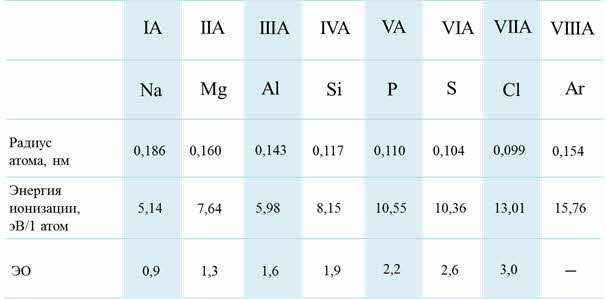
В группах сверху вниз радиусы атомов увеличиваются, энэргия ионизации и сродства к электрону уменьшается, электроотрицательность уменьшается, усиливаются металлические свойства, а неметаллические свойства ослабевают.
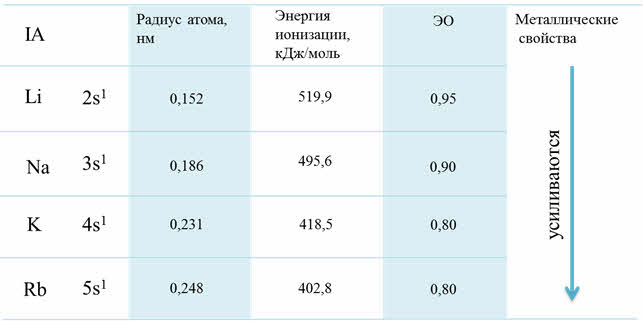
Изменение свойств по группам
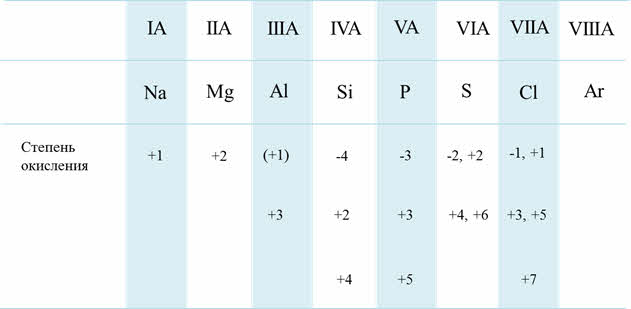
Кроме этого, по периоду с увеличением порядкового номера возрастает высшая степень окисления, а также возможность степеней окисления. Например, у кремния возможны такие степени окисления, как минус четыре, плюс два, плюс четыре; а у хлора – минус один, плюс один, плюс три, плюс пять, плюс семь.
Изменение СО по периоду
Если рассмотреть от первой до третьей А группы, то можно увидеть, что в группе сверху вниз увеличиваются металлические свойства, а также возрастает активность металлов. Например, во второй A группе металлические свойства и активность бария выражены гораздо сильнее, чем у магния.
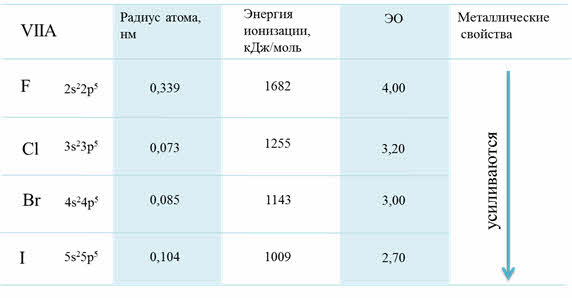
Рассмотрим для примера седьмую A группу – семейство галогенов. В этой группе сверху вниз радиус атома увеличивается, энергия ионизации уменьшается и электроотрицательность также уменьшается.
Возрастание активности металла
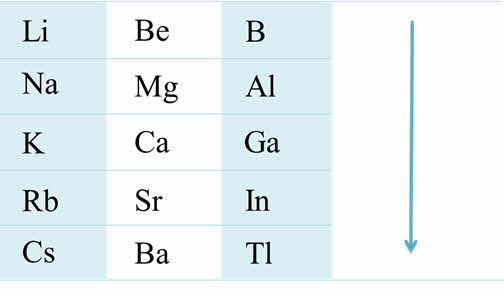
Если рассмотреть группы от четвёртой А до седьмой А, то можно проследить, что в этих группах сверху вниз уменьшается активность неметаллов, уменьшается стабильность соединений в высшей степени окисления, возрастает стабильность соединений в более низкой степени окисления. Например, в пятой A группе висмут проявляет металлические свойства и для него, в отличие от фосфора, наиболее характерна степень окисления плюс три.
Изменение свойств в VIIA группе
Благородные газы – элементы восьмой A группы. У них завершён внешний энэргетический уровень, причём у гелия два электрона на внешнем уровне, он относится к эс-элементам, а все остальные благородные газы относятся к пэ-элементам.

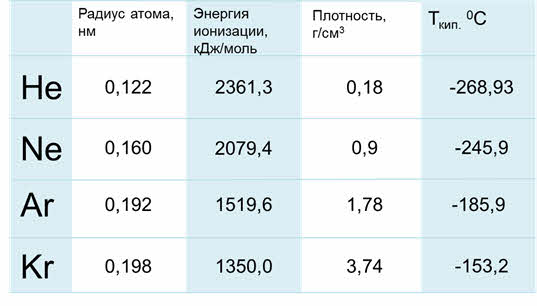
Радиус атомов у благородных газов увеличиваются сверху вниз, энергия ионизации уменьшается, плотность сверху вниз увеличивается, также как температура кипения.
Таким образом, к эс-элементам относятся элементы первой A и второй A группы, к пэ-элементам относятся элементы от третьей до восьмой А группы. Отличительной особенность этих элементов является то, что их валентные электроны расположены на эс- или пэ-подуровне.
По периоду слева направо у них наблюдается уменьшение радиуса атомов, увеличивается энергия ионизации и энергия сродства к электрону, электроотрицательность увеличивается, металлические свойства ослабевают, а усиливаются неметаллические.
В группах сверху вниз наблюдается иная закономерность: радиусы атомов увеличиваются, уменьшается энергия ионизации и энергия сродства к электрону, электроотрицательность уменьшается, металлические свойства усиливаются, а неметаллические ослабевают.
Читайте также:
