Металлы в химических реакциях проявляют только восстановительные свойства
Обновлено: 01.05.2024
В металлах – металлическая связь и металлическая кристаллическая решетка. В узлах решетки находятся положительно заряженные ионы металлов, связанные посредством обобществленных внешних электронов, принадлежащих всему кристаллу.
Это обуславливает все важнейшие физические свойства металлов: металлический блеск, электро- и теплопроводность, пластичность (способность изменять форму под внешним воздействием) и некоторые другие, характерные для этого класса простых веществ.
Металлы I группы главной подгруппы называют щелочными металлами.
Металлы II группы: кальций, стронций, барий – щелочноземельными.
Химические свойства металлов
В химических реакциях металлы проявляют только восстановительные свойства, т.е. их атомы отдают электроны, образуя в результате положительные ионы.
1. Взаимодействуют с неметаллами:
а) кислородом (с образованием оксидов)
Щелочные и щелочноземельные металлы окисляются легко при обычных условиях, поэтому их хранят под слоем вазелинового масла или керосина.
2Ca + O2 = 2CaO
Обратите внимание: при взаимодействии натрия – образуется пероксид, калия - надпероксид
2Na + O2 = Na2O2, К + О 2 = КО 2
а оксиды получают прокаливанием пероксида с соответствующими металлом:
Железо, цинк, медь и другие менее активные металлы медленно окисляются на воздухе и активно при нагревании.
3Fe + 2O2 = Fe3O4 (смесь двух оксидов: FeO и Fe2O3)
2Zn + O2 = 2ZnO
2Cu + O2 = 2CuO
Золото и платиновые металлы не окисляются кислородом воздуха ни при каких условиях.
б) водородом (с образованием гидридов)
2Na + H2 = 2NaH
в) хлором (с образованием хлоридов)
2K + Cl2 = 2KCl
Mg + Cl2 = MgCl2
2Al + 3Cl2 =2AlCl3
Обратите внимание: при взаимодействии железа образуется хлорид железа (III):
2Fe + 3Cl2 = 2FeCl3
г) серой (с образованием сульфидов)
2Na + S = Na2S
Hg + S = HgS
2Al + 3S = Al2S3
Обратите внимание: при взаимодействии железа образуется сульфид железа (II):
Fe + S = FeS
д) азотом (с образованием нитридов)
2Al + N2 = 2AlN
2. Взаимодействуют со сложными веществами:
Необходимо помнить, что по восстановительной способности металлы расположены в ряд, который называют электрохимическим рядом напряжений или активности металлов (вытеснительный ряд Бекетова Н.Н.):
Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Ni, Sn, Pb, (H2), Cu, Hg, Ag, Au, Pt
а) водой
Металлы, расположенные в ряду до магния, при обычных условиях вытесняют водород из воды, образуя растворимые основания – щелочи.
2Na + 2H2O = 2NaOH + H2↑
Магний взаимодействует с водой при кипячении.
Алюминий при удалении оксидной пленки бурно реагирует с водой.
Остальные металлы, стоящие в ряду до водорода, при определенных условиях тоже могут вступать в реакцию с водой с выделением водорода и образованием оксидов.
б) растворами кислот
(Кроме концентрированной серной кислоты и азотной кислоты любой концентрации. См. раздел «Окислительно-восстановительные реакции».)
Обратите внимание: не используют для проведения реакций нерастворимую кремниевую кислоту
Металлы, стоящие в ряду до магния и активно реагирующие с водой, не используют для проведения таких реакций.
Металлы, стоящие в ряду от магния до водорода, вытесняют водород из кислот.
Mg + 2HCl = MgCl2 + H2↑
Обратите внимание: образуются соли двухвалентного железа.
Образование нерастворимой соли препятствует протеканию реакции. Например, свинец практически не реагирует с раствором серной кислоты из-за образования на поверхности нерастворимого сульфата свинца.
Металлы, стоящие в ряду после водорода, НЕ вытесняют водород.
в) растворами солей
Для остальных металлов выполняется правило:
Каждый металл вытесняет из растворов солей другие металлы, расположенные в ряду правее него, и сам может быть вытеснен металлами, расположенными левее него.
Cu + HgCl2 = Hg + CuCl2
Fe + CuSO4 = FeSO4 + Cu
Как и в случае с растворами кислот, образование нерастворимой соли препятствует протеканию реакции.
г) растворами щелочей
Взаимодействуют металлы, гидроксиды которых амфотерны.
2Al + 2KOH + 6H2O = 2K[Al(OH) 4] + 3H2↑
д) с органическими веществами
Щелочные металлы со спиртами и фенолом.
Металлы участвуют в реакциях с галогеналканами, которые используют для получения низших циклоалканов и для синтезов, в ходе которых происходит усложнение углеродного скелета молекулы (реакция А.Вюрца):
2CH2Cl + 2Na = C2H6(этан) + 2NaCl
Неметаллы
В простых веществах атомы неметаллов связаны ковалентной неполярной связью. При этом образуются одинарные (в молекулах H2, F2, Cl2, Br2, I2), двойные (в молекулах О2), тройные (в молекулах N2) ковалентные связи.
Строение простых веществ – неметаллов:
1. молекулярное
При обычных условиях большинство таких веществ представляют собой газы (Н2, N2, O2, O3, F2, Cl2) или твердые вещества (I2, P4, S8) и лишь единственный бром (Br2) является жидкостью. Все эти вещества молекулярного строения, поэтому летучи. В твердом состоянии они легкоплавки из-за слабого межмолекулярного взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
2. атомное
Эти вещества образованы кристаллами, в узлах которых находятся атомы: (Bn, Сn, Sin, Ge n , Sen, Ten). Из-за большой прочности ковалентных связей они, как правило, имеют высокую твердость, и любые изменения, связанные с разрушением ковалентной связи в их кристаллах (плавление, испарение), совершаются с большой затратой энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма мала.
Многие элементы – неметаллы образуют несколько простых веществ – аллотропных модификаций. Аллотропия может быть связана с разным составом молекул: кислород О2 и озон О3 и с разным строением кристаллов: аллотропными модификациями углерода являются графит, алмаз, карбин, фуллерен. Элементы – неметаллы, имеющие аллотропные модификации: углерод, кремний, фосфор, мышьяк, кислород, сера, селен, теллур.
Химические свойства неметаллов
У атомов неметаллов преобладают окислительные свойства, то есть способность присоединять электроны. Эту способность характеризует значение электроотрицательности. В ряду неметаллов
At, B, Te, H, As, I, Si, P, Se, C, S, Br, Cl, N, O, F
электроотрицательность возрастает и усиливаются окислительные свойства.
Отсюда следует, что для простых веществ – неметаллов будут характерны как окислительные, так и восстановительные свойства, за исключением фтора – самого сильного окислителя.
1. Окислительные свойства
а) в реакциях с металлами (металлы всегда восстановители)
2Na + S = Na2S (сульфид натрия)
3Mg + N2 = Mg3N2 (нитрид магния)
б) в реакциях с неметаллами, расположенными левее данного, то есть с меньшим значением электроотрицательности. Например, при взаимодействии фосфора и серы окислителем будет сера, так как фосфор имеет меньшее значение электроотрицательности:
2P + 5S = P2S5 (сульфид фосфора V)
Большинство неметаллов будут окислителями в реакциях с водородом:
в) в реакциях с некоторыми сложными веществами
Окислитель – кислород, реакции горения
Окислитель – хлор
2KI + Cl2 = 2KCl + I2
2. Восстановительные свойства
а) в реакциях с фтором
б) в реакциях с кислородом (кроме фтора)
в) в реакциях со сложными веществами – окислителями
H2 + CuO = Cu + H2O
3. Реакции диспропорционирования: один и тот же неметалл является и окислителем и восстановителем
Cl2 + H2O = HCl + HClO
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
§ 11. Химические свойства металлов
В химических реакциях металлы проявляют только восстановительные свойства, т. е. их атомы отдают электроны, образуя в результате положительные ионы. Окислителями при этом могут выступать неметаллы (кислород, галогены, сера и др.), катионы водорода Н + и катионы других металлов.
С кислородом воздуха легко взаимодействуют щелочные и щёлочноземельные металлы (поэтому их хранят под керосином):

Железо, цинк, медь и другие менее активные металлы энергично окисляются кислородом только при нагревании:

Золото и платиновые металлы не окисляются кислородом воздуха ни при каких условиях.
Как вы уже знаете, металлы образуют с неметаллами бинарные соединения — оксиды, хлориды, сульфиды, фосфиды и т. д., например:

Щелочные и щёлочноземельные металлы легко реагируют с водой, восстанавливая катионы водорода до свободного водорода, и образуют при этом растворимые основания — щёлочи:

Менее активные металлы, например железо, взаимодействуют с водой только в раскалённом виде:
При этом, как и при горении железа, получается оксид состава Fe3O4 (железная окалина), который представляет собой смесь двух оксидов FeO • Fe2O3.
По восстановительной способности, как вы уже знаете, металлы располагают в ряд, который называют электрохимическим рядом напряжений:
К, Са, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, (H2), Cu, Hg, Ag, Au.
В этот ряд помещён и водород, который, как и металлы, способен отдавать электроны, образуя при этом положительно заряженные ионы Н + .
Как вы, очевидно, помните из курса химии 8 класса, из положения металлов в ряду напряжений вытекают два правила, характеризующие химические свойства металлов. Повторим их.
1. Металлы, стоящие в ряду напряжений левее водорода, вытесняют его из растворов кислот (рис. 35), а стоящие правее, как правило, не вытесняют водород из растворов кислот:


Рис. 35. Взаимодействие цинка с соляной кислотой
- правило соблюдается, если в реакции металла с кислотой образуется растворимая соль;
- концентрированная серная кислота и азотная кислота любой концентрации реагирует с металлами по-особому, при этом водород не образуется;
- на щелочные металлы правило не распространяется, так как они легко взаимодействуют с водой (а указанное правило относится к реакциям водных растворов кислот с металлами).
2. Каждый металл вытесняет из растворов солей другие металлы, находящиеся правее него в ряду напряжений, и сам может быть вытеснен металлами, расположенными левее, например (рис. 36):


Рис. 36.
Взаимодействие меди с раствором нитрата серебра
Это правило также имеет поправки, аналогичные таковым к первому правилу, а именно — правило соблюдается при условии образования растворимой соли; правило не распространяется на щелочные металлы.
Лабораторный опыт № 12
Взаимодействие растворов кислот и солей с металлами
§ 19.2. Химические свойства неметаллов
Как мы уже отмечали, для атомов, а следовательно, и для образованных ими простых веществ характерны как окислительные, так и восстановительные свойства.
Окислительные свойства простых веществ — неметаллов.
1. Окислительные свойства неметаллов проявляются в первую очередь при их взаимодействии с простыми веществами — металлами (как вы знаете, металлы всегда восстановители):


Окислительные свойства хлора Сl2 выражены сильнее, чем у серы S, поэтому и металл железо, который имеет в соединениях устойчивые степени окисления +2 и +3, окисляется им до более высокой степени окисления.
2. Большинство неметаллов проявляют окислительные свойства при взаимодействии с водородом. В результате образуются летучие водородные соединения.

3. Любой неметалл выступает в роли окислителя в реакциях с теми неметаллами, которые имеют меньшее значение электроотрицательности:

Электроотрицательность серы больше, чем у фосфора, поэтому в данной реакции она проявляет окислительные свойства.

Фтор F2 — самый сильный окислитель из неметаллов, проявляет в реакциях только окислительные свойства.
4. Окислительные свойства неметаллы проявляют и в реакциях с некоторыми сложными веществами.
Отметим в первую очередь окислительные свойства неметалла кислорода в реакциях со сложными веществами:

Не только кислород, но и другие неметаллы также могут быть окислителями в реакциях со сложными веществами — неорганическими (а, б) и органическими (в, г):
Сильный окислитель хлор Сl2 окисляет хлорид железа (II) в хлорид железа (III);
Хлор Сl2, как более сильный окислитель, вытесняет иод I2 в свободном виде из раствора иодида калия;

Галогенирование метана — характерная реакция для алканов;

Вы помните, конечно, качественную реакцию на непредельные соединения — обесцвечивание бромной воды.
Восстановительные свойства простых веществ — неметаллов.
При рассмотрении реакций неметаллов друг с другом мы уже отмечали, что в зависимости от значений их электроотрицательности один из них проявляет свойства окислителя, а другой — свойства восстановителя.
1. По отношению к фтору все неметаллы (даже кислород) проявляют восстановительные свойства.
2. Разумеется, неметаллы, кроме фтора, служат восстановителями при взаимодействии с кислородом:

В результате реакций образуются оксиды неметаллов: несолеобразующие и солеобразующие кислотные. И хотя галогены непосредственно с кислородом не соединяются, известны их оксиды

и др., которые получают косвенным путем.
3. Многие неметаллы могут выступать в роли восстановителя в реакциях со сложными веществами-окислителями:


Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, и восстановителем. Это реакции самоокисления-самовосста-новления (диспропорционирования):

Итак, подведем итоги! Большинство неметаллов могут выступать в химических реакциях как в роли окислителя, так и в роли восстановителя (восстановительные свойства неприсущи одному только фтору F2).
Химические свойства металлов

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
20 декабря 2021
· Обновлено 20 декабря 2021
Ждём вас 8 октября в 13:00. Вместе с педагогами, психологами и другими экспертами в образовании и воспитании ответим на главные вопросы мам и пап.
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков

Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Окислительно-восстановительные реакции

Разбираться в ОВР важно, чтобы хорошо сдать ЕГЭ по химии. Какие реакции называются окислительно-восстановительными, их типы, а также примеры окислителей и восстановителей — в нашей подробной статье.
28 декабря 2021
· Обновлено 3 июня 2022
Что такое ОВР
Окислительно-восстановительная реакция (ОВР) — это реакция, которая протекает с изменением степеней окисления.
В такой реакции всегда участвуют вещество-окислитель и вещество-восстановитель. Другие вещества могут выступать в качестве среды, в которой протекает данная реакция.
Конечно, в каждом правиле есть исключения. Например, реакция диспропорционирования галогенов в горячем растворе щелочи выглядит так: Br2 + KOH = KBrO3 + KBr + H2O. Здесь и окислителем, и восстановителем является простое вещество бром (Br2).
Теперь посмотрим внимательнее на вещества — участники окислительно-восстановительных реакций.
Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет принимать электроны, тем самым понижая свою степень окисления.
Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет отдавать электроны, тем самым повышая свою степень окисления.
Из определений понятно, что реакция включает два противоположных по действиям явления: процесс окисления и процесс восстановления. Процесс восстановления — это процесс принятия электронов, а процесс окисления — процесс отдачи электронов. Оба процесса протекают одновременно: окислитель восстанавливается, а восстановитель окисляется.
Вот мы и узнали общие закономерности протекания окислительно-восстановительных реакций. Теперь давайте разберемся, какие вещества могут быть окислителями, а какие — восстановителями, и может ли одно вещество проявлять те и другие свойства.
Примеры веществ-окислителей
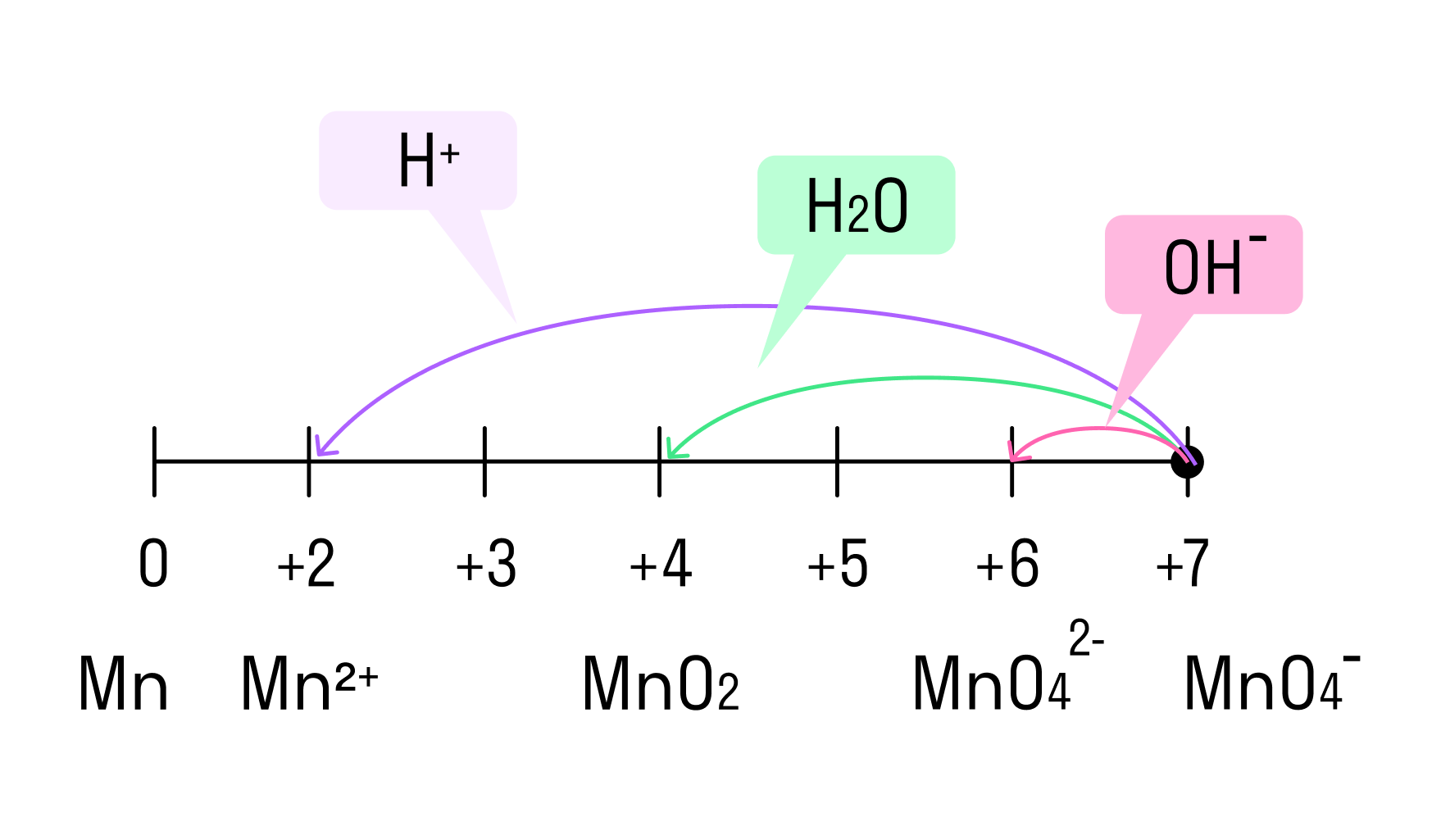
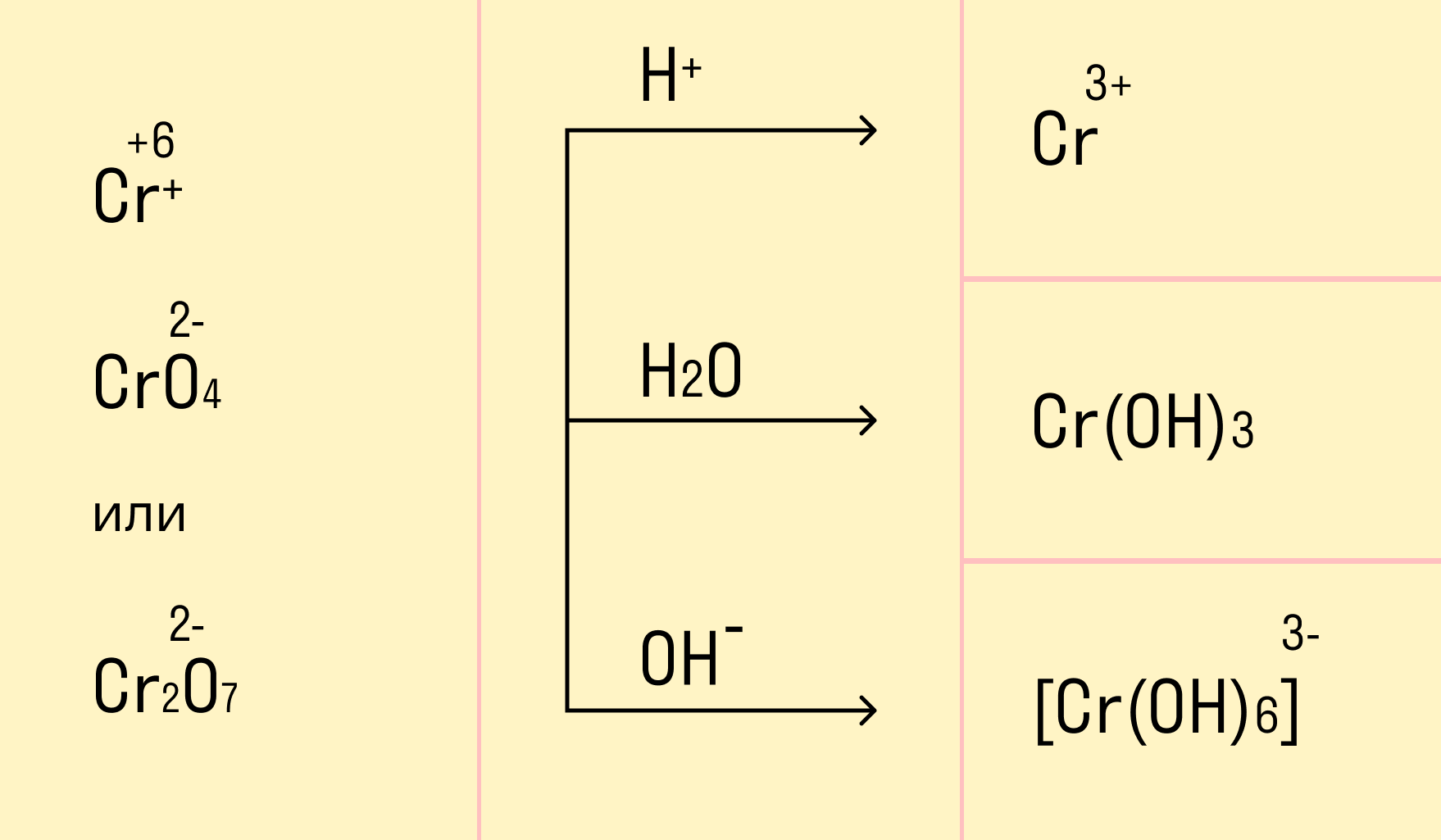
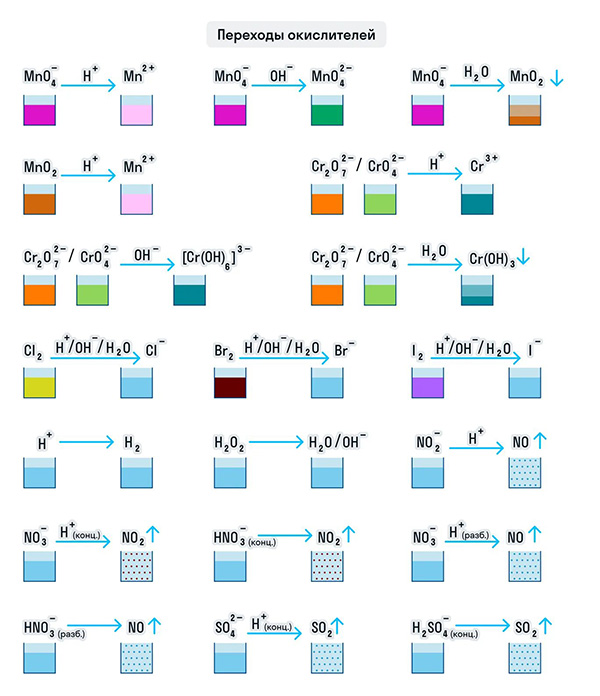
И марганец, и хром в кислой среде (H + ) образуют соли той кислоты, которая образовывала среду. В нейтральной среде (H2O) марганец превращается в оксид бурого цвета, а хром — в серо-зеленый нерастворимый в воде гидроксид. В щелочной среде (OH − ) марганец превращается в манганат (MnO4 2− ), а хром — в комплексное соединение светло-зеленого цвета.
Только окислителями могут быть простые вещества-неметаллы. Например, представители VIIA группы — галогены. Проявляя окислительные свойства в кислой среде, галогены восстанавливаются до соответствующих им галогеноводородных кислот: HF, HCl, HBr, HI. В щелочной среде образуются соли галогеноводородных кислот.
Кислород превращается в анион с устойчивой степенью окисления −2. А сера ведет себя как окислитель по отношению к водороду и металлам, образуя при этом сероводород и сульфиды.
Только окислителями могут быть и протон водорода (H + ) и катионы металлов в их высших степенях окисления при нескольких возможных. Ион Н + при взаимодействии с восстановителями переходит в газообразный водород (H2), а катионы металлов — в ионы с более низкой степенью окисления: 2CuCl2 + 2KI = CuCl + 2KCl + I2.
Рассмотрим как ведут себя сильные кислоты-окислители — азотная и серная. В зависимости от их концентрации меняются и продукты реакции.
Разбавленная азотная кислота никогда не реагирует с металлами с выделением водорода в отличие от разбавленной серной кислоты. Обе эти кислоты реагируют с металлами, стоящими в ряду активности после водорода.
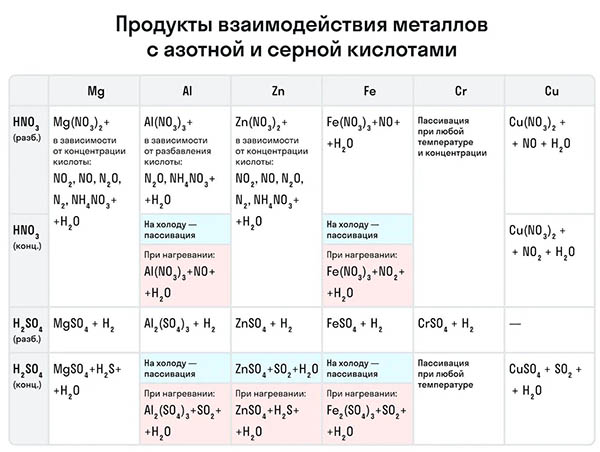
Эти кислоты проявляют окислительные способности и с некоторыми неметаллами, окисляя их до соответствующих кислот в высшей степени окисления неметалла-восстановителя.
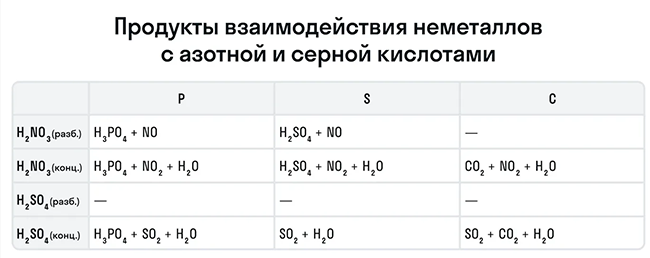
Для удобства мы собрали цвета переходов важнейших веществ-окислителей в одном месте.
Примеры веществ-восстановителей
Типичными восстановителями могут быть щелочные (IA) и щелочноземельные (IIA) металлы, цинк и алюминий, а также катионы металлов в своих низших степенях окисления при нескольких возможных. Например:
Типичными восстановителями также могут быть бескислородные кислоты и их соли. Например, H2S + 4Cl2 + 4H2O = 8HCl + H2SO4.
Гидриды активных металлов (щелочных и щелочноземельных) тоже являются типичными восстановителями. Например, NaH + H2O = NaOH + H2.
Для удобства мы собрали цвета переходов важнейших веществ-восстановителей в одном месте.

Окислительно-восстановительная двойственность
Окислительно-восстановительная двойственность — это способность атома проявлять как свойства окислителя, так и свойства восстановителя в зависимости от условия протекания химической реакции.
Разберем вещества, атомы которых обладают окислительно-восстановительной двойственностью.
По отношению к водороду и металлам сера играет роль окислителя: S + H2 = H2S.
При взаимодействии с сильными окислителями повышает свою степень окисления до +4 или +6: S + KMnO4 = K2SO4 + MnO2.
Кислородсодержащие соединения серы в степени окисления +4
Сера в сульфитах и сернистой кислоте при взаимодействии с сильными окислителями повышает степень окисления до +6: SO2 + 2HNO3 (конц) = H2SO4 + 2NO2.
С восстановителями соединения серы проявляют окислительные свойства, восстанавливаясь до степени окисления 0 или −2: SO2 + C = CO2 + S.
Пероксид водорода
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии восстановителей может понижать степень окисления до –2: 4H2O2 + PbS = PbSO4 + 4H2O.
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии окислителей может повышать степень окисления до 0: 3H2O2 + 2KMnO4 = 3O2 + 2MnO2 + 2KOH + 2H2O.
Простое вещество йод
Окислительная способность проявляется у йода в реакции с такими восстановителями, как сероводород, фосфор и металлы: I2 + H2S = S + 2HI.
Йод при взаимодействии с более сильными окислителями играет роль восстановителя: I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl.
Азотистая кислота и нитриты
При взаимодействии с более сильными окислителями азот повышает степень окисления до +5 и превращается либо в азотную кислоту из азотистой, либо в нитрат-анион из нитрит-аниона: 5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O.
При взаимодействии с сильными восстановителями обычно происходит восстановление до NO (иногда до других соединений азота в более низких степенях окисления): 2HNO2 + 2HI = 2NO + I2 + 2H2O.
Для удобства мы собрали представителей типичных окислителей и восстановителей в одну схему.

Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции можно поделить на четыре типа:
Рассмотрим каждую по отдельности.
Межмолекулярная ОВР — это реакция, окислитель и восстановитель которой являются различными веществами.
2KI + Br2 = 2KBr + I2, где Br2 — окислитель, а KI — восстановитель (за счёт I −1 ).
Внутримолекулярная ОВР — это реакция, в которой один атом является окислителем, а другой восстановителем в рамках одного соединения.
Пример такой окислительно-восстановительной реакции:
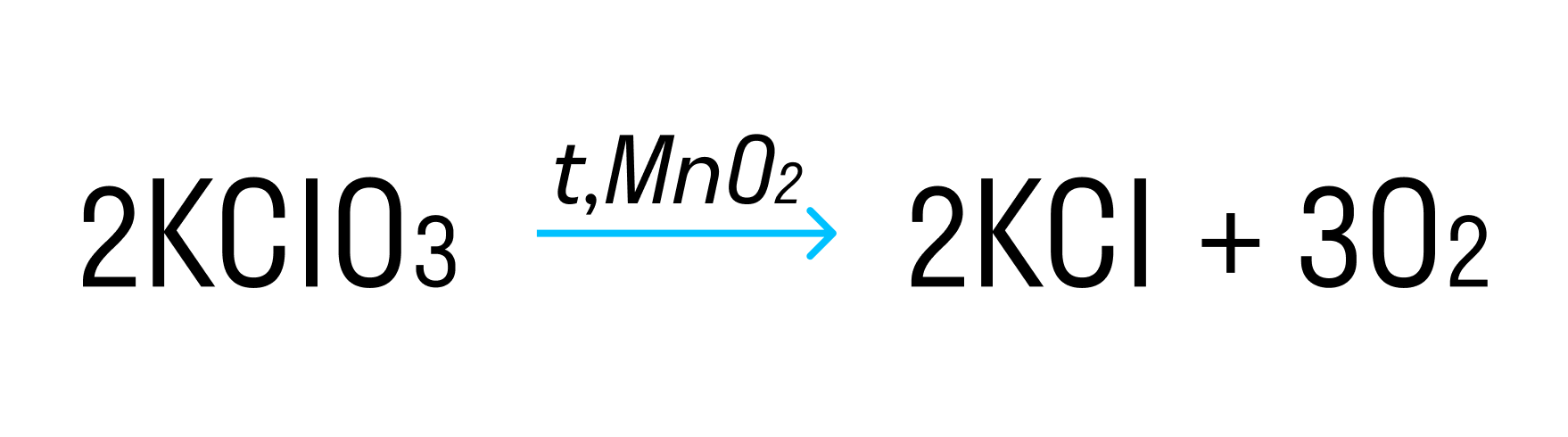
где Cl +5 — окислитель, а O −2 — восстановитель.
Термическое разложение нитратов — это внутримолекулярная ОВР. Вот схема разложения нитратов в зависимости от металла, входящего в состав соли.
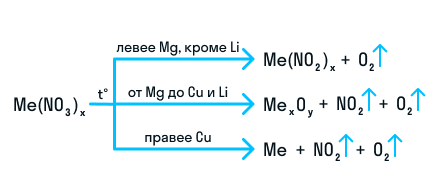
Исключение — разложение нитрата железа (II): 4Fe(NO3)2 = 2Fe2O3 + 8NO2 + O2. Здесь железо окисляется до +3 вопреки правилам. Иначе разлагается при нагревании и нитрат аммония: NH4NO3 = N2O + 2H2O.
Окислительно-восстановительная реакция диспропорционирования — это реакция, в ходе которой один и тот же атом является и окислителем, и восстановителем. Например, 3HNO2 = HNO3 + 2NO + H2O, где N +3 переходит в N +5 , являясь восстановителем, и N +3 переходит в N +2 , являясь окислителем.
Окислительно-восстановительная реакция контрпропорционирования — это реакция, в которой атомы одного и того же химического элемента в разных степенях окисления входят в состав разных веществ, при этом образуя новые молекулы одного и того же продукта.
Основные правила составления ОВР
Подобрать среди исходных веществ окислитель и восстановитель, а также вещество, которое отвечает за среду — при необходимости. Для этого нужно расставить степени окисления элементов и сравнить их окислительно-восстановительные свойства.
Составить уравнение реакции и записать продукты реакции. Следует помнить, что в кислой среде образуются соли одно-, двух- и трехзарядных катионов, а для создания среды чаще всего используют серную кислоту. В кислой среде невозможно образование оснóвных оксидов и гидроксидов, так как они вступят в реакцию с кислотой. В щелочной среде не могут образовываться кислоты и кислотные оксиды, а образуются соли.
Уравнять методом электронного баланса или методом полуреакций.
Составим алгоритм для уравнивания окислительно-восстановительных реакций методом электронного баланса.
Главное условие протекания ОВР — общее число электронов, отданных восстановителем, должно быть равно общему числу электронов, принятых окислителем.
Определите атомы, которые меняют свои степени окисления в ходе реакции.
Выпишите, сколько электронов принял окислитель и отдал восстановитель. Если восстановителей несколько, выписываем все.
Найдите НОК для суммарно отданных/принятых электронов.
Расставьте первые полученные коэффициенты перед окислителем и одним или несколькими восстановителями.
Уравняйте все присутствующие металлы в уравнении реакции.
Уравняйте кислотные остатки.
Уравняйте водород — в обеих частях его должно быть одинаковое количество.
Проверьте себя по кислороду — если все посчитано верно, то он сойдется.
Читайте также:
