Металлы в природе 9 класс
Обновлено: 17.05.2024
В данной разработке приведен подробный конспект урока химии в 9 классе по теме «Металлы в природе. Общие способы получения металлов». Содержание соответствует базовому курсу химии авт. О.С. Габриелян. К конспекту прилагается презентация (приложение1) и дополнительный материал(приложение 2).
| Вложение | Размер |
|---|---|
| konspekt_uroka_po_metallurgii._himiya._9kl.docx | 35.17 КБ |
| prilozhenie_1_k_uroku_po_metallurgii.him_.9kl.pptx | 114.33 КБ |
| prilozhenie_2_k_uroku_po_metallurgii.him_.9_kl.docx | 21.28 КБ |
Подтяните оценки и знания с репетитором Учи.ру
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Тема: «Металлы в природе. Общие способы получения металлов».
Цель: сформировать у учащихся представление о формах существования металлов в природе, познакомить с природными соединениями металлов; сформировать понятие о минералах и рудах. Познакомить учащихся с металлургией и ее разновидностями: пиро-, гидро- и электрометаллургией.
Оборудование: Учебник О.С. Габриелян. Химия. 9 класс; электронное приложение к учебнику, таблицы: «Производство чугуна», «Конвертор с кислородным дутьем», «Получение алюминия», коллекция руд железа и алюминия, компьютер, мультимедийный проектор.
Применяемые технологии:
Проверяет готовность учащихся
Подготовка к уроку
Актуализация знаний. Определение темы урока.
Беседа в формате вопрос-ответ:
-чем отличаются металлы натрий и золото?
-на какие группы можно разделить все металлы по их активности? К какой из них относится натрий? Золото?
-пользуясь какой таблицей мы можем судить об активности металлов?
- чем обусловлена активность металлов?
- вспомните, в каком виде золото можно найти в природе?
- а натрий в виде чистого металла мы сможем обнаружить в природе?
Сегодня и поговорим о природных соединениях металлов.
Диктует тему урока:
«Металлы в природе. Общие способы получения металлов»
Открывает презентацию к уроку
Слайд 1 Презентации (приложение 1)
-цветом, активностью, плотностью
- по своей активности металлы делятся на активные, средней активности и малоактивные. Натрий – активный металл, золото – малоактивный.
-электрохимический ряд напряжений металлов
- активность металлов обусловлена способностью к отдаче электронов: чем активнее металл, тем легче он отдает электроны
- в виде самородков
- нет. Натрий – активный металл: он очень активно взаимодействует с водой, кислородом и др. неметаллами, поэтому в природе он существует только в виде соединений
Записывают тему в тетрадь
Изучение нового материала.
Нахождение металлов в природе.
Способы получения металлов.
Слайд 2 Презентации (приложение 1):
Обратите внимание, что природные соединения металлов называются минералами. Металлы средней активности обычно существуют в природе в виде оксидов и сульфидов, активные металлы – в виде солей.
В быту мы окружены множеством изделий из различных металлов и сплавов. Узнаем как же из минералов можно получать металлы.
Минералы в природе обычно входят в состав руд.
Слайд 3 Презентации (приложение 1)
Откройте с. 75 учебника и прочитайте определение руды.
Дает определение металлургии.
Мы с вами уже обсудили как связана активность металлов с формами их существования в природе.
А как вы думаете: будет ли активность металлов влиять на выбор способа их получения?
Слайд 4 Презентации (приложение 1):
Просит переписать схему из слайда в тетрадь
Слайд 5 Презентации (приложение 1):
Дает определение пирометаллургии. Просит учащихся записать название способа, сырье и восстановители
Слайд 6 Презентации (приложение 1):
Просит записать подзаголовок со слайда и примеры реакций:
Оксид олова + углерод=
Оксид железа (III)+ оксид углерода (II)=
Показывает учащимся правильные уравнения, просит проверить.
Рассказывает учащимся о доменном производстве чугуна, о кислородном конвертере для производства стали. Демонстрирует таблицы «Производство чугуна», «Конвертор с кислородным дутьем». Далее рассказ учителя дополнительного материала (приложение 2).
Демонстрирует и комментирует видео «Кипящий слой» (ссылка на слайде 6 Презентации)
Слайд 7 Презентации (приложение 1):
Запишем пример восстановления металлов водородом, например, вольфрама из его оксида.
Демонстрирует уравнение реакции. Просит проверить.
Слайд 8 Презентации (приложение 1):
Просит записать подзаголовок слайда в тетрадь и составить в качестве примеров уравнения реакций восстановления алюминием оксида железа (III) и оксида марганца (IV).
Восстановление металлов алюминием – это экзотермический процесс. Демонстрирует видео «Алюминотермия» (ссылка на слайде 8 Презентации)
Слайд 9 Презентации (приложение 1):
Просит записать подзаголовок слайда в тетрадь и составить в качестве примера уравнения реакций получения цинка из его сульфида.
Слайд 10 Презентации (приложение 1):
Дает определение гидрометаллургии. Просит учащихся записать название способа и металлов, которые можно им получить.
Подчеркивает, что при таком способе получения нерастворимые соединения переводятся в растворимые, и уже растворы подвергаются переработке.
Слайд 11 Презентации (приложение 1):
Просит записать в тетрадь подпункт а) из слайда и в качестве примера составить уравнение реакции восстановления меди из ее сульфата железом.
Напоминает, что этот опыт ребята проводили, когда изучали химические свойства металлов.
Просит переписать в тетрадь текст пункта б) слайда и уравнение реакции.
Поясняет, что электролиз – это ОВР, проходящая под действием эл. тока. Более подробно этот процесс рассматривается в 11 классе.
Получение каких металлов мы с вами еще не обсудили?
Почему активные металлы нельзя получить пиро- и гидрометаллургией?
Учитель помогает ученикам наводящими вопросами сформулировать правильный ответ.
Итак, для получения активных (щелочных и щелочно-земельных) металлов нужен сильный восстановитель. И таким восстановителем является эл. ток. Его восстановительной способности хватит и для восстановления очень активных металлов (лития, натрия, калия и др.) Т.е. электролиз, о котором мы говорили выше, можно применять и для получения активных металлов.
Подумайте, можно ли получить активные металлы электролизом их водных растворов?
Поэтому для получения активных металлов эл. током действуют на расплавы их соединений.
Слайд 12 Презентации (приложение 1)
Дает определение электрометаллургии. Просит учащихся записать название способа и металлов, которые можно им получить.
Переписывают данные слайда в тетрадь. Рассматривают образцы минералов из коллекции.
- открывают учебник, читают определение.
Записывают в тетрадь формулу: руда = минерал + горная порода,
Обогащение руды – удаление из нее пустой породы.
-переписывают схему в тетрадь
- делают записи в тетрадь
- записывают текст слайда и составляют уравнения реакций
- проверяют правильность уравнений
- переписывают подзаголовок слайда в тетрадь, пишут уравнение реакции
-проверяют правильность составленного уравнения
- переписывают содержание слайда.
- делают запись в тетрадь, пишут уравнение реакции
- проверяют правильность уравнения
-делают записи в тетради
- активные металлы в природе находятся в виде солей. Чтобы их восстановить из солей, нужны сильные восстановители. Неметаллы такой силой не обладают, а очень активные металлы, например, нельзя применять как восстановители в гидрометаллургии, т.к. они взаимодействуют с водой.
- нет, потому что полученные металлы будут сразу же взаимодействовать с водой.
- делают записи в тетради
Осмысление и формулирование выводов по уроку.
В форме беседы помогает учащимся сформулировать выводы по теме урока:
1. Как вы думаете от чего зависит, в какой форме будет находиться металл в природе?
2. От чего зависит способ переработки руды для получения металла?
3. На чем основаны способы получения металлов из руд?
Таким образом, мы видим, что получение металлов зависит от химической активности металлов, то есть химических свойств, а также от количественного и качественного состава природных соединений металлов.
Записывают вывод в тетрадь
-форма нахождения металла в природе зависит от химической активности металла
-способ получения металла зависит от вида, в котором находится металл в природе, то есть от руды.
- в основе способов получения металлов лежат химические свойства самих металлов и их соединений, входящих в состав руд.
Предлагает выполнить упр.4 на с.80 учебника.
Предлагает проверить и обсудить решение.
Предлагает записать домашнее задание:
§12, записи в тетради – выучить.
Записывают домашнее задание.
Предварительный просмотр:
Подписи к слайдам:
Металлы в природе. Общие способы получения металлов. Химия 9 класс Урок 15 Автор: Ашмасова О.Е., учитель химии и биологии ОАНО КПГСПИК г. Балашиха, МО
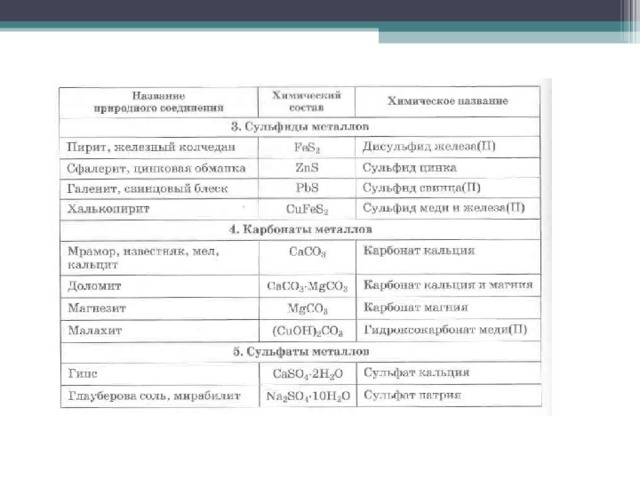
Нахождение металлов в природе В самородном виде ( малоактивные металлы: Ag, Pt , Au, реже Cu, Hg ) В виде минералов (химические природные соединения): Оксиды металлов средней активности : красный железняк Fe 2 O 3 ; бурый железняк 2 Fe 2 O 3 . 3Н 2 O ; магнитный железняк Fe 3 O 4 Сульфиды металлов малой и средней активности : свинцовый блеск PbS , цинковая обманка ZnS , киноварь HgS Соли активных металлов: мел, мрамор, известняк CaCO 3 , галит NaCl , сильвинит KCl . NaCl , фтораппатит 3 Ca 3 (PO 4 ) 2 , фосфорит Ca 3 (PO 4 ) 2
Руда → минерал → металл Руда= минерал + пустая порода Обогащение руды – удаление из нее пустой породы Концентрат – обогащенная руда – сырье для металлургического производства Металлургия – наука о производстве металлов, сплавов и их обработке, а так же и отрасль тяжелой промышленности по производству металлов и сплавов.
1. Пирометаллургия – получение металлов из руд по реакциям восстановления при высоких температурах. Сырье: оксиды и сульфиды металлов малой и средней активности Восстановители: С, СО, Н 2 , Al
б) Восстановление водородом. Метод дорогостоящий, используется для получения редкоземельных металлов.
г) Получение из сульфидов происходит в 2 стадии: обжиг сульфидов до оксидов восстановление металлов из оксидов
2 . Гидрометаллургия – получение металлов из растворов солей.(Медь, золото, серебро, магний, цинк, молибден, уран).
а) Восстановление более активным металлом . б ) Электролиз растворов солей.
3. Электрометаллургия – получение активных металлов из расплавов солей под действием электрического тока. Получают щелочные и щелочноземельные металлы (первая и вторая группа, главная подгруппа).
Приложение 2 (доп. материал к слайду 6)
Внедоменные способы получения железа
В ХIХ-ХХ веках большое количество чугуна и железа получали пиротехническим способом в специальных печах домнах, а потом уже из чугуна получали сталь в конверторах. Домны и конверторы – это металлургические печи довольно больших размеров см. таблица «Производство чугуна», «Конвертор с кислородным дутьем»». Выпуск чугуна и стали в них исчислялся миллионами тонн в год.
В настоящее время нет необходимости в таком количестве чугуна и стали, да и природные ресурсы металлических руд и коксующегося каменного угля значительно снизились. Все больше внимания уделяется методам прямого получения железа.
Под процессами прямого получения железа понимают такие процессы, которые дают возможность получать металлическое железо непосредственно из руды, минуя доменную печь.
Методы прямого получения железа из руд известны давно, но пока не нашли широкого применения.
Интересны они тем, что позволяют вести процесс не расходуя металлургический кокс, заменяя его другими видами топлива; получать чистый металл благодаря развитию способов глубокого обогащения руд, обеспечивающих высокое содержание железа в концентратах, но и полное освобождение от фосфора, серы и других примесей. Этого нельзя достичь при доменной плавке.
Большой интерес представляет собой прямое получение легированного железа (вспомните, что это такое) из комплексных руд, содержащих хром, никель, ванадий и другие полезные компоненты. Традиционная двух стадийная технология переработки таких руд на металлургических предприятиях ведется с большими потерями указанных элементов.
Немаловажным преимуществом прямых способов получения железа является возможность организации маломасштабного производства.
Опыт показал, что прямые способы целесообразно применять для получения губчатого железа, используемого при выплавке стали, а также производства железного порошка.
Наибольшее распространение получили способы восстановления с использованием различных агрегатов: шахтных печей и реторт, вращающихся печей, движущейся колосниковой решетки, реакторов кипящего слоя. Для процессов прямого получения железа применяют газообразные или твердые восстановители.
Некоторые полезные технологические принципы доменного производства перешли и сюда. Например, технология «кипящего слоя».
Демонстрируется видео «Кипящий слой» (ссылка на сл. № 6 в презентации к уроку)
В специальную печь на решетку помещают измельченную руду и твердый восстановитель (например, уголь), а снизу подают поток горячего воздуха. Твердые частички током воздуха поднимаются вверх, образуя движущийся слой. Если применяют газообразный восстановитель (СО или водород), то его нагревают подают снизу и частички руды «парят» в потоке восстановителя. Важно точно соблюдать температурный режим, чтобы частички не спекались, и процесс восстановления проходил более полно.
Презентация к уроку химии "Металлы в природе. Способы получения металлов"

Данная презентация разработана для урока химии в 9 классе. Тема урока:"Металлы в природе. Способы получения металлов". Материал презентации позволит учителю: 1) проверить как учащимися усвоен ранее изученный материал "Характеристика металлов по положению в Периодической системе Д.И. Менделеева"; 2) сэкономит время урока, так как основные моменты и вопросы учителя выведены на экран; 3) через рефлексию в конце урока понять насколько успешно прошел урок для каждого учащегося.
Просмотр содержимого документа
«Презентация к уроку химии "Металлы в природе. Способы получения металлов" »

МЕТАЛЛЫ В ПРИРОДЕ ОБЩИЕ СПОСОБЫ ПОЛУЧЕНИЯ МЕТАЛЛОВ.
Учитель химии: Голикова Екатерина Владимировна,
МОУ СОШ№2 ЗАТО Светлый

Металлы, встречающиеся в природе в свободном состоянии:
Это малоактивные металлы .
Их называют - самородками


Из активных металлов в самородном виде встречается только железо метеоритного происхождения.

В основном металлы присутствуют в природе в виде соединений – оксидов и солей (галогенидов, сульфидов, карбонатов, сульфатов).

- от греческого – «металлон» – шахта, рудник
- от греческого – «металлон» – шахта, рудник
Минералы и горные породы, которые используют для промышленного получения металлов, называют рудами.

Предварительная обработка руды.
2ZnS + 3O₂=2ZnO + 2SO₂

Какую степень окисления имеют металлы в природных соединениях и сырье, подготовленном для металлургического производства?
Во всех соединениях они имеют положительную степень окисления, то есть являются катионами: М ⁿ ⁺
Что необходимо сделать, чтобы получить чистый металл?

В зависимости от способа восстановления металлов, существует несколько видов металлургического производства.
- Пирометаллургия (от греч. «пирос» – огонь)
- восстановитель: углерод (кокс)
C + O₂ = CO₂ + Q
Fe₂O₃ + 3CO = 2Fe + 3CO₂

2) восстановитель: водород
WO₃ + 3H₂ = W + 3H₂O
3) металлотермия – вытеснение более активным металлом.
Cr₂O₃ + 2Al = 2Cr + Al₂O₃
Как называется этот способ?

II . Гидрометаллургия (от греческого «гидро» – вода).
Подумайте: в каком агрегатном состоянии должен находиться металл?
CuO + H₂SO₄ = CuSO₄ + H₂O
Fe + CuSO₄ = FeSO₄ + Cu

III . Электрометаллургия.
Активные металлы из природных соединений очень трудно восстановить с помощью химических веществ.
В начале XIX в. английский химик и физик Г. Дэви предложил использовать в качестве восстановителя не химические вещества, а электрический ток.
Химические реакции, протекающие под действием электрического тока, называют электролизом.

2 NaCl ( расплав) 2 Na + Cl ₂
Na ⁺ + 1ē Na °
2Cl⁻ - 2ē Cl ₂ °

Получение алюминия из оксида алюминия.
Окисд алюминия растворяют в расплавленном минерале криолите : Na₃AlF₆
1. Общая характеристика элементов металлов
Из \(118\) известных на данный момент химических элементов \(96\) образуют простые вещества с металлическими свойствами, поэтому их называют металлическими элементами .
Металлические химические элементы в природе могут встречаться как в виде простых веществ, так и в виде соединений. То, в каком виде встречаются металлические элементы в природе, зависит от химической активности образуемых ими металлов.
Металлические элементы, образующие химически активные металлы ( Li–Mg ), в природе чаще всего встречаются в виде солей (хлоридов, фторидов, сульфатов, фосфатов и других).
Соли, образуемые этими металлами, являются главной составной частью распространённых в земной коре минералов и горных пород.


В растворённом виде соли натрия, кальция и магния содержатся в природных водах. Кроме того, соли активных металлов — важная составная часть живых организмов. Например, фосфат кальция Ca 3 ( P O 4 ) 2 является главной минеральной составной частью костной ткани.
Металлические химические элементы, образующие металлы средней активности ( Al–Pb ), в природе чаще всего встречаются в виде оксидов и сульфидов.


Металлические элементы, образующие химически неактивные металлы ( Cu–Au ), в природе чаще всего встречаются в виде простых веществ.
 |  |  |
| Рис. \(7\). Самородное золото Au | Рис. \(8\). Самородное серебро Ag | Рис. \(9\). Самородная платина Pt |
Исключение составляют медь и ртуть, которые в природе встречаются также в виде химических соединений.

В Периодической системе химических элементов металлы занимают левый нижний угол и находятся в главных (А) и побочных (Б) группах.
Рис. \(13\). Положение металлов в Периодической системе. Знаки металлических химических элементов расположены ниже ломаной линии B — Si — As — Te
В электронной оболочке атомов металлов на внешнем энергетическом уровне, как правило, содержится от \(1\) до \(3\) электронов. Исключение составляют только металлы \(IV\)А, \(V\)А и \(VI\)А группы, у которых на наружном энергетическом уровне находятся соответственно четыре, пять или шесть электронов.
В атомах металлов главных подгрупп валентные электроны располагаются на внешнем энергетическом уровне, а у металлов побочных подгрупп — ещё и на предвнешнем энергетическом уровне.
Радиусы атомов металлов больше, чем у атомов неметаллов того же периода. В силу отдалённости положительно заряженного ядра атомы металлов слабо удерживают свои валентные электроны.
Рис. \(14\). Характер изменения радиусов атомов химических элементов в периодах и в группах. Радиусы атомов металлов существенно больше, чем радиусы атомов неметаллов, находящихся в том же периоде
Главное отличительное свойство металлов — это их сравнительно невысокая электроотрицательность (ЭО) по сравнению с неметаллами.

Рис. \(15\). Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу). ОЭО металлических химических элементов уступает соответствующей величине неметаллических химических элементов
Атомы металлов, вступая в химические реакции, способны только отдавать электроны, то есть окисляться, следовательно, в ходе превращений могут проявлять себя в качестве восстановителей .
Нахождение металлов в природе

Содержимое разработки
Тема: Нахождение металлов в природе
- ознакомить учащихся с наиболее распространенными элементами в земной коре;
- ознакомить учащихся с важнейшими соединениями металлов в природе (руды и минералы);
- указать на значение металлов и их соединений в организме человека и других живых организмов;
-обозначить экологические проблемы, возникающие при загрязнении окружающей среды тяжелыми металлами и их соединениями.
Тип урока: комбинированный.
Формы работы учащихся: фронтальная работа, работа в группах, индивидуальная работа, работа в парах.
Оборудование урока: мультимедийная презентация и оборудование для ее демонстрации, индивидуальные устройства для работы в сети Интернет.
Материалы урока: учебное пособие для 8 класса, листочки с фронтальными, индивидуальными и групповыми заданиями, а также заданием для рефлексии (см. Приложения)
Формы и методы: объяснительно-иллюстративный, фронтальный, наглядный, работа с книгой.
Целеполагание и мотивация
Первичное усвоение и осмысление учебного материала
Закрепление и систематизация знаний и умений
Применение знаний и умений
Проверка уровня усвоения знаний и умений
Инструктаж по дом. заданию
Рефлексия (подведение итогов)
Оргмомент (приветствие, проверка отсутствующих, проверка готовности учащихся к уроку, инструктаж по взаимопроверке знаний)
Теория, мой друг, суха, но зеленеет жизни древо… (И.Гете)
- проверка домашнего задания письменно на доске (с.174 № 3, 5 устно, 9*)
- вопросы № 1,2 (фронтально)
- тест по домашнему параграфу (фронтально)
3. Целеполагание и мотивация
Давайте вместе сформулируем тему нашего урока: природа, в, нахождение, металлы.
Правильно, тема нашего урока «Нахождение металлов в природе». Прежде чем мы с вами отправимся в путешествие, у нас должна быть карта. Давайте вместе ее составим. Как вы думаете, какие вопросы мы будем сегодня рассматривать?
Давайте разделимся на 4 группы и каждая группа ответит на этот вопрос с помощью подсказок (Приложение).
4. Первичное усвоение и осмысление учебного материала
Рассказ учителя (о самых распространенных элементах в земной коре)
5.Закрепление и систематизация знаний и умений
Работа с минералами
6. Применение знаний и умений (работа в парах)
Пара 3: Определите химическое количество 5 г. кальция.
Пара 4: Определите объем 44,8 дм 3 углекислого газа.
Пара 5: Назовите 5 металлов, которые будут реагировать с соляной кислотой.
Напишите 2 уравнения соответствующих реакций.
Пара 6: Назовите 5 металлов, которые будут реагировать с серной кислотой.
Пара 7: Назовите 5 элементов-металлов.
Пара 8: Составьте уравнения реакций и расставьте коэффициенты:
Индивидуальное задание 1:
1.Назовите 3 металла, которые не реагируют с кислотами.
2. Назовите 3 минерала, в которых содержится железо.
Индивидуальное задание 2: Определите объем водорода, который выделится
при взаимодействии 5 г. кальция с соляной кислотой.
Индивидуальное задание 3: Определите массовую долю меди в малахите.
7. Проверка уровня усвоения знаний производится учителем с помощью учащихся класса в процессе работы учащихся и затем выставляется соответствующая отметка в журнал и дневник учащегося.
8. Инструктаж по дом. заданию: параграф 36, задания 3,6
9. Рефлексия (подведение итогов)
Если вы согласны с утверждением, поставьте плюс:
1. Я узнал много нового и интересного.
2. На все возникшие в ходе урока вопросы я получил ответы.
3. Мне это пригодится в будущей профессиональной деятельности и в повседневной жизни.
Открытый урок в 9 классе "Нахождение металлов в природе. Применение металлов, их значение для живых организмов
методическая разработка по химии (9 класс) по теме
Урок направлен на углубление знаний учащихся о применении металлов, их значении в жизни растений, животных и человека.
| Вложение | Размер |
|---|---|
| urok_metally.doc | 468.5 КБ |
МОУ Чулковская средняя
общеобразовательная школа №20
Учитель: Кудряшова Л.А.
Открытый урок в 9-м классе
Эпиграф: «Просто знать еще не всё, знания надо уметь использовать»
Тема: «Нахождение металлов в природе. Применение металлов, их значение для живых организмов»
Цель: Углубление знаний учащихся о применении металлов, их значении в жизни растений, животных и человека .
- Дать представление о нахождении металлов в природе , сформировать представления о взаимосвязи химических и биологических процессов в живых организмах
- Развивать навыки научно-исследовательской работы учащихся, их творческой и деловой активности;
- Создавать условия для самостоятельной и продуктивной работы с различными источниками информации;
- Формировать ответственное отношение к делу, воспитывать бережное отношение к природе;
- Развивать умение владеть химической терминологией, четко формулировать и высказывать мысли, интерес к предмету, эрудицию.
План конспект урока
Тема: Нахождение металлов в природе. Применение металлов, их значение для живых организмов.
Цель: Углубление знаний учащихся о применении металлов, их значении в жизни растений, животных и человека.
Развивающие: Способствовать на уроке развитию умений: анализировать, сравнивать, логически мыслить, обоснованно высказывать свою точку зрения, развивать познавательный интерес, через реализацию меж предметных связей между курсами химии и биологии, а также формированию навыков работы с различными информационными источниками: таблицами, схемами.
Образовательные : Создать условия способствующие восприятию материала темы, конкретизации имеющихся знаний о нахождении металлов в природе, а также осознанного понимания биологической роли металлов в жизнедеятельности живых организмов.
Воспитательные: Обеспечить условия для развития коммуникативных способностей: умений слушать и слышать своих товарищей; волевых качеств – ответственности, толерантности. Формировать представления о взаимосвязи химических и биологических процессов в живых организмах.
Приветствие гостей и учащихся
Учитель читает загадку: (1 слайд)
Я твердый, ковкий и пластичный,
Блестящий, нужный всем, практичный.
Я вам уже подсказку дал,
Так кто же я такой…?
Ребята, мы с вами уже несколько уроков изучаем металлы и сегодня продолжим подробно знакомиться с этими веществами, но прежде давайте повторим основные знания о металлах, которые мы получили на прошлых уроках.
2. Актуализация опорных знаний
У доски двое учащихся решают домашние задачи. (Слайд №2)
Задание первому ученику решить задачу:
Некий жилец второго подъезда пришел в гости в квартиру №8 поиграть в шахматы. Кто из них не уступил пешку или шах поставил – неизвестно. Но только в результате жилец массой 0,8 г крупно провзаимодействовал с жильцом квартиры №8. массой 0,32г. Определите, как звали пропавшего жильца, который любил ходить в гости?
Задание второму ученику написать уравнения реакций получения меди разными способами.
Царь зовет к себе Стрельца - удалого молодца
И дает ему поручение государственного значения:
«Чтоб я стал очень богат, нужен меди целый склад
Ночь даю тебе подумать, утром буду ждать доклад!
Не смогешь – кого винить? Должен я тебя казнить.
Запиши себе названье, чтоб со страху не забыть».
А в это время учитель с учениками разгадывает кроссворд по физическим свойствам металлов. (Слайд№3).
Далее проверяем решение на доске домашнего задания. По ходу, которого задаем вопросы:
- Как же звали пропавшего жильца?
- Как учащийся определил валентность металла?
- Где в таблице Менделеева располагаются металлы?
- Какой элемент располагается в квартире №8?
- К какому типу реакций относится реакция взаимодействия кальция и кислорода?
- К каким видам металлургии относятся данные реакции?
- В ходе, каких реакций изменяется степень окисления элементов?
- Как называются эти реакции
Загадочная пауза, для всего класса
Разговор - ртуть, крик – платина.
Гладь металл, пока холодно.
Пролежал холод, сушь и оловянные трубы.
Не та грязь, что тусклая.
Звери живут за неметалл.
В это время два ученика у доски выполняют задания
1 ученик пишет электронный баланс к реакции горения кальция
2 ученик пишет полное и краткое ионное уравнение к реакции взаимодействия оксида меди с серной кислотой. В
Подведение итогов по проверке домашнего и дополнительного задания.
Таким образом, мы вспомнили, что…
Металлов много есть, но дело не в количестве:
В команде работящей металлической
Такие мастера, такие личности!
Преуменьшать нам вовсе не пристало
Заслуги безусловные металлов
Пред египтянином, китайцем, древним греком
И каждым современным человеком.
Итак сегодня на уроке мы поговорим о заслугах металлов и их значении в нашей жизни. Запишем в тетради тему урока:
«Нахождение металлов в природе. Применение металлов, их значение для живых организмов.» (Слайд №4)
А вот о применении металлов нам расскажет Стрельцова С., которая подготовила по этой теме небольшую мультимедийную презентацию используя стихотворение Ефима Ефимовского:
Металл – это точность.
Металл – это прочность,
Блеск и красота.
Не сразу в дом пришел металл,
Не сразу ложкой, вилкой стал.
Не сразу стал он кружкой
И заводской игрушкой.
Был путь металла долог:
Сперва пришел геолог.
Нашел он гору – в ней руда.
И горняки пришли туда.
И машинист дает гудок –
К печам руду доставит в срок.
И металлический ручей
Течет из огненных печей.
Еще работе не конец:
Придут и токарь и кузнец,
Слесарь и штамповщик,
И каждый вложит труд в металл,
Чтобы металл трудиться стал.
Он в проводах несет нам свет,
Металл – коньки, велосипед,
Метро, трамвай, будильник,
Утюг и холодильник.
- Где применяют металлы?
- Люди, каких профессий работают с металлами?
Значение металлов в нашей жизни трудно переоценить, оно однозначно очень велико, но сегодня мы на уроке поговорим и о значении металлов в жизни растений.
Ионы металлов – непременные участники биохимических процессов: они стимулируют, нормализуют обмен веществ, оказывают положительное действие на рост и размножение, на иммунологическую активность организма и продолжительность жизни. Все вы знаете, такое вещество, как хлорофилл, без него не может быть фотосинтеза – протекающего в зеленых листьях. В его состав в окисленном состоянии входит ион магния. А вот железо принимает участие в окислительных процессах протоплазмы при дыхании растений и в построении хлорофилла, хотя само и не входит в его состав. При недостатке этих элементов у зеленых растений возникает мраморность окраски листьев. Итак, металлы встречаются в растениях. А могут ли растения рассказать о металлах? В «Уральских сказах» П.П. Бажов писал о волшебных цветах и разрыв-траве, открывающих людям кладовые золота, железа, меди. Растения, которые указывают на наличие рудных месторождений, ученые называют рудознатцами. В последние десятилетия были найдены научно обоснованные связи между теми или иными растениями и месторождениями полезных ископаемых. Оказалось, что по внешнему виду или химическому составу некоторых растений можно судить, какие руды залегают в местах их произрастания. Например, Жимолость и пахучая гвоздика указывают на месторождения золота, а анютины глазки и фиалки на цинковые руды. Повышенное содержание в почве некоторых металлов изменяет обычную для растений окраску цветов и листьев. Так, избыток меди в почве вызывает появление синих и голубых тонов: лепестки роз голубеют, листья эшшольции становятся лимонными. А в горах Армении найдены красивые маки с черными пятнами на ярко-красных лепестках. Под маками оказалось месторождение молибдена, который и «нарисовал» черные узоры. Поэтому геологи, прежде чем начать подземные работы, очень внимательно изучают растительность.
А человек? Зависит ли наша жизнь и здоровье от металлических элементов. Ответ на этот вопрос мы спросим у ребят. Эту информацию они нашли при выполнении домашнего творческого задания. При этом мы проведем небольшое соревнование между рядами. За каждый ответ ряд получает фишку, если ответ развернутый , то за это положены дополнительные очки. В ходе беседы на мультимедийной доске учитель заполняет схему (такая же схема в раздаточном материале на столах у учащихся и они заполняют её вместе с учителем)
Биологическая роль металлов
Подводя итоги, хочется отметить, что в организме человека и животных с помощью современных аналитических методов исследования обнаружено около 70 химических элементов. Их можно разделить на 3 группы:
- макроэлементы, концентрация которых превышает 10 -3 % (К, Na, Ca, Mg, Fe);
- микроэлементы, доля которых составляет от 10 -3 до 10 -6 % (Mn,Zn,Cu,Sr, Bi, Ba, Co, Al, V,Cr и др.);
- ультромикроэлементы, содержание которых не превышает 10 -6 % (Hg, Au, Pb,Po,Ag и др.).
Да здесь почти вся таблица Менделеева. Получается, что наш организм испытывает постоянный «металлический» голод, который мы утоляем, употребляя в пищу, продукты богатые этими элементами. А что это за продукты? Ну, например, картофель, посмотрите, сколько элементов содержится в нем.
Читайте также:
