Металлы в природе презентация
Обновлено: 19.09.2024
В самородном виде
и в виде соединений находятся в
природе серебро, медь,
ртуть и олово.
Металлы, которые находятся в
ряду напряжений до олова,
встречаются в природе только
в виде соединений - минералов
Металлы низкой активности
Активные металлы
Менее активные металлы
?
?
?
Золото в природе чрезвычайно рассеяно.
По распространенности в земной коре оно занимает 74 место. Но оно содержится везде: в земле, воде, в организмах растений и животных. И всё это составляет около 100 млрд. тонн.
Крупнейшие в мире золотые самородки были найдены в Австралии, они весили 86 и 112 кг.
Я солнцу подобно, и ярче огня,
Монеты и слитки куют из меня
Платина относится к наименее распространенным в природе элементам. Земная кора содержит 5×10−7% платины. В самородном состоянии встречается в основном в виде сплавов с другими металлами, например, золотом и железом.
Самым крупным существующим в настоящий момент платиновым самородком является «Уральский гигант» весом 7 кг 860,5 г.
Был обнаружен в 1904 г.
На букву «П» моё названье,
Я с золотом дружу,
И в корону для красавиц
Вместе с золотом вхожу.
По распространенности в земной коре занимает 67 место, но запасы его в 20 раз больше, чем золота. Самый крупный самородок серебра весил 13,5 тонн.
Известно я давным-давно.
Чтоб не испортилась вода,
Меня в походы брали.
И мной героев награждали.
Иду на мелкую монету,
В колоколах люблю звенеть,
Мне ставят памятник за это
И знают: имя мое -
По распространенности в земной коре занимает 26 место.
Самый большой самородок меди весил 420 тонн. Был найден в 1857 г. в США.
Выступающие части этого самородка были отбиты каменными топорами
По распространенности занимает 66 место.
В самородном виде встречается редко, причем чаще её находят в виде сплавов (амальгам) с золотом, серебром и палладием.
Когда случайно я прольюсь
– блестящим шариком качусь
Руды – содержащие минералы природные образования, в которых металлы находятся в количествах, пригодных в технологическом и экономическом отношении для получения металлов в промышленности. В основном металлы получают из оксидных и сульфидных руд.
Сульфидные руды
Медный колчедан - CuFeS2
Цинковая обманка - ZnS
Свинцовый блеск (галенит) - PbS
Сульфид ртути (киноварь) - HgS
Бурый железняк (лимонит) – 2Fe2O3·3H2O
Среди металлов самый славный,
важнейший в мире элемент.
Железо
Магнитный железняк
(магнетит) –Fe3O4
Красный железняк
(гематит) – Fe2O3
Подумайте:
1. Чем различаются руды железа?
2. Какую руду лучше использовать для получения железа?
Исследование свойств руд железа
?
Подумайте:
Какой основной химический процесс лежит в основе получения металлов?
Процесс восстановления
Mn+ + nē = M0
Связаны с промышленным получением металлов из природного сырья
?
Основателем науки о металлах в России считается великий русский ученый М. В. Ломоносов.
Ему принадлежит первый в России учебник по горному делу и металлургии.
Несколько поколений русских инженеров воспитывалось на этом замечательном труде. Среди них П. П. Аносов.
1711 - 1765
Михаил Васильевич Ломоносов
Разработал способ получения булатной стали.
Он впервые использовал микроскоп для исследования внутреннего строения металлов.
Труды Аносова были продолжены Д. К. Черновым
1799 - 1851
Павел Петрович Аносов
Является основоположником
современного металловедения и металлографии – науки о строении металлов и сплавов.
Его научные открытия легли в основу производства высококачественных чугуна и стали.
1839 -1921
Дмитрий Константинович Чернов
Открыл процесс вытеснения металлов из растворов солей под действием других металлов и металлотермический метод.
Показал, что алюминий при высокой температуре восстанавливает оксиды до металлов.
1827 - 1911
Николай Николаевич Бекетов
«Металлург»,
Л. Татьяничева
Я в космос не летал.
Но эта сталь
— Моя.
А это значит,
Помогал и я
Достичь тебе
Загадочной звезды,
Которую держал
В своих ладонях ты.
Я в космос не летал.
В грохочущей ночи
С любовью я ковал
Путей твоих лучи.
Я отдых отвергал
И годы напролет
Сто тысяч сил впрягал
В твой чудо-звездолет.
Сильна моя ладонь.
Сильнее, чем металл,
Чем стужа и огонь.
А в космос — не летал!
«Россия, богатая железными рудами различного свойства, не бедна и искусными руками», - писал Аносов П.П. Этими искусными руками являются руки металлургов.
Профессию металлурга по значимости можно сравнить с профессией хлебороба. Хлебороб создает пищу для людей, а металлург – то, без чего не невозможно представить машины, дома технику.
Поэтому людям этой профессии поэты посвящают стихи:
Указом Президиума Верховного Совета СССР в 1957 году был утвержден День металлурга , с тех пор третье воскресенье июля стало праздничным днем для всех работников отрасли.
Россия занимает первое место по производству и экспорту никеля
Второе место по производству алюминия и титана
Третье место по экспорту металлопродукции
Четвертое место по производству стали
методы переработки руд, основанные на химических реакциях, происходящих при высоких температурах (греч. пирос – огонь).
Стадии получения и уравнения реакций:
медь, цинк, хром и др.
Получаемые металлы:
Алюминотермия –
восстановление металлов из оксидов с помощью алюминия
Способы получения металлов
1. Обжиг руды
2. Плавка - восстановление металлов из оксидов с помощью
угля, водорода, оксида углерода (II), более активных
металлов
ZnO + C = Zn + CO ↑
2ZnS + 3O2 = 2ZnO + 2SO2 ↑
Природное соединение растворяют в подходящем реагенте с целью получения раствора соли этого металла CuO + 2HCl = CuCl2 + H2O
Гидрометаллургия
методы получения металлов, основанные на химических реакциях, происходящих в растворах.
Стадии получения и уравнения реакций:
Получаемые металлы:
серебро, цинк молибден, золото, уран, медь и др.
Способы получения металлов
Из полученного раствора данный металл вытесняют более активным или восстанавливают электролизом
CuCl2 (раствор) + Fe = FeCl2 + Cu
методы получения металлов, основанные на электролизе, т.е. выделение металлов из растворов или расплавов их соединений с помощью электрического тока.
Электрометаллургия –
CuCl2
расплав
Уравнение реакции электролиза:
электролиз
Cu + Cl2
Получаемые металлы:
щелочные, щелочноземельные и алюминий
Негативное воздействие на окружающую среду:
1.Загрязнение почвы по причине массового складирования отходов.
Для выработки 1 т стали необходимо 3 т сырья. Поэтому образующиеся после выплавки стали шлаки также складируют в отвалы, что крайне пагубно влияет на почву.
Например, в уральском регионе скопилось 6 млрд. тонн отходов.
Предприятия черной металлургии выбрасывают в атмосферу 25% металлосодержащей пыли и оксида углерода (II) от общего количества этих веществ, попадающих в атмосферу.
На металлургию приходится 50 % выброса сернистого газа.
Также выбрасываются токсичные для человека вещества: бензопирен, фториды, соединения марганца, вольфрама, хрома и других металлов.
Металлургия использует 25% от всей потребляемой российской промышленностью воды. Например, для получения 1 т. алюминия используется 1150 т. воды, 1 т. никеля – 4000 т. В водоемы возвращается 60-70 % чистой воды и 30-40 % загрязненной различными примесями и вредными соединениями
Переработка и
использование отходов
Строительство очистных
сооружений и
замкнутых систем
водоснабжения
Разработка
новых технологий
Будущее за новыми чистыми технологиями
Существуют проекты добычи руды не нарушая ландшафт, с помощью биотехнологий. Используют рудные растворы с тионовыми и железо-бактериями, способными переводить нерастворимые сульфиды в растворимые сульфаты, которые подаются на гидрометаллургическую переработку.
Преимущества метода:
Используется на месте залегания руд.
Не загрязняется окружающая среда.
ТЕСТ на тему: «Металлы в природе. Общие способы их получения.»
1
2
3
4
5
Вариант 1
Современные очистные сооружения на предприятиях достаточно эффективны, но имеют высокую стоимость. Будучи директором крупного завода и имея в своем распоряжении значительную сумму денег, как вы поступите:
а)положите в банк для уплаты штрафов за загрязнение природной среды;
б) вложите в строительство очистных сооружений;
в)часть вложите в расширение производства, часть – для повышение зарплаты рабочих.
Из природных веществ можно назвать рудой:
а) мел; б) гранит; в) бурый железняк; г) песок
Кому принадлежал первый в России учебник по горному делу и металлургии:
а) Н.К. Чернову; ) П.П. Аносову; в) Н.Н. Бекетову; г) М.В. Ломоносову
Гидрометаллургия представляет собой получение металлов:
а) обжигом сульфидов;
б) переводом их соединений в раствор с последующим восстановлением;
в) обработку руды водяным паром
С помощью электролиза впервые был получен металл:
а) медь; б) железо; в) свинец; г) натрий
ТЕСТ на тему: «Металлы в природе. Общие способы их получения.»
Вариант 2
Вы работаете на металлургическом заводе и случайно узнаете о неисправности в системе очистных сооружений. Как вы поступите:
а) сообщите директору завода, чтобы он принял решение;
б) сделаете вид, что вам ничего неизвестно о неисправности;
в) скажете директору и, если он не примет меры, будете активно действовать сами
К рудам не относится:
а) мрамор; б) магнитит; в) галенит; г) лимонит.
Среди минералов не встречаются:
а) оксиды металлов; б) сульфиды металлов; в) гидриды металлов; г) силикаты металлов
Металлический марганец получают алюминотермией из оксида марганца (IV)/ Составьте уравнение реакции. Сумма коэффициентов в правой части уравнения равна:
а) 4; б) 5; в) 6; г) 7.
В настоящее время для получения хрома в качестве восстановителя чаще всего используется:
а) медь; б) натрий; в) хлор; г) алюминий
Проверь себя
Из записанных уравнений выберите те, которые относятся к пирометаллургическому способу:
2ZnS + 3O2 = 2 ZnO + 2SO2
ZnSO4 +Mg = MgSO4 + Zn
ZnO + CO = Zn + CO2
ZnO + H2SO4 = ZnSO4 + H2
ZnSO4 +Mg = MgSO4 + Zn
ZnO + H2SO4 = ZnSO4 + H2
ZnSO4 +Mg = MgSO4 + Zn
ZnO + H2SO4 = ZnSO4 + H2
2ZnS + 3O2 = 2 ZnO + 2SO2
ZnO + CO = Zn + CO2
2ZnS + 3O2 = 2 ZnO + 2SO2
ZnO + CO = Zn + CO2
2ZnS + 3O2 = 2 ZnO + 2SO2
ZnO + CO = Zn + CO2
2ZnS + 3O2 = 2 ZnO + 2SO2
ZnO + CO = Zn + CO2
Металлы в природе.
презентация к уроку химии (9 класс) по теме
В презентации "Металлы в природе" хорошие фото соединений различных металлов и фото - самородки благородных металлов.
| Вложение | Размер |
|---|---|
| prezentaciya_metally_v_prirode.zip | 1.27 МБ |
Подтяните оценки и знания с репетитором Учи.ру
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Подписи к слайдам:
М Е Т А Л Л Ы В П Р И Р О Д Е
УЧИТЕЛЬ ХИМИИ МОУ СОШ № 6г.ТОММОТДАЦУН НАДЕЖДА ПЕТРОВНА
МЕТАЛЛЫ В ПРИРОДЕ НАХОДЯТСЯ КАК В СВОБОДНОМ ВИДЕ, ТАК И В ВИДЕ РАЗЛИЧНЫХ СОЕДИНЕНИЙ.
В СВОБОДНОМ СОСТОЯНИИИ ВСТРЕЧАЮТС ТАКИЕ МЕТАЛЛЫ, КОТОРЫЕ ТРУДНО ОКИСЛЯЮТСЯ КИСЛОРОДОМ ВОЗДУХА - ПЛАТИНА , ЗОЛОТО, СЕРЕБРО. ЗНАЧИТЕЛЬНО РЕЖЕ РТУТЬ, МЕДЬ.
МЕТАЛЛЫ НАХОДЯЩИЕСЯ В ПРИРОДЕ В СВОБОДНОМ ВИДЕ -САМОРОДНЫЕ МЕТАЛЛЫ.САМОРОДНЫЕ МЕТАЛЛЫ СОДЕРЖАТЬСЯ В НЕБОЛЬШИХ КОЛИЧЕСТВАХ В ВИДЕ ЗЁРЕН ИЛИ ВКРАПЛЕНИЙ В ГОРНЫХ ПОРОДАХ
САМОРОДКИ.
НАЙДЕНЫ САМОРОДКИ:МЕДИ – 420 т.СЕРЕБРА – 13,5 т.ЗОЛОТА – 112 кг.
ИЗРЕДКА ВСТРЕЧАЮТСЯ ДОВОЛЬНО КРУПНЫЕ КУСКИ МЕТАЛЛОВ
Медь. (Сu)
Медь известна человеку более шести тысяч лет. Наиболее известны: медный блеск, или халькозин - Сu2S халькоперит - FeCuS2 ковеллин - CuS малахит -(CuOH)2CO3
Железо.
В СВОБОДНОМ ВИДЕ ВСТРЕЧАЕТСЯ ТОЛЬКО В МЕТЕОРИТАХ;ИЗВЕСТНО ОКОЛО 300 МИНЕРАЛОВ;ОСНОВНЫМИ МИНЕРАЛАМИ, СОДЕРЖАЩИМИ ЖЕЛЕЗО ЯВЛЯЮТСЯ МАГНИТНЫЙ ЖЕЛЕЗНЯК(МАГНЕТИТ), КРАСНЫЙ ЖЕЛЕЗНЯК(ГЕМАТИТ), БУРЫЙ ЖЕЛЕЗНЯК(ЛИМОНИТ)
ЩЕЛОЧНОЗЕМЕЛЬНЫЕ И ЩЕЛОЧНЫЕ МЕТАЛЛЫ.
ОЧЕНЬ АКТИВНЫ, ИХ ОКСИДЫ ТОЖЕ АКТИВНЫ, ПОЭТОМУ ВСТРЕЧААЮТСЯ В ПРИРОДЕ ТОЛЬКО В ВИДЕ СОЛЕЙ.
По теме: методические разработки, презентации и конспекты

Открытый урок в 9 классе "Нахождение металлов в природе. Применение металлов, их значение для живых организмов
Урок направлен на углубление знаний учащихся о применении металлов, их значении в жизни растений, животных и человека.
Интегрированный урок химии-биологии по теме:«Металлы в природе» (9 класс)
Данный урок является уроком практичекого применения знаний и умений по химии и биологии. В ходе урока ярко иллюстрируется взаимосвязь явлений и процессов, протекающих в живой и неживой природе. .

Металлы в природе
Презентация по теме "Металлы в природе"
Презентация содержит подборку фотографий по теме "Металлы в природе" 8 класс.
Презентация "Металлы в природе. Получение и применение металлов"
Металлы в природе.Получение и применение металлов.

Урок химии в 11 классе по теме: «Металлы в природе. Общие способы получения металлов»
"Человек не может обойтись без металлов. Если бы не было металлов, люди влачили бы самую жалкую жизнь среди диких зверей. ".

Методическая разработка урока по химии «Металлы в природе. Общие способы получения металлов» 9 класс (базовый курс, О.С. Габриелян)
В данной разработке приведен подробный конспект урока химии в 9 классе по теме «Металлы в природе. Общие способы получения металлов». Содержание соответствует базовому курсу химии авт.
Презентация на тему: Металлы в природе. Общие способы их получения

№ слайда 1
Металлы в природе. Общие способы их получения

№ слайда 2
Распространенность металлов в природе Содержание некоторых металлов в земной коре:Алюминий 8,2%Железо 5,0%Кальций 4,1%Натрий 2,3%Магний 2,3%Калий 2,1%

№ слайда 3
Распространенность металлов в природе Содержание некоторых металлов в морской воде:Na+ 1,05%Mg 2+ 0,12%

№ слайда 4
В природе металлы могут встречаться Только в свободном (самородном) виде (благородные металлы - золото, платина);В самородном виде и в виде соединений (металлы малой активности – серебро, медь, ртуть, олово);Только в виде соединений (металлы, стоящие в ряду напряжений до олова).

№ слайда 5

№ слайда 6

№ слайда 7

№ слайда 8

№ слайда 9

№ слайда 10

№ слайда 11
Чаще всего металлы встречаются в виде Солей неорганических кислотОксидов

№ слайда 12
Сульфиды Галенит PbS Киноварь HgSПирит FeS2И др.

№ слайда 13
Хлориды Сильвин KClГалит NaClСильвинит KCl • NaClКарналлит KCl • MgCl2 • 6H2OИ др.
№ слайда 14
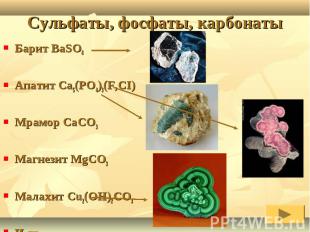
Барит BaSO4Апатит Ca5(PO4)3(F,CI) Мрамор CaCO3Магнезит MgCO3Малахит Cu2(OH)2CO3И др.

№ слайда 15
Магнетит Fe3O4Гематит Fe2O3Каолин Al2O3 • 2SiO2 • 2H2OИ др.

№ слайда 16
Минералы и горные породы, содержащие металлы и их соединения и пригодные для промышленного получения металлов, называются рудами.Отрасль промышленности, занимающаяся получением металлов из руд, называется металлургией.
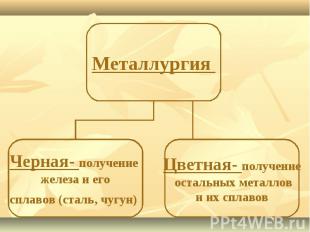
№ слайда 17

№ слайда 18
1. Пирометаллургия Восстановление металлов из руд при высоких температурах с помощью восстановителей.Соль → оксид Соли кислородсодержащих кислот – термическое разложение:CuCO3 = CuO + CO2Соли бескислородных кислот- обжиг:2ZnS + ЗО2 = 2ZnО + 2SО2

№ слайда 19
Восстановление углем или угарным газом:CuO + C → Cu + COCuO + CO → Cu + CO2Водородотермия:Cr2O3 + H2 → Cr + H2OМеталлотермия:Fe2O3 + Al → Fe + Al2O3

№ слайда 20
2. Гидрометаллургия Получение металлов из растворов их солей.Перевод нерастворимого соединения в раствор:CuO + H2SO4 = CuSO4 + H2OВосстановление металла из раствора: CuSO4 + Fe = FeSO4 + Cu.

№ слайда 21
Электрометаллургия – это способы получения металлов с помощью электрического тока (электролиза). 2NaCl → 2Na + Cl2MgBr2 → Mg + Br2Микробиологические методы получения металлов.

№ слайда 22
Презентация к уроку химии "Металлы в природе. Способы получения металлов"

Данная презентация разработана для урока химии в 9 классе. Тема урока:"Металлы в природе. Способы получения металлов". Материал презентации позволит учителю: 1) проверить как учащимися усвоен ранее изученный материал "Характеристика металлов по положению в Периодической системе Д.И. Менделеева"; 2) сэкономит время урока, так как основные моменты и вопросы учителя выведены на экран; 3) через рефлексию в конце урока понять насколько успешно прошел урок для каждого учащегося.
Просмотр содержимого документа
«Презентация к уроку химии "Металлы в природе. Способы получения металлов" »

МЕТАЛЛЫ В ПРИРОДЕ ОБЩИЕ СПОСОБЫ ПОЛУЧЕНИЯ МЕТАЛЛОВ.
Учитель химии: Голикова Екатерина Владимировна,
МОУ СОШ№2 ЗАТО Светлый

Металлы, встречающиеся в природе в свободном состоянии:
Это малоактивные металлы .
Их называют - самородками


Из активных металлов в самородном виде встречается только железо метеоритного происхождения.

В основном металлы присутствуют в природе в виде соединений – оксидов и солей (галогенидов, сульфидов, карбонатов, сульфатов).
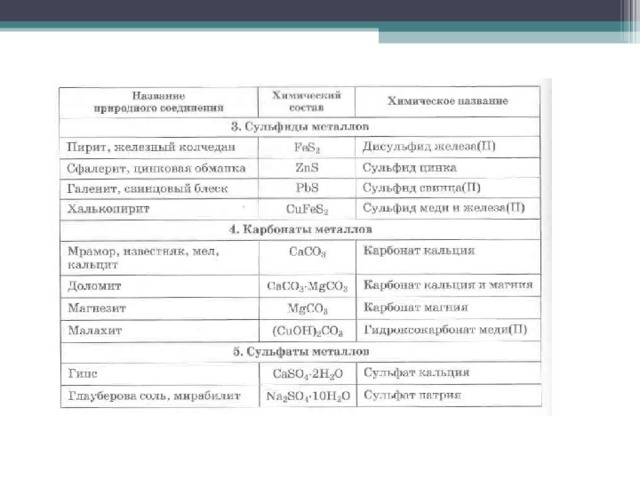

- от греческого – «металлон» – шахта, рудник
- от греческого – «металлон» – шахта, рудник
Минералы и горные породы, которые используют для промышленного получения металлов, называют рудами.

Предварительная обработка руды.
2ZnS + 3O₂=2ZnO + 2SO₂

Какую степень окисления имеют металлы в природных соединениях и сырье, подготовленном для металлургического производства?
Во всех соединениях они имеют положительную степень окисления, то есть являются катионами: М ⁿ ⁺
Что необходимо сделать, чтобы получить чистый металл?

В зависимости от способа восстановления металлов, существует несколько видов металлургического производства.
- Пирометаллургия (от греч. «пирос» – огонь)
- восстановитель: углерод (кокс)
C + O₂ = CO₂ + Q
Fe₂O₃ + 3CO = 2Fe + 3CO₂

2) восстановитель: водород
WO₃ + 3H₂ = W + 3H₂O
3) металлотермия – вытеснение более активным металлом.
Cr₂O₃ + 2Al = 2Cr + Al₂O₃
Как называется этот способ?

II . Гидрометаллургия (от греческого «гидро» – вода).
Подумайте: в каком агрегатном состоянии должен находиться металл?
CuO + H₂SO₄ = CuSO₄ + H₂O
Fe + CuSO₄ = FeSO₄ + Cu

III . Электрометаллургия.
Активные металлы из природных соединений очень трудно восстановить с помощью химических веществ.
В начале XIX в. английский химик и физик Г. Дэви предложил использовать в качестве восстановителя не химические вещества, а электрический ток.
Химические реакции, протекающие под действием электрического тока, называют электролизом.

2 NaCl ( расплав) 2 Na + Cl ₂
Na ⁺ + 1ē Na °
2Cl⁻ - 2ē Cl ₂ °

Получение алюминия из оксида алюминия.
Окисд алюминия растворяют в расплавленном минерале криолите : Na₃AlF₆
Презентация на тему: Металлы в природе


Распространенность металлов в природе Многие металлы широко распространены в природе. Содержание некоторых элементов металлов в земной коре: Алюминий-8,2% Железо-5,0% Кальций-4,1% Натрий-2,3% Магний-2,3% Калий-2,1%

Минералы и горные породы, содержащие металлы или их соединения и пригодные для промышленного получения металлов, называются рудами
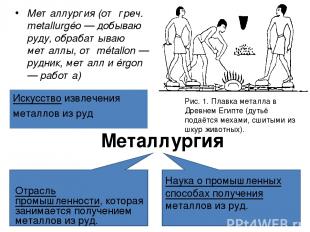
Металлургия Отрасль промышленности, которая занимается получением металлов из руд. Металлурги я (от греч. metallurgéo — добываю руду, обрабатываю металлы, от métallon — рудник, металл и érgon — работа) Наука о промышленных способах получения металлов из руд. Искусство извлечения металлов из руд Рис. 1. Плавка металла в Древнем Египте (дутьё подаётся мехами, сшитыми из шкур животных).

Самородные металлы золото серебро медь платина

MgCO3 Карбонаты Малахит Cu2(OH)2CO3 Магнезит Карбонат магния Мрамор CaCO3 Кварц SiO2

KCL Хлориды Каменная соль NaCl Карналлит KCl*MgCl2*6H2O Апатит Ca3(PO4)2 Сильвин Хлорид калия

Галенит PbS Пирит FeS2 Медный блеск Сульфид меди (II) Галит NaCl CuS Сульфиды

Fe2O3 Оксиды Магнетит Fe3O4 Лимонит 2Fe2O3* 3H2O Гематит Оксид железа (III) Каолин Al2O3*2SiO2*2H2O Флюорит CaF2


Способы получения металлов Пирометаллургия Гидрометаллургия Электрометаллургия (электролиз)

Пирометаллургия – восстановление металлов из руд при высоких температурах с помощью восстановителей (C, CO, H2, металлы) CuO + H2 AL + Fe2O3 FeO + C 4. ZnO + CO Задание. Составьте уравнения реакций получения металлов. Укажите условия их протекания. Составьте электронный баланс. БЕКЕТОВ Николай Николаевич (1827-1911) t0 t0 t0 t0
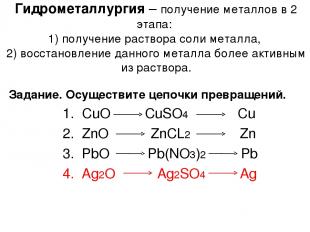
Гидрометаллургия – получение металлов в 2 этапа: 1) получение раствора соли металла, 2) восстановление данного металла более активным из раствора. Задание. Осуществите цепочки превращений. 1. CuO CuSO4 Cu 2. ZnO ZnCL2 Zn 3. PbO Pb(NO3)2 Pb 4. Ag2O Ag2SO4 Ag
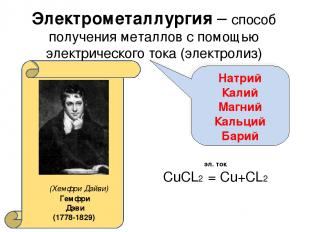

Домашнее задание § 9. Дополните в тетради методы получения металлов еще одним известным способом. ZnO + CO Ag2O Ag2SO4 Ag Определите массовую долю железа в буром железняке. t0
Читайте также:
