Метод пригодный для получения металлического калия
Обновлено: 16.05.2024
Калий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета. В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются. История и происхождение названия калий
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
В 1807 году английский химик Дэви электролизом твёрдого едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium ; это название до сих пор употребительно в английском, французском, испанском, португальском и польском языках). В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium , от араб. аль-кали — поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Присутствие в природе калия
В свободном состоянии не встречается. Калий входит в состав сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав всех клеток (см. ниже раздел Биологическая роль).
Калий — получение калия
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
K + + e − → K
2Cl − − 2e − → Cl2
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород:
4OH − − 4e − → 2H2O + O2
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Физические свойства калия
Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Химические свойства калия
Калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, легко отдаёт электроны.
Является сильным восстановителем. Он настолько активно соединяется с кислородом, что образуется не оксид, а супероксид калия KO2 (или K2O4). При нагревании в атмосфере водорода образуется гидрид калия KH. Хорошо взаимодействует со всеми неметаллами, образуя галогениды, сульфиды, нитриды, фосфиды и т. д., а также со сложными веществами, такими как вода (реакция проходит со взрывом), различные оксиды и соли. В этом случае они восстанавливают другие металлы до свободного состояния.
Калий хранят под слоем керосина.
Оксиды калия и пероксиды калия
При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:
Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:
Оксиды калия обладают ярко выраженными основными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия. Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится (при поглощении двух объёмов CO2 выделяется один объём O2), и давление в замкнутом пространстве упадёт, а в случае избытка супероксида калия (при поглощении двух объёмов CO2 выделяется три объёма O2) выделяется больше газа, чем поглотится, и давление повысится.
В случае эквимолярной смеси (Na2O2:K2O4 = 1:1) объёмы поглощаемого и выделяемого газов будут равны (при поглощении четырёх объёмов CO2 выделяется четыре объёма O2).
Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
Гидроксиды калия
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого калия при 20 °C в 100 г воды составляет 112 г.
Применение калия
- Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например, в атомных силовых установках на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав состава натрий 12 %, калий 47 %, цезий 41 % обладает рекордно низкой температурой плавления −78 °C.
- Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений.
- Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока.
Важные соединения

- Бромид калия — применяется в медицине и как успокаивающее средство для нервной системы.
- Гидроксид калия (едкое кали) — применяется в щелочных аккумуляторах и при сушке газов.
- Карбонат калия (поташ) — используется как удобрение, при варке стекла.
- Хлорид калия (сильвин, «калийная соль») — используется как удобрение.
- Нитрат калия (калийная селитра) — удобрение, компонент чёрного пороха.
- Перхлорат и хлорат калия (бертолетова соль) используются в производстве спичек, ракетных порохов, осветительных зарядов, взрывчатых веществ, в гальванотехнике.
- Дихромат калия (хромпик) — сильный окислитель, используется для приготовления «хромовой смеси» для мытья химической посуды и при обработке кожи (дубление). Также используется для очистки ацетилена на ацетиленовых заводах от аммиака, сероводорода и фосфина.
- Перманганат калия — сильный окислитель, используется как антисептическое средство в медицине и для лабораторного получения кислорода.
- Тартрат натрия-калия (сегнетова соль) в качестве пьезоэлектрика.
- Дигидрофосфат и дидейтерофосфат калия в виде монокристаллов в лазерной технике.
- Пероксид калия и супероксид калия используются для регенерации воздуха на подводных лодках и в изолирующих противогазах (поглощает углекислый газ с выделением кислорода).
- Фтороборат калия — важный флюс для пайки сталей и цветных металлов.
- Цианид калия применяется в гальванотехнике (серебрение, золочение), при добыче золота и при нитроцементации стали.
- Калий совместно с перекисью калия применяется при термохимическом разложении воды на водород и кислород (калиевый цикл «Газ де Франс», Франция).
Биологическая роль
Калий — важнейший биогенный элемент, особенно в растительном мире. При недостатке калия в почве растения развиваются очень плохо, уменьшается урожай, поэтому около 90 % добываемых солей калия используют в качестве удобрений.
Калий содержится большей частью в клетках, до 40 раз больше чем в межклеточном пространстве. В процессе функционирования клеток избыточный калий покидает цитоплазму, поэтому для сохранения концентрации он должен нагнетаться обратно при помощи натрий-калиевого насоса.
- Создание условий для возникновения мембранного потенциала и мышечных сокращений.
- Поддержание осмотической концентрации крови.
- Поддержание кислотно-щелочного баланса.
- Нормализация водного баланса.
- Обеспечение мембранного транспорта.
- Активация различных ферментов.
- Нормализация ритма сердца.
Рекомендуемая суточная доля калия составляет для детей от 600 до 1700 миллиграмм, для взрослых от 1800 до 5000 миллиграмм. Потребность в калии зависит от общего веса тела, физической активности, физиологического состояния, и климата места проживания. Рвота, продолжительные поносы, обильное потение, использование мочегонных повышают потребность организма в калии.
Основными пищевыми источниками являются сушёные абрикосы, дыня, бобы, киви, картофель, авокадо, бананы, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград. Калия достаточно много в рыбе и молочных продуктах.
Всасывание происходит в тонком кишечнике. Усвоение калия облегчает витамин В6, затрудняет — алкоголь.
При недостатке калия развивается гипокалиемия. Возникают нарушения работы сердечной и скелетной мускулатуры. Продолжительный дефицит калия может быть причиной острой невралгии.
При переизбытке калия развивается гиперкалиемия, для которой основным симптомом является язва тонкого кишечника. Настоящая гиперкалиемия может вызвать остановку сердца.
Изотопы
Природный калий состоит из трёх изотопов. Два из них стабильны: 39 K (изотопная распространённость 93,258 %) и 41 K (6,730 %). Третий изотоп 40 K (0,0117 %) является бета-активным с периодом полураспада 1,251×10 9 лет. В каждом грамме природного калия в секунду распадается в среднем 32 ядра 40 K, благодаря чему, например, в организме человека весом 70 кг ежесекундно происходит около 4000 радиоактивных распадов. 40 K считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (мощность оценивается в 44 ТВт). В минералах, содержащих калий, постепенно накапливается 40 Ar, один из продуктов распада калия-40, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Метод пригодный для получения металлического калия
Наиболее разработанными способами термического получения калия являются обменное разложение металлическим натрием едкого кали и хлористого калия.
При первом методе в реакционный аппарат непрерывно подаются расплавленные KOH и натрий, а в реакторе при 380—440° образуются едкий натр и металлический калий. Смесь расплавленных KOH (40%), NaOH (60%) и калия непрерывно вытекает из реактора. Непрерывность процесса обеспечивает высокую производительность реакционного аппарата (рис. 2)
Второй метод базируется на реакции
В СШA этот способ реализован на заводе фирмы Каллари. При обменном разложении получается смесь хлоридов калия и натрия и сплав металлических калия и натрия. В колонне из нержавеющей стали, наполненной кольцами Рашига из того же материала, происходит перегонка сплава, в результате которой получают металлический калий. Этот же завод выпускает сплав калия с натрием, содержащий до 60% К.
Оба способа имеют ряд существенных недостатков: низкое использование сырья, обусловленное большими потерями его в производстве; низкое качество получаемого металлического калия (загрязнен натрием, щелочами, окислами и перекисями); легкая взрываемость получаемого продукта при наличии примесей; сильная коррозия аппаратов, вызванная присутствием едкого кали и приводящая к необходимости частой замены реакторов.
К термическим методам получения калия относится также сульфатный, основанный на реакции
Недостатки его: высокая агрессивность расплава (остатков шихты) при температурах процесса 850—1050°; трудности, возникающие при извлечении остатков шихты из печи; низкое качество получаемого продукта. Хотя в этом случае применяется дешевый восстановитель и материальный поток относительно небольшой, но все же в настоящее время метод должен быть оценен как малоперспективный.
Недостатки термических способов получения калия и его сплавов с натрием побудили заняться разработкой вакуум-термических способов, этому благоприятствовало общее развитие вакуумной техники.
Вакуум-термические методы получения металлического калия базируются на следующих основных химических реакциях:



Алюмотермический способ разработан достаточно детально и может быть реализован в промышленности. Для его осуществления применяются вакуум-ретортные печи.
Загрузку и разгрузку реторты целесообразно производить без предварительного охлаждения. Перед началом термического процесса шихту следует выдержать при 600°. В последующем желательно максимально сократить продолжительность пребывания шихты при 700—800°, неблагоприятных для восстановления (улетучивание KCl). Наиболее полного извлечения калия добиваются, осуществляя процесс восстановления при температуре выше 900°; с повышением температуры продолжительность термического процесса резко сокращается. Давление в реторте во время реакции должно быть менее 0,5 мм рт. ст.
Технологические показатели этого способа в значительной мере зависят от состава шихты, наиболее перспективна шихта с молярным отношением CaO и KCl, равным 0,6—1,0 и Al к KCl, равным 0,8—1,2. Существенное повышение извлечения наблюдается при введении в шихту фтористых солей и, в частности, фтористого калия или фтористого кальция (5%). При применении алюминия в виде сплавов восстановительная способность его уменьшается с увеличением количества примесей.
Значительное влияние на извлечение калия оказывает крупность компонентов шихты — особенно восстановителя. Извлечение калия, приближающееся к 100%, можно получить лишь при работе на алюминиевом порошке и окиси кальция менее 36 мк.
Необходимость применения относительно дорогого алюминиевого порошка является недостатком алюмотермического метода.
Карбидотермический и силикотермический способы разработаны в одинаковой степени и оба могут быть реализованы в промышленности
При карбидотермическом способе можно применять в качестве восстановителя отходы карбидного производства (мелочь, получающаяся при дроблении блоков карбида кальция).
Удовлетворительные результаты восстановления достигнуты на вертикальной вакуум-ретортной печи, причем, в частности, решен вопрос раздельной конденсации соли и металла (рис. 3). Процесс можно вести без охлаждения печи, загружая шихту в горячую печь и выгружая продукты реакции также из горячей печи, что сокращает продолжительность цикла и снижает расход электроэнергии.

Разработаны технологические переделы процесса получения металлического калия и соответствующие мероприятия, обеспечивающие безопасность отдельных операций технологического процесса. Последнее имеет особо большое значение, поскольку выделение ацетилена может вызвать взрывы и отравление работающих.
Можно принять следующие технические условия на исходные материалы: потери при прокаливании хлористого калия не выше 0,3 /о, степень измельчения хлористого калия — не крупнее 80 меш, а карбида кальция — не крупнее 3 мм; время нахождения шихты на открытом воздухе не более 4 час. Некоторые показатели карбидотермического метода приведены в табл. 1.

По безопасности работы и меньшему удельному расходу восстановителя cиликотермический способ получения калия имеет преимущество перед карбидотермическим.
В качестве исходного сырья для получения калия силикотермическим методом применяют хлористый калий, известняк и ферросилиций Необходимо, чтобы исходные материалы содержали минимальное количество солей натрия, так как последний восстанавливается легче, чем :калий, и полностью переходит в продукт (металлический калий).
Исходная калийная соль должна быть высушена при температуре 200—400°. Остаточная влага не должна превышать десятых долей процента. Известняк прокаливается во вращающейся печи при температуре 1200—1250° до полного разложения карбоната.
Калийная соль, известь, фтористый кальций и ферросилиций подвергаются размолу во вращающейся шаровой мельнице до крупности — 80 меш. Соль и известь должны храниться в герметичной таре.
Исходные материалы дозируются и загружаются на 40—45 мин. в смеситель. Тщательно перемешанная шихта поступает на брикетирование, осуществляемое в валковых или револьверных прессах, при давлении порядка 500—700 кг/см2. Размеры брикетов диаметр 75 мм, высота 30 мм. Процесс прессования идет легко, а брикеты получаются прочными.
Готовые брикеты загружают в кюбеля и потом в горячую вакуум-ретортную электрическую или газовую печь. Температура процесса 900°. Остаточное давление в печи 0,2—0,3 мм рт. ст. Продолжительность цикла 10 час.: из них 2 часа загрузка и разгрузка печи и 8 час. процесс восстановления. Наиболее трудоемкой операцией при разгрузке печи является удаление сконденсировавшейся соли. Показатели силикотермического процесса приведены в табл.
Трудности, возникающие при электролитическом получении калия электролизом расплавленных сред при твердом или жидком катоде, вызывают необходимость дальнейших исследований как в части аппаратурного оформления, так и в направлении улучшения технико-экономических показателей.
В связи с получением при ряде процессов не калия, а сплавов его с натрием и свинцом, необходимо совершенствовать методы вакуумной отгонки калия из сплава свинец — калий и ректификации сплава натрий — калий.
Применяемый ныне способ получения калия обменным разложением едкого кали или хлористого калия металлическим натрием обладает существенными недостатками.
Более перспективны вакуумные методы (силикотермический или карбидотермический), которые могут быть реализованы в промышленном масштабе, для этого необходимо создание вакуумной печи, позволяющей получать за цикл 480—500 кг металлического калия.



Растворимость калия в едком кали несколько ниже растворимости натрия в едком натре и характеризуется следующими значениями (в 100 г КОН). 8—9 г при 400°, 4—3 г при 600°, 2,7—2,0 г при 650°, 0,5—1,3 г при 700°. Диффузия растворенного калия в расплавленном электролите меньше, чем натрия в едком натре Поэтому, несмотря на более низкую температуру кипения и более высокую упругость паров калия по сравнению с натрием, металлический калий можно получать электролитическим путем с более или менее приемлемыми технико-экономическими показателями.
Первые обстоятельные исследования электролиза расплавленного едкого кали были выполнены Лебланом и Броде. Они установили, что кислород воздуха взаимодействует с расплавленным едким кали, образуя перекись калия (K2O2), легко окисляющую выделяющийся на катоде металлический калий. Поэтому при электролизе едкого калия необходимо тщательно изолировать катодное пространство и электролит от кислорода воздуха.
Лоренц и Кларк проводили электролиз едкого кали с применением диафрагмы — колокола, окружающего катодное пространство и изолирующего электролит от соприкосновения с воздухом. В качестве колокола применялись магнезитовые тигли, электролизер — железный тигель, анод — железный лист, катод — железная проволока. Напряжение разложения KOH равно 2,22 в при 335°. Напряжение на электролизере составляло 15 в, выход по току достигал 58%.
Проводя электролиз расплавленного едкого кали с добавками К2СО3, Хевеси получил при температуре 320—340° выход по току 55%
Металлический калий может быть получен также электролизом хлористого калия (tпл = 790°). Последний получается из сильвинита дробной кристаллизациеи, отделяющей хлористый натрий. Необходимость этой операции обусловлена тем, что при электролите, представляющем смесь солей калия и натрия, на катоде образуется сплав двух металлов. Для снижения температуры плавления KCl в электролит вводится фтористый калий: эвтектика, содержащая 55% (мол.) хлористого калия, плавится при температуре 605°. Конструкция электролизеров аналогична применяемым при получении металлического натрия Катоды железные, аноды графитовые (угольные). На катоде выделяется калий, который должен быть защищен от окисления, На аноде выделяется хлор. Для получения хлора высокой концентрации (не ниже 60%) анодное пространство должно быть герметизировано.
Конструкция электролизера для получения калия из едкого кали изображена на рис. 1.

Вследствие легкого окисления калия и значительной его растворимости в электролите выход по току в промышленных условиях не превышает 50%. Здесь возникают большие трудности, чем при получении натрия: металл периодически возгорается, хлор выделяется в атмосферу цеха, а футеровочные материалы легко разрушаются, что вызывает необходимость частого капитального ремонта электролизеров.
В последние годы производство металлического калия осуществляют путем электролиза с жидким свинцовым катодом, получая сплавы калия со свинцом. В процессе электролиза на аноде выделяется хлор. Температура электролиза 650—700°. Выход по току достигает 75—80%. С повышением содержания калия в катодном сплаве выход по току снижается. При получении сплава, содержащего до 7% калия, выход по току составляет до 90%, но в случае применения электролизера, открытого сверху, даже при получении сплава с 7—9% калия выход по току падает до 55%. В качестве электролита применяется расплав, состоящий из 60% KCl и 40% KF. Такой электролит обладает высокими агрессивными свойствами, что приводит к разрушению футеровки, главным образом по линии раздела электролит — газовая фаза. Для того чтобы избежать разрушения футеровки, целесообразно вести процесс электролиза с коркой застывшего электролита (гарниссаж), как это имеет место, например, при получении алюминия.
Уменьшение агрессивности электролита может быть достигнуто заменой фтористого калия фтористым натрием, который к тому же менее гигроскопичен; но при этом на катоде возможно выделение металлического натрия, что приводит к получению тройного сплава свинец — калий — натрий.
При электролите, имеющем состав 60% К2СО3, 40% KCl, и температуре электролиза 700° получается сплав, содержащий 10—12% калия; выход по току достигает 70%. На угольных анодах происходит выделение кислорода, что приводит к большому их расходу.
При электролите, состоящем из KCl и Na2CO3, на жидком свинцовом катоде одновременно выделяются калий и натрий, что приводит к образованию тройного сплава; отношение калия к натрию в этом сплаве равно примерно 40:60.
Получение тройного сплава происходит также при электролизе с жидким свинцовым катодом и электролите, состоящем из KCl, NaCl и Na2CO3. В этом случае выход по току достигает 65—70%, температура электролиза 650—700°. Напряжение на электролизере в 10 ка составляет 6,5—7,0 в.
В случае применения электролита, состоящего из хлористого калия и углекислого натрия, а также хлорида натрия возникает необходимость в тщательной корректировке состава электролита и частой его смене. Быстрое изменение состава электролита приводит к неустойчивому режиму электролиза.
Получение двойного сплава Pb—К обусловливает необходимость освоения операции дистилляции для отделения калия от свинца, а при получении тройного сплава (Pb—К—Na) — необходимость еще одной операции: ректификации для разделения калия и натрия.
Из всех рассмотренных выше способов наиболее благоприятным является вариант получения калия на жидком свинцовом катоде с применением электролита, состоящего из хлористого калия без добавок других солей калия или натрия.
Особое внимание должно быть уделено вопросам аппаратуры.
При малой герметичности электролизеров наблюдается высокая концентрация свинца в атмосфере цеха, значительно превышающая санитарные нормы для этого металла; условия труда значительно осложняются также и вследствие выделения хлора в атмосферу цеха. Отсюда очевидная потребность в создании герметичного электролизера и разработке режима электролиза, гарантирующего нормальные условия труда и высокие технологические показатели процесса. Наряду с этим необходима разработка процесса дистилляции и конструкций дистилляторов непрерывного действия, обеспечивающих высокие технико-экономические показатели этого передела.
Примеси, не растворимые в калии, легко удаляются низкотемпературной фильтрацией. Однако этот метод не пригоден для удаления растворимых примесей щелочных или щелочноземельных металлов.
Натрий можно удалить из калия, окислив натрий кислородом. Вследствие того, что окись натрия значительно менее растворима в калии, чем окись калия, то окись натрия можно легко отфильтровать.
Чистый калий должен содержать не более следующего количества примесей: натрия — 1*10в-1%, тяжелых металлов 1*10в-3 %, азота 1*10в-2%, сульфатов 1*10в-2%, хлоридов 1*10в-2%.
Для получения чистого калия из металла технической чистоты, содержащего от 0,3—1% Na; 0,015—0,017% Cl и 5*10в-3—12*10в-3% сульфатов, была применена периодическая ректификация, при этом были использованы на линиях загрузки и разгрузки замораживающиеся затворы.

На рис. 11 показана схема установки для очистки калия ректификацией. Технический металл из бачка 9 по нагреваемому затвору 12 засасывается в куб 3. После замораживания затвора 12 в колонне 1 создается вакуум (остаточное давление ~ 0,2 мм рт. ст.), включается электрический нагрев и осуществляется ректификация металла при тмпературе куба 550—600° С. Дистиллированный калий из конденсатора 5 сливается в приемник 6. После окончания процесса колонна заполняется очищенным азотом. Слив дистиллята и кубового остатка осуществляется через затвор И. После этого цикл ректификации повторяется. Ректификационная колонна наполняется насадкой 2 в виде спирали из проволоки диаметром 0,3 мм на высоту 1000 мм.
В результате ректификации содержание примесей в металле понижается: натрия с 0,3—1% до 15—55*10в-3%, хлора с 15-17*10-3% до 13-64*10в-4%, сульфатов (SO4) с 5—12*10в-3%) до 4-10в4-%. Примеси тяжелых металлов в конденсате отсутствуют.
При дистилляции или ректификации щелочных металлов в вакууме водород удаляется в результате термической диссоциации гидридов. Температура диссоциации гидрида калия равна 250—300°С, гидрида натрия 300—400° С и гидрида лития 500—600°С.
Любые современные строения, инсталляции, малые архитектурные формы в большинстве основаны на металлоконструкциях. Это не всегда относится к беседкам, МАФам и другим.
Благодаря инновационным технологиям появилась возможность резать и обрабатывать металл с высокой точностью и намного проще, быстрее.
Металлические изделия и крепеж должны отличаться высокой прочностью, устойчивостью. Ведь многие из них постоянно контактируют с последствиями проливных дождей, перепадов.
Контейнерные перевозки считаются одним из недорогих видов транспортирования. Но сегодня контейнера используются не только для транспортировки грузов.
На рынке металла никогда не было отмечено падение спроса. Металлопрокат, имея огромный ассортимент, всегда остается востребованным материалом. Там где спрос, там.
Часто люди, которые только начинают свой бизнес, связанный с приемкой металла, могут отмечать, что цены на металлолом не стабильны. Это действительно так, и странного в.
Современная металлургическая промышленность производит огромное количество проката. Наиболее востребованный - лист нержавеющий купить, который выгоднее всего на сайте.
Зависимость от альтернативной энергетики ощущается человеком сильней с каждым днем. Для начала скажем об энергетике в общем. Она охватывает выработку, передачу, сбыт.
Получение калия: способы, реакция, формулы, виды калия и его химические свойства

Калий (К) – это пятый по распространенности в природе металл. Он расположен в 1 группе периодической системы химических элементов (ПСХЭ), поэтому относится к щелочным металлам и при смешивании с водой образует растворимые гидроксиды. В виде простого вещества элемент имеет серебристо-белый цвет, иногда с фиолетовым оттенком. По характеристикам он мягкий и низкоплавкий. Получение калия возможно из его гидрида, гидроксида, хлорида, хромата или дихромата.
Общая характеристика
При превращении калия в пар сине-зеленого цвета он разлагается на атомы К, к которым примешивается небольшое количество молекул К2. Растворить металл можно в жидком аммиаке с получением стандартного темно-синего раствора либо в расплаве едкого кали.

Калий имеет высокую реакционную способность, обладает сильными восстановительными свойствами (его внешняя электронная оболочка находится на большом удалении от ядра, а в таблице электроотрицательности он занимает вторую позицию после цезия), реагирует не только с разбавленными кислотами, неметаллами, нитритом водорода и дигидросульфидом, но и с кислородом воздуха и водой. В последнем случае выделяющийся водород быстро воспламеняется.
Со ртутью элемент превращается в сплав – амальгаму. С натрием, таллием, оловом, свинцом и висмутом у калия образуются интерметаллиды, обладающие высокой твердостью и химической стойкостью. Химическое соединение нескольких металлов плавится при более высокой температуре, чем каждый из образующих его компонентов, но имеет меньшую пластичность по сравнению с ними.
Однако есть вещества, с которыми элемент практически не вступает в реакцию, например, к таким относится азот. Это одна из отличительных особенностей калия от других щелочных металлов, в первую очередь, лития и натрия. Кроме того, он не сплавляется с литием, магнием, цинком, кадмием, алюминием и галлием.
Калий хорошо сохраняется под слоем бензина и керосина. Определить его можно по окрашиванию пламени горелки в фиолетовый цвет.
Применение
Калий играет важную биологическую роль в организме человека и развитии растений. Кроме того, он широко используется в повседневной жизни. Так, в комплексе с азотом и фосфором он является незаменимым удобрением для культурных растений, позволяющим повысить их урожайность, вегетативную массу и устойчивость к вредителям.

Сплав металла с натрием применяется для передачи тепловой энергии в замкнутых системах, а если к этому соединению добавить цезий, получится состав с рекордно низкой температурой плавления (минус 78 градусов Цельсия).
Для того чтобы использовать все эти полезные и важные соединения, нужно знать реакции получения калия из его соединений.
Получение металла
Неорганическое соединение белого цвета, гидрид калия, образуется из расплавленного металла, но оно нестабильно и при температуре в 400 градусов Цельсия в вакууме распадается на составляющие по следующей реакции:
Гидроксид калия образуется из соответствующего хлорида. Он широко применяется в производстве жидких мыл и для получения калия и его соединений. Для этого нужно провести электролиз, то есть пропустить через раствор ток. В результате на аноде образуется кислород, а на катоде калий:
Из хлорида можно получать не только гидроксид, но и металл в чистом виде. Для этого также потребуется реакция электролиза раствора:
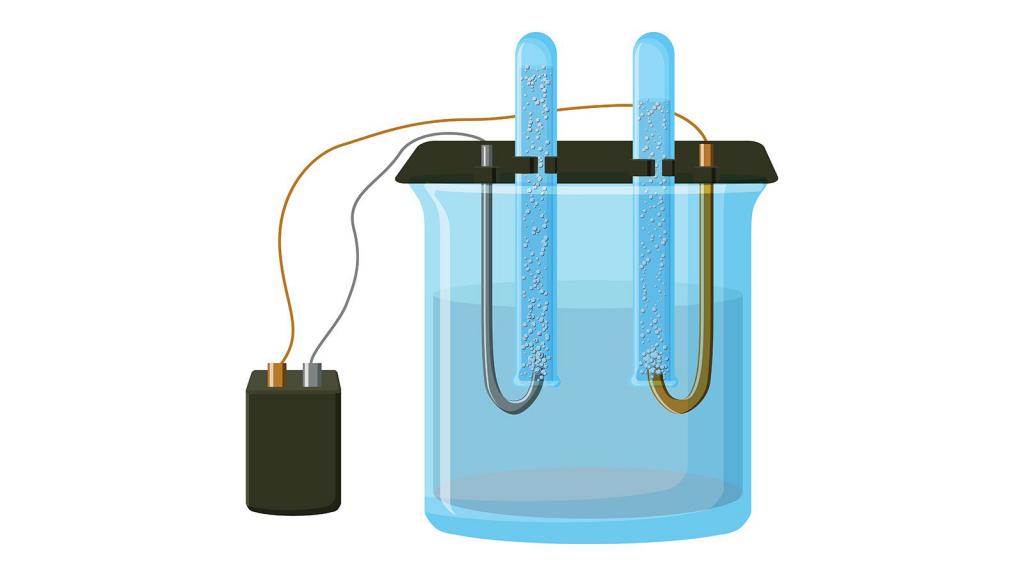
В отличие от предыдущего способа получения калия, в этом можно использовать исходное вещество не только в жидком состоянии, но и в виде расплава, но в этом случае происходят две параллельные реакции:
Катод, на котором будет образовываться калий, должен быть ртутным.
Получение исходных веществ
Иногда применяются хромат или дихромат калия. Напрямую металл из них не получить, но можно преобразовать их в гидроксиды или хлориды, которые впоследствии подвергнуть электролизу по приведенным выше реакциям. Получение гидроксида калия из хромата происходит так:
Чтобы процесс прошел успешно, сера и гидроксид хрома выпали в осадок, нужно брать горячую воду. Подобную реакцию можно также провести с помощью дихромата. Она протекает аналогичным образом, различие наблюдается только в значениях стехиометрических коэффициентов:
При нагревании дихромата до 500 градусов Цельсия гидроксид можно получить другим способом:
Есть и другие способы получения гидроксида. Например, с помощью реакции между поташом и насыщенным раствором гашеной извести.
Для получения хлорида калия из хромата реакции проводятся таким образом:
Соляная кислота берется в разбавленном виде. Получение калия хлора сопровождается выделением дихромата и воды.

Превратить дихромат в хлорид немного более сложно, для этого понадобится этиловый спирт и кипячение:
Получение калия хлора также возможно из поташа при взаимодействии с разбавленной соляной кислотой и из сульфата при реакциях с галогенидом бария.
Гидроксид и хлорид легко преобразуются друг в друга с помощью электролиза или при добавлении соответствующего галогенида.
Получение производных
Получение солей калия играет не менее важную роль, чем образование чистого металла. Несмотря на высокую стоимость, они используются в гальванотехнике, так как обеспечивают интенсивную работу электролитов при повышенной плотности тока. Это достигается за счет высокой растворимости.
Нитрат калия
Большое значение имеет получение нитрата калия (KNO3). Эта белая соль, называемая индийской селитрой, практически не токсична для живых организмов. Применяется и в мирных целях в качестве удобрения, и в военных как компонент взрывчатых и горючих веществ. Кроме того, получение нитрата калия нужно для обесцвечивания и улучшения прочностных характеристик хрустальных стекол, что широко используется в вакуумной электропромышленности и оптическом стекловарении. В металлургии полезны ее окислительные свойства в отношении никелевых и иных руд. А в пищевой промышленности соль выступает в качестве консерванта.
Для получения раствора нитрата калия можно воспользоваться следующими веществами:
- надпероксидом металла при добавлении к нему оксида азота (IV) и нагревании до 70 градусов Цельсия;
- гидроксидом и разбавленной азотной кислотой;
- гидроксидом в холодном состоянии и смесью оксидов азота (II) и (IV);
- горячим гидроксидом, оксидом азота (IV) и кислородом;
- горячим разбавленным нитритом калия и кислородом (реакция требует времени);
- нитритом калия и горячей перекисью водорода в разбавленной серной кислоте в качестве катализатора (кислоту можно заменить бромом, но он вступит в реакцию с образованием бромоводорода).
Полученное соединение плавится без разложения, устойчиво на воздухе, растворяется в воде без гидролиза, обладает сильными окислительными свойствами, восстанавливается только атомным водородом.
Сульфат калия
Соль, известная еще с XIV века, получила название сульфата калия (K2SO4) лишь в XVII. Она присутствует в водах соленых озер и месторождениях неметаллических минеральных ресурсов, но возможно получение сульфата калия в процессе синтеза следующих веществ:
- надпероксида калия и серы при 130-140 градусах Цельсия (вместо серы можно использовать ее оксид (IV), тогда будет достаточно температуры в 100 градусов);
- гидроксида калия и разбавленной серной кислоты;
- гидросульфата калия (разложением при 240 градусах);
- гидросульфата калия и концентрированного каустического поташа или хлорида этого же металла;
- хлорида калия и концентрированной серной кислоты при кипячении;
- сульфида калия и кислорода при температуре выше 500 градусов;
- разложением дисульфата калия при температуре выше 440 градусов и использовании оксида серы (IV) и кислорода в качестве катализаторов.
Другое название получаемого вещества – арканит. Оно имеет белый цвет, устойчиво к температурному воздействию, но легко растворяется в воде без кристаллогидратов. Для него характерно участие в обменных реакциях, восстановление водородом и углеродом.
На практике оно активно используется в сельском хозяйстве как бесхлорное удобрение для бедных калием почв. Особенно важен арканит для культур, чувствительных к хлору или потребляющих много серы. Урожай, выращенный с его применением, содержит большее количество сахара и витаминов, чем тот, который не удобрялся. Также удобрение используют для цветов, выращиваемых и на открытом воздухе, и в тепличных условиях.

Другое применение арканита – компонент при производстве стекла, квасцов, металлургических плавней. Он выступает и в качестве пищевой добавки, но само по себе вещество сложно назвать безопасным: оно раздражает глаза, кожу, желудочно-кишечный тракт, дыхательные пути и приводит к отравлению при длительном контакте с различными частями тела и организма.
Карбонат калия
Поташ или углекислый калий (К2СО3) был известен еще в древности и сохранял важное промышленное значение вплоть до ХХ века. Получение карбоната калия происходило путем выщелачивания из растительной золы и последующей очисткой продукта. В основном производство локализовалось в лесистой местности Европы, России и Северной Америки.
Сейчас известно больше реакций, в результате которых получается карбонат. Обычно используются следующие вещества:
- надпероксид калия и графит при небольшом нагревании до 30 градусов (вместо графита может быть использован угарный газ с нагреванием до 50 градусов);
- концентрированный гидроксид калия и углекислый газ;
- разложение гидрокарбоната калия при температуре от 100 до 400 градусов;
- гидрокарбонат и концентрированный гидроксид калия;
- сульфат калия, гидроксид кальция и угарный газ при температуре 200 градусов и под давлением, с последующим синтезом получившегося продукта К(НСОО) с кислородом при 700 градусах.
Получаемое белое вещество плавится без разложения, в воде сильно гидролизуется по аниону, создает сильнощелочную среду, реагирует с кислотами, неметаллами и их оксидами, а также вступает в реакции обмена.
Вещество малотоксичное и используется для производства жидкого мыла, пигментов, стекла, соединений калия. Применяется в крашении, выращивании сельскохозяйственных культур, проявлении фотографий. Кроме того, является популярной добавкой, уменьшающей температуру замерзания бетона, поглотителем сероводорода, обезвоживающим агентом, пищевой добавкой.
Перманганат калия
Красно-фиолетовая, почти черная марганцовка известна всем, так как ее можно увидеть практически в каждом доме. Хотя в последнее время существуют небольшие ограничения на покупку вещества из-за того, что его признали прекурсором. Получение перманганата калия (KMnO4) возможно несколькими способами, например, взаимодействием сульфата марганца (II) с водой и кислородом из дитионата калия. По прошествии некоторого времени при наличии нитрата серебра в качестве катализатора из этой смеси получится перманганат и сульфат калия, а также серная кислота.
Еще больше способов предполагает использование манганата калия, к нему можно добавлять следующие вещества:
- воду (реакция требует затрат времени);
- разбавленную соляную кислоту;
- углекислый газ;
- хлор.
Кроме того, манганат можно подвергать электролизу с образованием перманганата на аноде (на катоде будет водород).
Применение у получившегося вещества широкое. Благодаря окисляющей способности оно обеспечивает антисептическое действие. В медицине оно применяется для полоскания горла при воспалительных заболеваниях его слизистой, промывания ран, обработки ожогов и инфицированных ран, лечения язв, а также как рвотное средство при отравлениях алкалоидами.
Противопоказанием является гиперчувствительность, но передозировка может привести к летальному исходу даже у здорового человека, смертельная доза для среднего человека составляет всего 20-30 г.

При использовании перманганата нужно соблюдать меры предосторожности, так, вещество воспламеняется при смешивании с органическими и легковоспламеняющимися соединениями, активными металлами и неметаллами. При дополнительном нагревании возможен взрыв.
Гидроксид калия
Помимо солей, большое значение имеет гидроксид калия. Это вещество относится к щелочам, то есть веществам, растворы и расплавы которых могут проводить электрический ток.
Тривиальное название этого соединения - каустический поташ. Выглядит оно как белое гигроскопичное вещество. К его свойствам относятся плавление и кипение без разложения, хорошая растворимость в воде с образованием сильнощелочной среды, нейтрализация кислотами, реакционная способность в отношении металлов и неметаллов, их оксидов и гидроксидов. Из воздуха гидроксид калия активно поглощает воду и углекислый газ.
Как получение калия возможно из щелочи, так и гидроксид можно получить из металла. Для этого требуется лишь добавить к нему воду в чистом виде или в сочетании с кислородом. Кроме того, можно получать щелочь из карбоната и насыщенного гидроксида кальция либо электролизом хлорида. Последний способ активно используется в промышленном производстве.
Вещество опасно, может прижечь кожу или слизистые, разрушает все материалы органического происхождения. Работать с ним можно, только надежно защитив кожные покровы перчатками, а глаза очками.
Несмотря на опасность, щелочь имеет широкое применение в фотографии, нефтепереработке, пищевом, бумажном и металлургическом производстве, а также как щелочной элемент питания, нейтрализатор кислот, катализатор, газоочиститель, регулятор водородного показателя, электролит, компонент моющих средств, буровых растворов, красителей, удобрений, калийных органических и неорганических веществ, пестицидов, фармацевтических препаратов для лечения бородавок, мыла, синтетического каучука.

Таким образом, получение калия и соединений на его основе, в первую очередь, солей и гидроксида, имеет большое значение для промышленности и широкое применение в быту. Главное, помнить о технике безопасности при работе с этим щелочным металлом и осторожно применять материалы, в которых он используется. Благодаря этому можно будет избежать тех его свойств, которые являются опасными.
Читайте также:
