Методы выделения металлов из растворов
Обновлено: 24.06.2024
Электролитическое осаждение - процесс выделения металла на катоде при прохождении через раствор (электролит) постоянного тока. Обычно электролитами служат такие растворы, в которых металл присутствует в виде сульфата или хлорида, находящихся в диссоциированном состоянии: MeSO4 ↔ Ме 2+ + SO4 2- . Часть молекул воды тоже диссоциирует Н2О ↔ Н + + ОН - . Находящиеся в растворе ионы под действием электрического тока движутся к электродам: положительно заряженные ионы (катионы) направляются к электроду, соединенному с отрицательным полюсом источника тока - к катоду, а отрицательно заряженные ионы (анионы) - к положительному электроду, аноду. На электродах ионы теряют заряд, выделяясь в виде атомов (молекул), или образуют химические соединения.
Закон Фарадея. Закон Фарадея устанавливает, что при разложении различных соединений одним и тем же количеством электричества на электродах выделяются количества вещества, пропорциональные их электрохимическим эквивалентам: , где: т - количество выделенного на электроде вещества, мг; I - сила тока, а; t - время прохождения тока, сек; q — электрохимический эквивалент (количество вещества выделяемого одним кулоном электричества - током в 1 а в течение 1 сек).
Для выделения грамм-эквивалента любого иона через электролит необходимо пропустить одно и то же количество электричества, равное 96520 к. Это число называют числом Фарадея и обозначают - F. Подставляя значение электрохимического эквивалента, получаем: .
Выход по току и коэффициент использования энергии. При электролизе часть тока расходуется непроизводительно. На катоде может выделяться не только металл, но и водород. Образовавшийся катодный осадок может подвергаться окислению и растворяться. При электролизе неизбежна некоторая утечка тока. Указанные причины сниженают выход по току, который определяется отношением количества фактически отложившегося на катоде вещества к тому количеству вещества, которое соответствует прошедшему через электролит количеству электричества: , где: - количество вещества, практически отложившееся на электроде; - теоретическое количество отложенного вещества.
При электролизе около электродов собираются продукты электролиза и образуется гальванический элемент, дающий ток в обратном направлении. Электродвижущая сила такого тока называется электродвижущей силой поляризации. В результате возникновения электродвижущей силы поляризации электролиз может прекратиться, если не увеличить напряжения на электродах. Минимальное напряжение внешнего источника тока, которое необходимо приложить к электродам, чтобы началось разложение электролита, называется напряжением разложения.
Таким образом, не вся электрическая энергия расходуется на электролиз; часть ее идет на преодоление сопротивлений и прочие неизбежные потери. Поэтому важным показателем электролизной установки является коэффициент использования энергии.
Коэффициент использования энергии - отношение количества энергии, теоретически необходимого для электролиза , к израсходованному количеству энергии : .
Энергия, теоретически необходимая для получения при электролизе единицы массы металла, определяется умножением количества электричества, необходимого для осаждения металла, на напряжение разложения: .
Катодный процесс. На катоде разряжаются катионы: Ме 2+ + 2е = Me.Процесс присоединения электронов называется восстановитальным. В результате приведенной реакции образуется осадок, формирование которого идёт в 3 стадии: 1) адсорбции иона на поверхности катода; 2) разряда иона; 3) образования кристаллической решетки и роста кристалла.
В зависимости от режима электролиза металлы могут осаждаться или в виде плотного осадка равномерной толщины, или в виде порошка, или в виде рыхлого кристаллического слоя (губчатые осадки). Иногда образуются древовидные отростки, называемые дендритами.
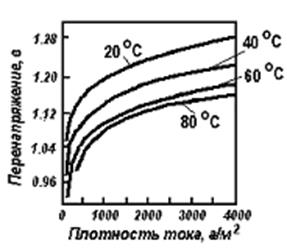
Рисунок 13.1 – Зависимость ή от Dk и Т
При электролитическом осаждении металла стараются получать плотный осадок, равномерного строения. В некоторых случаях получениют порошкообразные катодные осадки. На качество катодного осадка влияет введение в электролит коллоидов (желатины, столярного клея), которые адсорбируются поверхностью растущих на катоде кристаллов, обволакивают кристаллические центры и препятствуют их дальнейшему росту; поэтому катодный осадок получается мелкокристаллической структуры. Адсорбируемый слой коллоидов концентрируется на выпуклостях, имеющихся на катодной поверхности, и, препятствуя их дальнейшему росту, способствует выравниванию поверхности катодного осадка.
Присутствующие в растворах ионы водорода могут разряжаться на катоде вместе с ионами металла, если потенциал выделения водорода равен или меньше потенциала выделения металла. Потенциал выделения водорода зависит от материала катода, от состояния его поверхности. Наименьший потенциал выделения водорода наблюдается на губчатой платине. Зависимость перенапряжения водорода от плотности тока может быть выражена эмпирическим уравнением Тафеля: , где: — плотность тока; а и b — постоянные (а зависит от материала электрода, состояния его поверхности, состава электролита и температуры, b расчитывается по формуле: ).
Для выделения водорода со скоростью, соответствующей плотности тока, требуется дополнительная затрата энергии на восстановление иона водорода: Н + + ē → Н, чтоприводит к перенапряжению . различен на различных металлах, некоторые металлы катализируют реакцию.
С увеличением возрастает, с повышением Т - уменьшается (рисунок 1). Образование Н2 слагается из следующих стадий: 1) дегидратация ионов водорода, 2) разряд ионов водорода, 3) образования молекул водорода на поверхности катода; 4) отрыва пузырьков водорода с катода и выделения их в газовую фазу. Эта цепь процессов может быть изображена следующей схемой: Н3О + → Н + → → → Н2↑. Последняя стадия - выделение образовавшегося на катоде водорода - протекает тем успешнее, чем меньше поверхностное натяжение на границе жидкость - газ и чем оно больше на границе электрод - жидкость.
Выделение электроположительных металов происходит без особых затруднений, осаждение же электроотрицательных металлов идет успешно только при малых концентрациях водородного иона в электролите или при высоком перенапряжении водорода. Катодное осаждение кадмия и цинка возможно потому, что водород на них выделяется со значительным перенапряжением.
Прибавление в электролит коллоидов увеличивает перенапряжение водорода.
Анодный процесс. На аноде происходит разряд аниионов. При электролизе сернокислых растворов к аноду идут ионы гидроксила и кислотного остатка. Из этих двух ионов разряжаться на аноде будет тот, у которого потенциал более электроотрицательный, т. е. ион гидроксила. Так как гидроксильная группа после потери заряда неустойчива, то разряд иона гидроксила сопровождается образованием воды и выделением кислорода у анода: 4ОН - - 4е = 2Н2О + О2.
В кислых электролитах происходит разряд молекул воды: Н2О - 2е = 2Н + + 0.5О2.
При высокой плотности тока осадки получаются крупнокристаллическими, непрочно связанными с поверхностью катода, при низкой - мелкокристаллические, плотно пристающие к катоду.
На характер катодного осадка значительно влияет присутствие различных загрязнений в электролите. Одни примеси способствуют образованию древовидных наростов, другие приводят к получению дырчатых катодных отложений.
Из более концентрированных растворов получают катодные осадки плотные и мелкокристаллические; с понижением концентрации электролита осадок становится все менее плотным, наконец, рыхлым и даже порошковидным, легко осыпающимся с катода.
Разделение и осаждение металлов, получение конечных продуктов
Наиболее распространенные методы разделения и выделения металлов и их соединений из растворов — осаждение (электролиз, цементация, перевод в нерастворимые соединения, кристаллизация), сорбция, экстракция. Выбор наиболее рационального метода должен производиться в каждом отдельном случае с учетом ряда факторов, из которых первостепенное значение имеют состав поступающего на осаждение раствора и требования, предъявляемые к чистоте конечной продукции. Например, в медной промышленности применяют электролиз для переработки богатых растворов и цементацию меди — для осаждения меди при концентрации менее 15 г/л [20, 76].
Осаждение металлов производят электролизом, цементацией, восстановлением соединений до металла водородом, разложением комплексных солей.
Электролиз используют для извлечения металлов из очищенных растворов после выщелачивания (электроосаждение) и для получения чистых металлов из черновых продуктов (электрорафинирование). Этот метод получил широкое применение в гидрометаллургии меди, цинка, кадмия и марганца.
При цементации вытеснение ионов одного металла из растворов его солей производя ионами другого металла, расположенного выше в ряду напряжений (более электроотрицательного). Медь цементируют железом; или чугунной стружкой, железным скрапом губчатым железом, обезоловяненными консервными банками; золото — цинковой стружкой, цинковой и алюминиевой пылью; кадмий — цинковой пылью, никель —
кобальтовым порошком. Цементацию металлов производят в различных. аппаратах периодического или непрерывного действия (конусах барабанах, желобах, чанах, ваннах, аппаратах кипящего слоя).
Кроме того, никель, кобальт и медь осаждают из аммиачных растворов восстановлением их до металла водородом под давлением 3,5—5 МПа.
Осаждение меди или никеля из аммиачных растворов производят также разложением образовавшихся при выщелачивании комплексных углеаммониевых солей этих металлов. Медь осаждается в виде черной окиси меди, а никель — в виде карбоната. В результате дистилляции получают газообразный амиак и углекислоту, которые улавливают и вновь используют в процессе.
Часто металлы осаждаются в виде нерастворимых соединений: гидроокисей, сульфидов, ксантогенатов, карбонатов, вольфраматов, молибдатов и др. При оптимальном рН среды можно практически полностью отделить молибден от вольфрама в виде сульфида из растворов, содержащих вольфрамат натрия тиосоединения молибдена. Большое распространение в гидрометаллургических процeccax получил гидролиз, при котором возможно селективное осаждение некоторых металлов в виде гидроокисей иди основных шей.
При кристаллизации значительная часть извлекаемого металла осаждается в результате упарки и охлаждения раствора или изменения рН среды. Таким образом выделяют из раствора сульфат натрия при хлорирующем обжиге пиритных огарков и сульфат марганца при сернокислотном выщелачивании марганцевых руд. В вольфрамовой и молибденовой промышленности кристаллизацию применяют для получения чистых вольфрамата и молибдата аммония, содержание вредных примесей в которых не должно превышать тысячных долей процента.
В некоторых случаях, особенно при получении полупроводниковых соединений редких металлов, требуется, чтобы суммарное содержание всех примесей не превышало 0,05—0,1%. Поэтому полученные соединения перечищают (растворяют или разлагают их, затем повторно осаждают, часто завершающей стадией осаждения является электролиз, кристаллизация или восстановление до металла водородом).
Сорбционные и экстракционные методы извлечения металлов из растворов для значительного повышения концентрации их и очистки от вредных примесей получили широкое распространение в технологии урановых, золотосодержащих, вольфрамовых, молибденовых, медных и редко-метальных руд [20, 46, 92].
В качестве сорбентов применяют иониты— вещества, способные к обмену ионами с окружающим раствором и практически не растворимые в применяемых в гидрометаллургии растворителях. В зависимости от характера обмениваемых ионов эти вещества делят на катиониты и аниониты.
Наибольшее распространение получила сорбция осветленных растворов в колонках с неподвижным слоем ионита. Однако в урановой и золотодобывающей промышленности успешно внедрена сорбция металла ионитами из жидкой фазы пульпы — бесфильтрационная сорбция. Возможность применения такого способа определяется значительной разницей в крупности ионита и выщелачиваемого материала, что позволяет отделить ионит пропусканием пульпы через сито с отверстиями соответствующего размера. При осуществлении такого варианта ионообменного процесса значительно упрощается и делается более экономичной технологическая схема вследствие исключения операций предварительного фильтрования пульпы. Весьма эффективно совмещение йоннообменной сорбции с выщелачиванием из руды полезных компонентов (ионообменное выщелачивание), позволяющее значительно повысить технико-экономические показатели гидрометаллургического процесса.
Для последующей десорбции металлов из ионитов (элюирование) применяют растворы различных реагентов — нитрата аммоний или натрия, хлористого натрия, аммиака, едкого натра, углекислого натрия, минеральных кислот и др.
Во многих случаях сорбция металлов характеризуется высокими технологическими показателями. Так, емкость анионита по урану составляет 30—50 кг/м 3 смолы в набухшем состоянии, извлечение металла из раствора достигает 98—99,8 %, На 1 м 3 загруженной смолы сорбируется 12—23 кг урана в сутки. Еще более высокая емкость получена по вольфраму и молибдену — до 160 кг/м 3 анионита.
Продолжительность использования ионообменных сорбентов во многих случаях определяется постепенным снижением их емкости вследствие частичного «отравления» ионитов, образования инертных пленок и разрушения обменных групп. Кроме того, неизбежны механические потери ионитов. Например, после двух лет работы опытной установки, на которой уран извлекался непосредственно из пульпы, общие потери ионита вследствие истирания составили 23 %, а емкость уменьшилась на 10 %. Скорость поглощения и элюирования осталась прежней.
В качестве сорбента применяют также активированный уголь, главным образом для сорбции золота и серебра из цианистых растворов.
Очистка растворов от мышьяка и сурьмы, коллоидальной серы и некоторых других вредных примесей осуществляется сорбцией их гидратом окиси железа.
Все большее значение в гидрометаллургии приобретают экстракционные процессы, при которых водный раствор солей металлов вступает в контакт с несмешивающейся с водой органической жидкостью, извлекающей определенные металлы из исходного раствора в виде комплексных соединений. Эффективность экстракционного процесса количественно характеризуется коэффициентом распределения извлекаемого металла
где Y — концентрация металла в органической фазе; X — то же, в водной фазе.
Практически процесс экстракции может быть реализован при коэффициенте распределения металла не менее 0,3—0,5. Высокое извлечение или практически полное разделение металлов достигается при условии противоточного осуществления процесса, когда операция экстракции повторяется многократно.
В ряде случаев при экстракции достигается высокая селекция металлов из растворов, позволяющая осуществить разделение весьма близких по химическим свойствам элементов.
В качестве экстрагентов используют амины, кетоны, карбоновые кислоты, спирты, эфиры, фосфорсодержащие соединения.. В качестве растворителей экстрагентов (разбавителей) применяют углеводороды и их хлорпроизводные.
После отделения органической фазы от водной производится реэкстракцкя металла обработкой органической фазы щелочным или кислым раствором, а иногда только водой. В реэкстракте можно получить концентрацию извлекаемых элементов во много раз выше, чем в исходном растворе.
Экстракцию широко применяют в урановой промышленности. В настоящее время значительные успехи по экстракции достигнуты также в технологии извлечения и очистки многих редких и некоторых цветных металлов — меди, никеля, кобальта, тантала, ниобия, вольфрама, молибдена, рения, индия, германия, гафния и др.
В промышленности для экстракции применяют смесители, отстойники, колонны с насадкой, тарельчатые колонны с пульсацией, центробежные экстракторы и т. д.
Выделение металлов из растворов после выщелачивания
Анализ различных методов выделения металлов и их соединений из раствора после выщелачивания. Значение состава поступающего на осаждение раствора и требования, предъявляемые к чистоте конечной продукции при выборе метода выделения металлов из раствора.
| Рубрика | Химия |
| Вид | статья |
| Язык | русский |
| Дата добавления | 02.07.2018 |
| Размер файла | 23,6 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
УДК 622.772
Выделение металлов из растворов после выщелачивания
Самойлик В. Г., доцент, к.т.н., ГОУ ВПО «ДонНТУ»,
Копарев В. А., студент группы ОПИ-13 ГОУ ВПО «ДонНТУ».
Аннотация
металл выщелачивание раствор осаждение
Рассмотрены различные методы выделения металлов и их соединений из раствора после выщелачивания. Отмечено, что выбор наиболее рационального метода выделения металлов из раствора должен решаться в каждом отдельном случае с учетом ряда факторов, из которых первостепенное значение имеют состав поступающего на осаждение раствора и требования, предъявляемые к чистоте конечной продукции.
Ключевые слова: комбинированные методы обогащения, выщелачивание, осаждение, сорбция, экстракция.
Annotation
Various methods of separating metals and their compounds from the solution after leaching are considered. It was noted that the choice of the most rational method for the isolation of metals from solution should be solved in each individual case, taking into account a number of factors, of which the composition of the solution entering the precipitation and the requirements for the purity of the final product are of primary importance.
Key words: Combined methods of enrichment, leaching, precipitation, sorption, extraction.
Комбинированные методы обогащения полезных ископаемых содержат две основные обязательные операции: избирательный перевод одного из разделяемых компонентов из твердого в другое фазовое состояние (раствор, расплав, газообразное состояние); выделение разнородных фаз в разнородные продукты [1, 2].
В практике обогащения более широкое распространение получили процессы с использованием избирательного перевода твердого компонента в жидкое состояние. Это объясняется тем, что использование перевода в расплав или газообразное состояние приводит к росту энергоёмкости процесса.
Перевод твердого компонента в жидкое состояние проводится, в основном, путём химического растворения (выщелачивания). После выделения полезного компонента в раствор перед обогатителями встаёт задача по эффективному выделению этого компонента из раствора.
Выделение металлов и их соединений из раствора осуществляется разнообразными методами. Наиболее распространенными из них являются: осаждение, сорбция и экстракция.
Познакомимся с основными особенностями этих методов.
1. Осаждение
Осаждение металлов из растворов производят электролизом, цементацией, кристаллизацией, получением нерастворимых соединений и другими методами.
Электролиз (электроосаждение) широко используется при переработке меди, цинка, кадмия и марганца.
Цементация - электрохимический процесс, протекающий на поверхности металлических частиц. При цементации вытеснение ионов одного металла из раствора его солей осуществляется другим металлом, расположенным выше в ряд напряжений (более электроотрицательным). Так, для цементации меди применяют железо. Для цементации золота и серебра - цинковую и алюминиевую пыль.
Кристаллизация - это способ осаждения извлекаемого металла при упаривании и охлаждении раствора или изменении рН среды. В вольфрамовой и молибденовой промышленности кристаллизацию применяют для получения чистых вольфрамата и молибдата аммония, содержание вредных примесей в которых измеряется тысячными долями процента.
Для получения нерастворимых соединений растворы после выщелачивания подвергается воздействию соответствующих химических реагентов. В результате чего ценные компоненты переходят в форму нерастворимых соединений, которые выпадают в осадок.
Варьируя рН селективно осаждают такие металлы, как медь, никель, кобальт, железо и др. Медь и олово осаждаются в сильнокислых растворах, другие металлы - в слабокислых.
2. Сорбция
Сорбция - это метод извлечения металлов из растворов, основанный на способности синтетических ионообменных смол и некоторых природных сорбентов поглощать (сорбировать) из пропускаемого через него раствора ионы металла, отдавая в раствор эквивалентное число других ионов того же знака. Поэтому применяемые в сорбционном процессе твердые частицы называют ионообменниками или ионитами.
Иониты - твердые высокомолекулярные вещества. Они имеют трехмерную пространственную структуру макромолекул. Этим объясняется их низкая растворимость. По знаку заряда обменивающихся ионов иониты разделяются на катиониты и аниониты.
Воздушно-сухие иониты, выпускаемые промышленностью, состоят из твёрдых гранул размером от 0,5 до 4 мм. При погружении в воду они набухают. Скорость ионного обмена определяется скоростью диффузии в зерне ионита.
На рис. 1 приведена общая схема сорбционного концентрирования металлов из продуктивных растворов после выщелачивания.
Рисунок 1 - Общая схема концентрирования металлов
Сорбция осуществляется путем последовательного пропускания раствора через специальные аппараты, наполненные ионитом.
Для последующей десорбции металлов из ионитов (элюирование) применяют растворы различных реагентов с высокой концентрацией тех ионов, которые были замещены в сорбенте в процессе сорбции. Извлекаемый металл при этом переходит в новый, концентрированный по металлу раствор (элюат), а сорбент направляется снова в процесс.
3. Жидкостная экстракция
Жидкостная экстракция - это метод извлечения ценных компонентов из растворов, основанный на том, что при контактировании водного раствора, содержащего ценный компонент, с нерастворимыми в воде органическими жидкостями (экстрагентами) определенная часть этого компонента переходит (экстрагируется) в органическую жидкость. Обработка раствора экстрагентом может выполняться неоднократно, в результате чего достигается высокое извлечение полезного компонента.
Экстракт - органическая фаза после экстракции, насыщенная извлекаемым компонентом обрабатывается водным раствором какого-либо реагента и полезный компонент снова переводится в водную фазу. Полученный таким образом новый раствор (реэкстракт) отличается от исходного тем, что он содержит значительно меньше вредных примесей и более обогащен извлекаемым полезным компонентом.
Реэкстракт направляется на стадию осаждения извлекаемого металла, а органическая фаза возвращается снова в процесс (рис. 2).
Рисунок 2 - Общая схема экстракционного концентрирования металлов
Выбор наиболее рационального метода выделения металлов из раствора должен решаться в каждом отдельном случае с учетом ряда факторов, из которых первостепенное значение имеют состав поступающего на осаждение раствора и требования, предъявляемые к чистоте конечной продукции.
Список литературы
1. Самойлик, В. Г. Специальные и комбинированные методы обогащения полезных ископаемых: Учебное пособие [Текст] / В. Г. Самойлик. - Донецк: «Східний видавничий дім», 2015. - 165 с.
2. Келль, М. Н. Комбинированные процессы обогащения полезных ископаемых [Текст] / М.Н. Кель. - Л.: Изд-во ЛГИ, 1988. - 67 с.
Подобные документы
Особенности производства хлопковой целлюлозы по бисульфитно-аммиачному методу. Способы получения сернистого ангидрида и варочного раствора. Исследование правил выделения химических реагентов из аммиачного варочного раствора повторного использования.
контрольная работа [307,9 K], добавлен 11.10.2010
Изучение влияния металлов, входящих в состав твердого раствора, на стабильность к окислению порошков. Исследование свойств наноразмерных металлических порошков. Анализ химических и физических методов получения наночастиц. Классификация процессов коррозии.
магистерская работа [1,4 M], добавлен 21.05.2013
Строение атомов металлов. Положение металлов в периодической системе. Группы металлов. Физические свойства металлов. Химические свойства металлов. Коррозия металлов. Понятие о сплавах. Способы получения металлов.
реферат [19,2 K], добавлен 05.12.2003
Технологическая схема очистки поверхности металлоизделий от оксидов металлов и обработка промывных вод травильных агрегатов. Регенерация отработанного раствора серной кислоты методом кристаллизации. Малоотходная технология регенерации медьсодержащих вод.
курсовая работа [843,3 K], добавлен 11.10.2010
Приготовление растворов полимеров: процесс растворения полимеров; фильтрование и обезвоздушивание растворов. Стадии производства пленок раствора полимера. Общие требования к пластификаторам. Подготовка раствора к формованию. Образование жидкой пленки.
Методы выделения металлов из растворов
На основании результатов предыдущего экспериментального исследования авторов по снижению содержания меди в технологических растворах участка кучного выщелачивания разработана технология извлечения металлов из оборотных технологических растворов. Технология предусматривает сочетание осаждения меди и золота из растворов с одновременной регенерацией цианида натрия. Предложенная технологическая схема включает два химических реактора, шламосборник, нутч-фильтр, накопитель-нейтрализатор, емкость для приготовления щелочного раствора, сборник бедных растворов. Установлено, что при использовании этой схемы степень очистки оборотных технологических растворов участка кучного выщелачивания от соединений меди должна составить 98,12 % из сернокислых растворов и 99,98 % из солянокислых растворов; степень регенерации цианида натрия – 68,74–71,18 %. Предлагаемая технология является оригинальной и экономически эффективной.

1. Варламова И.А., Гиревая Х.Я., Калугина Н.Л., Куликова Т.М., Медяник Н.Л. Физико-химические закономерности извлечения тяжелых металлов из техногенных гидроминеральных месторождений. – Магнитогорск: МиниТип, 2010. – 246 с.
2. Калугин Д.А., Калугина Н.Л. Определение оптимальных параметров цементации меди из оборотных технологических растворов золотоизвлекательного участка // Общество, наука и инновации: сборник статей международной научно-практической конференции. – Уфа, 2013. – С. 54-58.
3. Калугина Н.Л., Варламова И.А., Калугин Д.А. Современные способы снижения содержания ионов меди (II), железа и хлора при обессоливании растворов // Химия. Технология. Качество. Состояние, проблемы и перспективы развития: сборник материалов международной заочной научно-технической конференции. – Магнитогорск: МГТУ, 2012. – С. 20-33.
4. Калугина Н.Л., Варламова И.А., Калугин Д.А., Варламова Н.А. Цементационное извлечение меди из растворов и различных материалов // Актуальные проблемы современной науки, техники и образования. – 2013. – Т. 1. - № 71. – С. 323-326.
6. Медяник Н.Л., Варламова И.А., Калугина Н.Л. Применение ионной флотации для извлечения меди и цинка из техногенных рудничных вод // Сталь. – 2014. - № 7. – С. 119-123.
7. Медяник Н.Л., Варламова И.А., Калугина Н.Л., Гиревая Х.Я. Выбор высокоэффективных реагентов для флотационного извлечения ионов меди (II) и цинка из техногенных гидроминеральных ресурсов // Вестник Иркутского государственного технического университета. – 2010. - № 3 (43). – С. 91-96.
8. Медяник Н.Л., Гиревая Х.Я. Извлечение ионов меди из сточных вод с помощью осадителей-восстановителей // Вестник Магнитогорского государственного технического университета им. Г.И. Носова. – 2007. - № 1. – С. 113-114.
10. Медяник Н.Л., Калугина Н.Л., Варламова И.А., Строкань А.М. Методология создания ресурсовоспроизводящих технологий переработки техногенного гидроминерального сырья //Вестник Магнитогорского государственного технического университета им. Г.И. Носова. – 2011. - № 1. – С. 5-9.
В настоящее время все более пристальное внимание обращают на себя технологии, позволяющие эффективно извлекать ионы металлов из промышленных растворов и создавать замкнутые системы оборотного водоснабжения. Таким образом, можно предотвратить их вредное воздействие на окружающую среду.
Полноценное извлечение цветных и драгоценных металлов из технологических растворов промышленных предприятий объясняется не только необходимостью защиты окружающей среды, но и ценностью самих металлов [1, 6, 8]. В связи с этим исследования по переработке технологических растворов и утилизации извлекаемых соединений металлов являются актуальной научной и практической задачей.
Одним из недостатков кучного выщелачивания золота цианидами является сложность обработки образующихся оборотных технологических растворов, использование которых должно обеспечить получение таких технологических показателей извлечения золота и серебра, которые не уступали бы достигаемым при использовании свежей воды. Следовательно, необходимо постоянно проводить кондиционирование оборотных растворов, т.е. использовать комплекс мер, обеспечивающих их очистку от вредных примесей, изменение концентрации отдельных компонентов. С экономической точки зрения наиболее интересной представляется очистка растворов введением реагента-осадителя с последующей обработкой осветленного фильтрата с целью извлечения циановодорода. Это удешевляет технологический процесс за счет возврата в него цианида натрия, осаждения совместно с драгметаллами малоактивной меди, повышенное содержание которой в растворе значительно снижает степень извлечения золота методом электроосаждения. Осаждение меди целесообразно проводить методом цементации.
Цель исследования - создание технологии извлечения меди, золота и серебра из оборотных технологических растворов золотоизвлекательного участка с одновременной регенерацией цианида натрия.
Материалы исследования
Первоначально на реальных технологических растворах золотоизвлекательного участка из обеззолоченного пруда, санитарного прудка, шламоотстойника, аварийного пруда были проведены экспериментальные исследования по следующим направлениям [2-5, 7, 9, 10]:
- определение оптимального значения рН цементации меди из оборотных технологических растворов;
- сравнение эффективности цементации меди железом различных марок;
- выявление зависимости между количеством введенного цементатора и степенью извлечения меди из технологических растворов;
- определение оптимального расхода сухой щелочи, необходимой для последующей нейтрализации растворов после цементации;
- определение расхода соляной и серной кислот для подкисления исходных технологических растворов до рН эффективной цементации;
- определение оптимального времени отстаивания твердой фазы из подкисленных технологических растворов.
Оптимальное значение рН цементации меди из оборотных технологических растворов - это рН, при котором достигается максимальное извлечение меди из технологических растворов. Полученные результаты свидетельствуют о том, что высокоэффективная цементация всех технологических растворов наблюдается при значениях рН, примерно равных 1,0. Степень извлечения меди в цементат составляет при этом от 96,74 % (из технологического раствора аварийного пруда) до 99,50 % (из технологического раствора шламоотстойника).
Сравнение эффективности цементации меди железом различных марок (CMS иASC-300), представленным заказчиком, проводили, используя технологический раствор обеззолоченного пруда. Установлено, что оптимальное молярное соотношение меди, содержащейся в растворе, и добавляемого железа составило υ(Cu):υ(Fe) = 1,00:1,65, что несколько превышает соотношение, указанное в паспорте. Также определено, что эффективную цементацию меди при рН 1,0 предпочтительно проводить железом марки CMS. Степень извлечения меди в этом случае максимальна и составляет 99,13 %.
Выявление зависимости между количеством введенного цементатора и степенью извлечения меди из технологических растворов исследовали с целью определения минимального расхода эффективного железа-цементатора. Эксперимент проводили с железом марки CMS, меняя массу железа, добавленного в одинаковые объемы (аликвоты) технологических растворов из обеззолоченного пруда, подкисленных до рН 1,068. Молярные соотношения между исходным количеством меди в технологическом растворе и количеством введенного цементатора варьировались от 2,86:1,00 до 1,00:2,60. Данные, полученные в ходе эксперимента, свидетельствуют о том, что остаточное содержание меди минимально, а степень извлечения меди достигает 99,10 - 99,17 % при молярном отношении υ(Cu):υ(Fe) = 1,00:1,88. Оптимальный расход железа марки CMS для извлечения в цементат меди из технологических растворов обеззолоченного пруда составляет 4,59 кг/м 3 . Однако уже при соотношении υ(Cu):υ(Fe) = 1,00:1,00 извлечение меди протекает достаточно эффективно (около 97 % меди извлекается в цементат), тогда расход железа - 2,44 кг/м 3 .
Изучив состав растворов после проведения эффективной цементации (рН примерно 1,0; молярное соотношение медь - цементатор υ(Cu):υ(Fe) = 1,00:1,88), получили следующие результаты:
- степень извлечения меди составляет при цементации железом CMS 99,65 % из обеззолоченного пруда, 97,44 % из санитарного прудка, 99,81 % из шламоотстойника,
99,39 % из аварийного пруда;
- цементация железом марки ASC-300 менее эффективна в этих условиях; степень извлечения меди составляет 98,99 % из обеззолоченного пруда, 89,78 % из санитарного прудка, 98,70 % из шламоотстойника, 97,62 % из аварийного пруда.
Содержание цианида натрия в условиях проведения эффективной цементации снижается по сравнению с исходными щелочными растворами в 1,86-24,6 раз для различных технологических растворов, что можно объяснить активным восстановлением и выделением циановодорода в сильнокислой среде.
Также был определен оптимальный расход гидроксида натрия, необходимого для последующей нейтрализации растворов после цементации. Полученные результаты свидетельствуют о том, что для достижения рН 5,0-6,0 необходимо добавление следующих количеств сухой щелочи: 9,2 кг на 1м 3 кислого раствора из обеззолоченного пруда, 3,55 кг на 1м 3 кислого раствора из санитарного прудка, 4,4 кг на 1м 3 кислого раствора из шламоотстойника, 4,0 кг на 1м 3 кислого раствора из аварийного пруда.
Был также установлен оптимальный расход соляной и серной кислот, необходимый для подкисления исходных технологических растворов до рН эффективной цементации.
В заключение изучили кинетику отстаивания твердой фазы из подкисленных технологических растворов. Установлено, что тридцатиминутное отстаивание достаточно для установления стабильного объема твердой фазы и практически полного осветления раствора над осадком.
Основываясь на результатах проведенных исследований, была разработана технология переработки технологических растворов, адаптированная к условиям опытно-промышленного участка кучного выщелачивания ООО «Башкирская медь», основанная на осаждении меди и драгметаллов методом цементации после подкисления технологических растворов до рН 1-2 с одновременной регенерацией циановодорода и переведением его в раствор в форме цианида натрия. Технологическая схема представлена на рис. 1.
Как установлено в ходе проведенного опытно-лабораторного эксперимента, при применении этой технологии степень очистки оборотных технологических растворов участка кучного выщелачивания от соединений меди составила 98,12 % из сернокислых растворов и 99,98 % из солянокислых растворов; степень регенерации цианида натрия - 68,74-71,18 %.
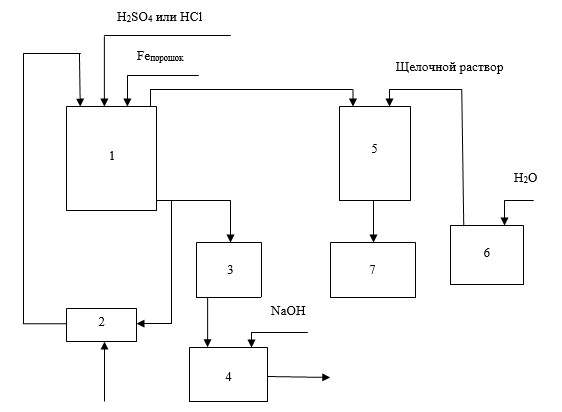
Рис. 1. Технологическая схема осаждения меди и драгметаллов из оборотных технологических растворов с одновременной регенерацией цианистого натрия: 1 - реактор I,
2 - шламосборник, 3 - нутч-фильтр, 4 - накопитель-нейтрализатор, 5 - реактор II, 6 - емкость для приготовления щелочного раствора, 7 - сборник бедных растворов
Предложенная технологическая схема включает:
Герметичный химический реактор I для последовательного подкисления исходных оборотных технологических растворов и проведения в них цементации. В нижней части реактора расположено пневматическое перемешивающее устройство с компрессором для подачи воздуха.
Процесс в реакторе I включает:
- подачу в реактор технологического раствора, его нагревание через рубашку острым водяным паром, подкисление при перемешивании до рН 1-2;
- выделение и отсос восстановленного циановодорода по герметичной системе в реактор II;
- отстаивание образующихся в процессе подкисления обводненных гидролитических шламов;
- удаление образовавшихся шламов после окончания процесса их осаждения в шламосборник;
- подачу отмеренного количества железа-цементатора в осветленный кислый раствор при перемешивании и проведение цементации;
- перемещение образующейся суспензии из реактора I на нутч-фильтр.
Шламосборник, в который закачиваются кислые гидролитические шламы из реактора I, служит одновременно подкислителем исходных технологических растворов, подаваемых на обработку. Это позволяет снижать расход кислоты, подаваемой в реактор I.
После проведения цементации образовавшаяся суспензия, состоящая из цементационного концентрата и подкисленного осветленного раствора, периодически подается на фильтроткань нутч-фильтра. После окончания фильтрования суспензии очищенный кислый раствор сбрасывается по трубопроводу в промежуточную емкость - накопитель-нейтрализатор. Твердый цементационный концентрат периодически снимают с фильтроткани и отправляют на переработку.
Накопитель-нейтрализатор представляет собой негерметичную емкость, в которую при перемешивании подается отмеренное количество твердого гидроксида натрия для доведения рН до 5-7. По окончании нейтрализации часть раствора из накопителя-нейтрализатора подается в емкость для приготовления щелочного раствора, часть - сбрасывается в санитарный пруд.
Герметичный химический реактор II предназначен для регенерации восстановленного циановодорода. Верхняя часть его имеет цилиндрическую форму, нижняя часть - коническая. Реактор через форсунки сверху заполняется щелочным раствором, поступающим из емкости для приготовления щелочного раствора. Щелочной раствор подается обильно в заведомом избытке. В результате реакции, протекающей между циановодородом и гидроксидом натрия, образуется раствор цианида натрия, который, после полного окончания процесса выделения циановодорода, отводится через патрубок в нижней части реактора в сборник бедных растворов.
Заключение.
Предлагаемая технология является экономически эффективной, так как ее внедрение позволит:
- значительно повысить степень извлечения золота на ОПУ КВ в процессе электроосаждения, т.к. она напрямую зависит от чистоты оборотных технологических растворов;
- использовать образующиеся в процессе цементации концентраты, содержащие медь, золото и серебро, для дополнительного извлечения драгметаллов;
- существенно снизить потребление участком такого дорогого реагента как цианид натрия;
- повысит экологичность производства золотоизвлекательного участка.
Рецензенты:
Стеблянко В.Л., д.т.н., профессор, профессор кафедры химии ФГБОУ ВПО «Магнитогорский государственный технический университет им. Г.И. Носова», г. Магнитогорск;
Черчинцев В.Д., д.т.н., профессор, зав. кафедрой промышленной экологии и безопасности жизнедеятельности ФГБОУ ВПО «Магнитогорский государственный технический университет им. Г.И. Носова», г. Магнитогорск.
Изучение способов выделения металлов платиновой группы и редких халькогенов из растворов сложного состава Текст научной статьи по специальности «Химические науки»
Аннотация научной статьи по химическим наукам, автор научной работы — Г. В. Глазунова, М. А. Ласточкина, Т. В. Вергизова, Т. Н. Грейвер
Изучен метод цементации из сульфатных растворов, содержащих цветные и благородные металлы, селен и теллур, который позволяет в зависимости от поставленной задачи получать как коллективные, так и селективные концентраты благородных металлов и редких халькогенов.
Похожие темы научных работ по химическим наукам , автор научной работы — Г. В. Глазунова, М. А. Ласточкина, Т. В. Вергизова, Т. Н. Грейвер
Сорбция благородных металлов и халькогенов из растворов выщелачивания пыли от обжига сульфидного никелевого концентрата
The method of cementation from sulfate solutions containing non-ferrous and noble metals was studied. The method allows producing collective and selective noble metals concentrates as well as rare chalcogens depending on problem put by.
Текст научной работы на тему «Изучение способов выделения металлов платиновой группы и редких халькогенов из растворов сложного состава»
Г.В.ГЛАЗУНОВА, М.А.ЛАСТОЧКИНА, Т.В.ВЕРГИЗОВА,
ОАО «Институт Гипроникель», Санкт-Петербург
ИЗУЧЕНИЕ СПОСОБОВ ВЫДЕЛЕНИЯ МЕТАЛЛОВ ПЛАТИНОВОЙ ГРУППЫ И РЕДКИХ ХАЛЬКОГЕНОВ ИЗ РАСТВОРОВ СЛОЖНОГО СОСТАВА
Гидрометаллургическая технология переработки платиносодержащих электролитных шламов позволяет получать сернокислые растворы, содержащие, наряду с цветными металлами, железом, селеном и теллуром, серебро, палладий, родий, рутений и иридий. Изучение возможности селективного выделения серебра, палладия, селена и теллура и редких платиновых металлов (Rh, Яи, 1г) изучено на растворах, состав которых приведен в таблице.
Состав сульфатных растворов гидрометаллургической переработки электролитных шламов, г/дм3
Cu 1,78 41,09 25,01
H2SO4 48,0 104,0 87,0
Rh 0,0136 0,248 0,06
Ru 0,002 0,029 0,013
Ir 0,0013 0,022 0,025
Серебро из сульфатных растворов сложного состава (таблица, растворы 2, 3) осаждали в виде хлорида, с получением
концентрата, содержащего 0,015 % палладия и более 75 % серебра.
Для избирательного извлечения палладия был выбран метод восстановления сульфатом двухвалентного железа, реализованный в химико-металлургическом цехе (ХМЦ) комбината «Североникель» в 1983 г. [3]. Как показала проверка, после осаждения хлорида серебра из раствора 3 (см. таблицу) сульфатом железа (II) при температуре 95 °С и расходе реагента 3-4 моля на 1 моль палладия был осажден концентрат, содержащий 56,5 % палладия. Извлечение палладия в концентрат составило 95-99 %, селена -1-5,1 %, при этом родий, рутений, иридий и теллур остаются в растворе и не соосажда-ются в палладиевый концентрат.
Как известно, в кислых растворах серебро, платина и палладий имеют потенциалы, близкие к системам, содержащим селеновую и теллуровую кислоты [2] и соцемен-тируются с редкими халькогенами медным либо никелевым порошком с образованием халькогенидов. При отсутствии в сернокислых растворах палладия и серебра (либо после их селективного извлечения) избирательное выделение селена и теллура ограничивается отделением редких халькогенов от металлов-спутников платины.
Цементация селена и теллура из сульфатных растворов исследована в работе [1]
ISSN 0135-3500. Записки Горного института. Т. 165
и применяется в ХМЦ комбината «Северо-никель» для осаждения селена из растворов газоочистки. Селен (IV) при цементации осаждается уже при комнатной температуре с образованием селенидов и теллуридов никеля (меди):
H2SeOз + 3Ме + 2H2SO4 = = MeSe + 2MeSO4 + ЗН2О; (1)
Те032^ + 3№ + 6Н+ = = №Те + 2Ni2+ + ЗНзО, (2)
причем при достаточном содержании меди в растворе образуются предпочтительно менее растворимые селениды меди Си^е и CuSe. Помимо реакций (1) и (2) в процессе цементации железо (III) восстанавливается до железа (II) по реакции
2Fe3+ + № = 2Fe2+ + Ni2+. (3)
Состав цементата зависит от расхода никелевого порошка, условий цементации и соотношения Си, Se и Те в растворе. Для обеспечения высокого извлечения в цемен-тат Se и Те расход никелевого порошка должен быть (с учетом его активности и расхода на побочные реакции, например, восстановление трехвалентного железа) примерно 4-5 моль на 1 моль суммы селена и теллура.
В сульфатных растворах гидрометаллургической переработки электролитных шламов (см. таблицу, растворы 1-3)
шламов (см. таблицу, растворы 1-3) селен и теллур присутствуют в степени окисления IV, в соответствии с этим можно ожидать, что избирательная цементация селена и теллура в присутствии металлов-спутников платины возможна при относительно низкой температуре.
Экспериментальную проверку процесса цементации проводили при комнатной температуре на растворах 1-3, предварительно очищенных от палладия и серебра. Продолжительность процесса определяли снижением окислительно-восстановительного потенциала (по отношению к хлорсеребряному электроду) от 550 до 300 мВ.
Установлено, что цементация при температуре 20-30 °С за 2-3 ч позволяет обеспечить селективное выделение селена и теллура. Из сульфатных растворов различного состава были получены цементаты, содержащие 33-45 % селена, 2,5-2,7 % теллура, что соответствует извлечению более 99,8 % селена и 98,7 % теллура. При этом родий, рутений и иридий в цементате не обнаружены.
После цементации из раствора, содержащего редкие спутники платины, осаждением тиомочевиной в автоклаве с последующим обезмеживанием был получен богатый концентрат металлов-спутников платины, содержащий более 30 % их суммы.
Таким образом, в зависимости от поставленной задачи при переработке сульфатных растворов, содержащих цветные и благородные металлы, селен и теллур, возможно получение как коллективных, так и селективных концентратов благородных металлов и редких халькогенов.
1. Грейвер Т.Н. Селен и теллур. Новая технология получения и рафинирования / Т. Н.Грейвер, И.Г.Зайцева, В.М.Косовер. М.: Металлургия, 1977. 206 с.
2. Латимер В. Окислительные состояния элементов и их потенциалы в водных растворах. М.: Иностранная литература, 1954. 400 с.
3. Поведение цветных и благородных металлов при переработке электролитных шламов методом двух-стадийной сульфатизации / В.М.Худяков, Т.Н.Грейвер, В.Д.Ким и др. // Цветные металлы. 1992. № 7. С.17-20.
Читайте также:
