Межатомные связи в металлах
Обновлено: 06.05.2024
Хорошо известно, что конструкционные материалы представляют собой агрегат атомов (ионов), находящихся во взаимодействии. Физические и прочностные характеристики твёрдых тел определяются расположением атомов (ионов) и химическими связями, действующими между ними.
Все твердые тела сопротивляются как деформации растяжения, так и деформации сжатия. Следовательно, между частицами твердого тела действуют как силы притяжения, так и силы отталкивания. При определенном расстоянии между частицами эти силы уравновешиваются, что и соответствует равновесному состоянию кристалла. В грубом приближении это может быть пояснено механической моделью (рисунок 1), представляющей собой два шарика, соединенных натянутым резиновым шнуром и сжатой спиральной пружиной. Шарики находятся в равновесии, так как сила натяжения шнура уравновешена расталкивающей силой сжатия пружины.
Рисунок 1 - Модель межатомных сил в твёрдом теле
На самом же деле картина значительно сложнее, так как силы взаимодействия между частицами тела находятся в более сложной зависимости от расстояния между ними, чем упругие силы. Теория и опыт показывают, что силы притяжения между частицами твердого тела проявляются уже при таких расстояниях, при которых силы отталкивания еще не сказываются. Те и другие силы возрастают с уменьшением расстояния между частицами, но силы притяжения возрастают значительно медленнее, чем силы отталкивания.
При соединении металлов атомы сближаются на расстояние 0,0002-0,0003 мкм, когда волновые функции валентных электронов перекрываются, и эти электроны получают возможность переходить от одного атома к другому, довольно свободно перемещаясь по всему объёму металла. Валентные электроны принято называть «коллективизированными», а связь, существующую между ионами, - металлической.
Для того, чтобы сварное соединение обладало теми же свойствами, что и свариваемые материалы, необходимо в зоне соединения (между свариваемыми поверхностями) сформировать такие же химические связи, как и в соединяемых материалах.
Для пояснения процесса образования сварного соединения рассмотрим схематически соединение двух монокристаллов с идеально чистыми и идеально ровными поверхностями (рисунок 2).
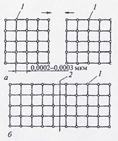 | а - монокристаллы до сварки; б - монокристаллы после сварки; 1 - ион кристаллической решётки; 2 - граница сварного соединения Рисунок 2 - Схема образования сварного соединения между двумя моно кристаллами |
Соединение таких монокристаллов (состояние а) в единое целое (состояние б) произойдёт, если сблизить их поверхности на расстояние равное или близкое параметру кристаллической решётки 0,0002-0,0003 мкм.
Сварка реальных твёрдых тел затрудняется рядом факторов. Реальные тела - поликристаллические. Они не имеют идеально чистых и гладких поверхностей.
После механической обработки на поверхности металлов присутствует и макроскопическая, и микроскопическая геометрическая неоднородность - волнистость и шероховатость соответственно. Микровыступы располагаются на волнистой поверхности, шаг которой может составлять от 1000 до 10000 мкм, а высота микровыступов от нескольких микрометров (после шлифования) до десятков микрометров (после токарной и фрезерной обработки), что на несколько порядков больше параметра кристаллической решётки.
При сближении таких поверхностей их контактирование произойдёт не по всей поверхности, а лишь в отдельных точках (рисунок 3).
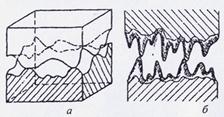 | Рисунок 3 - Модель контакта твёрдых тел по макроскопической волнистости (а) и микроскопической шероховатости (б) поверхностей |
Задача соединения реальных поверхностей металлов в одно целое значительно осложняется и наличием на контактных поверхностях, помимо микровыступов, оксидов, адсорбированных газов, влаги, органических (жировых) загрязнений.
Образование металлических связей возможно при условии удаления с контактных поверхностей загрязнений (наиболее прочными из которых являются оксиды) и обеспечения сплошности физического контакта, т. е. при сближении свариваемых поверхностей на расстояние параметра кристаллической решётки по всей поверхности соединения.
При всех способах сварки соединяемые поверхности предварительно подвергают обработке, обеспечивающей удаление поверхностных загрязнений и определённую геометрию поверхности. Однако в атмосфере воздуха на очищенных поверхностях уже за 2,4*10 -9 ч образуется мономолекулярный слой газа, поэтому, как бы ни очищали поверхности металла перед сваркой, они всегда оказываются покрытыми слоем оксида.
Наименьшую высоту микровыступов на свариваемых поверхностях обеспечивает их особо чистовое полирование, но и после такой трудоёмкой обработки высота микровыступов в сотни раз больше параметра кристаллической решетки. Поэтому образование сварного соединения (сближение свариваемых поверхностей, удаление оксидов и образование металлических связей) может происходить в процессе пластической деформации свариваемых поверхностей под действием приложенных сжимающих давлений или в процессе оплавления поверхностей с последующим самопроизвольным образованием общей сварочной ванны. Следовательно, все способы сварки можно условно разделить на сварку давлением и сварку плавлением.
Сварка давлением может осуществляться без подогрева (холодная сварка) и с подогревом. При холодной сварке необходима деформация более 90 %, в процессе которой происходит смятие микровыступов на свариваемых поверхностях и разрушение оксидных плёнок (рисунок 4).
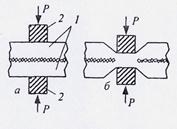 | а - исходное состояние; б - после сварки; 1 - свариваемые пластины; 2 - инструмент для передачи давления (пуансоны) |
| Рисунок 4 - Схема холодной сварки пластин |
Подогрев свариваемых заготовок облегчает процесс сварки, и соединение происходит при значительно меньшей деформации (рисунок 5).
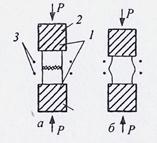 | a - исходное состояние; б - после сварки; 1 - свариваемые заготовки; 2 - инструмент для передачи давления (пуансоны); 3 - нагреватель (индуктор) |
| Рисунок 5 - Схема сварки давлением с подогревом |
При расплавлении металла в нём сохраняются связи между атомами (ионами). Сохраняются они и на межфазных границах твёрдый металл - жидкий, образовавшихся при плавлении кромок. Поэтому для формирования непрерывной межатомной связи достаточно образования общей сварочной ванны и, как следствие, исчезновения границы между соединяемыми поверхностями (рис. 1.6).
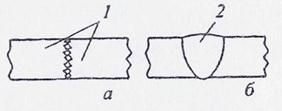 | а - исходное состояние; б - после сварки;1 - свариваемые заготовки; 2 - сварной шов |
| Рисунок 6 - Схема образования соединения при сварке плавлением |
Формированию сварного соединения могут препятствовать поверхностные загрязнения, прежде всего — оксиды. При этом оксиды могут растворяться в сварочной ванне (например, при сварке сталей, титана и др.) и загрязнять сварной шов кислородом. Если же оксиды тугоплавкие и нерастворимы в жидком металле, то они препятствуют сплавлению металла и образованию общей сварочной ванны (например, при сварке алюминия). В этом случае изыскивают приёмы, обеспечивающие разрушение и удаление оксидов в процессе сварки.
Таким образом, процесс сварки следует рассматривать как совокупность технологических приёмов (расплавление свариваемых поверхностей с образованием сварочной ванны, нагрев и деформация свариваемых заготовок и пр.) для установления межатомных связей на границах раздела соединяемых заготовок.
Следует отметить, что образование металлических связей между свариваемыми поверхностями — основной и необходимый этап формирования соединения, однако он не определяет конечные свойства полученных сварных соединений. Эти свойства зависят от ряда процессов, сопутствующих образованию межатомных связей - процессов, которые изменяют в зоне сварного соединения микроструктуру, химический и фазовый состав, и формируют внутренние напряжения, а также способствуют развитию деформации.
Наибольшие отклонения свойств сварного соединения от свойств основного металла наблюдаются при сварке плавлением, так как в этом случае металл нагревается, во-первых, неравномерно по всему объёму свариваемых заготовок и, во-вторых, до наиболее высокой температуры -температуры плавления.
При сварке давлением также могут происходить изменения фазового состава и микроструктуры свариваемых заготовок, так как металл может нагреваться выше температуры рекристаллизации и фазовых превращений. Но эти изменения не столь существенны, как при сварке плавлением.
Поэтому при рассмотрении процесса образования сварного соединения в условиях сварки плавлением следует ознакомиться с закономерностями:
· изменения химического состава металла сварного шва;
· формирования структуры соединения;
образования внутренних (сварочных) напряжений, возникающих при неравномерном нагреве и способных вызывать деформации свариваемых конструкций и даже разрушение сварного соединения.
Образование межатомных связей при сварке
2. Крсталлизация металлов и сплавов
Движущими силами объединения атомов или молекул вещества (твердого, жидкого, газообразного) являются силы взаимного притяжения и отталкивания. Зная характер взаимодействия между атомами, можно прогнозировать свойства материалов.
Если энергия взаимодействующих атомов меньше суммарной энергии изолированных атомов, то между ними возникает взаимодействие. Между атомами могут действовать гравитационные, магнитные и электрические силы. Роль магнитных взаимодействий мала (10 -6 эВ), а гравитационными силами можно вообще пренебречь (10 -32 эВ). Электростатическая энергия взаимодействия элементарных электрических зарядов, находящихся на расстоянии 0,2–0,3 нм составляет:
U = e 2 / r = – (5 – 7) эВ.
Это значение соответствует по порядку величины энергии связи атомов в кристаллах, обусловленной электрическим взаимодействием. При этом связь осуществляется валентными электронами атомов. Существенное различие между типами межатомных связей в твердых телах обусловлено качественным различиям в характере распределения валентных электронов и ионных остовов атомов.
П отенциальная энергия взаимодействия двух атомов зависит от расстояния r между ними и может быть представлена в виде суммы потенциалов притяжения и отталкивания (рис. 2.1). Энергия притяжения в системе ион-электрон является причиной металлической связи и проявляется при всех значениях r. Энергия отталкивания связана с деформацией электронных оболочек ионов и проявляется только на малых расстояниях. Величина r0 – равновесное расстояние между атомами. Энергию связи Eс оценивается как работа, которую необходимо затратить, чтобы оторвать атом и удалить в бесконечность.
Химические связи. Тип связи в значительной степени определяется разностью электроотрицательностей элементов:
где χА и χВ – электроотрицательности атомов А и В. Ионная связь возникает при полном или частичном обмене валентными электронами, ковалентная – при частичном. Металлическая связь по природе ковалентная, но при этом обобществляется множество электронов. Силы Ван-дер-Ваальса возникают без обмена зарядами.
Ионная (гетерополярная) связь возникает при большой разнице в электроотрицательностях связываемых атомов (Δχ > 2). Менее электроотрицательный атом отдает свои валентные электроны и превращается в катион, более электроотрицательный присоединяет электроны и становится анионом. Связь образуется за счет электростатического взаимодействия противоположно заряженных ионов, которое не зависит от направления. О связи говорят как о ненаправленной и ненасыщенной. В ионных кристаллах не существует отдельных молекул, «молекулой» считается весь кристалл. Энергия связи – несколько электронвольт. Ионные кристаллы, в основном диэлектрики, имеют высокие температуры плавления, прозрачны в широком диапазоне частот.
Идеальной ионной связи нет. Полного перехода электронов не происходит, они частично остаются в общем пользовании. Кристаллическое строение типичного ионного кристалла NaCl нельзя объяснить, только исходя из сферического характера сил электростатического притяжения катионов к анионам. Ионы хлора имеют полностью достроенную внешнюю оболочку, включающую 2s-электрона и 6p-электронов. Электронная плотность s-электронов распределена в виде сферы, три пары p-электронов образуют гантели, вытянутые по осям координат. Размер этих орбиталей превышает диаметр сферы. В образовании структуры NaCl основную роль приобретает взаимодействие p-электронов. Под действием кулоновских сил ионы натрия и хлора сближаются, их внешние электронные орбитали частично перекрываются (рис. 2.2). Такое перекрытие, связанное с обменным взаимодействием, приводит к структуре элементарного куба.
Т аким образом, центральные ненаправленные силы электростатического притяжения лишь сближают катионы и анионы. Образование кристаллической решетки происходит благодаря обменному взаимодействию p-орбиталей.
Металлическая связь. В кристаллической решетке металла внешние электроны покидают атомы, превращая их в катионы. Электростатическое взаимодействие обусловлено отталкиванием ионов (электронов) и притяжением ионов и электронов. Электроны стремятся приблизить катионы, уравновешивая силы отталкивания. Благодаря свободным электронам металлы хорошо проводят электрический ток и тепло. При нагревании колебания катионов увеличиваются, электронам труднее продвигаться между ними и электрическое сопротивление металла увеличивается. Металлическая связь существует в твердом, расплавленном и аморфном состоянии металлов.
П редставление о том, что связи в металлах осуществляются взаимодействием положительных ионов с электронным газом нельзя считать исчерпывающим. В качестве примера рассмотрим возникновение химической связи в кристалле натрия. Атомы ионизированы не полностью, часть валентных электронов остается связанной. Кулоновское взаимодействие сближает катионы натрия. Это приводит к частичному перекрытию p-орбиталей (рис. 2.3). Возникающие силы обменного взаимодействия обеспечивают формирование кристаллической структуры. Вклады ионной и ковалентной составляющих связи обнаружены во многих металлах.
Молекулярная связь. Молекулярные кристаллы образованы молекулами, связанными слабыми ван-дер-ваальсовыми силами. Взаимодействие молекул не приводит к разрыву или образованию новых связей.
Ориентационное взаимодействие. В полярных молекулах центры тяжести положительного и отрицательного зарядов не совпадают и они ориентируются так, чтобы рядом находились концы молекул с противоположными зарядами, в результате возникают силы притяжения.
Индукционное взаимодействие возникает между полярными и неполярными молекулами. Неполярная молекула поляризуется и становится полярной, молекулы притягиваются слабее, чем в случае двух полярных молекул.
Дисперсионное взаимодействие возникает между неполярными молекулами. При движении электроны создают состояния с повышенной электронной плотностью с одной стороны молекулы. Неполярная молекула становится полярной. Это вызывает перераспределение зарядов в соседних молекулах, между ними устанавливаются кратковременные связи. Если бы молекулы только притягивались, то это привело бы к их слиянию. При сближении молекул, на малых расстояниях возникает межмолекулярное отталкивание электронных оболочек.
Внутри молекул атомы соединены прочными ковалентными связями. В молекулярных кристаллах плавление, испарение, возгонка (переход вещества из твердого состояния в газообразное, минуя жидкое) происходит без разрушения отдельных молекул. Для молекулярных кристаллов характерны низкие температуры плавления, большие коэффициенты теплового расширения, малая твердость. Молекулярные кристаллы образуют многие органические, металлоорганические и комплексные соединения, бинарные соединения (Н2О, СО2, НСl), некоторые твердые простые вещества (Н2, N2, O2). В кристаллах твердых инертных газов (Ar, Ne, Kr, Xe) силы Ван-дер-Ваальса связывают между собой не молекулы, а атомы. В электрическом отношении молекулярные кристаллы являются диэлектриками.
В реальных кристаллах химические связи в чистом виде встречаются редко: имеет место их наложение. Одна из них преобладает, определяя структуру и свойства твердого тела.
Типы межатомных связей. Влияние на свойства материалов.
1) Ионная связь – присуща химическим соединениям, образованная элементами с резко различающейся валентностью. Так металлы, имея 1, 2 электрона на внешней орбите, которые не прочно связаны с ядром. Вступая в реакцию с неметаллами, металлы отдают электроны и превращаются в ионы. Неметаллы принимают эти электроны, превращаясь в отрицательные ионы => ионная связь обеспечивает электро – статическое притяжение.
Ионная связь жесткая и направленная => Все химические соединения прочные, твердые, но очень хрупкие(низкая пластичность). Ионная связь характерна для окислов различных элементов.
2) Ковалентная связь – Устанавливается в результате образования устойчивых соединений путем обобществления электронов группой атомов. Обобществление электронов зависит от валентности элемента и определяется по следующей зависимости: A = 8 – N, где А – число атомов обобществляющих электрон, 8 – устойчивая электронная конфигурация, N – валентность элемента.
Ковалентная связь возникает между атомами соседей, которые обобществляют один из электронов соседа. Ковалентная связь характерна для кристаллических тел. Пример – алмаз- кристаллическая модификация углерода с ковалентной связью. Образование алмаза возникает при обобществлении по одному электрону четырех атомов. Ковалентная связь – жесткая, направленная => прочная. Она характерна для пластмасс.
3) Металлическая связь
Все металлы – кристаллические вещества. Атомы имеют упорядоченное расположение и образуют кристаллическую решетку. Атомы удерживаются в ней за счет металлической связи. Металлическая связь обусловлена строением атома, на внешнем орбите у металла 1-2 электрона, они слабо связаны с ядром. Для металла характерны кристаллические решетки с плотным расположением атомов => Внешние оболочки соприкасаются и пересекаются. Все валентные электроны обобществляются(общие в пределах твердого тела) и образуют электронный газ. Возникают пары атомов превращающихся в разнозаряженных атомов, которые связаны силами электростатического напряжения. Металлическая связь – гибкая, нежесткая. Свойства металлов: высокая прочность, пластичность, электропроводность, теплопроводность.
Металлическая связь характерна всем металлам и их сплавам => Металлы широко применяются в производстве. В металлах можно повысить прочность:
Изменением химического состава
Изменением строением металла в результате термической обработки
4) Связь Ван – дер – Вальса
Она основана на том, что все атомы являются диполями. Это связано с тем, что при сближении атомов происходит поляризация, что приводит к появлению сил притяжения. Диполи возникают при смещении центров отр. Заряженных электронов относительно центров положительно заряженных электронов. Сила ВДВ направленная.
Связь слабая и незаметна, она присутствует в полимерах.
Кристаллические и аморфные материалы. Кристаллическое строение. Основные типы кристаллических решеток.
Твердые вещества существуют в двух состояниях:
1) Аморфное – атомы располагаются хаотично;
2) Кристаллическое – атомы располагаются упорядоченно;
Решетка характеризуется строением элементарной ячейки- состоит из мин. кол-ва атомов, расположенных так, что повторное в пространстве расположение атомов этой ячейки возможно воспроизвести в кристаллическую решетку.
Существует 14 типов кристаллических решеток. Для металлов характерны те которые обеспечивают плотное расположение атомов.
Кристаллическая решетка - Упорядоченное расположение атомов в пространстве, в котором каждый атом имеет одинаковое число соседних атомов, удаленных друг от друга на периодически повторяющихся расстояниях.
Основные типы кристаллических решеток металлов:
П ростая (кубическая решетка)- [ ].
Параметры: Период решётки (расстояние между атомами a =d), d – диаметр атома. 1/8·8 =1 атом на элемент, ячейку. а .
Для химического соединения данный тип решётки.
2 ) Кубич. объемно-центрир. решетка- [•]
характерна для тугоплавких мет.
a =1,21·d. 1/8·8 +1 =2. Feα, Ti, W, Nb.
3 ) Кубическая гранецентрированная решетка- [X]
1/8·8 +1/2·6 =4. Характерна для пластичных мет. Cu, Feγ, Au.
4 ) Тетрагональная решетка
Атомная плотность: 8*1/8+6=7
Степень тетрагон. –C/A: C не =0, С/A>0
5) Гексагональная решетка
Ячейка этой решетки - прямая призма, в основании которой находится правильный шестиугольник.
2.2 Металлическая межатомная связь и модель «электронного газа»
Вышеназванные характерные свойства металлов, в большинстве своём, могут быть объяснены спецификой межатомного взаимодействия и особенностями структуры металлов. Атомы металлов, находящихся в твёрдом стоянии, связаны между собой особым типом химической связи, которую называют металлической связью. Такая связь устанавливается посредством обобществления всех валентных электронов атомами материала. Валентные электроны, потерявшие связь со своими атомами, оказываются принадлежащими всему металлу в целом и, будучи относительно свободными, образуют в объёме металла так называемый «электронный газ» или точнее «электронную жидкость». Сами же атомы при этом становятся положительно заряженными ионами. Таким образом, на атомарном уровне металлы выглядят как совокупность расположенных в узлах кристаллической решётки положительно заряженных ионов, которые омываются газом относительно свободных электронов или иначе «электронной жидкостью» (рис. 7).
Рис. 7. Модель «электронного газа (жидкости)»
Наличием в объёме металла электронного газа или жидкости объясняются многие свойства металлов. Так, если к металлу приложить разность потенциалов, то под воздействием электрического поля относительно свободные электроны наряду с хаотическим движением приобретут направленное движение в сторону от минуса к плюсу. Другими словами в металле возникнет электрический ток. Поскольку в металлах свободных носителей заряда, т.е. электронов, достаточно много, их электропроводность оказывается очень высокой. Эти же электроны проводимости весьма эффективно могут переносить тепловую энергию от разогретого участка металла к более холодным областям, и этим объясняется высокая теплопроводность металлов. Кроме того, электронная жидкость хорошо отражает фотоны, т.е. частицы света, и тем самым обеспечивает металлам характерный блеск.
При пластическом деформировании металлов наблюдается сдвиг атомных слоёв относительно друг друга и металлическая связь способствует этому процессу. В данном случае электронная жидкость играет роль своеобразного клея, соединяющего атомные слои, и одновременно роль своеобразной смазки, облегчающей процесс скольжения этих слоёв. В результате металлы оказываются достаточно пластичными материалами.
2.3 Кристаллическая структура металлов
Металлическая связь, в отличие от ковалентной связи, не является строго направленной в пространстве и допускает произвольное число взаимодействующих частиц. В результате атомы металлов, стремясь к более выгодной и устойчивой конфигурации, обладающей меньшей свободной энергией, располагаются в пространстве наиболее компактным образом. Этим, в частности, объясняется относительно высокая плотность большинства металлов. Плотным атомным упаковкам металлов соответствуют следующие типы кристаллических структур:
1. Объёмоцентрированная кубическая структура или ОЦК-структура. Такую структуру описывает ОЦК-решётка, элементарная ячейка которой выглядит следующим образом:
Рис. 8. Элементарная ячейка ОЦК-структуры.
В узлах этой кристаллической решётки располагаются атомы, а точнее ионы, соответствующего металла. Координационное число в данном случае равно 8 (на ближайшем равном расстоянии от любого атома находится 8 аналогичных атомов). Коэффициент компактности равен 0,68. Это означает, что 68% объёма металла занято атомами, а остальную его часть составляют пустоты. Это достаточно плотное расположение атомов. Базис образуют два атома соответствующего металла (один атом, расположенный в центре ОЦК-ячейки, полностью ей принадлежит, и ещё один атом (8 по ⅛) дают узлы, расположенные в вершинах ячейки). ОЦК-структура наблюдается у таких металлов как Cr,Mo,W,Vи др.
2. Гранецентрированная кубическая структура или ГЦК-структура. Эту структуру описывает ГЦК-решётка, элементарная ячейка которой выглядит следующим образом:
Рис. 9. Элементарная ячейка ГЦК-структуры.
В узлах решётки также располагаются атомы соответствующих металлов. Координационное число здесь равно 12, а коэффициент компактности имеет значение 0,74. Базис образуют четыре атома металла (каждый атом, расположенный в центре грани принадлежит ячейке только наполовину, а поскольку таких атомов 6, то получается ровно 3; плюс один атом дают вершины ячейки). ГЦК-структура характерна для Al,Cu,Ni,Ag,AuиPt.
3. Гексагональная плотноупакованная структура или ГПУ-структура. Эту структуру описывает соответствующая ГПУ-решётка. Хотя ГПУ-решётку можно построить и с помощью меньшей по объёму ячейки, в данном случае в качестве элементарной ячейки лучше подойдёт шестигранная призма, которая нагляднее отражает гексагональную симметрию структуры (рис. 10).
Рис. 10. Элементарная ячейка ГПУ-структуры.
Координационное число для такой структуры равно 12 (если за начало отсчёта принять атом, расположенный в центре грани, то на равном ближайшем расстоянии от него находится 6 атомов, плюс по 3 атома сверху и снизу). Коэффициент компактности, как и у ГЦК-структуры, имеет значение 0,74. Это наивысшая степень упаковки атомов. Базис образуют 6 атомов соответствующего металла (3 атома внутри призмы полностью ей принадлежат; атомы в центре верхней и нижней грани принадлежат ячейке только наполовину, а каждый из 12 атомов в вершинах призмы принадлежит рассматриваемой ячейке лишь на 1/6 часть, поскольку находится на пересечении 6 аналогичных ячеек). ГПУ-структура наблюдается у таких металлов как Mg,Zn,Beи др.
Иногда у металлов наблюдается тетрагональная или простая гексагональная структура, но гораздо реже, чем три вышеназванные структуры.
Читайте также:
