Моногалогеналканы с металлическим натрием
Обновлено: 11.05.2024
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Пояснение:
1) Дегидрогалогенирование хлорбутана при действии спиртового раствора щелочи:
2) Окисление двойной связи бутена-1 подкисленным раствором перманганата калия (разрыв двойной связи):
3) Реакция этерификации – образование сложного эфира из спирта и карбоновой кислоты:
4) Щелочной гидролиз изопропилпропионата с образованием пропионата натрия и изопропилового спирта:
5) Сплавление соли пропионовой кислоты с щелочью с образованием этана и карбоната натрия:
372960
При написании уравнений реакций используйте структурные формулы органических веществ.
1) Из ацетата натрия метан получают по реакции декарбоксилирования, которая протекает при его сплавлении со щелочью, например, гидроксидом натрия:
2) При взаимодействии метана с хлором в мольном соотношении один к одному образуются преимущественно монохлорметан (Х1) и хлороводород:
3) При обработке монохлорметана водным раствором щелочи протекает нуклеофильное замещение атома хлора на гидроксильную группу с образованием метилового спирта (Х2):
4) Получить метаналь (формальдегид) из метилового спирта можно, действуя слабым окислителем – оксидом меди (II) при нагревании:
5) Перманганат калия, подкисленный серной кислотой, окисляет метаналь до углекислого газа и воды. При этом, так как среда раствора кислая, перманганат-ион восстанавливается до двухвалентного марганца:
D33737
1) При действии на пропанол-1 бромоводорода происходит реакция замещения гидроксильной группы в спирте на атом брома с образованием 1-бромпропана (Х1)
2) Получить пропен из 1-бромпропана можно по реакции дегидробромирования со спиртовым раствором щелочи, например, гидроксидом натрия:
3) В кислой среде пропен может вступить в реакцию с водой в соответствии с правилом Марковникова – водород идет к наиболее гидрогенизированному атому, а гидроксильная группа к наименее гидрогенизированному. При этом образуется изопропиловый спирт:
5) Ацетон можно превратить в изопропанол (X2) по реакции гидрирования при нагревании, с использованием катализатора гидрирования, например, никеля:
E6C6A4
1) При прокаливании соли карбоновой кислоты с избытком щелочи образуется углеводород, в данном конкретном случае – бензол (Х1):
2) Бензол вступает с реакцию алкилирования с пропеном в присутствии кислотных катализаторов, при этом образуется кумол (Х2):
3) Кумол вступает в реакцию с хлором на свету по цепному радикальному механизму. При недостатке хлора в основном происходит замещение атома водорода при третичном атоме углерода:
4) При действии на хлорпроизводное спиртовым раствором щелочи происходит отщепление хлороводорода:
5) В последней реакции, на первый взгляд, можно подумать, протекает превращение углеводорода с двойной связью в соответствующий диол, но, чтобы образовался гликоль, нужно охлаждение (0-10 о С), а не нагрев. При нагревании будет происходить глубокое окисление до бензоата калия и карбоната калия.
Проблема в том, что по всей видимости, в этом задании банка ФИПИ, которое кстати попалось некоторым на досрочном экзамене ЕГЭ в апреле 2016-го, опечатка, и имелось ввиду 0 о С, а не нагрев.
995FCC
1) При действии на бромэтан водного раствора щелочи протекает нуклеофильное замещение атома брома на гидроксид-ион, при этом образуется этиловый спирт (Х1):
2) Этиловый спирт (Х1) можно превратить в уксусную кислоту, окислив его водным раствором перманганата калия в кислой среде при нагревании:
3) Уксусная кислота вступает в реакцию нейтрализации с щелочами, например, с гидроксидом натрия, при этом образуется ацетат натрия (Х2):
4) После выпаривания водного раствора ацетата натрия (Х2) и сплавления полученного твердого ацетата натрия с твердым гидроксидом натрия происходит реакция декарбоксилирования с образованием метана (X3) и карбоната натрия:
5) Пиролиз метана при 1500 о C приводит к образованию ацетилена (X4) и водорода:
1C6CBE
1) Пропилацетат, являясь сложным эфиром, подвергается щелочному гидролизу с образованием ацетата калия (X1) и пропанола:
2) Из ацетата калия по реакции декарбоксилирования, которая протекает при его сплавлении с щелочью, получают метан:
3) При температуре 1200 o C и быстром охлаждении (для предотвращения разложения ацетилена до простых веществ) метан разлагается на ацетилен (X2) и водород:
4) Димеризация ацетилена происходит в присутствии катализаторов – солянокислого раствора хлоридов меди (I) и аммония – с образованием винилацетилена:
5) При пропускании винилацетилена через бромную воду наблюдается обесцвечивание бромной воды за счет присоединения брома к кратным связям с образованием насыщенного бромпроизводного бутана – 1,1,2,2,3,4-гексабромбутана (X3):
26D1FD
1) В промышленности формальдегид получают окислением метана на катализаторе фосфате алюминия при температуре 450 o C и давлении 1-2 МПа:
2) При гидрировании на катализаторах (Pt, Pd, Ni) карбонильная группа формальдегида восстанавливается до гидроксильной, т.е. альдегид превращается в спирт – метанол (X1):
3) Металлический натрий взаимодействует с метанолом с образованием метилата натрия (X2) и выделением водорода:
4) Реагируя с соляной кислотой, метилат натрия обратно превращается в метанол (X1):
6C53D6
1) В присутствии оксида алюминия при температуре 400 o C происходит дегидратация спирта с образованием этилена (X1) и воды:
3) При действии избытка бромоводорода на этиленгликоль происходит замещение гидроксильных групп на анионы брома, в результате чего образуется 1,2-дибромэтан (X3):
4) Этин (или ацетилен) можно получить действием на 1,2-дибромэтан спиртовым раствором щелочи:
5) По реакции М.Г. Кучерова в присутствии солей ртути в кислой среде (в водном или спиртовом растворе) ацетилен превращается в этаналь:
5B7666
1) Получить ацетон (пропанон) можно по реакции М.Г. Кучерова, действуя на пропин (X1) водой в присутствии солей ртути в кислой среде (в водном или спиртовом растворе):
2) При гидрировании на катализаторах (Pt, Pd, Ni) карбонильная группа кетона восстанавливается до гидроксильной, т.е. кетон превращается во вторичный спирт – изопропанол (X2):
3) При действии бромоводорода на изопропанол происходит нуклеофильное замещение гидроксильной группы на анион брома, в результате чего образуется 2-бромпропан:
4) При действии спиртового раствора щелочи 2-бромпропан превращается в ненасыщенный углеводород – пропилен (X3):
5) Дегидрированием пропилена на катализаторе (Pt, Pd, Ni) можно получить пропин (X1):
EE403A
1) Получить бромметан можно действием брома на метан (X1) на свету. Реакция замещения протекает по свободнорадикальному механизму:
2) При взаимодействии бромметана с аммиаком вначале образуется соль амина, которая при избытке аммиака превращается в свободный амин. В случае метиламина образуются метиламин (X2) и бромид аммония:
3) Азотистая кислота неустойчива, поэтому ее получают в ходе реакции, действуя на подкисленный раствор амина нитритом натрия. В случае первичного амина – метиламина - наблюдается выделение азота, а в растворе образуется метанол (X3):
4) Действием на метиловый спирт оксидом меди (II) при нагревании получим формальдегид, при этом Cu +2 восстановится до Cu 0 :
11E9DF
1) Алканы с основной цепью 6 и более атомов углерода способны вступать в реакцию дегидроциклизации, при этом образующийся шестичленный цикл далее дегидрируется и превращается в энергетически более устойчивый бензольный цикл ароматического углеводорода. В данном случае образующийся циклогексан дегидрируется в бензол (X1):
2) Алкилирование ароматических углеводородов алкилгалогенидам и в присутствии безводного AlCl3является классическим примером реакции Фриделя-Крафтса. Реакция представляет собой электрофильное замещение в бензольном кольце. Алкилирование бензола метилхлоридом приводит к образованию толуола (X2):
3) При действии на толуол избытком хлора на свету все атомы водорода в метильном радикале толуола замещаются на хлор. Реакция замещения протекает по свободнорадикальному механизму:
4) При щелочном гидролизе тригалогенидов с атомами хлора при одном атоме углерода с высокими выходами образуются соли карбоновых кислот (в данном случае бензоат калия (X3)):
5) Из бензоата калия по реакции декарбоксилирования, которая протекает при его сплавлении с щелочью, получают бензол (X1):
AC20AD
1) 1,2-дихлорэтан является геминальным дихлорпроизводным этана. В условиях водного раствора щелочи 1,2-дихлорэтан превращается в карбонильное соединение – ацетальдегид:
2) При восстановлении карбонильных соединений водородом образуются спирты. Так, пропуская смесь паров ацетальдегида и водорода над никелевым катализатором, можно получить этанол (X1):
3) Замещение гидроксильной группы спирта на аминогруппу происходит в жестких условиях. Пропуская пары этанола и аммиак над нагретым оксидом алюминия, получают этиламин:
4) При пропускании через водный раствор этиламина углекислого газа происходит образованием гидрокарбоната этиламмония (X2):
5) При нагревании гидрокарбонат этиламмония разлагается на углекислый газ, этиламин (X3) и воду:
Примечание: правильным может считаться вариант, в котором веществом Х2 является не гидрокарбонат, а карбонат этиламмония.
7EAE60
1) Ацетилен (этин) вступает в реакцию гидратации в присутствии солей ртути в водном растворе с образованием ацетальдегида (реакция Кучерова) (Х1):
2) Ацетальдегид при действии на него подкисленного водного раствора перманганата калия превращается в уксусную кислоту:
3) Уксусная кислота вступает в реакцию нейтрализации с гидроксидом натрия, при этом образуется ацетат натрия (Х2) и вода:
4) Ацетат натрия взаимодействует с галогеналканами с образованием сложных эфиров, в данном случае образуется метиловый эфир уксусной кислоты (метилацетат)(Х3):
5) Сложные эфиры в присутствии кислот могут вступать в реакцию гидролиза. При гидролизе метилацетата в кислой среде образуется уксусная кислота и метанол:
7E4C51
1) При действии спиртового раствора щелочи на любой из изомеров дибромэтана образуется ацетилен (X1):
2) Действуя на ацетилен (X1) водой в присутствии солей ртути в кислой среде (в водном или спиртовом растворе), получают ацетальдегид (X2) (реакция М.Г.Кучерова):
4) Получить хлоруксусную кислоту можно действием хлора на уксусную кислоту на свету. Реакция замещения протекает по свободнорадикальному механизму, в результате чего атом водорода при алкильном радикале замещается на хлор (X3):
5) При обработке хлоруксусной кислоты аммиаком образуется аминокислота – глицин:
39882С
1) При температуре выше 140 0 C в присутствии концентрированной серной кислоты спирты подвергаются внутримолекулярной дегидратации с образованием алкена и воды. В данном случае при 180 0 C и действии конц. H2SO4 пропанол-1 превращается в пропилен (X1):
2) При пропускании пропилена через бромную воду наблюдается обесцвечивание бромной воды за счет присоединения брома к двойной связи с образованием 1,2-дибромпропана (X2):
3) При действии спиртового раствора щелочи на 1,2-дибромпропан образуется пропин:
4) Действуя на пропин водой в присутствии солей ртути в кислой среде (в водном или спиртовом растворе), получают ацетон (X3) (реакция М.Г.Кучерова):
5) Пропуская смесь паров ацетона и водорода над палладиевым катализатором, получают пропанол-2 (или изопропанол) (X4):
A8F8C2
1) Циклопропан присоединяет бромоводород с раскрытием цикла, в результате чего образуется 1-бромпропан:
2) В лабораторных условиях алканы получают по реакции Вюрца из галогеналканов. Частичный положительный заряд на атоме углерода при галогене в галогенопроизводных делает возможной реакцию этих соединений с активными металлами. Моногалогеналканы уже при комнатной температуре взаимодействуют с натрием, превращаясь в алканы с удвоенным углеродным скелетом. Таким образом, из двух молекул 1-бромпропана получается н-гексан (X1):
3) Алканы, имеющие в молекуле шесть и более атомов углерода, могут вступать в более сложные реакции дегидрирования, в ходе которых отщепление водорода сопровождается замыканием цепи в цикл: реакции дегидрирования – циклизации. В данном случае гексан превращается в бензол (X2):
4) Толуол получают алкилированием бензола метилгалогенидом в присутствии катализатора AlCl3 (электрофильное замещение, механизм SE):
92C355
1) В лабораторных условиях пропан можно получить по реакции Вюрца из галогеналканов – хлорэтана и хлорметана, однако данная реакция сопряжена с образованием двух побочных продуктов – бутана и этана. Моногалогеналканы при комнатной температуре способны взаимодействовать с натрием:
2) Дегидрированием пропана на катализаторе (Pt, Pd, Ni) можно получить пропилен (X1):
4) Многоатомные спирты способны вступать в реакции нуклеофильного замещения с галогеноводородами. Действуя избытком бромоводорода на пропандиол-1,2 получается 1,2-дибромпропан (X3):
5) При действии спиртового раствора щелочи на дигалогеналкан – 1,2-дибромпропан – образуется пропин (X4):
Способы получения моногалогеналканов
1. Действие галоидов на предельные углеводороды на свету (реакция металепсии)
Замещение может идти и дальше с образованием полигалоидных соединений.
Из галоидов энергичнее всех действует фтор; однако эта реакция протекает очень бурно и часто сопровождается взрывами и обугливанием вещества; поэтому такой способ применяется для препаративных целей только в особых, тщательно разработанных условиях. Весьма энергично действует хлор, труднее — бром и всего труднее—иод. Реакция с иодом
обратима, а следовательно, может идти до конца только тогда, когда образующийся йодистый водород удаляется. Это достигается прибавлением окиси ртути (образуется йодная ртуть) или йодноватой кислоты, которая окисляет йодистый водород с выделением иода по уравнению
2. Получение из спиртов
Из спиртов галоидные соединения могут быть получены различными способами. Наиболее обычными из этих способов являются действие галоидных соединений фосфора и действие галоидоводородных кислот.
Взаимодействие пятигалоидных соединений фосфора со спиртами протекает по уравнению
При нагреваний может реагировать со спиртами и бромокись (хлорокись) фосфора:
Аналогично реагируют трехгалоидные соединения фосфора, например:
Для реакции можно брать не готовые галоидные соединения фосфора, а отдельно фосфор и галоид, причем в последнем случае возникающие галоидные соединения реагируют со спиртом в момент своего образования.
Так можно получать бромистые и йодистые ал.килы, но с треххлористым фосфором реакция идет по-разному в зависимости от строения спирта. Первичные спирты образуют лишь небольшое количество галоидпроизводных, а главным образом получаются эфиры фосфористой' кислоты:
Третичные спирты превращаются в соответствующие алкил-хлориды:
а вторичные спирты дают смесь двузамещенных эфиров фосфористой кислоты и хлористых алкилов:
С галоидоводородными кислотами спирты реагируют по уравнению
Такие реакции обратимы; следовательно, чтобы реакция дошла практически до конца, необходимо вводить в реакцию как можно меньше воды, т. е. применять возможно более концентрированные кислоты, или, еще лучше, насыщать спирт газообразным галоидоводородом.
Из галоидоводородных кислот легче всего реагирует со спиртами иодистоводородная кислота и труднее всего — хлористоводородная кислота. Однако и последняя легко вступает в реакцию в момент образования (например, если поваренную соль облить спиртом и к смеси прибавлять концентрированную серную кислоту). Из спиртов легче всего реагируют третичные, труднее — вторичные, еще труднее — первичные. В последнем случае прибегают иногда к добавкам в реакционную смесь ZnCl2 или СаCl2.
3. Присоединение галоидоводородов к этиленовым углеводородам
Концентрированная фтористоводородная кислота не присоединяется к олефинам; реакция идет лишь с безводным H2F2 (лучше под давлением). Однако реакция присоединения обычно осложняется реакциями полимеризации. Поэтому фтористые алкилы часто получают действием, например, фтористого серебра на йодистые алкилы:
Физические свойства. Если сравнить физические свойства соединений, содержащих различные галоиды (табл. 2), то можно видеть, что ниже всего температуры кипения фтористых соединений, у хлористых соединений они ниже, чем у бромистых, и выше всего у йодистых. Из фтористых алкилов фтористые метил, этил, пропил и изопропил являются газами, из хлористых алкилов хлористый метил и хлористый этил — вещества газообразные, из бромистых алкилов газом является лишь бромистый метил, а йодистый метил — уже жидкость. Из изомерных соединений при наиболее высоких температурах кипят нормальные первичные, ниже кипят вторичные и наиболее низко — третичные соединения.
Плотности йодистых соединений — наиболее высокие, фтористых — наиболее низкие. При переходе от низших гомологов к высшим плотности уменьшаются: для первых гомологов быстро, а затем — медленнее. Бромистые и йодистые соединения—тяжелее воды. Галоидные алкилы бесцветны, нерастворимы в воде, легко растворяются в спирте и эфире.
Низшие гомологи хлористых и бромистых соединений обладают характерным сладковатым запахом, при вдыхании действуют анестезирующим образом. Фтористые соединения сначала действуют также анестезирующе, а при длительном воздействии поражают органы дыхания (это обусловлено легкостью гидролиза алкилмонофторидов и отщепления от них фтористого водорода). Характерный запах йодистых соединений мало походит на запах соединений остальных галоидов; на свету йодистые соединения окрашиваются в бурый цвет вследствие разложения их с выделением иода.
Презентация по теме "Галогеноалканы" дисциплины ОУД.10, специальности 33.02.01 Фармация,СПО

В зависимости от числа атомов галогена и от их природы галогеналканы можно разделить на:
моногалогеналканы, содержащие один атом галогена, и
ди-, три- и полигалогеналканы, в молекулах которых несколько атомов галогена.
Моногалогеналканы классифицируют на первичные, вторичные и третичные в зависимости от природы атома углерода, у которого находится галоген.
Среди дигалогеналканов выделяют геминальные, в которых атомы галогена находятся у одного атома углерода, ивицинальныес расположением атомов галогена у соседних углеродных атомов


1. Летучесть. Молекулы фтор-, хлоралканов полярны, т.к. электроотрицательность галогенов и углерода:
Связи С—F и С—Сl сильно полярны, что приводит к притяжению между диполями соседних молекул:
2. Температуры кипения фтор- и хлоралканов близки к температурам кипения углеводородов с такой же молекулярной массой. Молекулы бром- и иодалканов малополярны. Атом брома имеет такую же массу, как шесть групп —СН2—, но размеры молекулы бромалкана гораздо меньше, чем молекулы алкана равной массы. Меньший размер молекул приводит к уменьшению взаимодействия между ними и к более низкой температуре кипения.
Температура кипения бром- и иодалканов значительно ниже температуры кипения алканов с той же молекулярной массой
3. Растворимость. Галогенопроизводные плохо растворимы в воде.
4. Запах. Галогеналканы имеют сладковатый запах (немного тошнотворный).
5. Плотность. Хлоралканы легче воды, а бром- и иодалканы — тяжелее.

Химические свойства галогеналканов
Реакция замещения:
C2H3Cl + 2NH3 → C2H3NH2 + NH4HCl
хлорэтан этиламин
С2H3Сl+NaOH → C2H3OH + NaCl
хлорэтан этанол

Химические свойства галогеналканов

Химические свойства галогеналканов

Присоединение галогеноводородов к алкенам.
R-CH=CH2+HCl→R-CHCl-CH3
Реакции спиртов с галогеноводородами.
R-OH+H-Cl→R-Cl+H2O
Взаимодействие галогенидов фосфора или тионилхлорида со спиртами.
3R-OH+PCl3→3R-Cl+H3PO3

Присоединение галогеноводородов к алкинам.
R-C≡CH+2HCl→R-CCl2-CH3
Взаимодействие альдегидов и кетонов с PCl5, PBr5 или SF4. Реакция идёт при нагревании.
R—CHO + PCl5 → R—CHCl2 + POCl3
Присоединение галогенов к алкенам
R-CH=CH2 + Cl2 → R-CHCl-CHCl
Раскрытие циклических простых эфиров (например, ТГФ) при реакции с NaI в среде H3PO4+P2O5.
C4H8O + HI → I-CH2CH2CH2CH2-I
При 180 °C ТГФ с хлороводородом даёт 1,4-дихлорбутан

Применение галогеналканов
Галогеналканы используются:
как растворители для жиров и масел;
2) в качестве хладагентов (например, дихлорметан CCl2H2);
3) при тушении пожаров (например, CBr2ClF — дибромфторхлорметан).

Спасибо за внимание
Рабочие листы и материалы для учителей и воспитателей
Более 3 000 дидактических материалов для школьного и домашнего обучения
Алканы
Мы приступаем к новому разделу - органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать наизусть, зубрить свойства органических веществ.
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций ;)
- Атомы в молекуле соединены в определенной последовательности, в соответствии с их валентностью. Порядок связи атомов отражает химическое строение.
- Зная свойства веществ, можно установить их химическое строение, и наоборот, зная строение вещества можно сделать вывод о его свойствах.
- Атомы или группы атомов оказывают взаимное влияние друг на друга непосредственно или через другие атомы
- Свойства вещества зависят от количественного и качественного состава, а также от химического строения молекулы

Алканы (парафины) - насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями - содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда - CnH2n+2.
Номенклатура алканов
Номенклатура (от лат. nomen - имя + calare - созывать) - совокупность названий индивидуальных химических веществ, а также правила составления этих названий. Названия у алканов формируются путем добавления суффикса "ан": метан, этан, пропан, бутан и т.д.

Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos - соответственный).
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д.
- Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.

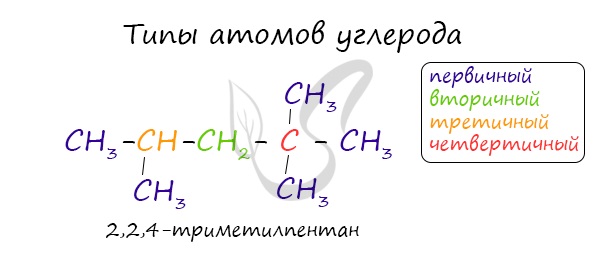
В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.
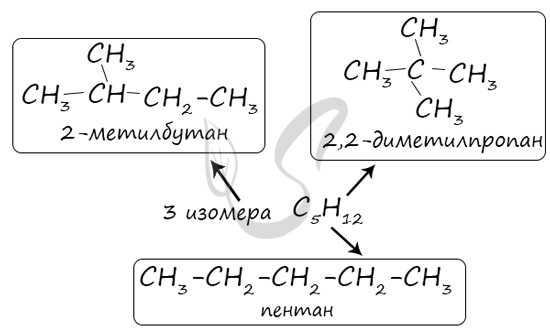
Изомерами (греч. isomeros - составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.

В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.
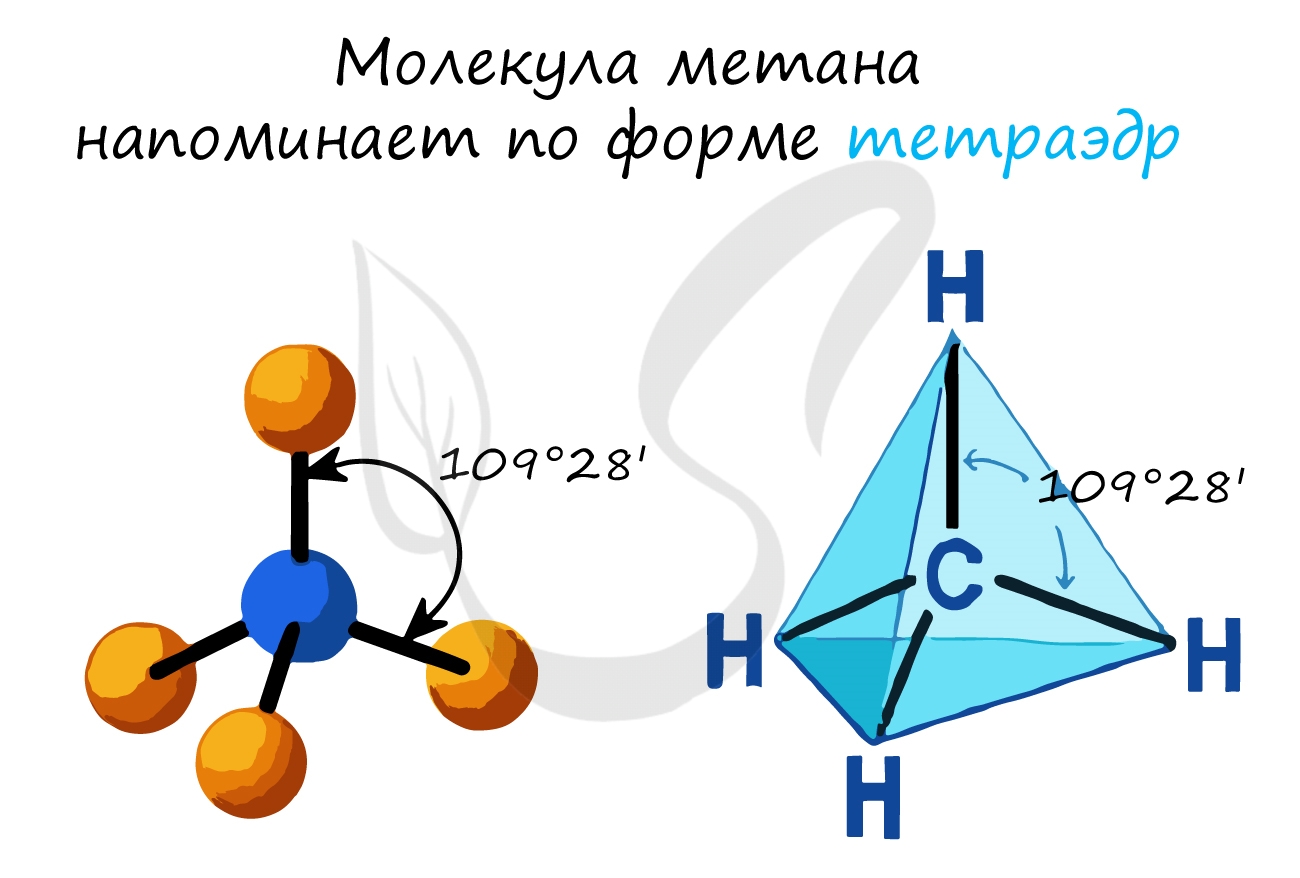
- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
- Тип гибридизации атомов углерода - sp 3
- Валентный угол (между химическими связями) составляет 109°28'
Природный газ и нефть
Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить одной формулой, он непостоянен и зависит от месторождения.
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.

Получение алканов
В ходе крекинга нефти получается один алкан и один алкен.
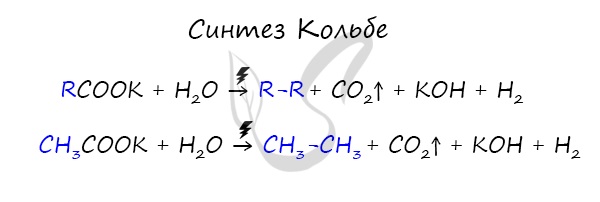
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.

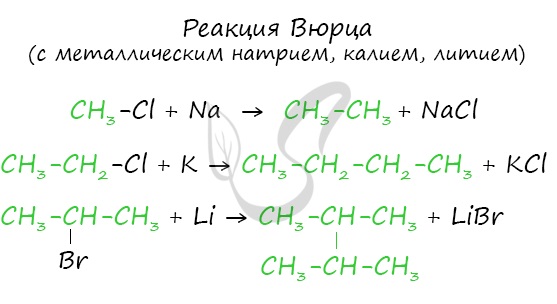
Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.
В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).

На схеме выше мы сначала получили реактив Гриньяра, а потом использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.

В результате электролиза солей карбоновых кислот может происходить образование алканов.
В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Химические свойства алканов
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода, чуть труднее - у вторичного и значительно труднее - у первичного.

Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.

Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
Для удобства и более глубокого понимания, азотную кислоту - HNO3 - можно представить как HO-NO2.

Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
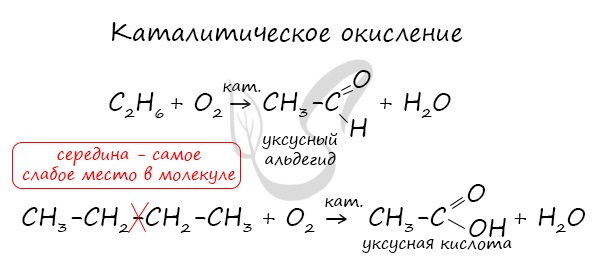
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
Пиролиз (греч. πῦρ - огонь + λύσις - разложение) - термическое разложение неорганических и органических соединений. Принципиальное отличие пиролиза от горения - в отсутствии кислорода.
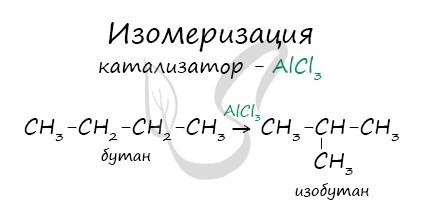
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.
Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Алкины
Алкины - непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну тройную связь С≡С. Каждая такая связь содержит одну сигма-связь (σ-связь) и две пи-связи (π-связи).
Алкины также называют ацетиленовыми углеводородами. Первый член гомологического ряда - этин - CH≡CH (ацетилен). Общая формула их гомологического ряда - CnH2n-2.
Номенклатура и изомерия алкинов
Названия алкинов формируются путем добавления суффикса "ин" к названию алкана с соответствующим числом: этин, пропин, бутин и т.д.
При составлении названия алкина важно учесть, что главная цепь атомов углерода должна обязательно содержать тройную связь. Нумерация атомов углерода в ней начинается с того края, к которому ближе тройная связь. В конце названия указывают атом углерода у которых начинается тройная связь.

Для алкинов характерна изомерия углеродного скелета, положения тройной связи, межклассовая изомерия с алкадиенами.
Пространственная геометрическая изомерия для них невозможна, ввиду того, что каждый атом углерода, прилежащий к тройной связи, соединен только с одним единственным заместителем.
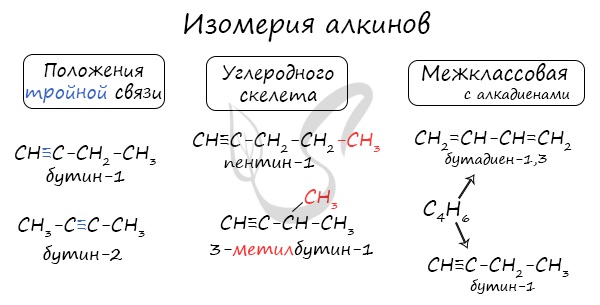
- В молекулах алкинов присутствуют тройные связи, длина которых составляет 0,121 нм
- Тип гибридизации атомов углерода - sp
- Валентный угол (между химическими связями) составляет 180°
Получение алкинов
При нагревании метана до 1200-1500 °C происходит димеризация молекул метана, в ходе чего отщепляется водород.
Осуществляется напрямую, из простых веществ. Протекает на вольтовой (электрической) дуге, в атмосфере водорода.
2C + H2 → (t, вольтова дуга) CH≡CH
В результате разложения карбида кальция образуется ацетилен и гидроксид кальция II.
Получение гомологов ацетилена возможно в реакциях дегидрогалогенирования дигалогеналканов, в которых атомы галогена расположены у одного атома углерода или у двух соседних атомов.

Химические свойства алкинов
Алкины - ненасыщенные углеводороды, легко вступающие в реакции присоединения. Реакции замещения для них не характерны.
Водород присоединяется к атомам углерода, образующим тройную связь. Пи-связи (π-связи) рвутся, остается единичная сигма-связь (σ-связь).
CH≡C-CH3 + H2 → (t, Ni) CH2=CH-CH3 (в реакции участвует 1 моль водорода)
CH≡CH + 2H2 → (t, Ni) CH3-CH3 (в реакции участвует 2 моль водорода)
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.

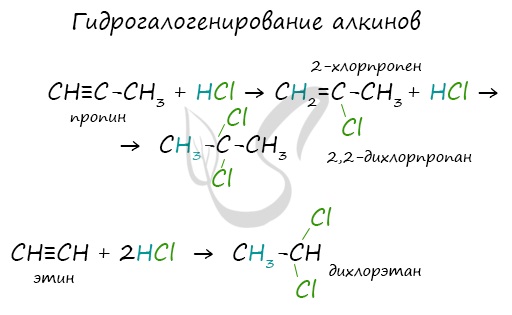
Алкины вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена - к наименее гидрированному атому углерода.
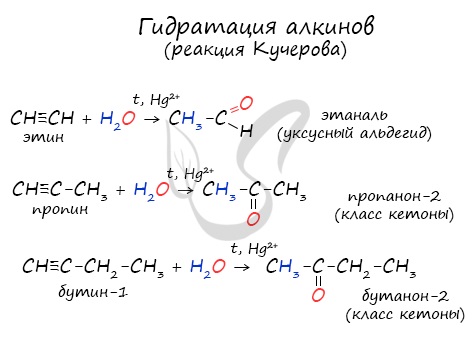
Реакцией Кучерова называют гидратацию ацетиленовых соединений с образованием карбонильных соединений. Открыта русским химиком М.Г. Кучеровым в 1881 году. Катализатор - соли ртути Hg 2+ .
Только в реакции с ацетиленом образуется уксусный альдегид. Во всех остальных реакциях (с гомологами ацетилена) образуются кетоны.
При горении алкины, как и все органические соединения, сгорают с образование углекислого газа и воды - полное окисление.
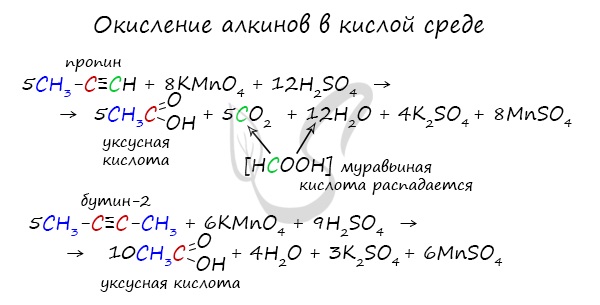
Сильные окислители (особенно в подкисленной среде) способны разрывать молекулы алкинов в самом слабом месте - в месте тройной связи.
Так, при окислении пропина, образуется уксусная кислота и муравьиная кислота, окисляющаяся до угольной кислоты, которая распадается на углекислый газ и воду.
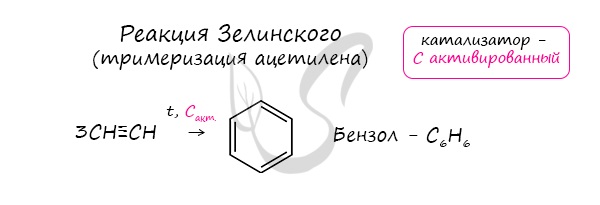
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород - бензол.
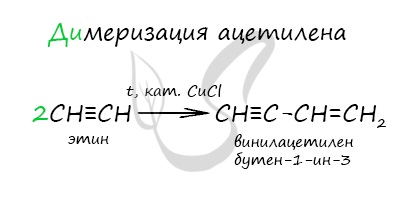
Димеризация ацетилена происходит при наличии катализатора - солей меди I. В результате реакции две молекулы ацетилена соединяются, образуя винилацетилен.
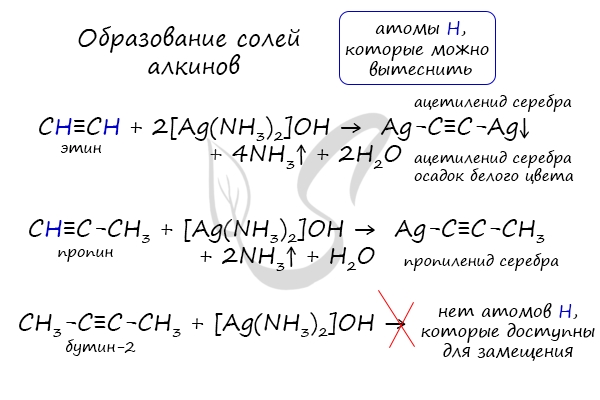
В случае если тройная связь прилежит к краевому атому углерода, то имеющийся у данного атома водород может быть замещен атомом металла. Если тройная связь спрятана внутри молекулы, то образование солей невозможно.
Реакция аммиачного раствора серебра и ацетилена - качественная реакция, в ходе которой выпадает осадок ацетиленида серебра.
Читайте также:
