Мышьяк металл или неметалл
Обновлено: 18.05.2024
As, химический элемент V группы периодической системы Менделеева, атомный номер 33, атомная масса 74,9216; кристаллы серо-стального цвета. Элемент состоит из одного устойчивого изотопа 75 As.
Историческая справка. Природные соединения М. с серой (аурипигмент As2S3, реальгар As4S4) были известны народам древнего мира, которые применяли эти минералы как лекарства и краски. Был известен и продукт обжигания сульфидов М. — оксид М. (III) As2O3 («белый М.»). Название arsenikón встречается уже у Аристотеля; оно произведено от греч. ársen — сильный, мужественный и служило для обозначения соединений М. (по их сильному действию на организм). Русское название, как полагают, произошло от «мышь» (по применению препаратов М. для истребления мышей и крыс). Получение М. в свободном состоянии приписывают Альберту Великому (См. Альберт Великий) (около 1250). В 1789 А. Лавуазье включил М. в список химических элементов.
Распространение в природе. Среднее содержание М. в земной коре (кларк) 1,7·10 -4 % (по массе), в таких количествах он присутствует в большинстве изверженных пород. Поскольку соединения М. летучи при высоких температурах, элемент не накапливается при магматических процессах; он концентрируется, осаждаясь из горячих глубинных вод (вместе с S, Se, Sb, Fe, Co, Ni, Cu и др. элементами). При извержении вулканов М. в виде своих летучих соединений попадает в атмосферу. Так как М. многовалентен, на его миграцию оказывает большое влияние окислительно-восстановительная среда. В окислительных условиях земной поверхности образуются арсенаты (As 5+ ) и арсениты (As 3+ ). Это редкие минералы, встречающиеся только на участках месторождений М. Ещё реже встречается самородный М. и минералы As 2+ . Из многочисленных минералов М. (около 180) основное промышленное значение имеет лишь арсенопирит FeAsS (см. Мышьяковые руды).
Малые количества М. необходимы для жизни. Однако в районах месторождении М. и деятельности молодых вулканов почвы местами содержат до 1% М., с чем связаны болезни скота, гибель растительности. Накопление М. особенно характерно для ландшафтов степей и пустынь, в почвах которых М. малоподвижен. Во влажном климате М. легко вымывается из почв.
В живом веществе в среднем 3·10 -5 % М., в реках 3·10 -7 %. М., приносимый реками в океан, сравнительно быстро осаждается. В морской воде лишь 1·10 -7 % М., но зато в глинах и сланцах 6,6·10 -4 %. Осадочные железные руды, железомарганцевые конкреции часто обогащены М.
Физические и химические свойства. М. имеет несколько аллотропических модификаций. При обычных условиях наиболее устойчив так называемый металлический, или серый, М. (α-As) — серо-стальная хрупкая кристаллическая масса; в свежем изломе имеет металлический блеск, на воздухе быстро тускнеет, т. к. покрывается тонкой плёнкой As2O3. Кристаллическая решётка серого М. ромбоэдрическая (а = 4,123 Å, угол α = 54°10', х = 0,226), слоистая. Плотность 5,72 г/см 3 (при 20°C), удельное электрическое сопротивление 35·10 -8 ом․м, или 35·10 -6 ом․см, температурный коэффициент электросопротивления 3,9·10 -3 (0°—100 °C), твёрдость по Бринеллю 1470 Мн/м 2 , или 147 кгс/мм 2 (3—4 по Моосу); М. диамагнитен. Под атмосферным давлением М. возгоняется при 615 °C не плавясь, т. к. тройная точка (см. Диаграмма состояния) α-As лежит при 816 °C и давлении 36 ат. Пар М. состоит до 800 °C из молекул As4, выше 1700 °C — только из As2. При конденсации пара М. на поверхности, охлаждаемой жидким воздухом, образуется жёлтый М. — прозрачные, мягкие как воск кристаллы, плотностью 1,97 г/см 3 , похожие по свойствам на белый Фосфор. При действии света или при слабом нагревании он переходит в серый М. Известны также стекловидно-аморфные модификации: чёрный М. и бурый М., которые при нагревании выше 270°C превращаются в серый М.
Конфигурация внешних электронов атома М. 3d 10 4s 2 4p 3 . В соединениях М. имеет степени окисления + 5, + 3 и – 3. Серый М. значительно менее активен химически, чем фосфор. При нагревании на воздухе выше 400°C М. горит, образуя As2O3. С галогенами М. соединяется непосредственно; при обычных условиях AsF5 — газ; AsF3, AsCl3, AsBr3 — бесцветные легко летучие жидкости; AsI3 и As2l4 — красные кристаллы. При нагревании М. с серой получены сульфиды: оранжево-красный As4S4 и лимонно-жёлтый As2S3. Бледно-жёлтый сульфид As2S5 осаждается при пропускании H2S в охлаждаемый льдом раствор мышьяковой кислоты (или её солей) в дымящей соляной кислоте: 2H3AsO4 + 5H2S = As2S5 + 8H2O; около 500°C он разлагается на As2S3 и серу. Все сульфиды М. нерастворимы в воде и разбавленных кислотах. Сильные окислители (смеси HNO3 + HCl, HCl + KClO3) переводят их в смесь H3AsO4 и H2SO4. Сульфид As2S3 легко растворяется в сульфидах и полисульфидах аммония и щелочных металлов, образуя соли кислот — тиомышьяковистой H3AsS3 и тиомышьяковой H3AsS4. С кислородом М. даёт окислы: оксид М. (III) As2O3 — мышьяковистый ангидрид и оксид М. (V) As2O5 — мышьяковый ангидрид. Первый из них образуется при действии кислорода на М. или его сульфиды, например 2As2S3 + 9O2 = 2As2O3 + 6SO2. Пары As2O3 конденсируются в бесцветную стекловидную массу, которая с течением времени становится непрозрачной вследствие образования мелких кристаллов кубической сингонии, плотность 3,865 г/см 3 . Плотность пара отвечает формуле As4O6: выше 1800°C пар состоит из As2O3. В 100 г воды растворяется 2,1 г As2O3 (при 25°C). Оксид М. (III) — соединение амфотерное, с преобладанием кислотных свойств. Известны соли (арсениты), отвечающие кислотам ортомышьяковистой H3AsO3 и метамышьяковистой HAsO2; сами же кислоты не получены. В воде растворимы только арсениты щелочных металлов и аммония. As2O3 и арсениты обычно бывают восстановителями (например, As2O3 + 2I2 + 5H2O = 4HI + 2H3AsO4), но могут быть и окислителями (например, As2O3 + 3C = 2As + 3CO).
Оксид М. (V) получают нагреванием мышьяковой кислоты H3AsO4 (около 200°C). Он бесцветен, около 500°C разлагается на As2O3 и O2. Мышьяковую кислоту получают действием концентрированной HNO3 на As или As2O3. Соли мышьяковой кислоты (арсенаты) нерастворимы в воде, за исключением солей щелочных металлов и аммония. Известны соли, отвечающие кислотам ортомышьяковой H3AsO4, метамышьяковой HAsO3, и пиромышьяковой H4As2O7; последние две кислоты в свободном состоянии не получены. При сплавлении с металлами М. по большей части образует соединения (Арсениды).
или (реже) восстановлением As2O3 углем. Оба процесса ведут в ретортах из огнеупорной глины, соединённых с приёмником для конденсации паров М. Мышьяковистый ангидрид получают окислительным обжигом мышьяковых руд или как побочный продукт обжига полиметаллических руд, почти всегда содержащих М. При окислительном обжиге образуются пары As2O3, которые конденсируются в уловительных камерах. Сырой As2O3 очищают возгонкой при 500—600°C. Очищенный As2O3 служит для производства М. и его препаратов.
Небольшие добавки М. (0,2—1,0% по массе) вводят в свинец, служащий для производства ружейной дроби (М. повышает поверхностное натяжение расплавленного свинца, благодаря чему дробь получает форму, близкую к сферической; М. несколько увеличивает твёрдость свинца). Как частичный заменитель сурьмы М. входит в состав некоторых баббитов и типографских сплавов.
Чистый М. не ядовит, но все его соединения, растворимые в воде или могущие перейти в раствор под действием желудочного сока, чрезвычайно ядовиты; особенно опасен Мышьяковистый водород. Из применяемых на производстве соединений М. наиболее токсичен мышьяковистый ангидрид. Примесь М. содержат почти все сульфидные руды цветных металлов, а также железный (серный) колчедан. Поэтому при их окислительном обжиге, наряду с сернистым ангидридом SO2, всегда образуется As2O3; большая часть его конденсируется в дымовых каналах, но при отсутствии или малой эффективности очистных сооружений отходящие газы рудообжигательных печей увлекают заметные количества As2O3. Чистый М., хотя и не ядовит, но при хранении на воздухе всегда покрывается налётом ядовитого As2O3. При отсутствии должной вентиляции крайне опасно травление металлов (железа, цинка) техническими серной или соляной кислотами, содержащими примесь М., т. к. при этом образуется мышьяковистый водород.
М. в организме. В качестве микроэлемента (См. Микроэлементы) М. повсеместно распространён в живой природе. Среднее содержание М. в почвах 4·10 -4 %, в золе растений — 3·10 -5 %. Содержание М. в морских организмах выше, чем в наземных (в рыбах 0,6—4,7 мг в 1 кг сырого вещества, накапливается в печени). Среднее содержание М. в теле человека 0,08—0,2 мг/кг. В крови М. концентрируется в эритроцитах, где он связывается с молекулой гемоглобина (причём в глобиновой фракции содержится его вдвое больше, чем в геме). Наибольшее количество его (на 1 г ткани) обнаруживается в почках и печени. Много М. содержится в лёгких и селезёнке, коже и волосах; сравнительно мало — в спинномозговой жидкости, головном мозге (главным образом гипофизе), половых железах и др. В тканях М. находится в основной белковой фракции, значительно меньше — в кислоторастворимой и лишь незначительная часть его обнаруживается в липидной фракции. М. участвует в окислительно-восстановительных реакциях: окислительном распаде сложных углеводов, брожении, гликолизе и т. п. Соединения М. применяют в биохимии как специфические Ингибиторы ферментов для изучения реакций обмена веществ.
М. в медицине. Органические соединения М. (аминарсон, миарсенол, новарсенал, осарсол) применяют, главным образом, для лечения сифилиса и протозойных заболеваний. Неорганические препараты М. — натрия арсенит (мышьяковокислый натрий), калия арсенит (мышьяковистокислый калий), мышьяковистый ангидрид As2O3, назначают как общеукрепляющие и тонизирующие средства. При местном применении неорганические препараты М. могут вызывать некротизирующий эффект без предшествующего раздражения, отчего этот процесс протекает почти безболезненно; это свойство, которое наиболее выражено у As2O3, используют в стоматологии для разрушения пульпы зуба. Неорганические препараты М. применяют также для лечения псориаза.
Полученные искусственно радиоактивные изотопы М. 74 As (T 1 /2 = 17,5 сут) и 76 As (T 1 /2 = 26,8 ч) используют в диагностических и лечебных целях. С их помощью уточняют локализацию опухолей мозга и определяют степень радикальности их удаления. Радиоактивный М. используют иногда при болезнях крови и др.
Согласно рекомендациям Международной комиссии по защите от излучений, предельно допустимое содержание 76 As в организме 11 мккюри. По санитарным нормам, принятым в СССР, предельно допустимые концентрации 76 As в воде и открытых водоёмах 1·10 -7 кюри/л, в воздухе рабочих помещений 5·10 -11 кюри/л. Все препараты М. очень ядовиты. При остром отравлении ими наблюдаются сильные боли в животе, понос, поражение почек; возможны коллапс, судороги. При хроническом отравлении наиболее часты желудочно-кишечные расстройства, катары слизистых оболочек дыхательных путей (фарингит, ларингит, бронхит), поражения кожи (экзантема, меланоз, гиперкератоз), нарушения чувствительности; возможно развитие апластической анемии. При лечении отравлений препаратами М. наибольшее значение придают унитиолу (см. Антидоты).
Меры предупреждения производственных отравлений должны быть направлены прежде всего на механизацию, герметизацию и обеспыливание технологического процесса, на создание эффективной вентиляции и обеспечение рабочих средствами индивидуальной защиты от воздействия пыли. Необходимы регулярные медицинские осмотры работающих. Предварительные медицинские осмотры производят при приёме на работу, а для работающих — раз в полгода.
Лит.: Реми Г., Курс неорганической химии, пер. с нем., т. 1, М., 1963, с. 700—712; Погодин С. А., Мышьяк, в кн.: Краткая химическая энциклопедия, т. 3, М., 1964; Вредные вещества в промышленности, под общ. ред. Н. В. Лазарева, 6 изд., ч. 2, Л., 1971.
Большая советская энциклопедия. — М.: Советская энциклопедия . 1969—1978 .
МЫШЬЯК
МЫШЬЯК
As (arsenicum),
химический элемент VA подгруппы периодической системы элементов, относится к семейству азота N, P, As, Sb, Bi. Мышьяк наиболее известен из-за использования его и его соединений в качестве яда. В рудах встречается в виде сульфидов, арсенидов, арсенитов и арсенатов. Наибольшее распространение среди мышьяксодержащих минералов имеет арсенопирит (мышьяковый колчедан) FeAsS - основное сырье для получения мышьяка, содержащее до 46% As. Лидерами по производству мышьяка являются Франция, Мексика, Швеция и США. Соединения мышьяка известны с античных времен, наиболее ранние сведения встречаются в работах древнегреческого философа Теофраста (372-287 до н.э.). Открытие элемента обычно приписывают Альберту Великому (Магнусу, 1206-1280), немецкому философу и автору работ по физике. В 1733 Г. Брандт установил, что белый мышьяк в действительности является оксидом мышьяка, а в 1817 шведский химик и минеролог Й. Берцелиус определил относительную атомную массу мышьяка.
Свойства и соединения. Мышьяк относится к неметаллам, хотя из трех его аллотропных модификаций (желтой, черной и металлической, или серой) серая представляет собой кристаллическую массу с металлическим блеском на свежем изломе и, в отличие от других модификаций, обладает металлической электрической проводимостью. Серая форма наиболее стабильна при комнатной температуре и свойства в таблице приведены для нее. СВОЙСТВА СЕРОГО МЫШЬЯКА
Атомный номер 33 Атомная масса 74,9216 Изотопы
Температура плавления, ° С 817 (при 37 атм) Температура кипения, ° С 615 (сублимация) Плотность, г/см3 5,73 Твердость (по Моосу) 3,5 Содержание в земной коре, % (масс.) 0,0005 Степени окисления -3, +3, +5 Мышьяк и все его соединения очень ядовиты. Мышьяк не растворяется в воде, на воздухе медленно окисляется, при сильном нагревании сгорает с образованием оксида As2O3 ("белый мышьяк" с характерным чесночным запахом, плохо растворяется в воде, но взаимодействует с ней с образованием амфотерного гидроксида мышьяка(III) As(OH)3, или ортомышьяковой кислоты H3AsO3, которая в свободном состоянии не получена, а известна лишь в водном растворе, где находится в равновесии с метамышьяковистой кислотой:
.
При взаимодействии As2O3 со щелочами образуются соли мышьяковистой кислоты - арсениты). Соединения мышьяка(III) - восстановители; окисляясь, они переходят в соединения мышьяка(V). Мышьяковая кислота H3AsO4 - твердое, хорошо растворимое в воде вещество, более сильная кислота, чем мышьяковистая. При прокаливании образует белую стеклообразную массу - As2O5 (оксид мышьяка(V), или мышьяковый ангидрид). Соли мышьяковой кислоты - арсенаты (средние) и гидро- и дигидроарсенаты (кислые). Мышьяковая кислота и ее соли - окислители. Гидрид мышьяка, или арсин, AsH3 - бесцветный газ с чесночным запахом, малорастворимый в воде. Образуется при восстановлении соединений мышьяка. При нагревании разлагается с выделением свободного мышьяка, который, оседая на холодной поверхности, образует черный блестящий налет ("мышьяковое зеркало"). С некоторыми металлами мышьяк образует арсениды, например Cu3As, Ca3As2.
Применение. В промышленности элементный мышьяк применяют для производства сплавов различного назначения. При добавлении мышьяка к сплавам на основе меди получают мышьяковые латуни и бронзы (в том числе зеркальную бронзу) и тугоплавкие сплавы. Сплавы на основе свинца с добавками мышьяка используются для изготовления аккумуляторных пластин, подшипников, защитной оболочки кабеля, а добавки мышьяка к свинцу применяются для повышения прочности дроби. Однако наибольшее применение находят соединения мышьяка. Растворимые в воде соединения мышьяка применяются в малых дозах в медицине - в стоматологии, для лечения кожных болезней и органов дыхания. Соединения мышьяка используются также в производстве стеклянных изделий, инсектицидов, для уничтожения грызунов, сорняков, при дублении кож и защите кожаных изделий, для обработки музейных экспонатов от порчи.
ЛИТЕРАТУРА
Немодрук А.А. Аналитическая химия мышьяка. М., 1976 Гуревич Ю.Д., Гвоздев Н.В. Переработка мышьякосодержащего сырья. М., 1983

Зеленоватый полуметалл
Мышьяк / Arsenicum (As), 33
[Ar] 3d 10 4s 2 4p 3
2,18 [1] (шкала Полинга)
5,73 (серый мышьяк) г/см³
1090 К (817°C), 3700 кПа
a =4,132; α =54,13 Å
Содержание
История
Происхождение названия
Название мышьяка в русском языке связывают с употреблением его соединений для истребления мышей и крыс. Греческое название ἀρσενικόν происходит от персидского زرنيخ (zarnik) — «жёлтый аурипигмент». Народная этимология возводит к др.-греч. ἀρσενικός — мужской [3] .
В 1789 году А. Л. Лавуазье выделил металлический мышьяк из триоксида мышьяка («белого мышьяка»), обосновал, что это самостоятельное простое вещество, и присвоил элементу название «арсеникум».
Нахождение в природе
Мышьяк — рассеянный элемент. Содержание в земной коре 1,7·10 −4 % по массе. В морской воде 0,003 мг/л [4] . Это вещество может встречаться в самородном состоянии, имеет вид металлически блестящих серых скорлупок или плотных масс, состоящих из маленьких зернышек. Известно около 200 мышьяксодержащих минералов. В небольших концентрациях часто содержится в свинцовых, медных и серебряных рудах. Довольно часто встречаются два природных соединения мышьяка с серой: оранжево-красный прозрачный реальгар AsS и лимонно-жёлтый аурипигмент As2S3. Минерал, имеющий промышленное значение — арсенопирит (мышьяковый колчедан) FeAsS или FeS2•FeAs2 (46 % As), также добывают мышьяковистый колчедан — лёллингит (FeAs2) (72,8 % As), скородит FeAsO4 (27 — 36% As). Большая часть мышьяка добывается попутно при переработке мышьяксодержащих золотых, свинцово-цинковых, медноколчеданных и других руд.
Месторождения
Главный промышленный минерал мышьяка — арсенопирит FeAsS. Крупные медно-мышьяковые месторождения есть в Грузии, Средней Азии и Казахстане, в США, Швеции, Норвегии и Японии, мышьяково-кобальтовые — в Канаде, мышьяково-оловянные — в Боливии и Англии. Кроме того, известны золото-мышьяковые месторождения в США и Франции. Россия располагает многочисленными месторождениями мышьяка в Якутии, на Урале, в Сибири, Забайкалье и на Чукотке [5] .
Получение
Открытие способа получения металлического мышьяка (серого мышьяка) приписывают средневековому алхимику Альберту Великому, жившему в XIII в. Однако гораздо ранее греческие и арабские алхимики умели получать мышьяк в свободном виде, нагревая «белый мышьяк» (триоксид мышьяка) с различными органическими веществами.
Существует множество способов получения мышьяка: сублимацией природного мышьяка, способом термического разложения мышьякового колчедана, восстановлением мышьяковистого ангидрида и др.
В настоящее время для получения металлического мышьяка чаще всего нагревают арсенопирит в муфельных печах без доступа воздуха. При этом освобождается мышьяк, пары которого конденсируются и превращаются в твердый мышьяк в железных трубках, идущих от печей, и в особых керамических приёмниках. Остаток в печах потом нагревают при доступе воздуха, и тогда мышьяк превращается в As2O3. Металлический мышьяк получается в довольно незначительных количествах, и главная часть мышьякосодержащих руд перерабатывается в белый мышьяк, то есть в триоксид мышьяка — мышьяковистый ангидрид As2О3.
Применение
Мышьяк используется для легирования сплавов свинца, идущих на приготовление дроби, так как при отливке дроби башенным способом капли сплава мышьяка со свинцом приобретают строго сферическую форму, и кроме того, прочность и твёрдость свинца возрастают.
Мышьяк особой чистоты (99,9999 %) используется для синтеза ряда ценных и важных полупроводниковых материалов — арсенидов и сложных алмазоподобных полупроводников.
Сульфидные соединения мышьяка — аурипигмент и реальгар — используются в живописи в качестве красок и в кожевенной отрасли промышленности в качестве средств для удаления волос с кожи.
В пиротехнике реальгар употребляется для получения «греческого», или «индийского», огня, возникающего при горении смеси реальгара с серой и селитрой (ярко-белое пламя).
Многие из мышьяковых соединений в очень малых дозах применяются в качестве лекарств для борьбы с малокровием и рядом тяжелых заболеваний, так как оказывают клинически значимое стимулирующее влияние на ряд функций организма, в частности, на кроветворение. Из неорганических соединений мышьяка мышьяковистый ангидрид может применяться в медицине для приготовления пилюль и в зубоврачебной практике в виде пасты как некротизирующее лекарственное средство. Этот препарат называли «мышьяк» и применялся в стоматологии для девитализации пульпы зуба (см. пульпит). В настоящее время препараты мышьяка применяются в зубоврачебной практике редко из-за токсичности. Разработаны и применяются другие методы безболезненной денервации зуба под местной анестезией.
Биологическая роль и физиологическое действие
Мышьяк и все его соединения ядовиты. При остром отравлении мышьяком наблюдаются рвота, боли в животе, понос, угнетение центральной нервной системы. Сходство симптомов отравления мышьяком с симптомами холеры длительное время позволяло маскировать использование соединений мышьяка (чаще всего, триоксида мышьяка) в качестве смертельного яда. Во Франции порошок триоксида мышьяка за высокую «эффективность» получил обиходное название «наследственный порошок» (фр. poudre de succession ). Существует предположение, что соединениями мышьяка был отравлен Наполеон на острове Святой Елены. В 1832 году появилась надёжная качественная реакция на мышьяк — проба Марша, значительно повысившая эффективность диагностирования отравлений.
На территориях, где в почве и воде избыток мышьяка, он накапливается в щитовидной железе у людей и вызывает эндемический зоб.
Помощь и противоядия при отравлении мышьяком: приём водных растворов тиосульфата натрия Na2S2O3, промывание желудка, приём молока и творога; специфическое противоядие — унитиол. ПДК в воздухе для мышьяка 0,5мг/м³.
Работают с мышьяком в герметичных боксах, используя защитную спецодежду. Из-за высокой токсичности соединения мышьяка использовались как отравляющие вещества в Первую мировую войну.
В западных странах мышьяк был известен преимущественно как сильный яд, в то же время в традиционной китайской медицине он почти на протяжении двух тысяч лет использовался для лечения сифилиса и псориаза. Теперь медики доказали, что мышьяк оказывает положительный эффект и в борьбе с лейкемией. Китайские ученые обнаружили, что мышьяк атакует белки, которые отвечают за рост раковых клеток.
Мышьяк в малых дозах канцерогенен, его использование в качестве лекарства, «улучшающего кровь» (так называемый «белый мышьяк», например «Таблетки Бло с мышьяком», и др.) продолжалось до середины 1950-х гг., и внесло свой весомый вклад в развитие онкологических заболеваний.
Недавно широкую огласку получила техногенная экологическая катастрофа на юге Индии — из-за чрезмерного отбора воды из водоносных горизонтов мышьяк стал поступать в питьевую воду. Это вызвало токсическое и онкологическое поражение у десятков тысяч людей.
Считалось, что «микродозы мышьяка, вводимые с осторожностью в растущий организм, способствуют росту костей человека и животных в длину и толщину, в отдельных случаях рост костей может быть вызван микродозами мышьяка в период окончания роста» [6] .
Считалось также, что «При длительном потреблении небольших доз мышьяка у организма вырабатывается иммунитет: Этот факт установлен как для людей, так и для животных. Известны случаи, когда привычные потребители мышьяка принимали сразу дозы, в несколько раз превышающие смертельную, и оставались здоровыми. Опыты на животных показали своеобразие этой привычки. Оказалось, что животное, привыкшее к мышьяку при его употреблении, быстро погибает, если значительно меньшая доза вводится в кровь или под кожу.» Однако такое «привыкание» носит очень ограниченный характер, в отношении т. н. «острой токсичности», и не защищает от новообразований. Тем не менее, в настоящее время исследуется влияние микродоз мышьяксодержащих препаратов в качестве противоракового средства.
Возможно, в некоторых живых организмах мышьяк является необходимым элементом, занимая место фосфора в биохимических реакциях [7] [8] [9] . В 2010 году сообщалось об открытии бактерии GFAJ-1, в состав ДНК которой вместо фосфора входит мышьяк, в калифорнийском озере Моно [10] [11] [12] . Достоверность этого открытия оспаривается [13] .
Загрязнения мышьяком
На территории Российской Федерации в г. Скопин Рязанской области вследствие многолетней работы местного металлургического комбината СМК «Металлург» в могильниках предприятия было захоронено около полутора тысяч тонн пылеобразных отходов с высоким содержанием мышьяка. С учётом того, что пяти миллиграммов мышьяка достаточно, чтобы отравить человека, в могильниках находится более 200 миллиардов смертельных доз мышьяка [14] .
Известно также о загрязнении отходами военного производства, содержащими мышьяк, в городе Свирск на берегу Братского водохранилища [15] [16] .

Мышьяк — минерал из класса самородных элементов, полуметалл, химическая формула As. Обычны примеси Sb, S, Fe, Ag, Ni; реже Bi и V. Содержание As в самородном мышьяке достигает 98%. Химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) четвёртого периода периодической системы; имеет атомный номер 33. Мышьяк (неочищенный мышьяк) представляет собой твердое вещество, извлекаемое из природных арсенопиритов. Он существует в двух основных формах: обыкновенный, так называемый “металлический” мышьяк, в виде блестящих кристаллов стального цвета, хрупких, не растворимых в воде и желтый мышьяк, кристаллический, довольно неустойчивый. Мышьяк используется в производстве дисульфида мышьяка, крупной дроби, твердой бронзы и различных других сплавов (олова, меди и т.п.)

СТРУКТУРА
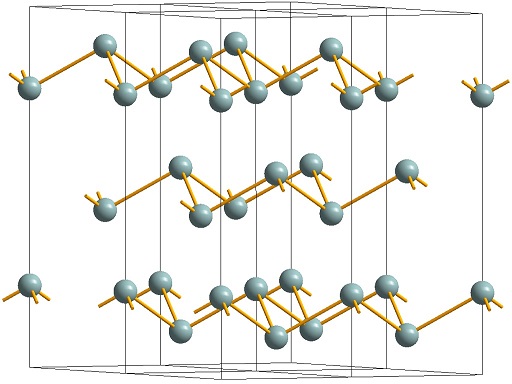
Кристаллическая структура мышьяка дитригонально-скаленоэдрическая симметрия. Сингония тригональная, в. с. L633L23PC. Кристаллы крайне редки, имеют ромбоэдрический или псевдокубический габитус.
Установлено несколько аллотропных модификаций мышьяка. В обычных условиях устойчив металлический, или серый мышьяк (альфа-мышьяк). Кристаллическая решетка серого мышьяка ромбоэдрическая, слоистая, с периодом а=4,123 А, угол а = 54° 10′. Плотность (при температуре 20° С) 5,72 г/см 3 ; температурный коэфф. линейного расширения 3,36 • 10 град ; удельное электрическое сопротивление (температура 0° С) 35 • 10 —6 ом • см; НВ = ж 147; коэфф. сжимаемости (при температуре 30° С) 4,5 х 10 -6 cm 2 /кг. Температура плавления альфа-мышьяка 816° С при давлении 36 атмосфер.
Под атм. давлением мышьяк возгоняется при температуре 615° С не плавясь. Теплота сублимации 102 кал/г. Пары мышьяка бесцветны, до т-ры 800° С состоят из молекул As4, от 800 до 1700° С — из смеси As4 и As2, выше температуры 1700° С — только из As2. При быстрой конденсации паров мышьяк на поверхности, охлаждаемой жидким воздухом, образуется желтый мышьяк— прозрачные мягкие кристаллы кубической системы с плотностью 1,97 г/см 3 . Известны также другие метастабильные модификации мышьяка: бета-мышьяк — аморфная стеклообразная, гамма-мышьяк — желто-коричневая и дельта-мышьяк — коричневая аморфная с плотностями соответственно 4,73; 4,97 и 5,10 г/см 3 . Выше температуры 270° С эти модификации переходят в серый мышьяк.
СВОЙСТВА

Цвет на свежем изломе цинково-белый, оловянно-белый до светло-серого, быстро тускнеет за счет образования тёмно-серой побежалости; чёрный на выветрелой поверхности. Твёрдость по шкале Мооса 3 – 3,5. Плотность 5,63 – 5,8 г/см 3 . Хрупкий. Диагностируется по характерному запаху чеснока при ударе. Спайность совершенная по и менее совершенная по . Излом зернистый. Уд. вес 5,63-5,78. Черта серая, оловянно-белая. Блеск металлический, сильный (в свежем изломе), быстро тускнеет и становится матовым на окислившейся, почерневшей с течением времени поверхности. Является диамагнетиком.
МОРФОЛОГИЯ

Мышьяк обычно наблюдается в виде корок с натечной почковидной поверхностью, сталактитов, скорлуповатых образований, в изломе обнаруживающих кристаллически-зернистое строение. Самородный мышьяк довольно легко узнается по форме выделений, почерневшей поверхности, значительному удельному весу, сильному металлическому блеску в свежем изломе и совершенной спайности. Под паяльной трубкой улетучивается, не плавясь (при температуре около 360°), издавая характерный чесночный запах и образуя белый налет As2О3 на угле. В жидкое состояние переходит лишь при повышенном внешнем давлении. В закрытой трубке образует зеркало мышьяка. При резком ударе молотком издает чесночный запах.
ПРОИСХОЖДЕНИЕ

Мышьяк встречается в гидротермальных месторождениях в виде метаколлоидных образований в пустотах, образуясь, очевидно, в последние моменты гидротермальной деятельности. В ассоциации с ним могут встречаться различные по составу мышьяковистые, сурьмянистые, реже сернистые соединения никеля, кобальта, серебра, свинца и др., а также нерудные минералы.
В литературе имеются указания на вторичное происхождение мышьяка в зонах выветривания месторождений мышьяковистых руд, что, вообще говоря, мало вероятно, если учесть, что в этих условиях он очень неустойчив и, быстро окисляясь, разлагается полностью. Черные корочки состоят из тонкой смеси мышьяка и арсенолита (As2О3). В конце концов образуется чистый арсенолит.
В земной коре концентрация мышьяка невелика и составляет 1,5 промилле. Он встречается в почве и минералах и может попасть в воздух, воду и грунт благодаря ветровой и водной эрозии. Кроме того, элемент поступает в атмосферу из других источников. В результате извержения вулканов в воздух выделяется около 3 тыс. т мышьяка в год, микроорганизмы образуют 20 тыс. т летучего метиларсина в год, а в результате сжигания ископаемого топлива за тот же период выделяется 80 тыс. т.
На территории СССР самородный мышьяк был встречен в нескольких месторождениях. Из них отметим Садонское гидротермальное свинцово-цинковое месторождение, где он неоднократно наблюдался в виде почковидных масс на кристаллическом кальците с галенитом и сфалеритом. Крупные почкообразные скопления самородного мышьяка с концентрически-скорлуповатым строением были встречены на левом берегу р. Чикоя (Забайкалье). В парагенезисе с ним наблюдался лишь кальцит в виде оторочек на стенках тонких жил, секущих древние кристаллические сланцы. В виде обломков (рис. 76) мышьяк был найден также в районе ст. Джалинда, Амурской ж. д. и в других местах.
В ряде месторождений Саксонии (Фрейберг, Шнееберг, Аннаберг и др.) самородный мышьяк наблюдался в ассоциации с мышьяковистыми соединениями кобальта, никеля, серебра, самородным висмутом и др. Все эти и другие находки этого минерала практического значения не имеют.

Мышьяк используется для легирования сплавов свинца, идущих на приготовление дроби, так как при отливке дроби башенным способом капли сплава мышьяка со свинцом приобретают строго сферическую форму, и кроме того, прочность и твёрдость свинца существенно возрастают. Мышьяк особой чистоты (99,9999 %) используется для синтеза ряда полезных и важных полупроводниковых материалов — арсенидов (например, арсенида галлия) и других полупроводниковых материалов с кристаллической решёткой типа цинковой обманки.
Сульфидные соединения мышьяка — аурипигмент и реальгар — используются в живописи в качестве красок и в кожевенной отрасли промышленности в качестве средств для удаления волос с кожи. В пиротехнике реальгар употребляется для получения «греческого», или «индийского», огня, возникающего при горении смеси реальгара с серой и селитрой (при горении образует ярко-белое пламя).
Некоторые элементоорганические соединения мышьяка являются боевыми отравляющими веществами, например, люизит.
В начале XX века некоторые производные какодила, например, сальварсан, применяли для лечения сифилиса, со временем эти препараты были вытеснены из медицинского применения для лечения сифилиса другими, менее токсичными и более эффективными, фармацевтическими препаратами, не содержащими мышьяк.
Многие из мышьяковых соединений в очень малых дозах применяются в качестве препаратов для борьбы с малокровием и рядом других тяжелых заболеваний, так как оказывают клинически заметное стимулирующее влияние на ряд специфических функций организма, в частности, на кроветворение. Из неорганических соединений мышьяка мышьяковистый ангидрид может применяться в медицине для приготовления пилюль и в зубоврачебной практике в виде пасты как некротизирующее лекарственное средство. Этот препарат в обиходе и жаргонно называли «мышьяк» и применяли в стоматологии для локального омертвления зубного нерва. В настоящее время препараты мышьяка редко применяются в зубоврачебной практике из-за их токсичности. Сейчас разработаны и применяются другие методы безболезненного омертвления нерва зуба под местной анестезией.

Мышьяк (лат. Arsenicum , химический символ — As) — химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) четвёртого периода периодической системы; имеет атомный номер 33. Простое вещество представляет собой хрупкий полуметалл стального цвета с зеленоватым оттенком (в серой аллотропной модификации). Яд и канцероген.
- 1 История
- 2 Этимология
- 3 Нахождение в природе
- 3.1 Месторождения
- 7.1 Токсичность
- 7.2 Токсикология
- 7.3 В традиционной медицине
- 7.4 В судебной медицине
- 7.5 Жизнь на основе мышьяка
Мышьяк является одним из древнейших элементов, используемых человеком. Сульфиды мышьяка As2S3 и As4S4, так называемые аурипигмент («арсеник») и реальгар, были знакомы римлянам и грекам. Эти вещества ядовиты.
Мышьяк является одним из элементов, встречающихся в природе в свободном виде. Его можно сравнительно легко выделить из соединений. Поэтому история не знает, кто впервые получил в свободном состоянии элементарный мышьяк. Многие приписывают роль первооткрывателя алхимику Альберту Великому. В трудах Парацельса также описано получение мышьяка в результате реакции арсеника с яичной скорлупой. Многие историки науки предполагают, что металлический мышьяк был получен значительно раньше, но он считался разновидностью самородной ртути. Это можно объяснить тем, что сульфид мышьяка был очень похож на ртутный минерал. Выделение из него было очень легким, как и при выделении ртути. Элементарный мышьяк был известен в Европе и в Азии ещё со средних веков. Китайцы получали его из руд. В отличие от европейцев, они могли диагностировать смерть от отравления мышьяком. Но этот метод анализа не дошёл до настоящих времён. Европейцы научились определять наступление смерти при отравлении мышьяком гораздо позже, это впервые сделал Джеймс Марш. Данная реакция используется и в настоящее время.
Мышьяк иногда встречается в оловянных рудах. В китайской литературе средних веков описаны случаи смерти людей, которые выпивали воду или вино из оловянных сосудов, из-за наличия в них мышьяка. Сравнительно долго люди путали сам мышьяк и его оксид, принимая их за одно вещество. Это недоразумение было устранено Георгом Брандтом и Антуаном Лораном Лавуазье, которые и доказали, что это разные вещества, и что мышьяк — самостоятельный химический элемент. Оксид мышьяка долгое время использовался для уничтожения грызунов. Отсюда и происхождение русского названия элемента. Оно происходит от слов «мышь» и «яд».
Этимология
Название мышьяка в русском языке происходит от слова «мышь», в связи с употреблением его соединений для истребления мышей и крыс. Греческое название ἀρσενικόν происходит от персидского زرنيخ (zarnik) — «жёлтый аурипигмент». Народная этимология возводит к др.-греч. ἀρσενικός — мужской.
Латинское название arsenicum является прямым заимствованием греческого ἀρσενικόν . В 1789 году А. Лавуазье включил мышьяк в список химических элементов под названием arsenic.
Мышьяк — рассеянный элемент. Содержание в земной коре 1,7⋅10 −4 % по массе. В морской воде 0,003 мг/л. Этот элемент иногда встречается в природе в самородном виде, минерал имеет вид металлически блестящих серых скорлупок или плотных масс, состоящих из мелких зёрнышек.
Известно около 200 мышьяковосодержащих минералов. В небольших концентрациях часто сопутствует свинцовым, медным и серебряным рудам. Довольно распространены два природных минерала мышьяка в виде сульфидов (бинарных соединений с серой): оранжево-красный прозрачный реальгар AsS и лимонно-жёлтый аурипигмент As2S3. Минерал, имеющий промышленное значение для получения мышьяка — арсенопирит (мышьяковый колчедан) FeAsS или FeS2·FeAs2 (46 % As), также перерабатывают мышьяковистый колчедан — лёллингит (FeAs2) (72,8 % As), скородит FeAsO4 (27—36 % As). Большая часть мышьяка добывается попутно при переработке мышьяковосодержащих золотых, свинцово-цинковых, медноколчеданных и других руд.
![Мышьяк]()
![Мышьяк]()
Главный промышленный минерал мышьяка — арсенопирит FeAsS. Крупные медно-мышьяковые месторождения есть в Грузии, Средней Азии и Казахстане, в США, Швеции, Норвегии и Японии, мышьяково-кобальтовые — в Канаде, мышьяково-оловянные — в Боливии и Англии. Кроме того, известны золото-мышьяковые месторождения в США и Франции. Россия располагает многочисленными месторождениями мышьяка в Якутии, на Урале, в Сибири, Забайкалье и на Чукотке.
Изотопы
Известны 33 изотопа и, по крайней мере, 10 возбуждённых состояний ядерных изомеров. Из этих изотопов стабилен только 75 As, и природный мышьяк состоит только из этого изотопа. Наиболее долгоживущий радиоактивный изотоп 73 As имеет период полураспада 80,3 дня.
В настоящее время для получения металлического мышьяка чаще всего нагревают арсенопирит в муфельных печах без доступа воздуха. При этом освобождается мышьяк, пары которого конденсируются и превращаются в твёрдый мышьяк в железных трубках, идущих от печей, и в особых керамических приёмниках. Остаток в печах потом нагревают при доступе воздуха, и тогда мышьяк окисляется в As2O3. Металлический мышьяк получается в довольно незначительных количествах, и главная часть мышьякосодержащих руд перерабатывается в белый мышьяк, то есть в триоксид мышьяка — мышьяковистый ангидрид As2O3.
Основной способ получения — обжиг сульфидных руд с последующим восстановлением оксида углём (углеродом):
Мышьяк используется для легирования сплавов свинца, идущих на приготовление дроби, так как при отливке дроби башенным способом капли сплава мышьяка со свинцом приобретают строго сферическую форму, и кроме того, прочность и твёрдость свинца существенно возрастают.
Мышьяк особой чистоты (99,9999 %) используется для синтеза ряда полезных и важных полупроводниковых материалов — арсенидов (например, арсенида галлия) и других полупроводниковых материалов с кристаллической решёткой типа цинковой обманки.
В пиротехнике реальгар употребляется для получения «греческого» огня или «индийского» (бенгальского) огня, возникающего при горении смеси реальгара с серой и селитрой (при горении образует ярко-белое пламя).
Некоторые элементоорганические соединения мышьяка являются боевыми отравляющими веществами, например, люизит.
Многие из мышьяковых соединений в очень малых дозах применяются в качестве препаратов для борьбы с малокровием и рядом других тяжёлых заболеваний, так как оказывают клинически заметное стимулирующее влияние на ряд специфических функций организма, в частности, на кроветворение. Из неорганических соединений мышьяка мышьяковистый ангидрид может применяться в медицине для приготовления пилюль и в зубоврачебной практике в виде пасты как некротизирующее лекарственное средство. Этот препарат в обиходе и жаргонно называли «мышьяк» и применяли в стоматологии для локального омертвления зубного нерва (см. пульпит). В настоящее время (2015 г.) препараты мышьяка редко применяются в зубоврачебной практике из-за их токсичности. Сейчас разработаны и применяются другие методы безболезненного омертвления нерва зуба под местной анестезией.
Токсичность
Токсикология
Мышьяк и все его соединения ядовиты и канцерогенны. Неорганические соединения мышьяка относятся к 1 категории канцерогенов по МАИР, арсенобетаин и другие органические соединения, не метаболизируемые в организме человека — к 3 группе. Смертельная доза мышьяка для человека составляет 50-170 мг (1,4 мг/кг массы тела). При остром отравлении мышьяком наблюдаются рвота, боли в животе, понос, угнетение центральной нервной системы. Сходство симптомов отравления мышьяком с симптомами холеры длительное время позволяло маскировать использование соединений мышьяка (чаще всего, триоксида мышьяка, т. н. «белого мышьяка») в качестве смертельного яда. Во Франции порошок триоксида мышьяка за высокую эффективность получил обиходное название «наследственный порошок» (фр. poudre de succession ). Существует предположение, что соединениями мышьяка был отравлен Наполеон на острове Святой Елены. В 1832 году появилась надёжная качественная реакция на мышьяк — проба Марша, значительно повысившая эффективность диагностирования отравлений.
Помощь и противоядия при отравлении мышьяком: приём водных растворов тиосульфата натрия Na2S2O3, промывание желудка, приём молока и творога; специфическое противоядие — унитиол. ПДК в воздухе для мышьяка 0,5 мг/м³.
Считалось, что при длительном потреблении небольших доз мышьяка у организма вырабатывается иммунитет. Этот факт установлен как для людей, так и для животных. Известны случаи, когда привычные потребители мышьяка принимали сразу дозы, в несколько раз превышающие смертельную, и оставались здоровыми. Опыты на животных показали своеобразие этой привычки. Оказалось, что животное, привыкшее к мышьяку при его употреблении, быстро погибает, если значительно меньшая доза вводится в кровь или под кожу. Однако такое «привыкание» носит очень ограниченный характер, в отношении т. н. «острой токсичности», и не защищает от новообразований. Тем не менее, в настоящее время исследуется влияние микродоз мышьяксодержащих препаратов в качестве противоракового средства.
Как органические, так и неорганические соединения мышьяка токсичны для живых организмов. Тем не менее, в малых дозах некоторые соединения мышьяка способствуют обмену веществ, укреплению костей, оказывают положительное влияние на кроветворную функцию и имунную систему, увеличивают усвоение азота и фосфора из пищи. С растениями, наиболее заметный эффект мышьяка — замедление обмена веществ, что снижает урожайность, но мышьяк также стимулирует фиксацию азота.
Отмечалось, что для растущего организма у человека и животных микродозы мышьяка способствуют росту костей в длину и толщину, а в отдельных случаях рост костей под воздействием микродозам мышьяка отмечался и в период окончания роста.
Некоторые авторы рассматривают мышьяк, как жизненно важный микроэлемент и причисляют его к ультрамикроэлементам — микроэлементам, необходимым в особо малых концентрациях (подобно селену, ванадию, хрому и никелю). Необходимая суточная доза для человека составляет 10-15 мкг.
В традиционной медицине
В западных странах мышьяк был известен преимущественно как сильный яд, в то же время в традиционной китайской медицине он почти на протяжении двух тысяч лет использовался для лечения сифилиса и псориаза.
Мышьяк в малых дозах канцерогенен, его использование в качестве лекарства, «улучшающего кровь» (так называемый «белый мышьяк», например, «Таблетки Бло с мышьяком», и др.) продолжалось до середины 1950-х гг., и внесло свой весомый вклад в развитие онкологических заболеваний.
Соединение мышьяка сальварсан (также известен как «препарат 606» и арсфенамин) — исторически первое эффективное и в то же время относительно безвредное этиотропное лекарство от сифилиса, созданное химиком Паулем Эрлихом. К настоящему времени сальварсан вышел из употребления и заменён другими, гораздо более эффективными и безопасными средствами.
В судебной медицине
Метод обнаружения мышьяка в теле человека, трупах и продуктах питания при подозрениях на отравления был разработан в начале XIX в. английским химиком Джеймсом Маршем.
Жизнь на основе мышьяка
Известны экстремофильные бактерии, которые способны выживать при высоких концентрациях арсената в окружающей среде. Было высказано предположение, что в случае штамма GFAJ-1 мышьяк замещает фосфор в биохимических реакциях, в частности, входит в состав ДНК, однако это предположение не подтвердилось.
На территории Российской Федерации в городе Скопине Рязанской области вследствие многолетней работы местного металлургического комбината СМК «Металлург» в могильниках предприятия было захоронено около полутора тысяч тонн пылеобразных отходов с высоким содержанием мышьяка. Мышьяк является характерным сопутствующим элементом многих месторождений золота, что приводит к дополнительными экологическим проблемам в золотодобывающих странах, таких как, например, Румыния.
Читайте также:


