Общая характеристика металлов 9 класс ответы
Обновлено: 18.05.2024
Оборудование: Видеоролик; карточки с заданиями; коллекция металлов; периодическая система химических элементов Д.И. Менделеева; демонстрационная компьютерная техника.
1. Организационный момент (учащиеся распределены по 5 группам)
Здравствуйте дорогие ребята. Сегодня у вас необычный урок. Вы изучили тему “Химические реакции” и вам предстоит перейти к изучению нового раздела неорганической химии. Вы сегодня познакомитесь с веществами, с которыми мы сталкиваемся на каждом шагу, без которых наша жизнь стала бы невозможной. Работать вы будете группами, каждая из которых будет выполнять свое задание.
2. Актуализация опорных знаний
Чтобы узнать о каких веществах пойдет речь, я вам предлагаю посмотреть небольшой видеоролик (кинофрагмент).
- Как вы думаете, о каких веществах пойдет сегодня речь?
- Как эти вещества связаны с нашим металлургическим заводом?
Тема нашего урока “Металлы” (на доске прикрепляется название темы “Металлы”).Приложение 1
М.В. Ломоносов посвятил металлам такие строки: “Металлы подают укрепление и красоту важнейшим вещам, в обществе потребным. Ими защищаемся от нападения неприятеля, ими утверждаются корабли и силою их связаны. Металлы отверзают недро земное к плодородию, служат нам в ловлении земных и морских животных для пропитания нашего…. И кратко сказать, ни едино художество, ни едино ремесло простое употребление металлов миновать не может”.
3. Изучение нового материала
С незапамятных времен человек познакомился с семеркой металлов: железом, медью, серебром, оловом, золотом, ртутью и свинцом. Два из них – золото и серебро – за красоту и стойкость стали называться благородными. К другим металлам отношение было не менее почтительное. Известны периоды в истории человечества, когда железо ценилось дороже золота. Но главное достоинство так называемых простых металлов в том, что эти великие труженики сыграли решающую роль в развитии цивилизации. Где бы вы ни были дома, на улице или в транспорте – вокруг нас трудятся металлы. А какое множество тайн и загадок хранит их производство и применение.
В средневековой Европе каждому металлу, входящему в замечательную семерку, была посвящена одна из крупнейших планет. Научный трактат того времени, написанный в стихотворной форме, сообщает следующее:
Семь металлов создал свет
По числу семи планет:
Дал нам космос на добро
Медь, железо, серебро,
Злато, олово, свинец.
И спеши, мой сын, узнать:
Всем им ртуть – родная мать!
Меди была посвящена Венера, Марсу соответствовало гремящее в боях железо, серебру – Селена (Луна), золоту – Гелиос (Солнце), олову – Юпитер, свинцу – Сатурн и ртути – Меркурий. Алхимики полагали, что металлы рождаются в недрах Земли под влиянием лучей Солнца. Астрологи считали, что каждая планета управляет судьбой металла на Земле, поэтому металлы обозначали знаком планеты. Само слово “металл” произошло от греческого слова “металлон”, что означает “шахта”, “копи”.
История человечества выделяет три века, связанных с металлами: медный, бронзовый, железный.
- Почему именно в таком порядке? Как вы думаете?
- В каком веке мы сегодня живем?
- А какими металлами и их соединениями богат Кузбасс?
Чтобы ответить на этот вопрос воспользуемся физической картой и своими знаниями по географии.
Задание 1. По карте определите основные месторождения металлических руд и металлов Кузбасса и укажите их местоположение (работа в группе с физической картой полезных ископаемых).
(В Кузбассе известны многочисленные месторождения высококачественных железных руд, а также редких цветных металлов – золота, серебра, цинка, алюминия, меди, марганца).
Металлы встречаются не только на нашей планете, например на Луне, обнаружено большое количество самородного железа.
- А как определить металлом или неметаллом является вещество?
У вас на столах находятся карточки с химическими знаками разных простых веществ. Определите, сколько из них относятся к металлам.
Задание 2. (групповая работа) (Приложение 3).
- К какой группе отнести незнакомые вам вещества?
- Как узнать по химическому знаку к металлам или неметаллам можно отнести элемент?
Таким образом, первым вопросом нашего урока будет изучение положения металлов в периодической системе химических элементов (на доске прикрепляется название первого пункта плана урока “Положение металлов в периодической системе химических элементов”).
- В каких группах больше всего металлов?
- В каких периодах содержатся металлы?
- Сделайте вывод, как по ПСХЭ определить принадлежность простого вещества к той или иной группе?
Запомните, что в короткопериодном варианте ПСХЭ четные ряды больших периодов состоят только из металлов, равно как и все побочные подгруппы представлены только металлами! К металлам относятся также лантаноиды и актиноиды.
В итоге из 118 химических элементов ПС к металлам относятся 89.
- Как меняются металлические и неметаллические свойства элементов в группах? в периодах?
- С чем это связано?
- А что еще можно узнать об атомах по периодической системе химических элементов? (Строение атома и закономерности изменения свойств элементов).
Каковы особенности строения атомов металлов вам сейчас и предстоит узнать.
Значит, важным вопросом, при изучении свойств вещества является положение элемента в ПСХЭ и строение его атома (на доске прикрепляется название второго вопроса урока “Особенности строения атомов металлов”).
Каждая группа будет работать с семейством определенных металлов по заданиям 1, которые находятся у вас на столах. Возьмите пакет с заданием 1, внимательно прочитайте его и заполните соответствующие графы в своих тетрадях. Как только группа справится со своим заданием, данные внесите в соответствующую графу на доске (Приложение 4, 5).
Задание 1. (групповая работа с разными семействами металлов). Учащиеся работают с таблицами и вносят данные в сводную таблицу на доске (Приложение 5).
- Каковы особенности строения атомов металлов?
- Что сходного у металлов одной группы?
- Как изменяются радиусы атомов металлов в периодах и группах?
- Обоснуйте, почему полоний (84) и висмут (83) тоже относятся к металлам?
1. Для металлов характерно небольшое число электронов (1-3) на внешнем слое;
2. Металлы обладают сравнительно большим радиусом атома, чем неметаллы.
Бор содержит 3 электрона на внешнем слое, но не является металлом, так как имеет маленький радиус атома. Ванадий и полоний содержат 5 и 6 электронов соответственно на внешнем слое, но являются металлами, так как имеют большой радиус атома.
- А зачем нужно знать строение атома? (предсказывать свойства).
- На какие группы делятся свойства веществ?
- Что мы понимаем под физическими свойствами вещества?
- Что мы понимаем под химическими свойствами вещества?
Следующим этапом нашей работы будет изучение физических свойств металлов (на доске пункт плана “Физические свойства металлов”).
Перед вами коллекция разных металлов и некоторых изделий из них. Используя коллекцию, учебник и справочные материалы выполните задание 2. Заполните соответствующую графу в своих тетрадях, а затем внесите данные в сводную таблицу на доске (Приложение 4, 5).
Задание 2. (групповая работа с заданиями 2).
- Назовите общие физические свойства металлов.
- Как можно объяснить наличие общих физических свойств у такого большого числа разнообразных простых веществ?
- Каковы особенности металлической кристаллической решетки и металлической связи?
Физические свойства металлов определяются именно их строением. Все металлы, кроме ртути, при обычных условиях – твердые вещества. Однако это свойство различно у каждого из металлов. Самые мягкие – натрий, калий и индий легко режутся ножом, самый твердый – хром – царапает стекло (приложение).
По плотности металлы делятся на легкие и тяжелые. К легким относятся металлы – натрий, калий, магний, алюминий, к тяжелым – цинк, олово, свинец, серебро, золото (приложение).
Самыми блестящими металлами являются – ртуть, серебро, палладий.
По электро- и теплопроводности первое место принадлежит серебру, затем идет медь, золото, алюминий, цинк, железо, свинец и т.д.
- Какие физические свойства металлов обусловлены наличием свободных электронов?
- Какие металлы наиболее электропроводны? теплопроводны?
- Какие металлы входят в состав электрической лампочки? Какие функции они там выполняют?
- По каким свойствам металлы отличаются друг от друга? Почему?
Таким образом, физические свойства металлов связаны со строением атомов металлов, наличием металлической связи и кристаллической металлической решеткой.
А для чего необходимо изучать свойства веществ? (На доске следующий вопрос плана урока “Роль металлов в нашей жизни”).
О некоторых металлах и их применениях расскажут ребята разных групп.
Что интересного и где можно еще узнать о металлах расскажет библиотекарь школы.
(Библиотекарь знакомит учащихся с литературой о металлах и сайтами, на которых можно найти сведения о металлах).
4. Проверка полученных знаний.
- 1-я группа. Почему металлы, над изучением которых вы сегодня работали, называются щелочными?
- 2-я группа. Какие металлы относятся к щелочноземельным и почему они так называются?
- 3-я группа. Почему для изучения свойств элементов этой группы взяли только алюминий?
- 4-я группа. Почему железо называют переходным элементом?
Групповая работа с тестами. (Приложение 6).
5. Подведение итогов урока
- С какой группой веществ вы сегодня познакомились?
- Какие вопросы мы рассмотрели с вами на уроке?
Дорогие ребята. Наш урок подходит к концу. Можно ли считать, что вы успешно справились с поставленными перед вами задачами и расширили свои знания о металлах.
Возьмите листочки с вопросами, которые мы сегодня разбирали на уроке, и поставьте знак “-” если вы не узнали ничего нового сегодня по этому вопросу и знак “+”, если вам удалось расширить свои знания по данной теме.
Поднимите руку, у кого знаков плюсов больше.
А теперь проведем самоанализ своей работы, поставив цифру
“2” - я был на уроке;
“3” - я слушал и смотрел, как работают другие;
“4” - я изучал литературу, помогал отбирать материал, вносил предложения;
“5” - я изучал предложенную литературу, активно участвовал в работе группы, был генератором идей.
Итоговая оценка будет выставлена с учетом вашего конспекта по данной теме.
7. Домашнее задание. (Приложение 5)
1. Общая характеристика элементов металлов
Из \(118\) известных на данный момент химических элементов \(96\) образуют простые вещества с металлическими свойствами, поэтому их называют металлическими элементами .
Металлические химические элементы в природе могут встречаться как в виде простых веществ, так и в виде соединений. То, в каком виде встречаются металлические элементы в природе, зависит от химической активности образуемых ими металлов.
Металлические элементы, образующие химически активные металлы ( Li–Mg ), в природе чаще всего встречаются в виде солей (хлоридов, фторидов, сульфатов, фосфатов и других).
Соли, образуемые этими металлами, являются главной составной частью распространённых в земной коре минералов и горных пород.


В растворённом виде соли натрия, кальция и магния содержатся в природных водах. Кроме того, соли активных металлов — важная составная часть живых организмов. Например, фосфат кальция Ca 3 ( P O 4 ) 2 является главной минеральной составной частью костной ткани.
Металлические химические элементы, образующие металлы средней активности ( Al–Pb ), в природе чаще всего встречаются в виде оксидов и сульфидов.


Металлические элементы, образующие химически неактивные металлы ( Cu–Au ), в природе чаще всего встречаются в виде простых веществ.
 |  |  |
| Рис. \(7\). Самородное золото Au | Рис. \(8\). Самородное серебро Ag | Рис. \(9\). Самородная платина Pt |
Исключение составляют медь и ртуть, которые в природе встречаются также в виде химических соединений.

В Периодической системе химических элементов металлы занимают левый нижний угол и находятся в главных (А) и побочных (Б) группах.
Рис. \(13\). Положение металлов в Периодической системе. Знаки металлических химических элементов расположены ниже ломаной линии B — Si — As — Te
В электронной оболочке атомов металлов на внешнем энергетическом уровне, как правило, содержится от \(1\) до \(3\) электронов. Исключение составляют только металлы \(IV\)А, \(V\)А и \(VI\)А группы, у которых на наружном энергетическом уровне находятся соответственно четыре, пять или шесть электронов.
В атомах металлов главных подгрупп валентные электроны располагаются на внешнем энергетическом уровне, а у металлов побочных подгрупп — ещё и на предвнешнем энергетическом уровне.
Радиусы атомов металлов больше, чем у атомов неметаллов того же периода. В силу отдалённости положительно заряженного ядра атомы металлов слабо удерживают свои валентные электроны.
Рис. \(14\). Характер изменения радиусов атомов химических элементов в периодах и в группах. Радиусы атомов металлов существенно больше, чем радиусы атомов неметаллов, находящихся в том же периоде
Главное отличительное свойство металлов — это их сравнительно невысокая электроотрицательность (ЭО) по сравнению с неметаллами.

Рис. \(15\). Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу). ОЭО металлических химических элементов уступает соответствующей величине неметаллических химических элементов
Атомы металлов, вступая в химические реакции, способны только отдавать электроны, то есть окисляться, следовательно, в ходе превращений могут проявлять себя в качестве восстановителей .
Химические свойства металлов

Металлы – активные восстановители с положительной степенью окисления. Благодаря химическим свойствам металлы широко используются в промышленности, металлургии, медицине, строительстве.
Активность металлов
В реакциях атомы металлов отдают валентные электроны и окисляются. Чем больше энергетических уровней и меньше электронов имеет атом металла, тем легче ему отдавать электроны и вступать в реакции. Поэтому металлические свойства увеличиваются сверху вниз и справа налево в таблице Менделеева.
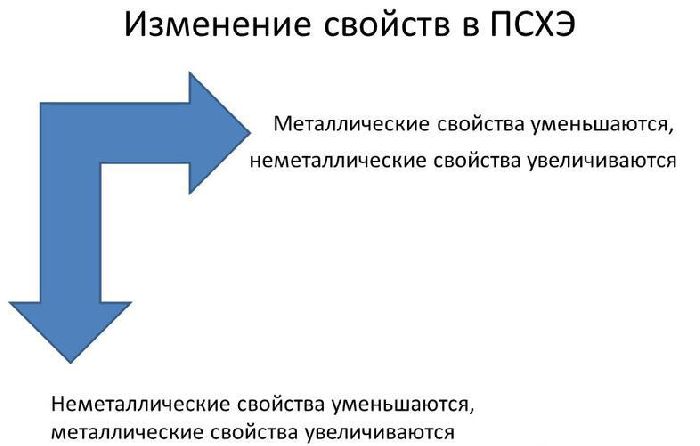
Рис. 1. Изменение металлических свойств в таблице Менделеева.
Активность простых веществ показана в электрохимическом ряду напряжений металлов. Слева от водорода находятся активные металлы (активность увеличивается к левому краю), справа – неактивные.
Наибольшую активность проявляют щелочные металлы, находящиеся в I группе периодической таблицы и стоящие левее водорода в электрохимическом ряду напряжений. Они вступают в реакцию со многими веществами уже при комнатной температуре. За ними идут щелочноземельные металлы, входящие во II группу. Они реагируют с большинством веществ при нагревании. Металлы, находящиеся в электрохимическом ряду от алюминия до водорода (средней активности) требуют дополнительных условий для вступления в реакции.

Рис. 2. Электрохимический ряд напряжений металлов.
Некоторые металлы проявляют амфотерные свойства или двойственность. Металлы, их оксиды и гидроксиды реагируют с кислотами и основаниями. Большинство металлов реагирует только с некоторыми кислотами, замещая водород и образуя соль. Наиболее ярко выраженные двойственные свойства проявляют:
- алюминий;
- свинец;
- цинк;
- железо;
- медь;
- бериллий;
- хром.
Каждый металл способен вытеснять стоящий правее него в электрохимическом ряду другой металл из солей. Металлы, находящиеся слева от водорода, вытесняют его из разбавленных кислот.
Свойства
Особенности взаимодействия металлов с разными веществами представлены в таблице химических свойств металлов.
Реакция
Особенности
Уравнение
Большинство металлов образует оксидные плёнки. Щелочные металлы самовоспламеняются в присутствии кислорода. При этом натрий образует пероксид (Na2O2), остальные металлы I группы – надпероксиды (RO2). При нагревании щелочноземельные металлы самовоспламеняются, металлы средней активности – окисляются. Во взаимодействие с кислородом не вступают золото и платина
При комнатной температуре реагируют щелочные, при нагревании – щелочноземельные. Бериллий не вступает в реакцию. Магнию дополнительно необходимо высокое давление
Только активные металлы. Литий вступает в реакцию при комнатной температуре. Остальные металлы – при нагревании
Металлы

К металлам относится большая часть элементов периодической системы – 82 химических элементов. Какими свойствами они обладают, и чем отличаются от неметаллов?
Общая характеристика
Металлами называют группу элементов, в виде простых веществ, которые обладают металлическими свойствами (пластичность, ковкость, блеск, электронная проводимость и т. д.)
Основное отличие элементов-металлов – они обладают только восстановительными свойствами, а в реакциях могут только окисляться. В соединениях они могут иметь только положительные степени окисления как в элементарных положительно заряженных ионах, так и в сложных ионах, где они образуют положительные центры.
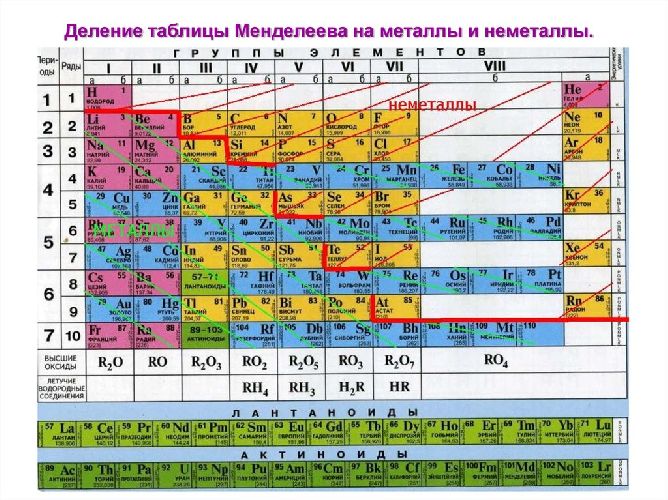
Рис. 1. Список металлов.
Как правило, на внешнем уровне элементов металлов находится небольшое число электронов (1-3), значения электроотрицательности невысокие. К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы под чертой бор-астат. Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов. Образующиеся положительные ионы устойчивы, так как имеют завершенную внешнюю электронную оболочку.
Физические и химические свойства
Все металлы, кроме ртути, при нормальных условиях в виде простых веществ находятся в твердом агрегатном состоянии и образуют металлическую кристаллическую решетку.

Рис. 2. Металлы в таблице Д.И. Менделеева.
Таблица «Металлы»
В следующей таблицы представлены группы основных металлов:
| Группа металлов | Металл |
| Щелочные | литий, натрий, калий и т.д. |
| Щелочноземельные | кальций, стронций, барий и т.д. |
| Переходные | уран, титан, железо, платина и т.д. |
| постпереходные | алюминий, свинец, олово и т.д. |
| Тугоплавкие | молибден, вольфрам |
| Цветные | медь, титан, магний и т.д. |
| Благородные | золото, серебро и т.д. |
Металлы пластичны и ковки, особенно если на внешнем электронном уровне атомов по одному электрону: слои атомов перемещаются относительно друг друга без разрушения кристаллической решетки (щелочные металлы, медь, серебро, золото). В атомах непластичных хрупких металлов хрома и марганца – большое число валентных электронов.
Плотность, твердость, температура плавления металлов изменяются в широком диапазоне и зависят от атомной массы, строения атома и геометрии кристаллической решетки. Самый легкий металл – литий (плотность 0,53 г/см 3 ), самый тяжелый – осмий (плотность 22,5 г/см 3 ). Металлы с плотностью больше 5 г/см 3 относят к тяжелым, меньше 5 г/см 3 – к легким металлам.
Самая низкая температура плавления у ртути (-39 градусов по Цельсию), самый тугоплавкий металл – вольфрам (температура плавления 3410 градусов по Цельсию.) Энергия атомизации вольфрама составляет 836 кДж/моль, а температура кипения его 5930 градусов.
Металлы вступают в реакцию как с простыми, так и со сложными веществами. Как типичные восстановители металлы реагируют почти со всеми неметаллами-окислителями (кислород, сера, азот и т. д.):
Также металлы реагируют с такими сложными веществами, как оксиды и гидроксиды, разбавленные растворы кислот, с растворенными в воде щелочами.
В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются; в пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают

Рис. 3. Металлы главных подгрупп.
Нахождение металлов и способы их получения
Самый распространенный на земле элемент-металл – алюминий. За ним следуют железо, кальций, натрий.
Некоторые металлы встречаются в природе в самородном состоянии (золото, ртуть, платина), но в основном они находятся в природе в виде оксидов и солей.
Получение металлов происходит с помощью металлургии (получение из руд), пирометаллургии (получение с помощью реакции восстановления при высокой температуре), гидрометаллургии (извлечение из руд в виде растворимых соединений), электрометаллургии (получение металлов электролизом расплавов и растворов их соединений).
Что мы узнали?
Металлы – вещества, которые обладают высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В данной статье по химии 9 класса рассматриваются их физические и химические свойства, формулы класса металлов, а также способы получения.
Общая характеристика металлов 9 класс

КГУ«Школа-гимназия №32»
г. Нур-Султан
Общая характеристика металлов.
Учитель химии
Дарипова Айгуль Айтказиновна

Цели обучения:
9.1.4.1 знать определение металлической связи, металлической кристаллической решетки
9.1.4.2 определять вид связи и тип кристаллической решетки в металлах и предсказывать их физические свойства
9.2.1.3 описывать характерные физические и химические свойства металлов, объяснять способность металлов проявлять только восстановительные свойства

Критерии оценивания
Может перечислить физические свойства металлов
Может дать определение металлической связи
Может описать строение металлической кристаллической решетки
Может объяснить физические свойства металлов на основе их строения
Может предсказать физические свойства металлов на основе расположения в периодической таблице

Металлы, заметьте, бывают везде:
На суше и в море, в воздушной среде.
Металлы мы «видим» в различных вещах,
В серёжках и кольцах, других мелочах.
Приносят радость амулеты
И разноцветные браслеты.
Оберегают нас металлы,
Даря магическую тайну.

Древние алхимики говорили: «Семь металлов создал свет по числу семи планет», – и полагали, что под влиянием лучей планет в недрах Земли и рождаются металлы. Солнце – золото (Au), Юпитер – олово (Sn), луна – серебро (Ag), Марс – железо (Fe), Меркурий – ртуть (Hg), Сатурн – свинец (Pb), Венера – медь (Cu). Само слово «металл», по-видимому, происходит от греческого «металлон», что означает «рудники», «копи». В истории человечества выделяют века: медный, бронзовый, железный



Положение металлов в системе химических элементов Д. И. Менделеева
Элементы, образующие простые вещества — металлы, занимают левую нижнюю часть периодической системы
На внешнем уровне 1-3 реже 4 и 5 электронов
К металлам относятся s-элементы (кроме H, He), большинство p-элементов, все d- и f-элементы
Имеют большой радиус атома
Являются восстановителями



Общая характеристика металлов
Металлы – простые вещества, обладающие в обычных условиях характерными свойствами: высокими электропроводностью и теплопроводностью, способностью хорошо отражать свет (что обуславливает их блеск и непрозрачность), возможностью принимать нужную форму под воздействием внешних сил (пластичностью). Существует и другое определение металлов – это химические элементы, характеризующиеся способностью отдавать внешние (валентные) электроны.
Из всех известных химических элементов около 90 являются металлами. Большинство неорганических соединений – это соединения металлов.

Вид химической связи и тип кристаллической решетки

Металлическая связь – это химическая связь, образующаяся между катионами и свободно движущимися электронами в металлической кристаллической решетке



Задание 1
Изобразить электронную и графическую формулу атома магния;
Показать схему образования катиона магния
Определить вид химической связи и тип кристаллической решетки для магния и хлорида магния

Физические свойства металлов
Тверды они все, кроме ртути,
Блестящи и твёрды по сути.
Беда у них тоже одна —
Коррозия ест их до дна.

Общие физические свойства металлов
Благодаря наличию свободных электронов («электронного газа») в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
1) Пластичность — способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение «электронного газа».
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность — у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий — литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются «легкими металлами».
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.

Задание 2 по вариантам
1 вариант: распределить металлы по возрастанию температуры плавления
2 вариант: распределить металлы по возрастанию плотности

Закрепление
Индивидуальная работа
Что такое металлическая связь?
Какие силы существуют между катионами и электронами в металлической кристаллической решетке?
Почему медь проводит электрический ток?
Почему железо обладает ковкостью?
Опираясь на расположение металлов в ПСХЭ, сравните температуры плавления у металлов проставьте знаки «˃» «˂» между парами металлов:
Na Cu
Ca Fe
Mg Al
Объясните свой выбор

Что такое металлическая связь? Вид химической связи между катионами металлов и электронами
Какие силы существуют между катионами и электронами в металлической кристаллической решетке? Электростатические силы притяжения
Почему медь проводит электрический ток? В кристаллической решетке имеются делокализованные электроны, которые под действием электрического тока принимают направленное движение
Почему железо обладает ковкостью? Делокализованные электроны не дают разрушиться слоям катионов в кристаллической решетке Опираясь на расположение металлов в ПСХЭ, сравните температуры плавления у металлов проставьте знаки «˃» «˂» между парами металлов:
Na ˂ Cu
Ca ˂ Fe
Mg ˂ Al
Объясните свой выбор: плотность щелочных и щелочноземельных металлов меньше, чем у других металлов, переход из твердого состояния в жидкое требует меньше энергии
Читайте также:
