Общие химические свойства металлов 11
Обновлено: 28.09.2024
Загадки
Первый слог – предлог известный,
Слог второй трудней найти:
Часть его составит цифра,
К ней добавьте букву «Й».
Чтобы целое узнать,
Надо вам металл назвать.
Порознь каждый ядовит, вместе будет — аппетит.
Кислота тепла боится, быстро в воду превратится.
«Она идет», «она прошла»,
Никто ни скажет, что пришла.
Ответ
Натрий
(Хлорид натрия)
(Угольная и сернистая кислота)
(Химическая реакция)
Если все объединим получим тему урока
Тема урока
Общие химические свойства металлов
сформировать понятие об общих химических свойствах металлов и их восстановительных способностях.
Задачи:
Образовательные:
сформировать понятие об общих химических свойствах металлов;
проверить знания о строении металлов и их физических свойствах.
Развивающие:
совершенствовать умения записывать уравнения химических реакций; применять знания и практические умения, работая по инструкции, с соблюдением правил Техники безопасности;
развивать познавательную активность учащихся, вырабатывать умение анализировать, делать выводы;
создать условия для развития познавательного интереса к предмету
устанавливать межпредметные связи.
Воспитательные:
воспитывать экологическую культуру (на примере последствий загрязнения окружающей среды тяжелыми металлами), ответственное отношение к собственному здоровью (в связи с необходимостью или вредом поступления в организм некоторых металлов);
воспитывать коммуникативные компетенции, умение высказывать собственное мнение, сотрудничать в группе.
Проверка домашнего задания
А1
Электронная формула атома магния:
1)1s22s2 2) 1s22s2 2p63s2
3) 1s22s2 2p63s1 4) 1s22s2 2p63s23p2
А2Электронная формула внешнего энергетического уровня атомов элементов главной подгруппы II группы Периодической системы:
А.ns1. В.ns2 np1.
Б. ns2. Г. ns2 np2.
А3
Металл, обладающий самой высокой электропроводностью, - это
железо 2) медь
3) серебро 4) алюминий
Тесты
А 4 . В каком ряду химические элементы расположены в порядке увеличения их атомного радиуса?
1) Na, Mg, Al 2) Al, Mg, Na 3) K, Na, Li 4) Mg, Be, Ca
А 5 . Металл, обладающий самой высокой электропроводностью, - это
1) железо 2) медь 3) серебро 4) алюминий
А 6 . Самый тугоплавкий металл – это:
хром 2) медь 3) вольфрам 4) железо
А7
В каком ряду химические элементы расположены в порядке ослабления металлических свойств?
1) Li, K, Rb 2) Al, Mg, K 3) Ca, Mg, Li 4) K, Ca, Be
А8 Самый легкоплавкий металл – это:
1) цезий 2) ртуть 3) алюминий 4) железо
Составьте уравнения химических реакций согласно схеме:
Ca ---- CaO ---- Ca(OH)2 ----- CaCO3 ----- CaCl2
Тесты
А9 В каком ряду химические элементы расположены в порядке увеличения их атомного радиуса?
Na, Mg, Al 2) Al, Mg, Na
3) K, Na, Li 4) Mg, Be, Ca
А10 Металл, обладающий самой высокой пластичностью, - это:
1) золото 2) медь
3) серебро 4) алюминий
Составьте уравнения химических реакций согласно схеме:
Ca ---- CaO ---- Ca(OH)2 ----- CaCO3 ----- CaCl2
Интересно
Назовите семь чудес света и укажите, какую роль играли металлы в их создании
Проверь себя
В эпоху античности семью чудесами света считали египетские пирамиды, висячие сады Вавилона, статую Колосса Родосского, Храм Артемиды в Эфесе, статую олимпийского бога Юпитера, мавзолей в Галикариасе, Александрийский маяк.
В создании египетских пирамид играла немалую роль медь, т.к. для сооружения пирамиды использовались инструменты, изготовленные из меди.
Гигантская статуя Колосса Родосского была полностью изготовлена из бронзы.
Статуя Юпитера была частично сделана из золота: из благородного металла был изготовлен плащ Юпитера.
Новая тема
Почему щелочные и щелочноземельные металлы хранят под керосином? Почему литий, в отличие от натрия и калия, хранят в вазелине?
Щелочные и щелочноземельные металлы очень активны и реагируют практически со всем, с чем соприкасаются.
Например, на воздухе эти металлы легко окисляются. Если эти металлы хранить под слоем керосина, к которому они инертны, то можно уберечь от ненужных взаимодействий. Литий — самый легкий из металлов. Он легче керосина и в отличие от других металлов всплывает в нем, поэтому его хранят в вазелине.
Запомни!
В химических реакциях металлы выступают в роли восстановителей и повышают степень окисления, превращаясь из простых веществ в катионы.
Химические свойства металлов различаются в зависимости от химической активности металла. По активности в водных растворах металлы расположены в ряд напряжений.
Этот ряд впервые составил и изучил выдающийся украинский ученый Н. Н. Бекетов, поэтому у данного ряда есть еще одно название — ряд Бекетова.
Общие химические свойства металлов 11

Общая характеристика некоторых элементов
в связи с их положением в Периодической системе
Элемент ЕГЭ: 1.2.2. Общая характеристика металлов IA-IIIA групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. 1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа)… 1.2.4. Общая характеристика неметаллов IVA-VIIA групп…
1.2.2. Общая характеристика металлов IA-IIIA групп …
Все элементы IА–IIIА-групп Периодической системы относят к металлам (кроме бора). На внешнем энергетическом уровне эти элементы имеют не более трех электронов, что соответствует номеру группы, в которой они расположены.
Металлы IA-группы называют щелочными, так как при взаимодействии с водой они образуют щелочи. Металлы IIА-группы, за исключением бериллия и магния, называют щелочноземельными.
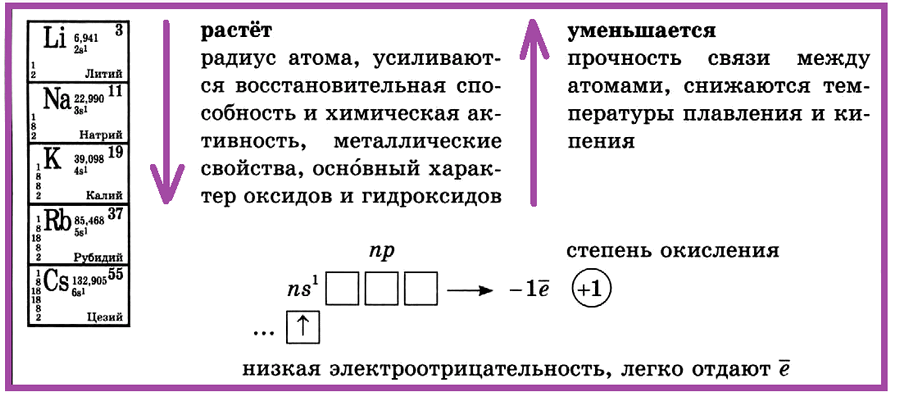
I группа, главная подгруппа —
щелочные металлы (литий, натрий, калий, рубидий, цезий).
I группа, главная подгруппа — щелочные металлы: литий, натрий, калий, рубидий, цезий. С увеличением порядкового номера в ПСХЭ растет радиус атома, усиливаются восстановительная способность и химическая активность, металлические свойства, основный характер оксидов и гидроксидов.
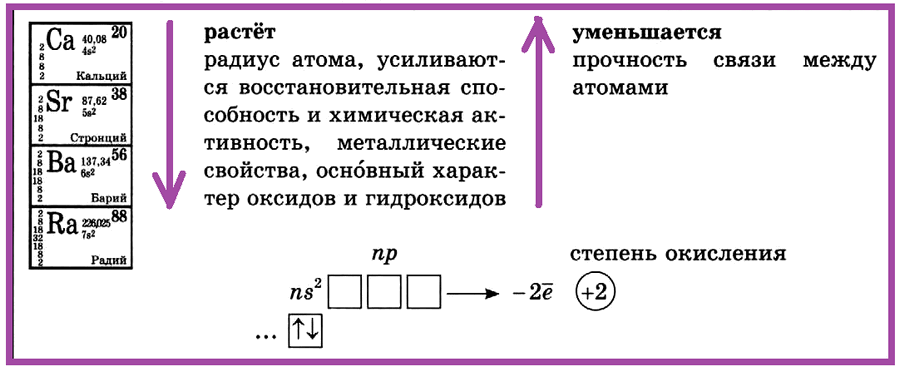
II группа, главная подгруппа —
щёлочноземельные металлы (кальций, стронций, барий, радий)
II группа, главная подгруппа — щёлочноземельные металлы: кальций, стронций, барий, радий. С увеличением порядкового номера в ПСХЭ растет радиус атома, усиливаются восстановительная способность и химическая активность, металлические свойства, оснОвный характер оксидов и гидроксидов.
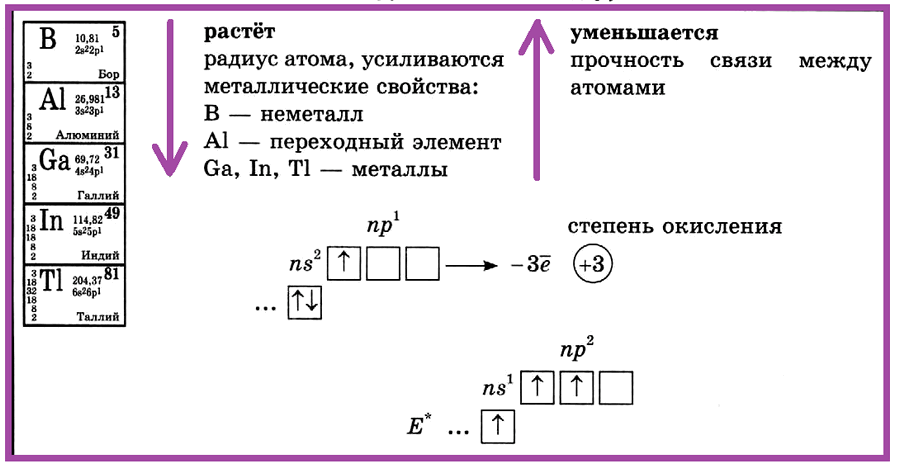
Элементы III группы главной подгруппы
(бор, алюминий, галлий, индий, таллий)
Элементы III группы главной подгруппы: бор, алюминий, галлий, индий, таллий. С увеличением порядкового номера в ПСХЭ растет радиус атома, усиливаются металлические свойства. В — неметалл, Аl — переходный элемент, Ga, In, Тl — металлы.
1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа) …
Понятие переходный элемент относится к d-элементам, занимающим переходное положение между s- и p-элементами. Они расположены в побочных подгруппах (группах IБ-VIIIБ). Все d-элементы являются металлами, валентные электроны которых расположены на ns- и (n–1)d-подуровнях, т.е. они имеют электронную конфигурацию: (n–1)d 1–10 ns 1–2 .
Химические свойства металлов

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
Cu, Hg, Ag, Pt, Au
Восстановительная способность металлов в свободном состоянии
Возрастает справа налево
Взаимодействие металлов с кислородом
Быстро окисляются при обычной температуре
Медленно окисляются при обычной температуре или при нагревании
Взаимодействие с водой
Выделяется водород и образуется гидроксид
При нагревании выделяется водород и образуются оксиды
Водород из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с концентрированными азотной и серной кислотами
С кислотами не реагируют, растворяются в царской водке
Взаимодействие с солями
Не могут вытеснять металлы из солей
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей
Взаимодействие с оксидами
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов
1. Общая характеристика элементов металлов
Из \(118\) известных на данный момент химических элементов \(96\) образуют простые вещества с металлическими свойствами, поэтому их называют металлическими элементами .
Металлические химические элементы в природе могут встречаться как в виде простых веществ, так и в виде соединений. То, в каком виде встречаются металлические элементы в природе, зависит от химической активности образуемых ими металлов.
Металлические элементы, образующие химически активные металлы ( Li–Mg ), в природе чаще всего встречаются в виде солей (хлоридов, фторидов, сульфатов, фосфатов и других).
Соли, образуемые этими металлами, являются главной составной частью распространённых в земной коре минералов и горных пород.


В растворённом виде соли натрия, кальция и магния содержатся в природных водах. Кроме того, соли активных металлов — важная составная часть живых организмов. Например, фосфат кальция Ca 3 ( P O 4 ) 2 является главной минеральной составной частью костной ткани.
Металлические химические элементы, образующие металлы средней активности ( Al–Pb ), в природе чаще всего встречаются в виде оксидов и сульфидов.


Металлические элементы, образующие химически неактивные металлы ( Cu–Au ), в природе чаще всего встречаются в виде простых веществ.
 |  |  |
| Рис. \(7\). Самородное золото Au | Рис. \(8\). Самородное серебро Ag | Рис. \(9\). Самородная платина Pt |
Исключение составляют медь и ртуть, которые в природе встречаются также в виде химических соединений.

В Периодической системе химических элементов металлы занимают левый нижний угол и находятся в главных (А) и побочных (Б) группах.
Рис. \(13\). Положение металлов в Периодической системе. Знаки металлических химических элементов расположены ниже ломаной линии B — Si — As — Te
В электронной оболочке атомов металлов на внешнем энергетическом уровне, как правило, содержится от \(1\) до \(3\) электронов. Исключение составляют только металлы \(IV\)А, \(V\)А и \(VI\)А группы, у которых на наружном энергетическом уровне находятся соответственно четыре, пять или шесть электронов.
В атомах металлов главных подгрупп валентные электроны располагаются на внешнем энергетическом уровне, а у металлов побочных подгрупп — ещё и на предвнешнем энергетическом уровне.
Радиусы атомов металлов больше, чем у атомов неметаллов того же периода. В силу отдалённости положительно заряженного ядра атомы металлов слабо удерживают свои валентные электроны.
Рис. \(14\). Характер изменения радиусов атомов химических элементов в периодах и в группах. Радиусы атомов металлов существенно больше, чем радиусы атомов неметаллов, находящихся в том же периоде
Главное отличительное свойство металлов — это их сравнительно невысокая электроотрицательность (ЭО) по сравнению с неметаллами.

Рис. \(15\). Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу). ОЭО металлических химических элементов уступает соответствующей величине неметаллических химических элементов
Атомы металлов, вступая в химические реакции, способны только отдавать электроны, то есть окисляться, следовательно, в ходе превращений могут проявлять себя в качестве восстановителей .
Читайте также: