Окисление металла при сварке
Обновлено: 30.06.2024
Выше (см. гл. 9) уже рассмотрено поведение отдельных компонентов сплавов и их влияние на качество получаемого металла шва. Однако в заключение надо сделать обобщение влияния на качество сварных соединений, так называемых «вредных» примесей, к которым относятся сера, фосфор, кислород, азот, водород, а в некоторых случаях н углерод.
Сера — всегда вредная примесь при сварке металлов, так как она образует относительно легкоплавкие эвтектики Me — — MeS, что создаст возможность образования «горячих» или кристаллизационных трещин в металле шва. Ее содержание в металле и в сварочных материалах всегда следует жестко лимитировать.
Снижение вредного влияния серы достигается ее переводом из сульфидов железа в сульфиды с более высокой температурой плавления (MnS; Гпл=1883 К; CaS; Г„л= 2273 К), с тем чтобы она не могла участвовать в процессе кристаллизации, образуя неметаллические включения, еще в жидком металле сварочной ванны (Гпл=1800 К).
Это достигается при введении в сварочную ванну достаточного количества марганца. Кальций вводят в металл ванны в виде силикокальция через электродные покрытия или порошковую проволоку.
Общее снижение содержания серы в металле при сварке возможно при сильно основных шлаках. Бескислородные фто - ридные флюсы также способствуют удалению серы из металла в результате образования летучих фторидов металла (FeF2, FeF3) и твердых сульфидов:
CaFs + FeS-^CaS + FeFst.
Сера удаляется при электрошлаковой сварке и переплаве металлов.
Фосфор — почти всегда вредная примесь в металлах, снижающая их пластичность. Так, при кристаллизации стали фосфор образует ряд соединений с железом (БезР, Fe2P, FeP и FeP2), отличающихся своей хрупкостью, кристаллы которых могут стать зародышами холодных трещин. Содержание фосфора в металле шва при дуговой сварке понизить практически не удается, так как он удаляется в окислительных шлаках, а сварочные шлаки — восстановительные. Концентрация фосфора в шве снижается только при электрошлаковой сварке.
При сварке медных сплавов фосфор не представляет собой вредную примесь, так как он способен раскислять металл, образуя летучий оксид Р2О5:
5Cu20 + 2Cu3P-> 16Cu + P205f.
Кислород — вредная примесь в металле при сварке, снижающая пластические свойства металла, поэтому при всех видах сварки предусматривается процесс раскисления металла шва до допустимой нормы. При сварке металлов высокой активности (Al, Ti, Zr) следует создавать бескислородную атмосферу — аргон, гелий, вакуум, галидные флюсы, так как раскислителей для таких металлов подобрать нельзя.
Однако при сварке конструкционных сталей следует сохранять некоторую окисленность металла для уменьшения растворимости водорода.
Азот поглощается металлом сварочной ванны из атмосферы дугового промежутка, в котором он находится в основном в атомарном и частично в ионизированном состояниях. Растворимость азота в жидком металле выше, чем в твердом, и в процессе кристаллизации металла шва он может выделяться в газообразном состоянии, образуя поры.
При кристаллизации металла сварочной ванны азот образует почти со всеми металлами соединения — нитриды различной степени устойчивости (см. рис. 9.33). Особенно устойчивые нитриды образуют ^-металлы IVB, VB, VIB групп периодической системы. Нитриды железа Fe4N, Fe2N образуют очень хрупкие игольчатые кристаллы, разрушение которых приводит к зарождению холодных трещин (замедленное разрушение). Из промышленных металлов только медь не дает устойчивых нитридов и поэтому ее можно сваривать в атмосфере азота (см. п. 10 3).
Однако азот не всегда представляет собой вредную примесь и в некоторых сталях аустенитного класса содержание его доводят до 0,3. 0,4%.
Водород при сварке — всегда вредная примесь («водородная хрупкость»).
Источники водорода при сварке металлов: 1) водород, поглощенный металлом из атмосферы дугового разряда, и 2) водород, растворенный в основном металле.
Водород, поглощенный из атмосферы дугового разряда, в которой он находится в атомарном и в ионизированном состояниях, при кристаллизации резко понижает свою растворимость и, выделяясь из металла, вызывает возникновение пор и трещин.
Водород, содержащийся в основном металле, может находиться в состоянии твердого раствора внедрения — диффузионно-подвижный водород, а также находиться в связанном состоянии — гидридный водород. Водород в молекулярном состоянии находится в микронесплошностях металла.
Диффузионно-подвижный водород может перемещаться в металле в результате концентрационной или термической диффузии, создающейся вследствие градиента температур. Последний вид диффузии описывается уравнением
Технология сварки высоколегированных аустенитных сталей и сплавов

Высоколегированные аустенитные стали и сплавы обладают комплексом положительных свойств. Поэтому одну и ту же марку стали иногда можно использовать для изготовления изделий различного назначения, например коррозионно-стойких, хладостойких, жаропрочных и т.д. В связи с этим и требования к свойствам сварных соединений будут различными. Это определит и различную технологию сварки (сварочные материалы, режимы сварки, необходимость последующей термообработки и т.д.), направленную на получение сварного соединениях необходимыми свойствами, определяемыми составом металла шва и его структурой.
Характерные для высоколегированных сталей теплофизические свойства определяют некоторые особенности их сварки. Пониженный коэффициент теплопроводности при равных остальных условиях значительно изменяет распределение температур в шве и околошовной зоне (рис. 1). В результате одинаковые изотермы в высоколегированных сталях более развиты, чем в углеродистых. Это увеличивает глубину проплавления основного металла, а с учетом повышенного коэффициента теплового расширения возрастает и коробление изделий.
Поэтому для уменьшения коробления изделий из высоколегированных сталей следует применять способы и режимы сварки, характеризующиеся максимальной концентрацией тепловой энергии. Примерно в 5 раз более высокое, чем у углеродистых сталей, удельное электросопротивление обусловливает больший разогрев сварочной проволоки в вылете электрода или металлического стержня электрода для ручной дуговой сварки. При автоматической и полуавтоматической дуговой сварке следует уменьшать вылет электрода и повышать скорость его подачи. При ручной дуговой сварке уменьшают длину электродов и допустимую плотность сварочного тока.
Одна из основных трудностей при сварке рассматриваемых сталей и сплавов - предупреждение образования в швах и околошовной зоне горячих трещин. Предупреждение образования этих дефектов достигается:
1) Ограничением (особенно при сварке аустенитных сталей) в основ ном и наплавленном металлах содержания вредных (серы, фосфора) и ликвирующих (свинца, олова, висмута) примесей, а также газов - кислорода и водорода. Для этого следует применять режимы, уменьшающие долю основного металла в шве, и использовать стали и сварочные материалы с минимальным содержанием названных примесей. Техника сварки должна обеспечивать минимальное насыщение металла шва газами. Этому способствует применение для сварки постоянного тока обратной полярности. При ручной сварке покрытыми электродами следует поддерживать короткую дугу и сварку вести без поперечных колебаний. При сварке в защитных газах, предупреждая подсос воздуха, следует поддерживать коротким вылет электрода и выбирать оптимальными скорость сварки и расход защитных газов. Необходимо также принимать меры к удалению влаги из флюса и покрытия электродов, обеспечивая их необходимую прокалку. Это уменьшит также вероятность образования пор, вызываемых водородом;
2) Получением такого химического состава металла шва, который обеспечил бы в нем двухфазную структуру. Для жаропрочных и жаростойких сталей с малым запасом аустенитности и содержанием никеля до 15 % это достигается получением аустенитно-ферритной структуры с 3 . 5 % феррита. Большее количество феррита может привести к значительному высокотемпературному охрупчиванию швов ввиду их сигматизации. Стремление получить аустенитно-ферритную структуру швов на глубокоаустенитных сталях, содержащих более 15 % Ni, потребует повышенного их легирования ферритообразующими элементами, что приведет к снижению пластических свойств шва и охрупчиванию ввиду появления хрупких эвтектик, а иногда и ?-фазы.
Поэтому в швах стремятся получить аустенитную структуру с мелкодисперсными карбидами и интерметаллидами. Благоприятно и легирование швов повышенным количеством молибдена, марганца и вольфрама, подавляющих процесс образования горячих трещин. Количество феррита в структуре швов на коррозионно-стойких сталях может быть повышено до 15 . 25 %. Высоколегированные стали содержат в качестве легирующих присадок алюминий, кремний, титан, ниобий, хром и другие элементы, обладающие большим сродством к кислороду, чем железо. Поэтому при наличии в зоне сварки окислительной атмосферы возможен их значительный угар, что может привести к уменьшению содержания или к полному исчезновению в структуре шва ферритной и карбидной фаз, особенно в металле с небольшим избытком ферритизаторов.
Для сварки рекомендуется использовать неокислительные низкокремнистые, высокоосновные флюсы (фторидные) и покрытия электродов (фтористокальциевые). Сварка короткой дугой и предупреждение подсоса воздуха служит этой же цели. Азот - сильный аустенитизатор, способствует измельчению структуры за счет увеличения центров кристаллизации в виде тугоплавких нитридов. Поэтому азотизация металла шва способствует повышению их стойкости против горячих трещин.
Высокоосновные флюсы и шлаки, рафинируя металл шва и иногда модифицируя его структуру, повышают стойкость против горячих трещин. Механизированные способы сварки, обеспечивая равномерное проплавление основного металла по длине шва и постоянство термического цикла сварки, позволяют получить и более стабильные структуры на всей длине сварного соединения;
3) Применением технологических приемов, направленных на изменение формы сварочной ванны и направления роста кристаллов аустенита. Действие растягивающих сил, перпендикулярное направлению роста столбчатых кристаллов, увеличивает вероятность образования горячих трещин (рис. 2). При механизированных способах сварки тонкими электродными проволоками поперечные колебания электрода, изменяя схему кристаллизации металла шва, позволяют уменьшить его склонность к горячим трещинам;
4) Уменьшением силового фактора, возникающего в результате термического цикла сварки, усадочных деформаций и жесткости закрепления свариваемых кромок. Снижение его действия достигается ограничением силы сварочного тока, заполнением разделки швами небольшого сечения и применением соответствующих конструкций разделок. Этому же способствует хорошая заделка кратера при обрыве дуги. Кроме перечисленных общих особенностей сварки высоколегированных сталей и сплавов, есть специфические особенности, определяемые их служебным назначением. При сварке жаропрочных и жаростойких сталей обеспечение требуемых свойств во многих случаях достигается термообработкой (аустенизацией) при температуре 1050 . 1110 °С, снимающей остаточные сварочные напряжения, с последующим стабилизирующим отпуском при температуре 750 . 800 °С. При невозможности термообработки сварку иногда выполняют с предварительным или сопутствующим подогревом до температуры 350 . 400 °С. Чрезмерное охрупчивание швов за счет образования карбидов предупреждается снижением содержания в шве углерода. Обеспечение необходимой окалиностойкости достигается получением металла шва, по составу идентичного основному металлу. Это же требуется и для получения швов стойких к общей жидкостной коррозии.
При сварке коррозионно-стойких сталей различными способами для предупреждения МКК не следует допускать повышения в металле шва содержания углерода за счет загрязнения им сварочных материалов (графитовой смазки проволоки и т.д.), длительного и многократного пребывания металла сварного соединения в интервале критических температур.
В связи с этим сварку необходимо выполнять при наименьшей погонной энергии, используя механизированные способы сварки, обеспечивающие непрерывность получения шва. Повторные возбуждения дуги при ручной сварке, вызывая нежелательное тепловое действие на металл, могут вызвать появление склонности его к коррозии. Шов, обращенный к агрессивной среде, по возможности следует сваривать в последнюю очередь, чтобы предупредить его повторный нагрев, последующие швы в многослойных швах - после полного охлаждения предыдущих. Следует принимать меры к ускоренному охлаждению швов. Брызги, попадающие на поверхность основного металла, могут быть впоследствии очагами коррозии. Следует тщательно удалять с поверхности швов остатки шлака и флюса, так как взаимодействие их в процессе эксплуатации с металлом может повести к коррозии или снижению местной жаростойкости.
Для повышения стойкости швов к межкристаллитной коррозии и создания в их металле аустенитно-ферритной структуры при сварке их обычно легируют титаном или ниобием. Однако титан обладает высоким сродством к кислороду и поэтому при способах сварки, создающих в зоне сварки окислительную атмосферу (ручная дуговая сварка, сварка под окислительными флюсами), выгорает в количестве 70 . 90 %. Легирование швов титаном возможно при сварке в инертных защитных газах, при дуговой и электрошлаковой сварке с использованием фторидных флюсов. В металле швов содержание титана должно соответствовать соотношению Ti/C > 5. Ниобий при сварке окисляется значительно меньше и его чаще используют для легирования шва при ручной дуговой сварке. Его содержание в металле шва должно соответствовать Nb/C > 10. Однако он может вызвать появление в швах горячих трещин.
Газовая сварка обеспечивает большую зону разогрева, значительный перегрев расплавленного металла и замедленное охлаждение. При этом происходит значительный угар легирующих элементов. Она наименее благоприятна для сварки этих особенно кислотостойких сталей, в которых может развиваться значительная межкристаллитная коррозия. Газовая сварка может использоваться для сварки жаропрочных и жаростойких сталей толщиной 1 . 2 мм. Сварка ведется нормальным пламенем с мощностью пламени 70 . 75 л/ч на 1 мм толщины. Процесс следует вести с возможно большей скоростью левым способом, мундштук держать под углом 45° к поверхности. В сварных соединениях образуются большие коробления.
Ручная дуговая сварка это высокоманевренный способ. При сварке высоколегированных сталей сварочные проволоки одной по ГОСТу марки имеют достаточно широкий допуск по химическому составу. Различие типов сварных соединений, пространственного положения сварки и т.п. способствует изменению глубины проплавления основного металла, а также изменению химического состава металла шва. Все это заставляет корректировать состав покрытия с целью обеспечения необходимого содержания в шве феррита и предупреждения, таким образом, образования в шве горячих трещин. Этим же достигаются и необходимая жаропрочность и коррозионная стойкость швов.
Применением электродов с фтористокальциевым покрытием, уменьшающим угар легирующих элементов, достигается получение металла шва с необходимым химическим составом и структурами. Уменьшению угара легирующих элементов способствует и поддержание короткой дуги без поперечных колебаний электрода. Это снижает вероятность появления дефектов на поверхности основного металла в результате попадания на него брызг.
Тип покрытия электрода диктует необходимость применения постоянного тока обратной полярности (при переменном или постоянном токе прямой полярности дуга неустойчива). Тщательная прокалка электродов, режим которой определяется их маркой, способствует уменьшению вероятности образования в швах пор и вызываемых водородом трещин. Некоторые данные о режимах и выборе электродов для ручной дуговой сварки приведены в табл. 1 и 2, а о свойствах сварных соединений - в табл. 3 и на рис. 3.
Табл. 1 Ориентировочные режимы ручной дуговой сварки аустенитных сталей
№83 Окисление и раскисление металла при сварке

При сварке на воздухе расплавленный металл окисляется атомарным и ионным свободным или связанным кислородом.
Просмотр содержимого документа
«№83 Окисление и раскисление металла при сварке»
Окисление и раскисление металла при сварке.
При сварке на воздухе расплавленный металл окисляется атомарным и ионным свободным или связанным кислородом. Свободным называют кислород, который получается в зоне дуги из атмосферы воздуха; связанным — кислород, находящийся в оксиде, например SiО2.
При сварке стали в значительном количестве окисляется железо, например
[Fe] + ( 1 ⁄2 О2) → [FeO], где квадратными скобками (как принято в теории металлургических процессов) обозначены вещества в металлическом, а круглыми — в шлаковом расплаве. В результате реакции получается низший оксид железа — закись железа FeO.
В сварочном расплаве закись железа растворяется в железе меньше, чем в сталеплавильной печи, что объясняется, прежде всего, малым промежутком времени, в течение которого происходит окисление и растворение компонентов при сварке.
При охлаждении сварочной ванны происходит обратное явление: закись железа (или отрицательные ионы кислорода) выпадают из раствора, так как их растворимость уменьшается со снижением температуры. Скорость охлаждения металла в сварочной ванне влияет на количество выпавшей закиси железа из раствора. При относительно низких скоростях охлаждения закись железа полностью выпадает из раствора и располагается по границам зерен как более легкоплавкий компонент, затем при дальнейшем охлаждении ниже 570°С свободная закись железа преобразуется в более высший оксид железа Fe2О4(4FeО → Fe3О4 + Fe) в виде глобулей (шлаковых шариков), которые нарушают прочную связь между зернами и вызывают красноломкость металла, а при комнатной температуре — хрупкость.
Кроме оксида железа металл шва засорен и другими оксидами, образующимися от окисления других элементов, например Mn, Si, С.
Окисление марганца, кремния и углерода свободным кислородом протекает по формулам:
Улучшение прочностных свойств стали достигается восстановительным процессом, называемым раскислением.
Различают осаждающее и диффузионное раскисление.
Сущность осаждающего раскисления сводится к тому, что железо восстанавливается из растворенной закиси железа металлом, обладающим более высоким химическим сродством к кислороду и дающим оксид с очень малой растворимостью в железе. Химическая реакция осаждающего раскисления
[FeO] + (Ме) → [Fe] + (МеО).
Оксид МеО выпадает при охлаждении из раствора в виде отдельной фазы (шлаковой частицы), всплывает на поверхность сварного шва и образует совместно с другими оксидами сварочный шлак.
В качестве осаждающих раскислителей при сварке применяют чистые материалы (С, Аl), ферросплавы (ферромарганец, ферросилиций, ферротитан и др.), комплексные раскислители (сплавы, содержащие два раскисляющих элемента и более одновременно).
При подборе раскислителя учитывают его раскислительную способность. Например, при раскислении большим количеством углерода в процессе затвердевания расплава в шве могут от раскисления оставаться газы СО и СО2, образуя в швах поры:
Чтобы этого не было, нужно иметь остаточного кислорода такое количество, которое обеспечивало бы кристаллизацию без излишнего количества газовыделений.
Стремятся также к тому, чтобы продукты раскисления равномерно распределялись в металле шва.
Содержание азота или его вредное влияние в металле шва можно снизить при раскислении и введением в металл химических элементов, образующих с азотом нерастворимые в жидком металле нитриды, которые в лучшем случае поднимаются из металла шва в сварочный шлак, а в худшем случае — остаются в металле шва с незначительным ухудшением механических свойств. Например, алюминий, применяемый для раскисления железа, соединяется со свободным азотом, образуется нитрид алюминия Аl + N → A1N, который из сварочной ванны удаляется в шлаковую фазу.
При пользовании несколькими раскислителями подбирают их так, чтобы продуктами раскисления являлись бы основные, кислотные и амфотерные оксиды. Эти оксиды, соединяясь между собой, быстрее поднимаются вверх (в сварочный шлак) и не оказывают вредного влияния.
Сущность диффузионного раскисления состоит в том, что для удаления закиси железа из металлического расплава пользуются такими сварочными материалами (покрытием, флюсом, порошком), при плавлении которых образуются сложной структуры шлаки, восстановительные шлаки. Принципиальная химическая реакция диффузионного раскисления [FeO] + (SiО2) → (SiО2 · FeO).
В качестве минералов для диффузионного раскисления пользуются такими, в которых содержится малое количество оксидов основного металла.
При сварке сталей раскисление железа и других химических элементов стали обязательно, так как при существующей технологии в металле шва кислорода может оказаться больше, чем в свариваемом металле.
Окисление металлов при сварке
Высокие температуры, используемые при сварке плавлением, с одной стороны, понижают термодинамическую устойчивость оксидов, как это было показано в п. 9.2, но, с другой стороны, скорость их образования резко увеличивается и за очень небольшое время сварочного цикла металлы поглощают значительное количество кислорода. Поглощенный кислород может находиться в металле или в растворенном состоянии в виде оксидов (обычно низшей степени окисления), или субоксидов (ТІбО, ТізО, Ті20), а также может создавать неметаллические включения эндогенного типа, образовавшиеся при раскислении металла более активными элементами. И то, и другое резко снижает качество сварных соединений, особенно пластичность металла шва. Исследования этого вопроса показали, что основная масса кислорода в металле обычно находится в неметаллических включениях [20]. Источниками кислорода в металле при сварке служат окислительно-восстановительные реакции между металлом и атмосферой сварочной дуги, металлом и шлаками, образующимися в результате плавления флюсов или при разложении и плавлении компонентов электродного покрытия, а также при взаимодействии с наполнителями порошковой проволоки.
Особенно велики скорости взаимодействия металла с окружающей средой в высокотемпературной зоне сварки (см. п. 8.6), к которой следует отнести каплю плавящегося металла на торце электрода илн электродной проволоки, дуговой или плазменный разряд и переднюю часть ванны. Более медленно эти процессы развиваются в хвостовой части ванны, так как там температура приближается к температуре кристаллизующегося металла. Температурный перепад между этими зонами настолько велик,
что реакции окисления — восстановления меняют свое направление (см. п. 8.4). Так, в капле плавящегося на электроде металла происходит интенсивное поглощение кремния и марганца в результате окисления железа, в то время как в хвостовой части сварочной ванны кремний и марганец восстанавливают железо, окисляясь сами.
Кроме того, взаимодействие металла с кислородом при сварке осложняется образованием растворов оксидов в металлах, а это сильно изменяет их термодинамическую устойчивость из-за возрастания энтропии в процессе растворения.
ОКИСЛЕНИЕ МЕТАЛЛОВ В РАСТВОРАХ
Все промышленно важные металлы растворяют свои оксиды, образуя жидкие растворы, а некоторые образуют с ними твердые растворы, но обычно в очень малых концентрациях.
Процесс диссоциации оксида металла в растворе может быть выражен уравнением (квадратные скобки обозначают раствор в металле) 2[МеО] *=±2 [Me] + 02|, где [МеО] —оксид металла, растворенный в металле.
Этот процесс в ненасыщенных и насыщенных растворах реализуется различно, как показано на рис. 9.5, а, б.
Для ненасыщенного раствора (рис, 9.5, а) число степеней свободы будет С = 2 + 2 — 2 — 2 или р^ = f(T, х), где х — состав ненасыщенного раствора (обозначение р'02 введено для давления диссоциации, зависящего не только от температуры, но и концентрации раствора). Таким образом, р^ не может уже рассматриваться как константа равновесия, зависящая только от температуры, но эта величина будет определять энергию Гиббса, соответствующую данной системе:
Принимаем, что Кц — К; = Кр при ро = 1.
Для насыщенного раствора (рис. 9.5, б), в котором появляется еще одна фаза — избыток растворяемого вещества, число степеней свободы будет
POl=f(T) Xmc = fl(T), а энергия Гиббса будет равна
Р, т, к р, т, хнас~?(Т)
Рнс 9 5. Схема взаимодействия металла с кислородом в ненасыщенном (а) и насыщенном (б) растворах
Следовательно, один и тот же процесс окисления металла может развиваться в насыщенном и ненасыщенном растворе по-разному.
Поведение растворенного вещества в растворе определяется его активностью, а не массовой концентрацией, так как растворенное вещество взаимодействует с растворителем, образуя комплексы переменного состава, а его молекулы могут также взаимодействовать друг с другом. Активность растворенного вещества может быть представлена уравнением
где a, — активность компонента в растворе; у, — коэффициент активности — величина, как правило, меньшая единицы; А, — молярная доля или безразмерная концентрация.
В разбавленных растворах (малой концентрации) коэффициент активности стремится к единице. Металлы обычно очень ограниченно растворяют свои оксиды, а оксиды других металлов практически не растворяют.
Для насыщенного раствора (рис. 9.5, б) напишем уравнение, аналогичное выражению (9.7) :
CLнас^^ У насА Нао (9-8)
В насыщенном растворе, концентрация которого определяется только температурой, активность растворенного вещества условно можно принять за единицу, так как оно находится в равновесии со свободной фазой растворенного вещества, и, принимая также уі = у»ао можно записать отношение
Тогда при условии ненасыщенности раствора оксида металла в металле можно написать константу равновесия так:
Кр = Ро2 = Ро2(аме/амео)> (9.10)
где аще~ Аме/Аме вас; амео = Амео/Амео нас в соответствии с формулой (9.9).
Отсюда видно, что давление диссоциации ро2 представляет собой функцию концентрации раствора при условии постоянной температуры.
Выразим эту зависимость через расчетные термодинамические функции (AG0):
Ро2 = Ро2(аМео/ аМе) (9.11)
AG = AG0+2і? ПпаМе-—2i? TlnaMeo (9-12)
Если аМео-*"1 и аме-*"1> то Ро2^Ро2> 3 AG->-AG0, но если амео—>-0, что соответствует чистому металлу, не содержащему в себе оксида, то
Ро2 = 0, а AG —оо. (9.13)
Таким образом, можно сделать вывод, что нельзя получить металл чистым по кислороду в условиях равновесных металлургических процессов.
ПОНЯТИЕ О СИСТЕМАХ МЕТАЛЛ - КИСЛОРОД
Рассмотрим взаимодействие наиболее важных промышленных металлов с кислородом. В сварочной технике наиболее часто встречаются сплавы на основе железа — стали самых разнообразных марок и назначений. Общий объем сварных конструкций из стали исчисляется десятками миллионов тонн.
Медь и ее сплавы сваривают в очень небольших объемах, так как медь — дефицитный цветной металл. Сварные изделия из меди необходимы в электротехнической промышленности, в химическом, энергетическом и общем машиностроении. В последнее время непрерывно увеличивается производство сварных конструкций из титана и его сплавов, из алюминия и его сплавов, а также из тугоплавких металлов, таких как вольфрам и молибден.
Система железо — кислород. Железо может проявлять в своих соединениях степень окисления от +6 до +2. Оксид Fe03, образованный ковалентными полярными связями, обладает кислотными свойствами, неустойчив и при сварке образоваться не может. Оксид Fe203 — соединение со смешанными связями, ам - фотерное — образует соли (ферриты). В природе Fe203 встречается в виде железной руды — гематита, или если он гидратирован, то в виде (РегОз-ШО), бурого железняка или гетита.
При высоких температурах Fe203 разлагается
ЗРезОз 2Fe304 -)- 1 /202,
при температуре 1725 К давление кислорода будет 105 Па. Феррит железа Fe304 = Fe(Fe02)2— очень устойчивое соединение. Встречается в природе в виде магнетита — железной руды. При температурах выше 845 К Fe304 разлагается
2Fe304 ^6Fe0 + 02f; lg po2 = - 32 056/Г + lg T + 14,55;
при температурах ниже 845 К реакция идет сразу до железа:
Рис. 9.6. Нонвариат* ная система железа, его оксидов и кислорода
1/2Fe304 ^3/2Fe + 02t; lgp02= - 28 264/7" + lg T + 10,076. (9.15)
Основной оксид железа FeO легко окисляется и переходит, поглощая кислород, в Fe304 и потом в Fe203. При температурах выше 845 К оксид может разлагаться до железа:
2Fe0^2Fe + 02f; lgPo!=- 26 868/7’ + lg7’ + 8,4. (9.16)
Оксиды железа при Т = 845 К образуют нонвариантную систему (рис. 9.6) Fe304; FeO; Fe; Ог, существующую при строго определенных параметрах состояния (Г = 845 К; lgрог = = — 20,48).
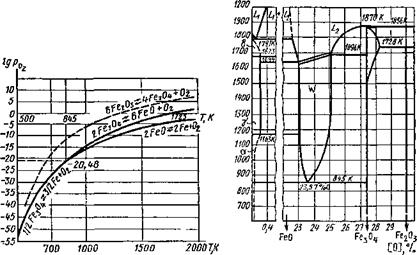
Рис. 9.7. Зависимость логарифма давления Рис. 9.8. Диаграмма плавкости сис-
диссоциации оксидов железа от темпера - темы Fe—О (массовые доли)
Уравнения (9.14). (9.16) приведены по В. А. Кистяковскому, и совместным решением этих уравнений можно определить параметры нонвариантной системы.
Кривые давлений диссоциации по этим уравнениям приведены на рис. 9.7, но эти кривые характерны для насыщенных растворов. Области между кривыми характеризуют ненасыщенные растворы, которые могут существовать в системе железо — кислород в зависимости от температуры и концентрации кислорода. Такими фазами в системе железо — кислород будут:
L — жидкий раствор FeO в железе, предельную концентрацию можно определить по уравнению Н. Н. Доброхотова:
lg[% FeO]Hac= - 6000/Г + 3,36; (9.17)
Z.2 — жидкий раствор FeO в Fe3C4( ликвирующий с раствором L,
6 — твердый раствор FeO в 6-железе;
у — твердый раствор FeO в у-железе (оксиаустенит);
а — твердый раствор FeO в а-железе;
W—твердый раствор FeO в Fe304, образующийся при кристаллизации L2 и существующий при температуре выше 845 К — вюстит.
Все эти фазы представлены на диаграмме плавкости системы Fe—О, которая приведена на рис. 9.8.
Наибольшее значение для металлургических процессов при сварке имеет область L, соответствующая сварочной ванне, поглощающей кислород. Она отделена от остальной сисемы линией, уравнение которой (9.17) приведено выше.
Процессы в этой области: 2[FeO] 2[Fe] + 02f.
раствор раствор газ
Константа равновесия может быть записана так:
Кр = Рсъ = p'oftlc/a FeO = f (7), (9.18)
где рЬг—давление диссоциации, зависящее не только от температуры, но и концентрации кислорода; po,— давление диссоциации для насыщенного раствора, зависящее только от температуры (AG0 = — RT In р02); aFe и aFe0 — активности компонентов раствора (см. рис. 9.7).
Ввиду малой растворимости оксида железа в жидком железе [уравнение (9.17)] можно записать:
aFe = Nfz jNve«ас « [% Fe] / [% Fe]Hac « 1; aFeo = /Vrco/AVeo нас « [% FeO] / [% FeO]пае.
Подставляя эти значения в уравнение константы равновесия, получим
Ке = Ро2 = р'о, [ % FeO] V [ % FeO]2. (9..19)
По формуле (9.19) можно найти энергию Гиббса для этого случая:
р'ог = Рог [% FeO]2/[% FeO] „ас;
AG = — RT In p'o, = AG° + 2RT In [% FeO] sac — 2RT ln[%FeO].
Из полученных уравнений видно, что при [% FeO] -»- —>- О p'os —>- 0, а AG-voo, т. е. при любых малых концентрациях кислорода в газовой атмосфере жидкое железо будет его поглощать, окисляясь при этом, из-за чего в процессе сварки стали
любым способом не можем избежать окисления металла шва^и
Рис. 9.9. Нонвари - антная система меди, ее оксидов и
должны принимать дополнительные меры для снижения содержания кислорода до допустимых пределов — раскисление.
Система медь — кислород. Медь с кислородом образует в основном два соединения: куприт Си20 и тенорит СиО, которые вместе с кислородом и металлической медью образуют при Т « 650 К нонвариантную систему (рис. 9.9). Медь — малоактивный металл и его оксиды относительно легко распадаются. Наиболее устойчивый оксид — Си20, образующий растворы в жидкой меди:
4Си + 02 ї=ї 2[Си20].
КИСЛОрОДа жидк. раствор
В растворе он повышает свою устойчивость, но в момент кристаллизации образуется эвтектика Си—Си20 и свободная фаза Си20 теряет свою устойчивость. «Водородная болезнь» меди, приводящая к разрушению металла, вызывается следующим процессом:
2 [Н] + Си20 2Си + Н20.
Водород, растворенный в металле, взаимодействует с Си20, находящимся в эвтектике, и восстанавливает его до Си, но образующаяся при этом вода не может диффундировать в металл и разрушает его по границам зерен.
Диаграмма плавкости Си—О приведена на рис. 9.10. На диаграмме область L указывает на образование раствора Си20 — Си, но растворимость Си20 в твердой фазе ничтожно мала. Таким образом, при сварке меди и ее сплава необходимо принимать все меры для снижения степени ее окисления или вводить раскислители (см. п. 9.4).
Система никель — кислород. Никель с кислородом дает два соединения: №20з и NiO; Г4і20з малоустойчив, сильный окислитель и используется для получения электрической энергии в щелочных аккумуляторах. В условиях сварки он не может существовать.
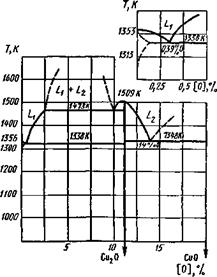
Рис. 9.10. Диаграмма плавкости системы Си — О (массовые доли)
Рис. 9.11. Диаграмма плавкости системы Ni — О (массовые доли)
Оксид NiO устойчивый, обладает основными свойствами, сильно растворим в жидком никеле, а в твердом никеле почти не растворяется. Диаграмма плавкости Ni—О приведена на рис. 9.11.
Процессы окисления при сварке для никеля рассчитывают так же, как для железа и меди, с учетом активности оксида в растворе.
Система титан — кислород. Титан с кислородом образует ряд осидов с различной степенью окислення: ТіО; Ті203; Ті305; Ті02, а также ряд субоксидов: Ті20; ТізО; ТібО. Кроме того, кислород может растворяться в твердом металле. Оксиды, особенно низшей степени окисления, обладают большой шириной области гомогенности. На рис. 9.12 приведена фазовая диаграмма оксидов титана, в которой заштрихованные участки представляют собой двухфазные области. Диаграмма плавкости Ті—О для малых концентраций кислорода приведена на рис. 9.13 (по И. И. Корнилову). Титан — весьма активный металл и его оксиды все термодинамически устойчивы, наиболее устойчив низший оксид ТЮ, повышающий свою устойчивость при растворении в жидком титане. Процессы диссоциации оксидов титана идут ступенчато:
Графики изменения значений AG0 в зависимости от температуры приведены на рис. 9.14, уравнения стандартного изменения энергии Гиббса по стандартным значениям энтальпий и энтропий приведены ниже:
6ТЮ2 ^ 2Ti305 - f 02f; AG° = 745 960-162,28 Т (кривая 1);
4Ti305 ^ 6Ti203 + 02f; AG° = 724 200-160,12 T (кривая 2);
2Ti2(W4TiO + 02f; AG° = 963 200-186,88 T (кривая 3);
2ТіО^* 2Ti + 02f; AG° = 1 036 780-196,54 T (кривая 4);
4Ti02 ^ 2Ti203 + Out; AG° = 718 400-159,96 T (кривая 5);
Атомов кислорода на атом титана
0 0,2 0А 0,6 0,8 1,0 1,2 1,ц 1,6 1,8 2,0
1- Г~1-- 1- 1-- 1-- 1- 1--- 1- 1-- 1---- 1----- 1---- 1 і - 1--------- 1 1 1 rn
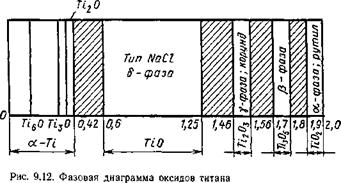
Рис. 9.13. Диаграмма плавкости системы Ті—О (атомные доли) для малых содержаний кислорода
Рис. 9.14. Изменение AG0 для ступенчатой диссоциации окси-і дов титана
2500 2300 2/00 то то
Система алюминий — кислород. Алюминий образует один оксид А1203 (корунд) и два субоксида АЮ и А120, но субоксиды крайне неустойчивы. Корунд А1203 образует ряд гидратов и проявляет изоморфизм:
А1203 • ЗН20 -^ткА1203 • Н20 -§Z§5. v. А120з - ІШ*. а-А120з
гидраргилит бемит у корунд а корунд
Наиболее устойчивая форма оксида алюминия — а-корунд; А120з — амфотерный оксид, образующий соли как в кислой, так и в щелочной среде, чем пользуются при подготовке к сварке, протравливая поверхности соединяемых деталей и электродной проволоки._ Субоксиды алюминия получаются при сплавлении А120з с алюминием:
А1203 + А1 ^ ЗАЮ (71 = 1773 К);
А1203 + 4А1 ^ ЗА120 (Т = 1873 К) -
Оксиды алюминия не растворяются в металле и при поглощении кислорода при сварке образуют или пленки оксидов, или просто включения А1203. И то и другое сильно понижает качество сварных соединений.
ТЕОРИЯ сварочных процессов
Граничные условия
Чтобы решить дифференциальное уравнение теплопроводности, необходимо задать распределение температур в начальный момент времени (начальное условие) и условия взаимодействия тела с окружающей средой на его границах (граничные условия). Начальное условие определяется …
Основные допущения и упрощения, принятые в классической теории распространения теплоты при сварке
На современном уровне развития математики аналитическое решение уравнения теплопроводности в общем виде (5.21) еще не найдено, однако при введении некоторых допущений и упрощений можно получить пригодные для практического использования частные …
Дифференциальное уравнение теплопроводности
Сложный процесс изменения температуры точек тела с координатами jc, у, z во времени t описывается дифференциальным уравнением теплопроводности. Для вывода этого уравнения необходимо рассмотреть баланс теплоты в некотором элементарном объеме …
Основные реакции в зоне сварки
Рассмотрим основные реакции в зоне сварки, характерные для стали, как наиболее распространенного в промышленности металла. Особенности процессов, протекающих при сварке других металлов и сплавов, будут рассматриваться при описании технологии сварки этих сплавов. __________ —*
При сварке стали одной из главных задач является получение расплавленного металла, по возможности свободного от примесей кислорода, азота, водорода и серы.
''Кислород является наиболее вредной примесью, так как окисляет расплавленный металл, образуя химические соединения — окислы.
Если окислы растворимы в жидком металле, то они поглощаются последним, образуя с ним при затвердевании твердый раствор. Нерастворимые окислы выделяются из затвердевшего металла, переходя в шлак. Часть нерастворимых окислов остается в металле шва в виде включений шарообразной формы (так называемых глобул) или, располагаясь по границам зерен, нарушает сцепление их между собой.
С железом кислород образует три окисла:
закись железа по реакции 2 Fe-f - 02^±2 Fe О; окись железа по реакции 3 Fe - f - 2 Fe304;
закись-окись железа по реакции 2 Fe - f-1,5 02^± Fe303,
При окислении сперва образуется закись железа, которая в дальнейшем при соответствующих условиях (температуре, соотношении кислорода и железа в сварочной ванне) может переходить в окись и закись-окись железа. При окислении железа в процессе сварки основную роль играет закись железа, так как только она способна растворяться в жидком металле.
Установлено, что в чистом расплавленном железе может растворяться до 0,22% кислорода в виде закиси железа, концентрация которой в расплавленном железе может достигать 0,5%. Содержание кислорода в стали (представляющей сплав железа с углеродом) будет меньше, так как растворимость закиси железа в сплаве уменьшается по мере повышения в нем содержания углерода. Когда содержание кислорода в стали достигнет 0,035%, избыточный кислород будет выделяться из раствора в виде закиси-окиси железа и располагаться между зернами металла.
Кислород легко соединяется также с углеродом, марганцем, кремнием и другими элементами, входящими в состав свариваемого металла, электродов, электродных покрытий и флюсов, образуя соответствующие окислы этих элементов.
Окисление элементов при сварке может происходить или в зоне сварочной дуги, где кислород находится в атомарном состоянии и отличается высокой химической активностью, или при взаимодействии их с закисью железа (FeO) в ванне расплавленного металла.
Вследствие окисления содержание некоторых элементов в металле шва может резко уменьшаться, что заметно ухудшает его свойства. Так, например, при сварке голыми электродами количество углерода может уменьшаться в металле шва на 50—60%, а марганца — на 40 —50% по сравнению с их содержанием в электродной проволоке. * —-~
Присутствие кислорода в металле шва в виде твердого раствора или включений окислов, в первую очередь сказывается на ухудшении механических свойств наплавленного металла: понижаются пределы прочности и текучести, относительное удлинение, ударная вязкость. Кроме того, кислород вредно влияет и на другие свойства металла — снижает стойкость его против коррозии, повышает склонность к старению, делает металл хладноломким и красноломким.
Таким образом, главным. условием получения наплавленного металла высокого качества является защита его от окисления кислородом окружающей среды. Это достигается, во-первых, созданием вокруг расплавленного металла защитной среды из газов и шлаков. Однако полностью защитить металл от окисления не удается. Поэтому вторым средством для решения указанной задачи является удаление кислорода из наплавленного металла с помощью химических элементов, обладающих большим сродством к кислороду, чем железо, и образующих окислы, менее растворимые в жидком металле, чем FeO. Этот процесс называется раскис -
л ением и играет очень важную роль при сварке, так как обеспечивает получение чистого, высококачественного металла шва. Благодаря раскислению, а также надежной защите жидкого металла газами и шлаком, образуемыми при расплавлении покрытия электрода и флюса, содержание кислорода в металле шва очень невелико и практически составляет 0,005—0,057 %. В электродной проволоке содержание кислорода не превышает 0,01%.
Реакции окисления и раскисления обусловлены одним и тем же химическим процессом, но протекающим лишь в противоположных направлениях. Этот процесс можно выразить следующей общей формулой:
где т — число молекул металла (Me) или другого элемента, участвующего в реакции с кислородом; п — число молекул кислорода (О^, пошедшего. на окисление или содержавшегося в окисле.
Стрелками указано направление реакции: вправо — окисление, влево — раскисление (восстановление металла из окисла). При определенных соотношениях металла и кислорода вся система может находиться в состоянии химического равновесия при данной температуре и давлении, т. е. процессы окисления или восстановления протекать не будут. Тогда в данном объеме вещества будут находиться как чистый металл, так и его окисел. Такое состояние характеризуется некоторой величиной, называемой константой[4] равновесия К. Эта величина равна:
Берутся весовые проценты концентраций взаимодействующих веществ. Числитель представляет собой произведение концентраций веществ, вступающих в реакцию, а знаменатель — концентрацию продуктов реакции. Для каждого вещества значения К, соответствующие равновесному состоянию системы при различных давлениях и температурах, определены опытным путем и даются в виде таблиц или графиков. Чем больше действительная величина К отличается от равновесной, вычисленной для той же температуры и давления, тем больше будет скорость реакции. Если отношение концентраций веществ в правой части формулы больше равновесного значения К, то реакция пойдет вправо и произойдет окисление элемента Me. При обратном соотношении процесс идет влево и происходит раскисление (восстановление элемента Me из окисла). С повышением температуры скорость этих реакций возрастает.
Если взаимодействовать с кислородом могут несколько элементов, как это имеет место в сварочной ванне, то в первую очередь окислению подвергаются те элементы, которце обладают наибольшим химическим сродством к кислороду. По мере окисления этих элементов концентрация их в зоне реакции уменьшается и скорость окисления замедляется; тогда начинают более интенсивно окисляться другие элементы, обладающие меньшим сродством к кислороду. Постепенно процесс окисления охватывает все новые и новые элементы и протекает до тех пор, пока концентрация всех элементов в жидком металле не будет соответствовать, равновесной. То же имеет место и при обратном процессе—раскислении.
Если элементы, наиболее часто применяемые в качестве рас - кислителей при сварке, расположить по признаку уменьшения их химической активности к кислороду, то получим следующий ряд: алюминий (обладает наибольшим сродством к кислороду), титан, ванадий, кремний, углерод, марганец и хром.
Эти элементы поступают в сварочную ванну из присадочного металла, покрытия электрода или флюса и вступают в химическое взаимодействие с окислами металла. В качестве веществ, содержащих раскислители, применяют ферросплавы — ферромарганец, ферросилиций, ферротитан и др.
Ферросплавы вводятся в состав электродного покрытия или флюса и при их расплавлении почти полностью переходят в шлак. При этом входящие в них элементы окисляются, отнимая кислород у окислов железа. Вновь образовавшиеся окислы элементов — раскис - лителей в большей своей части остаются в шлаках, покрывающих металл шва, и после сварки удаляются вместе с ними.
Рассмотрим некоторые наиболее типичные реакции раскисления. Раскисление кремнием и марганцем происходит по реакциям:
FeOMeT Мпмет^*МпОшл —J - FeMeT.
Образующиеся при этом окись кремния и закись марганца плохо растворимы в жидком металле и переходят в шлак. Закиси железа и марганца по своим химическим свойствам являются основаниями и могут вступать в реакцию с кислотными окислами, образуя соединения типа 2FeO - SiOa; 2MnO - Si02 (силикаты) и 2FeO • ТЮ2 (титанаты). Эти соединения почти не растворимы в жидком металле и полностью остаются в слое шлака.
Окислы по своим химическим свойствам могут быть кислые и основные. К кислым окислам относятся окись кремния (Si02) и двуокись титана (TiOj). К основным окислам относятся окись кальция (СаО), закись железа (FeO), закись марганца (МпО), окись натрия (NaaO), окись калия (К20) и окись магния (MgO).
Если в шлаках, образующихся при сварке, преобладают кислые окислы, то такие шлаки, а также образующие их покрытия и флюсы называются кислыми. Преобладание в шлаке основных окислов, наоборот, придает ему химические свойства основания. Соответственно, электродные покрытия и флюсы, дающие основные шлаки, называются основными.
При сварке электродами с кислыми покрытиями процесс раскисления протекает также за счет углерода, содержащегося в металле сварочной ванны и ферросплавах, вводимых в покрытие обычно в ввде ферромарганца.
Реакция раскисления углеродом протекает так:
Образовавшаяся газообразная окись углерода (СО) не растворяется в жидком металле и выделяется из него в атмосферу, что вызывает сильное кипение сварочной ванны. Поэтому кислые покрытия иногда называют кипящими.
При высоких температурах сварочной ванны, содержащиеся в шлаках окись кремния Si02 и закись марганца МпО вступают в реакцию с железом сварочной ванны. Эти реакции протекают на границе раздела жидкого шлака и жидкого металла последующей схеме:
(Si02) + 2 [Fe]—>-2 (FeO) + [Si];
шлак металл I шлак металл
С повышением температуры сварочной ванны скорость и полнота протекания этих реакций увеличиваются. Как видно из схемы, образующаяся закись железа FeO растворяется в жидком металле. При последующем остывании металла шва находящаяся в нем закись железа вступает в реакцию с другими элементами, содержащимися в расплавленном металле, такими, как Si, Сг, Мп, образуя чистое железо и окислы этих элементов, которые могут оставаться в металле шва. Поэтому при сварке сталей, содержащих повышенное количество кремния, хрома и марганца, не рекомендуется пользоваться покрытиями или флюсами с высоким содержанием окислов кремния и марганца, так как при этом увеличивается содержание кислорода в металле шва, снижающего его ударную вязкость. Основные электродные покрытия и флюсы дают и основные шлаки, содержащие преимущественно окись кальция (СаО), которая не отнимает кислород от окислов металлов. Поэтому в покрытия основного типа для раскисления наплавленного металла вводятся ферросплавы! ферросилиций или ферротитан. В электродных покрытиях этого типа основными реакциями раскисления будут:
раскисление кремнием 2 FeO - f - Si Si02 - f - 2 Fe; раскисление титаном 2 FeO - f - Ті ^Ті02-[- 2 Fe.
Эти реакции протекают без газообразования и сварочная ванна остается спокойной. Поэтому покрытия основного характера называют также спокойными. Основные электродные покрытия дают наплавленный металл с высокими механическими свойствами.
В результате происходящих в сварочной ванне реакций раскисления содержание кремния и марганца в металле шва несколько увеличивается, например кремния до 0,1—43,3 %, марганца до 0,7—1% и более.
Выше указывалось, что алюминий обладает большим сродством к кислороду. Однако окись алюминия (А1203) не растворима в жидком металле и медленно переходит в шлак. Кроме того, алюминий способствует окислению углерода, что вызывает пористость шва. По этим причинам алюминий как раскислитель при сварке стали почти не применяется.
Углерод в тех концентрациях, какие встречаются в сварных швах стали, является менее активным раскислителем, чем кремний. С кислородом окислов углерод взаимодействует, главным образом, в момент расплавления электрода и только в зоне наиболее высоких температур сварочной ванны. Раскисление же марганцем и кремнием происходит при более низких температурах и протекает вплоть до начала кристаллизации металла шва.
Если кремния в металле шва недостаточно, то раскисление может происходить преимущественно за счет углерода с образованием СО, избыточное количество которой не успевает выделиться из твердеющего металла и остается в нем, образуя газовые поры. Поэтому для получения плотного беспористого шва необходимо подавлять реакцию окисления углерода повышением содержания кремния в металле сварочной ванны до 0,2—0,3%. При понижении содержания кремния в металле шва до 0,12% и ниже неизбежно образование большого количества пор.
Азот поглощается расплавленным металлом из окружающего воздуха. Под действием высоких температур сварочной дуги азот частично переходит в атомарное состояние и растворяется в жидком металле. В процессе охлаждения азот выделяется из раствора и, взаимодействуя с металлом и его окислами, образует химические соединения, называемые нитридами — Fe2N; Fe4N; MnN; SiN. Нитриды в стали повышают ее прочность и твердость, но сильно уменьшают пластичность. Поэтому азот является вредной примесью в наплавленном металле.
^Наибольшее насыщение металла азотом дает дуговая сварка длинной дугой и голыми электродами, наименьшее — газовая. При сварке непокрытыми электродами содержание азота в металле шва может достигать 0,12—0,2%. - С увеличением тока содержание азота в наплавленном металле уменьшается. Увеличение содержания
углерода и особенно марганца в присадочной проволоке или покрытии электрода значительно снижает содержание азота в наплавленном металле. При сварке электродами с качественными покрытиями содержание азота в металле незначительно и составляет всего 0,005— 0,015%.
Сера является вредной примесью в стали. Она образует сернистое железо (сульфид железа FeS), которое имеет температуру плавления 1193°, т. е. более низкую, чем сталь. Поэтому при кристаллизации стали сернистое железо остается еще в жидком виде в прослойках между кристаллами сплава и является одной из причин образования горячих трещин при сварке. Серу удаляют введением марганца, который образует с ней химическое соединение — сернистый у марганец (MnS) по реакциям:
FeS - f - Мп MnS 4~ Fe;
Сернистый марганец не растворяется в жидком металле и полностью переходит в шлак.
Удалению серы способствует также окись кальция, при этом происходит реакция
FeS - f - CaO = FeO - f - CaS.
5 FeO = PaOs + 9 Fe
5Fe0 = P205+ 11 Fe;
Присутствие фосфора вызывает неоднородность металла шва, рост зерен и снижение пластичности, особенно при низких температурах (хладноломкость). Он присутствует в металле шва в виде фосфидов железа: Fe3P и Fe2P. Удаление фосфора происходит при реакциях:
с закисью железа. . 2 Fe2P
с окисью кальция. . 3 СаО или 4 СаО - j - РаОв = Са4Р2Ов
Получаемые соединения фосфора переходят в шлак. Основные шлаки лучше удаляют фосфор из металла, чем кислые.
Водород является вредной примесью в стали. При температуре дуги водород диссоциирует на атомы и, находясь в атомарном состоянии, способен хорошо растворяться в наплавленном металле.
При остывании и затвердевании металла атомы водорода вновь соединяются в молекулы, которые собираются в отдельных местах шва, образуя газовые пузырьки. Водород не всегда успевает полностью выделиться из металла и вызывает появление в нем пористости и мелких трещин, так называемых флокенов. Сталь с флокенами является хрупкой, в изломе флокены имеют вид светлых пятен и не выявляются обычно применяемыми методами контроля качества швов без разрушения.
По мере увеличения температуры металла растворимость водо
рода увеличивается, достигая наибольшей степени при 2400°. Насыщение металла водородом происходит в основном в момент переноса капель металла в дуге. В 100 г металла может раствориться до 43 см3 водорода. При содержании водорода до 6,5 смъ на 100 г металла шов получается плотным; при более высоком насыщении металла водородом появляются пористость, флокены, снижается пластичность, металл становится хрупким в холодном состоянии.
Источником насыщения металла водородом является влага, содержащаяся в электродном покрытии, флюсах и окружающем воздухе или находящаяся на поверхности свариваемого металла в виде воды, снега, инея. Кроме того, вЪдород содержится в ржавчине, которая может быть на сварочной проволоке или кромках металла. Наименее металл насыщается водородом при сварке на постоянном токе обратной полярности, наиболее — при сварке на переменном токе. Это обусловлено тем, что при сварке на переменном токе в момент перехода тока через нулевое значение жидкий металл не защищен действием электрического поля дуги и доступен для растворения в нем атомов водорода, несущих отрицательный заряд электричества.
Чтобы предотвратить насыщение металла водородом при сварке стали необходимо следующее:
1. Обеспечить минимальное содержание влаги в покрытии и флюсах, в окружающей шов атмосфере и на кромках металла. С этой целью применяемые для сварки электроды следует тщательно просушивать путем прокалки. Для покрытий основного типа (УОНИ и др. см. § 2 гл. VI) прокалку ведут при 350° в течение 5 час. Хранить электроды следует в сухом месте, а при их увлажнении вновь подвергать прокалке перед выдачей сварщику. Желательно, чтобы сварщики при работе на открытом воздухе имели герметически закрывающиеся футляры для хранения электродов. При работе под дождем и снегом места сварки должны быть надежно защищены от попадания влаги палатками из брезента, фанеры и других материалов.
Перед сваркой необходимо тщательно протирать и просушивать кромки металла, не оставляя на, них влаги.
При сварке труб концы их нужно закрывать деревянными пробками, чтобы не допустить циркуляции влажного воздуха внутри трубы и подсоса его из трубы в шов.
2. Использовать проволоку без ржавчины и удалять ее с кромок свариваемого металла.
3. Стараться не применять многопроходных швов при автоматической сварке под флюсом, так как при наложении последующих слоев водород насыщает нижележащие слои в момент их расплавления.
Читайте также:
