Оксиды активных металлов список
Обновлено: 07.07.2024
Осно́вные оксиды — оксиды 1, 2 и некоторых 3 валентных металлов. К ним относятся:
- оксиды металлов главной подгруппы первой группы (щелочные металлы) Li — Fr
- оксиды металлов главной подгруппы второй группы (щелочноземельные металлы) Mg — Ra
- оксиды переходных металлов в низших степенях окисления
Металлы в основных оксидах обычно проявляют степень окисления 1 и 2.
Содержание
Характерные реакции
- Основные оксиды наиболее активных металлов (щелочных и щелочноземельных, начиная с оксида кальция) при взаимодействии с водой (реакция гидратации) образуют соответствующие им гидроксиды (основания). Например, при растворении оксида кальция (негашёной извести) в воде образуется гидроксид кальция — сильное основание:
- Основные оксиды взаимодействуют с кислотами, образуя соответствующие соли:
- К образованию солей также приводит реакция основных оксидов с кислотными оксидами:
- И с амфотерными оксидами:
Все основные оксиды
- Li2O; Na2O; K2O; CuO; Ag2O; MgO; CaO; SrO; BaO; HgO; MnO; CrO; NiO;
- Оксид франция Fr2O; Cs2O; Rb2O; FeO
См. также
Ccылки
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Основные оксиды" в других словарях:
ОКСИДЫ — ОКСИДЫ, соединения химических элементов (кроме фтора) с кислородом. При взаимодействии с водой образуют основания (основные оксиды) или кислоты (кислые оксиды), многие оксиды амфотерны. Большинство оксидов при обычных условиях твёрдые вещества,… … Современная энциклопедия
Оксиды — ОКСИДЫ, соединения химических элементов (кроме фтора) с кислородом. При взаимодействии с водой образуют основания (основные оксиды) или кислоты (кислые оксиды), многие оксиды амфотерны. Большинство оксидов при обычных условиях твёрдые вещества,… … Иллюстрированный энциклопедический словарь
Оксиды — Оксид (окисел, окись) бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй… … Википедия
Оксиды металлов — это соединения металлов с кислородом. Многие из них могут соединяться с одной или несколькими молекулами воды с образованием гидроксидов. Большинство оксидов являются основными, так как их гидроксиды ведут себя как основания. Однако некоторые… … Официальная терминология
оксиды — Соединение химического элемента с кислородом. По химическим свойствам все оксиды делятся на солеобразующие (наприме, Na2О, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7) и несолеобразующие (например, СО, N2O, NO, H2O). Солеобразующие оксиды подразделяют на… … Справочник технического переводчика
ОКСИДЫ — хим. соединения элементов с кислородом (устаревшее название окислы); один из важнейших классов хим. веществ. О. образуются чаще всего при непосредственном окислении простых и сложных веществ. Напр. при окислении углеводородов образуются О.… … Большая политехническая энциклопедия
Основные факты — Нефть – это горючая жидкость, представляющая собой сложную смесь из углеводородов. Различные типы нефти существенно различаются по химическим и физическим свойствам: в природе она представлена и в виде черного битумного асфальта, и в форме… … Нефтегазовая микроэнциклопедия
Оксиды — [oxides] соединение химического элемента с кислородом. По химическим свойствам все оксиды делятся на солеобразующие (например, Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7) и несолеобразующие (например, СО, N2O, NO, H2O). Солеобразующие оксиды… … Энциклопедический словарь по металлургии
Основные оксиды

Оксиды – сложные вещества, состоящие из двух элементов, одним из которых является кислород. Оксиды могут быть солеобразующими и несолеобразующими: одним из видов солеобразующих оксидов являются основные оксиды. Чем они отличаются от других видов, и каковы их химические свойства?
Классификация оксидов
Солеобразующие оксиды подразделяются на основные, кислотные и амфотерные оксиды. Если основным оксидам соответствуют основания, то кислотным – кислоты, а амфотерным оксидам соответствуют амфотерные образования. Амфотерными оксидами называют такие соединения, которые в зависимости от условий могут проявлять либо основные, либо кислотные свойства.
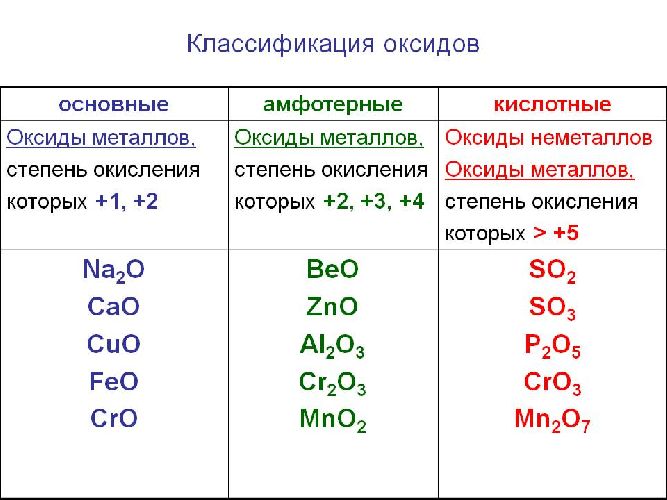
Рис. 1. Классификация оксидов.
Физические свойства оксидов очень разнообразны. Они могут быть как газами (CO2), так и твердыми (Fe2O3) или жидкими веществами (H2O).
оксиды, в которых элементы проявляют свою высшую активность называются высшими оксидами. Порядок возрастания кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов.
Химические свойства основных оксидов
Основными оксидами называются оксиды, которым соответствуют основания. Например, основным оксидам K2O, СaO соответствуют основания KOH, Ca(OH)2 .

Рис. 2. Основные оксиды и соответствующие им основания.
Основные оксиды образуются типичными металлами, а также металлами переменной валентности в низшей степени окисления (например, CaO, FeO), реагируют с кислотами и кислотными оксидами, образуя при этом соли:
Основные оксиды также взаимодействуют с амфотерными оксидами, в результате чего происходит образование соли, например:
С водой реагируют только оксиды щелочных и щелочно-земельных металлов:
Многие основные оксиды имеют характер восстанавливаться до веществ, состоящих из атомов одного химического элемента:
При нагревании разлагаются только оксиды ртути и благородных металлов:

Рис. 3. Оксид ртути.
Список основных оксидов:
| Название оксида | Химическая формула | Свойства |
| Оксид кальция | CaO | негашенная известь, белое кристаллическое вещество |
| Оксид магния | MgO | белое вещество, малорастворимое в воде |
| Оксид бария | BaO | бесцветные кристаллы с кубической решеткой |
| Оксид меди II | CuO | вещество черного цвета практически нерастворимое в воде |
| Оксид ртути II | HgO | твердое вещество красного или желто-оранжевого цвета |
| Оксид калия | K2O | бесцветное или бледно-желтое вещество |
| Оксид натрия | Na2O | вещество, состоящее из бесцветных кристаллов |
| Оксид лития | Li2 O | вещество, состоящее из бесцветных кристаллов, которые имеют строение кубической решетки |
В главных подгруппах периодической системы при переходе от одного элемента к другому сверху вниз наблюдается усиление основных свойств оксидов
Что мы узнали?
При образовании основных оксидов одним из обязательных элементов является кислород.Основные оксиды обладают рядом физических и химических свойств, таких как взаимодействие с водой, кислотами и другими оксидами.
Активные металлы

Металлы, легко вступающие в реакции, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.
Положение в таблице Менделеева
Металлические свойства элементов ослабевают слева направо в периодической таблице Менделеева. Поэтому наиболее активными считаются элементы I и II групп.
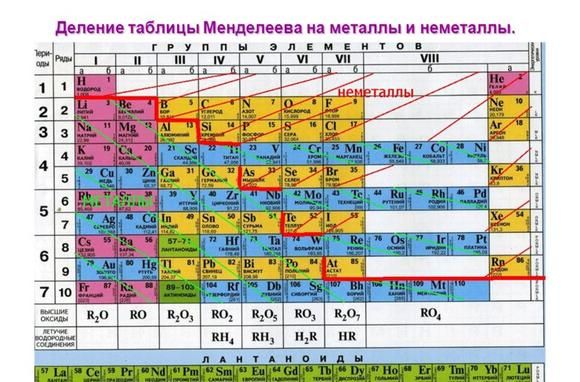
Рис. 1. Активные металлы в таблице Менделеева.
Все металлы являются восстановителями и легко расстаются с электронами на внешнем энергетическом уровне. У активных металлов всего один-два валентных электрона. При этом металлические свойства усиливаются сверху вниз с возрастанием количества энергетических уровней, т.к. чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Наиболее активными считаются щелочные металлы:
- литий;
- натрий;
- калий;
- рубидий;
- цезий;
- франций.
К щелочноземельным металлам относятся:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен. Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.

Рис. 2. Электрохимический ряд напряжений металлов.
К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.
Свойства
Активные металлы отличаются мягкостью (можно разрезать ножом), лёгкостью, невысокой температурой плавления.
Основные химические свойства металлов представлены в таблице.
Реакция
Уравнение
Исключение
Щелочные металлы самовозгораются на воздухе, взаимодействуя с кислородом
Литий реагирует с кислородом только при высокой температуре
Щелочноземельные металлы и алюминий на воздухе образуют оксидные плёнки, а при нагревании самовозгораются
Реагируют с простыми веществами, образуя соли
Алюминий не вступает в реакцию с водородом
Бурно реагируют с водой, образуя щёлочи и водород
Реакция с литием протекает медленно. Алюминий реагирует с водой только после удаления оксидной плёнки
Реагируют с кислотами, образуя соли
Взаимодействуют с растворами солей, сначала реагируя с водой, а затем с солью
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.

Рис. 3. Минералы и чистые металлы.
К активным металлам относятся элементы I и II групп – щелочные и щелочноземельные металлы, а также алюминий. Их активность обусловлена строением атома – немногочисленные электроны легко отделяются от внешнего энергетического уровня. Это мягкие лёгкие металлы, быстро вступающие в реакцию с простыми и сложными веществами, образуя оксиды, гидроксиды, соли. Алюминий находится ближе к водороду и для его реакции с веществами требуются дополнительные условия – высокие температуры, разрушение оксидной плёнки.
Основные оксиды, перечень, список, физические и химические свойства

Основные оксиды, перечень, список, физические и химические свойства.


Основные оксиды – солеобразующие оксиды металлов, которым соответствуют основания. Как правило, металлы в них проявляют степень окисления +1 или +2.
Основные оксиды:
В свою очередь оксидами называют неорганические химические соединения, состоящие из двух химических элементов, одним из которых является кислород. Кислород в оксидах проявляет степень окисления -2. Все оксиды делятся на солеобразующие и несолеобразующие.
К солеобразующим оксидам помимо основных оксидов также относят кислотные и амфмотерные оксиды. Соответственно кислотным оксидам соответствуют кислоты, амфотерным оксидам – амфотерные основания.
К основным оксидам относятся оксиды щелочных и щёлочноземельных металлов, а также оксиды переходных металлов в низших степенях окисления.
Какие оксиды основные? Список, примеры и перечень основных оксидов:
| Название оксида: | Химическая формула: |
| Оксид бария | BaO |
| Оксид калия | K2O |
| Оксид кальция | CaO |
| Оксид лития | Li2 O |
| Оксид магния | MgO |
| Оксид меди II | CuO |
| Оксид натрия | Na2O |
| Оксид ртути II | HgO |
Физические свойства основных оксидов:
Общим физическим свойством для всех основных оксидов является то, что они представляют собой твердые вещества. В то время как другие: внешний вид, цвет, плотность, температуры плавления и кипения, молярная масса, твердость и пр. различаются.
| Название оксида: | Химическая формула: | Внешний вид: |
| Оксид бария | BaO | бесцветные кристаллы |
| Оксид калия | K2O | твердое бесцветное или бледно-желтое вещество |
| Оксид кальция | CaO | белое кристаллическое вещество |
| Оксид лития | Li2 O | бесцветные кристаллы |
| Оксид магния | MgO | твердое белое вещество |
| Оксид меди II | CuO | твердое черное вещество |
| Оксид натрия | Na2O | бесцветные кристаллы |
| Оксид ртути II | HgO | твердое вещество красного или желто-оранжевого цвета |
Получение основных оксидов:
Основные оксиды получаются в результате:
- 1. окисления металлов кислородом (кроме благородных):
2Сa + О2 → 2CaО (t = 300 o C);
- 2. термического разложения гидроксидов:
Ba(OH)2 → BaO + H2О (t = 780-800 o C);
Сa(OH)2 → СaO + H2О (t = 520-580 o C);
- 3. термического разложения солей:
BaCO3 → BaO + CO2 (t = 1000-1450 o C);
MgCO3 → MgО + СО2 (t > 650 o C);
Химические свойства основных оксидов. Химические реакции основных оксидов:
Для основных оксидов характерны следующие общие химические реакции:
1. взаимодействие с водой.
В реакцию с водой вступают не все основные оксиды, а только оксиды наиболее активных металлов, которые расположены в главных подгруппах первой и второй групп периодической таблицы химических элементов Д.И. Менделеева (натрий, калий, кальций, барий и др.).
В результате взаимодействия основных оксидов с водой образуются основания.
MgО + Н2О → Mg(ОН)2 (t = 100-125 o C);
2. взаимодействие с кислотными оксидами.
В результате химической реакции основных оксидов с кислотными оксидам образуется соль.
CaО + SiО2 → CaSiО3 (t = 1100-1200 o C);
MgО + SiО2 → MgSiО3 (t = 1100-1200 o C);
3. взаимодействие с кислотами.
В результате химической реакции основных оксидов с кислотами образуется соль и вода.
Аналогично проходят реакции основных оксидов и с другими кислотами.
4. взаимодействие с амфотерными оксидами.
В результате химической реакции основных оксидов с амфотерными оксидам образуется соль.
BaO + ZnO → BaZnO2 (t = 1100 o C);
BaO + SnO → BaSnO2 (t = 1000 o C);
5. восстановление до простых веществ:
BaO + Be → Ba + BeO (t = 270 o C);
3BaO + 2Al → 3Ba + Al2O3 (t = 1200 o C);
2Al + 4BaO → Ba(AlO2)2 + 3Ba (t = 1100-1200 o C);
2Al + 4BaO → BaAl2O4 + 3Ba (t = 1100-1200 o C);
3BaO + Si → 2Ba + BaSiO3 (t = 1200 o C);
4CaО + 2Al → 2Ca + Ca(AlO2)2 (t = 1200 o C);
Li2O + Mg → 2Li + MgO (t > 800 o C);
2Li2O + Si → 4Li + SiO2 (t = 1000 o C);
2MgО + Si → 2Mg + SiО2;
MgО + 2K → Mg + K2О;
MgО + Са → Mg + СаО (t = 1300 o C);
CuО + H2 → Cu + H2О (t = 300 o C);
CuО + С → Cu + СО (t = 1200 o C);
3CuО + 2Al → 3Cu + Al2О3 (t = 1000-1100 o C).
6. взаимодействие с галогеноводородами (бромоводородом, йодоводородом и пр.).
В результате химической реакции основных оксидов с галогеноводородами образуется соль и вода.
Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (107 238)
- Экономика Второй индустриализации России (103 687)
- Этилен (этен), получение, свойства, химические реакции (30 339)
- Программа искусственного интеллекта ЭЛИС (30 332)
- Метан, получение, свойства, химические реакции (27 138)
- Крахмал, свойства, получение и применение (26 873)
- Природный газ, свойства, химический состав, добыча и применение (25 794)
- Целлюлоза, свойства, получение и применение (25 500)
- Пропилен (пропен), получение, свойства, химические реакции (24 235)
- Прямоугольный треугольник, свойства, признаки и формулы (24 163)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Кислотные оксиды

Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород. В названиях оксидов сначала указывают слово оксид, затем название второго элемента, которым он образован. Какие особенности имеют кислотные оксиды, и чем они отличаются от других видов оксидов?
Оксиды делятся на солеобразующие и несолеобразующие. Уже по названию ясно, что несолеобразующие не образуют солей. Таких оксидов немного : это вода H2 O, фторид кислорода OF2 (если условно его считать оксидом), угарный газ, или оксид углерода (II), монооксид углерода CO; оксиды азота (I) и (II): N2 O (оксид диазота, веселящий газ) и NO (монооксид азота).
Солеобразующие оксиды образуют соли при взаимодействии с кислотами или щелочами. В качестве гидроксидов им соответствуют основания, амфотерные основания и кислородосодержащие кислоты. Соответственно они называются основными оксидами (например, CaO), амфотерными оксидами (Al2 O3 ) и кислотными оксидами, или ангидридами кислот (CO2).
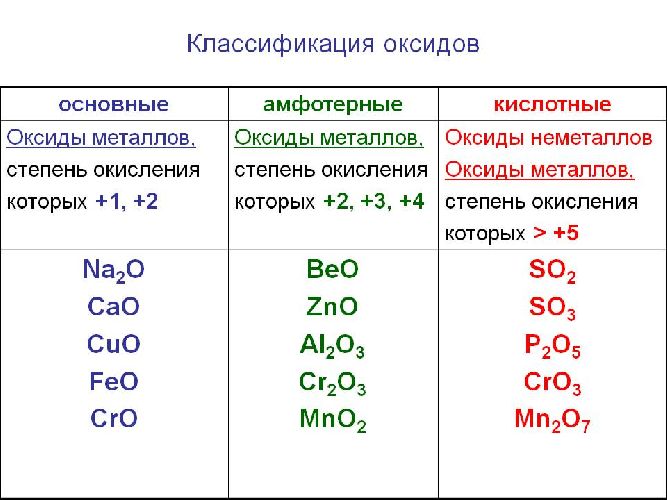
Рис. 1. Виды оксидов.
Часто перед учащимися встает вопрос, как отличить основной оксид от кислотного. Прежде всего необходимо обратить внимание на второй элемент рядом с кислородом. Кислотные оксиды – содержат неметалл или переходный металл (CO2 , SO3 , P2 O5 ) основные оксиды – содержат металл (Na2 O, FeO, CuO).
Основные свойства кислотных оксидов
Кислотные оксиды (ангидриды) – вещества, которые проявляют кислотные свойства и образуют кислородосодержащие кислоты. Следовательно, кислотным оксидам соответствуют кислоты. Например, кислотным оксидам SO2 ,SO3 соответствуют кислоты H2 SO3 и H2 SO4 .
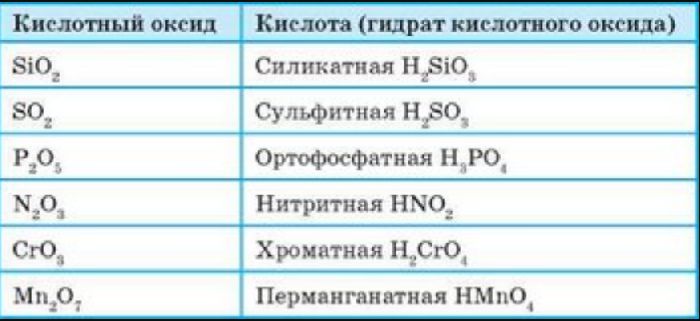
Рис. 2. Кислотные оксиды с соответствующими кислотами.
Кислотные оксиды, образуемые неметаллами и металлами с переменной валентностью в высшей степени окисления (например, SO3 , Мn2 O7 ), реагируют с основными оксидами и щелочами, образуя соли:
Типичными реакциями являются взаимодействие кислотных оксидов с основаниями в результате чего образуется соль и вода:
Все кислотные оксиды, кроме диоксида кремния SiO2 (кремниевый ангидрид, кремнезем), реагируют с водой, образуя кислоты:
Кислотные оксиды образуются при взаимодействии с кислородом простых и сложных веществ (S+O2 =SO2 ), либо при разложении в результате нагревания сложных веществ, содержащих кислород, – кислот, нерастворимых оснований, солей (H2 SiO3 =SiO2 +H2 O).
Список кислотных оксидов:
| Название кислотного оксида | Формула кислотного оксида | Свойства кислотного оксида |
| Оксид серы (IV) | SO2 | бесцветный токсичный газ с резким запахом |
| Оксид серы (VI) | SO3 | легколетучая безцветная токсичная жидкость |
| Оксид углерода (IV) | CO2 | бесцветный газ без запаха |
| Оксид кремния (IV) | SiO2 | бесцветные кристаллы, обладающие прочностью |
| Оксид фосфора (V) | P2 O5 | белый легковозгораемый порошок с неприятным запахом |
| Оксид азота (V) | N2 O5 | вещество, состоящее из бесцветных летучих кристаллов |
| Оксид хлора (VII) | Cl2 O7 | бесцветная маслянистая токсичная жидкость |
| Оксид марганца (VII) | Mn2 O7 | жидкость с металлическим блеском, являющаяся сильным окислителем. |

Рис. 3. Примеры кислотные оксиды.
Кислотные оксиды относятся к солеобразующим оксидам и образуются с помощью кислот. Кислотные оксиды вступают в реакции с основаниями и водой, а их образование происходит при нагревании и разложении сложных веществ.
Читайте также:
