Определение металлов в воде фотометрическим методом
Обновлено: 17.05.2024
Наиболее полная информация о чистой воде, дополняемая Вами.
Фотометрические методы химического анализа воды
Фотометрия – инструментальный анализ окрашенных жидкостей. Принцип основан на снижении интенсивности световой волны, проходящей через фильтр. Мембраной служит окрашенная проба жидкости в стеклянной кювете. Концентрация вещества определяется по закону Бугера-Ламберта-Бера. Молекулы разных составов поглощают световые электромагнитные волны определенной длины. Анализ проводят на спектрометрах, фотометрах и фотоколориметрах. Приборы отличаются использованием монохромного или фильтрованного луча, методами измерения и получения результатов.
Особенности приборов для фотометрических измерений
Фотометр – прибор, работающий на монохромной волне длиной 315-1050 нанометров, но в широком диапазоне частот. Отобранная проба фильтруется, добавляются реактивы для окраски загрязняющего вещества. Прибор настраивают на волну в диапазоне загрязняющего вещества. Измеряют интенсивность потока на входе и выходе из кюветы. Получают результат. Фотометры с заводской настройкой на определение группы веществ используются для экспресс анализов.

Спектрофотометры СФ-46 работают, преобразуя, сравнивая два потока оптического излучения, до и после взаимодействия с образцом. Используется монохромная волна 190-1100 нм, работает прибор в спектральном диапазоне 400-750 нм с погрешностью до 0,5 %.
По другой схеме на пробу подается полихромный поток света, монохроматор на выходе выделяет узкий сектор для исследования в фотоприемнике. Прибор исследует волны 160-3300 нм, выдает информацию о веществе, обнаруживает неизвестные загрязнения в малом количестве.
Лабораторные фотоколориметры ФКФ, ФЭК 56, ФЭК-56М работают с известными растворами, после подготовки графика для определения вещества по светопоглощающей способности. Эти приборы комплектуются ТПР, обеспечивая определение фотометрическим титрованием.
В них световая волна длиной 315-630 нм обеспечивается установкой компенсирующих фильтров, так используется полихромный луч. Одинаковые по интенсивности пучки света пропускают через контрольную и рабочую кюветы, определяют концентрацию пробы через светопоглощение, измерением электрических импульсов, полученных с фотоэлемента.
Достоверность результатов, полученных с приборов этой категории одинакова для параллельных проб, так как по закону Бугера-Ламберта-Бера:
- Окрашенный раствор одинаковой концентрации, толщине слоя и в равных условиях поглощает одну долю падающего света.
- Закономерность справедлива для слабо окрашенных растворов, чтобы показатель преломления соответствовал растворителю.
- Температура при измерении должна быть постоянной.
- Пучок света параллельный.
- Светопоглощение только для одного компонента.
Методы определения компонентов
Технология исследования на приборе включает операции:
- Подготовка пробы с переводом исследуемого вещества в состояние, когда он поглощает электромагнитные колебания.
- Измерение интенсивности поглощения проводят в спектре 315-630 нм.
- Учет потерь при прохождении света через кюветы, растворитель, рассеяние, которое уравновешивается контрольной кюветой.
- Подбор оптимального диапазона измерения с установкой оптического фильтра.
Важно подготовить ФЭК к работе, согласно инструкции. Обязательно прогреть прибор после включения в течение 30 минут. Выбор размера кювет зависит от интенсивности окрашивания раствора, а их чистота обеспечит меньшую погрешность в измерениях. В комплекте поставляют кюветы из кварцевого стекла длиной 1-50 мм и объемом 0,5-20 мл.
Пройдя сквозь кювету с окрашенным раствором, световой поток попадает на фотоэлемент и создает электрический потенциал. Чтобы перевести показания электрического импульса в концентрацию, необходимо воспользоваться переводным графиком.

Методом сравнения по другому называют методом молярного коэффициента светопоглощения, сравнивая концентрацию рабочего раствора с калиброванными. В этом случае необходимо подобрать контрольный раствор под рабочий по интенсивности светопоглощения. Шкала эталонных растворов готовится заранее.
Компенсационный метод также относится к сравнению цвета эталонного и рабочего раствора. Они совмещаются на экране применением приспособлений, что облегчает подгонку тона с высокой точностью. При достижении полного совпадения, поля сливаются. При этом не нужно менять калибровочную кювету – в рабочий раствор добавляют растворитель, или увеличивают окрашенный слой. Обсчет результатов ведут по разработанной методике.
При массовом выполнении однотипных анализов по определению малых концентраций ионов, в результате образования комплексных солей приобретающих характерную окраску, составляют градуировочные графики на каждый определяемый компонент. В этом случае калибровочные растворы не хранят, а используют их, как рабочие. Контрольной будет кювета с растворителем. Показатели преломления основных растворителей известны:
- вода – 1,3333;
- хлороформ – 1,4456;
- этанол – 1,3613.
Измеряют оптические плотности калиброванных растворов, по результатам строят кривую. Важно, чтобы разброс точек был минимальным, а линия зависимости оптической плотности раствора от количества вещества начиналась от нулевой точки координат.

Метод добавок применяют, когда в сложном многокомпонентном составе нужно определить искомое вещество в малой концентрации. В этом случае определяют оптическую плотность пробы, в которой содержится искомый компонент. Далее к пробе добавляют заведомо известное количество определяемого вещества. При вторичном измерении оптическая плотность добавки увеличится, за счет имеющегося в пробе того же элемента. Подсчитать содержание искомого вещества можно по графику или методике.
Определение вещества методом фотометрического титрования доступно, если прибор оснащен титровальной приставкой. В этом случае строятся линии на титрант и пробу на одном графике. Точка пересечения этих прямых будет точкой эквивалентности. Именно на этот показатель нужно ориентироваться в титровании на калориметре.
Преимущества и недостатки фотометрии
Особенность фотометрических методов определения элементного состава в получении стабильного цвета пробы, на время измерений. Важно контролировать рН раствора, так как комплексные окрашенные соединения теряют цвет в кислой среде. Важно подготовку проб и исследования проводить при постоянной температуре, соответствующей стандартным условиям.
Достоинства приборов:
- Определение малых концентраций ионов тяжелых и щелочноземельных металлов, сложных веществ.
- Высокая избирательность.
- Погрешность результатов 0,5-1,5%.
Недостатки:
- Методы ограничены трудностями приготовления эталонных растворов, когда в пробе присутствуют вещества, которые не определяются, но оказывают влияние на результат.
- Сложная подготовка проб для анализа. Необходимость градуировки или построения калибровочных графиков.
Заключение
Инструментальные методы анализов точнее, выполняются быстрее. Исключаются ошибки, связанные с применением нескольких этапов осаждения, выпаривания, прокаливания, экстракции. Точность многоступенчатых исследований ниже, погрешности суммируются.
Фотометрический и рентгенофлуоресцентный методы анализа при определении тяжелых металлов в питьевой воде
Одними из важнейших загрязнителей биосферы, представляющие наибольший интерес для различных служб контроля качества являются металлы (в первую очередь тяжелые, то есть имеющие атомный вес больше 40). В значительной мере это связано с биологической активностью многих из них.

С тяжелыми металлами человек встречается повсеместно – в воздухе, почве, пище, косметике, а также в питьевой воде. На организм человека и животных физиологическое действие металлов различно и зависит от природы металла, типа соединения, в котором он существует в природной среде, а также его концентрации. Многие тяжелые металлы проявляют выраженные комплексообразующие свойства.
Так, в водных средах ионы этих металлов гидратированы и способны образовывать различные гидроксокомплексы, состав которых зависит от кислотности раствора. Если в растворе присутствуют какие-либо анионы или молекулы органических соединений, что возможно в питьевой воде, то ионы этих металлов образуют разнообразные комплексы различного строения и устойчивости.
В ряду тяжелых металлов одни крайне необходимы для жизнеобеспечения человека и других живых организмов и относятся к так называемым биогенным элементам. Другие вызывают противоположный эффект и, попадая в живой организм, приводят к его отравлению или гибели. Эти металлы относят к классу ксенобиотиков, то есть чуждых живому.
Специалистами по охране окружающей среды среди металлов-токсикантов выделена приоритетная группа. В нее входят кадмий, медь, мышьяк, никель, ртуть, свинец, цинк, железо и хром как наиболее опасные для здоровья человека и животных.
Лаборатория санитарно-эпидемиологического и радиационного контроля ГБУ «Центр экспертиз, испытаний и исследований в строительстве» по заказу Комитета государственного строительного надзора города Москвы проводит оценку на соответствие СаНПин 2.1.4.1074-01 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества»содержания тяжелых металлов в пробах питьевых вод при вводе объекта в эксплуатацию.
Пробы воды анализируются на наличие таких тяжелых металлов, как железо, цинк, марганец.
Предельно допустимые концентрации (ПДК) для металлов в питьевой воде централизованного водоснабжения согласно СаНПин 2.1.4.1074-01 приведены в таблице.

Сотрудники ЛСЭРК осуществляют анализ проб воды на содержание металлов как фотометрическим, так и рентгенофлуоресцентным методами анализа.
Фотометрический метод анализа.
Фотометрический анализ – часть спектрофотометрического анализа, основанный на получении окрашенных (поглощающих видимый свет) растворов и количественном измерении поглощения света этими растворами с помощью приборов с фотоэлементами. В фотометрическом анализе применяют фотоэлектроколориметры, измеряющие поглощение света в некотором интервале длин волн, выделяемом светофильтрами. Чем выше концентрация поглощающего соединения в растворе, тем выше измеряемый сигнал (оптическая плотность). Это и позволяет определять концентрацию исследуемого раствора.
Сотрудники ЛСЭиРК проводят этот вид анализа на приборе Спектрофотометр Shimadzu UV-1800.

Рис.1 Спектрофотометр Shimadzu UV-1800

Рис. 2,3 Подготовка пробы к выполнению измерения концентрации железа и цинка фотометрическим методом в пробах питьевой воды.
Лаборатория СЭиРК аккредитована на несколько методик для определения металлов в воде фотометрическим методом:
- ГОСТ 4011-72 «Измерение концентрации общего железа с сульфосалициловой кислотой и с ортофенантролином»
- ПНДф 14.1:2.195-2003 «Измерение содержания ионов цинка фотометрическим методом с сульфарсазеном»
- ГОСТ 4974-2014 «Определение содержания марганца фотометрическими методами»
Рентгенофлуоресцентный анализ.
Метод рентгенофлуоресцентного анализа (РФА) основан на зависимости интенсивности рентгеновской флуоресценции от концентрации элемента в образце. При облучении образца мощным потоком излучения рентгеновской трубки возникает характеристическое флуоресцентное излучение атомов, которое пропорционально их концентрации в образце.
В ГБУ «ЦЭИИС» анализ осуществляется на приборе Спектроскан МАКС-GVM.

Рис. 4 Спектроскан МАКС-GVM
Подготовка проб проводится при помощи дополнительного оборудования.

Рис. 5 Перистальтический насос для подготовки проб РФА.
Фотометрический и рентгенофлуоресцентный методы анализа имеют свои преимущества и недостатки.
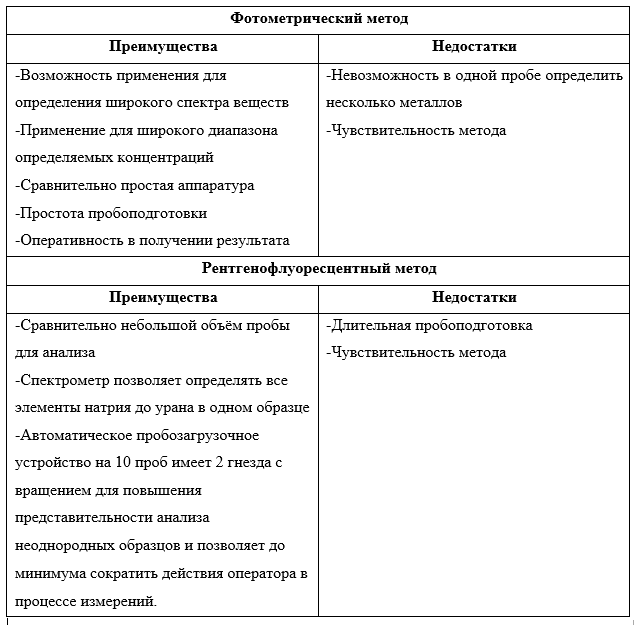
В лаборатории ГБУ «ЦЭИИС» был проведен сравнительный анализ результатов проб питьевой воды на содержание металлов цинка, железа и марганца двумя методами.
Полученные результаты приведены в таблице № 3.
Таб. 3 – Сравнительные результаты анализов фотометрии и РФА.
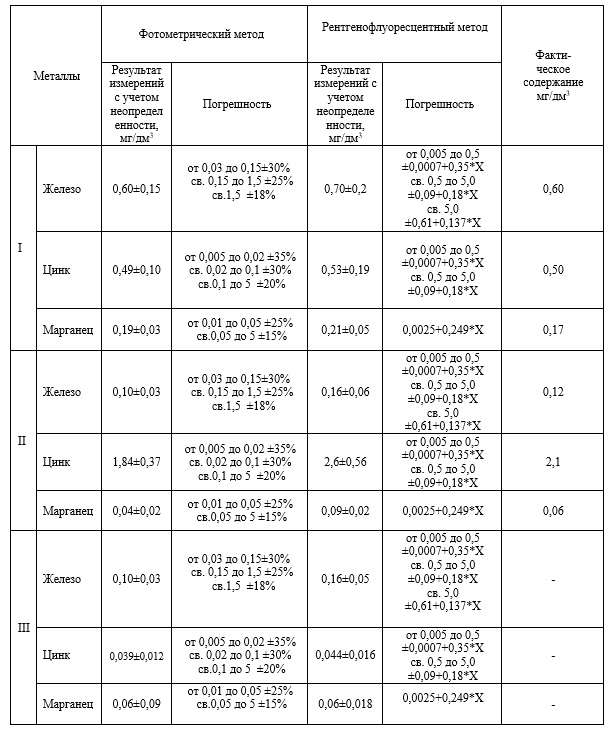
Для проведения анализа были использованы стандартные образцы проб с заданным содержанием металлов, а также проба, отобранная на одном из объектов капитального строительства. Как видно из сравнительной таблицы, близкие значения результатов фотометрического и рентгенфлуоресцентного методов анализа к фактическому содержанию, говорят о высокой точности и воспроизводимости методов.
Диапазон измерений массовой концентрации общего железа без разбавления пробы 0,05-2,00 мг/дм 3 (для фотометрического метода). В этом интервале суммарная погрешность измерения с вероятностью Р=0,95 находится пределах 0,01-0,03 мг/дм 3 .
Диапазон измерений железа от 0,005-50 мг/дм 3 (для РФА). Границы суммарной абсолютной погрешности измерений (при P =0,95) 0,002-7,5 мг/дм 3 .
Диапазон измеряемых концентраций цинка от 0,005 до 5,0 мг/дм 3 для обоих методов анализа. В этом интервале суммарная погрешность измерения с вероятностью Р=0,95 находится пределах 0,002-0,9 и 0,002-0,99 мг/дм 3 для фотометрического и РФА соответственно.
Содержание марганца измеряется в диапазоне от 0,01 до 5,0 мг/дм 3 включительно. Значение погрешности с доверительной вероятностью P-0,95 укладываются в интервал от 0,003 до 0,75 мг/дм 3 (для фотометрического анализа) и 0,005-1,25 мг/дм 3 (для РФА)
Лаборатория санитарно-экологического и радиационного контроля может использовать оба метода в своей работе, исходя из поставленных задач.
IX Международная студенческая научная конференция Студенческий научный форум - 2017

Оптические свойства воды оцениваются по её прозрачности, которая в свою очередь зависит от длины волны излучения, проходящего через воду. Вследствие поглощения оранжевых и красных компонентов света вода приобретает голубоватую окраску. Вода прозрачна только для видимого света и сильно поглощает инфракрасное излучение, поэтому на инфракрасных фотографиях водная поверхность всегда получается чёрной. Ультрафиолетовые лучи легко проходят через воду, поэтому растительные организмы способны развиваться в толще воды и на дне водоёмов, инфракрасные лучи проникают только в поверхностный слой. Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.
Питьевая вода — это вода, которая предназначена для безопасного неограниченного ежедневного и неограниченного потребления человеком и другими живыми биологическими существами. Основным отличием от столовых и минеральных вод является пониженное содержание солей, а также наличие действующих стандартов на общий состав и свойства (СанПиН 2.1.4.1116-02 — для вод, расфасованных в ёмкости и СанПиН 2.1.4.1074-01 — для централизованных систем водоснабжения).
Вода многих источников пресной воды непригодна для питья людьми, так как может служить источником распространения болезней или вызывать долгосрочные проблемы со здоровьем, если она не отвечает определённым стандартам качества воды. Вода, не наносящая вред здоровью человека и отвечающая требованиям действующих стандартов качества называется питьевой водой. В случае необходимости, чтобы вода соответствовала санитарно-эпидемиологическим нормам, её очищают или, официально говоря, «подготавливают» с помощью установок водоподготовки.
Источники питьевой воды
Основным источником питьевой воды является природная вода, которую очищают и обеззараживают муниципальные службы, осуществив все этапы водоподготовки и водоочистки, необходимые для получения сначала технической, а после водопроводной воды. В России основными являются водохранилища, реки, озёра. Доля подземных вод не велика. В целом источники следующие:
Дождевая и талая вода;
Подземные источники, колодцы, артезианская скважина, родники;
Водозабор из водохранилищ, рек, озёр;
Вода из айсбергов.
Вода делится на артезианскую, питьевую, минеральную, очищенную, газированную, ключевую и воду из скважины. (согласно ГОСТ 51232-98 "Вода питьевая. Общие требования к организации и контролю качества.")
Анализ питьевой воды на тяжёлые металлы.
В настоящее время термином «тяжелые металлы» обозначают ряд химических элементов, обладающими определенными химическими свойствами, а также токсичностью для человеческого организма, и достаточно распространены в природе. Некоторые из них, такие как железо, цинк, медь, молибден, участвуют в определенных биологических процессах и необходимы для организма в небольших количествах. Однако, важно, чтобы эти количества не были превышены, иначе эффект для здоровья будет негативный. Другие металлы, такие как ртуть, кадмий, мышьяк, свинец, токсичны для организма даже в малых количествах.
Тяжелые металлы в окружающей среде
В связи с развитием химического производства, металлургической и других видов промышленности, а также ростом количества техногенных отходов, контроль над содержанием тяжелых металлов в окружающей среде, а тем более в воде, становится все более актуальным. В основном источником тяжелых металлов в воде становятся сточные воды предприятий и городские стоки. Но происходит и поступление из атмосферы, так как выхлопные газы автомобилей, отходы сжигания угля в котельных и некоторые промышленные газовые выбросы так же содержат тяжелые металлы. Известно, что тяжелые металлы могут легко мигрировать из хранилищ отходов производства и мест городских свалок в грунтовые и речные воды, многие из них образуют стойкие органические соединения, которые переносятся на большие расстояния от источника. Водные растения, микроорганизмы и большинство видов рыб обладают способностью аккумулировать тяжелые металлы из воды, именно поэтому требованиями к качеству воды рыбохозяйственных водоемов установлены очень низкие ПДК для тяжелых металлов.
Распространённые тяжёлые металлы
Кадмий. Достаточно рассеянный и редкий элемент. Техногенным источником кадмия в природных водах обычно являются сточные воды рудообогатительных предприятий, металлургических и химических производств. Кадмий медленно выводится из организма, поэтому его относят к кумулятивным, к накапливающимся ядам. Соединения кадмия высокотоксичны. Особенно пары оксида кадмия. В организме кадмий встраивается в белковые молекулы, нарушая их работу. В результате поражается центральная нервная система, печень и почки, хроническое отравление приводит к анемии и разрушению костей, острое отравление может приводить к летальному исходу. Предельно допустимые концентрации кадмия: 0,001 в питьевой воде (СанПиН 1074-01); 0,001 в природных водах (ГН 2.1.5.1315-03)
Виды анализов воды на тяжёлые и токсичные металлы
Существует несколько методик анализа воды на тяжелые металлы. Наиболее простым с точки зрения проведения анализа является многоэлементный анализ на атомно-эмиссионном спектрометром, позволяющий за один анализ получать данные о концентрациях всех элементов. Также существуют методики определения каждого элемента в отдельности — фотометрические, флуориметрические и др.
Атомно-эмиссионная спектрометрия(АЭС) — совокупность методов элементного анализа, которые основаны на изучении спектров испускания свободных атомов и ионов газовой фазе. Обычно эмиссионные спектры регистрируют в наиболее удобной оптической области длин волн приблизительно от 200 до 1000 нм.
Фотометрический анализ(ФА) - совокупность методов молекулярно -абсорбционного спектрального анализа, основанных на избирательном поглощении электромагнитного излучения в видимой, ИК и УФ областях молекулами определяемого компонента или его соединений с подходящим реагентом. ФА включает визуальную фотометрию, спектрофотометрию и фотоколориметрию. Последняя отличается от спектрофотометрии тем, что поглощение света измеряют в видимой области спектра, реже - в ближних УФ и ИК областях (т. е. в интервале длин волн приблизительно от 315 до 980 нм), а также тем, что для выделения нужного участка спектра (шириной 10-100 нм) используют не монохроматоры, а узкополосные светофильтры.
Флуориметрический (люминесцентный) анализ основан на измерении излучения (интенсивности или суммы света), который возникает в результате выделения избыточной энергии возбужденными молекулами анализируемого вещества.
Анализ воды на тяжелые металлы подразумевает определение концентраций рядя элементов. Некоторые из них являются токсичными для человека, другие же необходимы для жизнедеятельности организма, однако превышение их концентраций вредно для здоровья. Поэтому рекомендуется контролировать их содержание в воде.
В условиях лаборатории анализ питьевой воды лучше проводить с помощью фотометрического метода.
Для проведения анализа концентрации меди в питьевой воде потребуется 250 см 3 воды,для анализа свинца- 1 дм 3 , для анализа молибдена - 200 см 3 , для анализа железа - 200 см 3 , для анализа марганца - 1 дм 3 воды.
При фотометрическом колориметрировании меди используют синий светофильтр (=430 нм) и кювету с толщиной рабочего слоя 50 мм. Из измеренной оптической плотности исследуемой пробы вычитают оптическую плотность контрольной пробы.
Интенсивность окраски раствора свинца в воде измеряют фотометрически, пользуясь шкалой стандартных растворов, приготовленной в тех же условиях, что и исследуемая проба воды.Измерение оптической плотности проводят с зеленым светофильтром (=515 нм), используя кювету с толщиной рабочего слоя 2 см. Из найденных значений оптической плотности каждого раствора вычитают оптическую плотность холостого определения. (по ГОСТ 18293-72 Вода питьевая. Методы определения содержания свинца, цинка, серебра.)
С помощью шкалы стандартных растворов определяется содержание свинца α= 0,031 мг/дм 3 .
С помощью шкалы определяют концентрацию молибдена С= 0,052 мг/дм 3 .
Измеряют оптическую плотность окрашенных растворов железа в воде, используя фиолетовый светофильтр (=400-430 нм) и кюветы с толщиной оптического слоя 2, 3 или 5 см 3 . Массовую концентрацию общего железа находят по градуировочному графику. (по ГОСТ 4011-72 Вода питьевая. Методы измерения массовой концентрации общего железа.)
С помощью градуировочного графика определяют концентрацию железа С= 0,0012 мг/дм 3 . Оптическую плотность стандартных растворов марганца в воде измеряют на фотоколориметре с зеленым светофильтром (=530 нм), используя кюветы с толщиной рабочего слоя 20-50 мм. (по ГОСТ 4974-72 Вода питьевая. Методы определения содержания марганца.) С помощью стандартной шкалы определяют концентрацию марганца α =0,00012 мг/дм 3 .
Список используемой литературы
ЭЛЕКТРОКОАГУЛЯЦИОННАЯ ОЧИСТКА ВОДЫ ОТ КОЛЛОИДНЫХ ПАВБоровская Л.В., Доценко С.П.Современные наукоёмкие технологии. 2010. №4.С.76-78
ФИЗИЧЕСКАЯ ХИМИЯ. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА (ЭЛЕКТРОННЫЙ УЧЕБНИК) Данилин В.Н., Боровская Л.В., Шурай П.Е.
Международный журнал экспериментального образования. 2009. №4 С.10
ФИЗКОЛЛОИДНАЯ ХИМИЯ (ЭЛЕКТРОННЫЙ УЧЕБНО-МЕТОДИЧЕСКИЙ КОМПЛЕКС) Боровская Л.В.
VII Международная студенческая научная конференция Студенческий научный форум - 2015
Фотометрический метод анализа (Фотометрия)- совокупность методов мол.-абсорбционного спектрального анализа, основанных на избират. поглощении электромагнитного излучения в видимой, ИК и УФ областях молекулами определяемого компонента или его соединения с подходящим реагентом. Концентрацию определяемого компонента устанавливают по закону Бугера -Ламберта - Бера. Фотометрический метод включает визуальную фотометрию, спектрофотометрию и фотоколориметрию. Последняя отличается от спектрофотометрии тем, что поглощение света измеряют гл. обр. в видимой области спектра, реже - в ближних УФ и ИК областях (т. е. в интервале длин волн от ~ 315 до ~ 980 нм), а также тем, что для выделения нужного участка спектра (шириной 10-100 нм) используют не моно-хроматоры, а узкополосные светофильтры.
Приборы
Приборами для фотоколориметрии служат фотоэлектроколориметры (ФЭК), характеризующиеся простотой оптической и электрической схем. Большинство фотометров имеет набор из 10-15 светофильтров и представляет собой двухлучевые приборы, в которых пучок света от источника излучения (лампа накаливания, редко ртутная лампа) проходит через светофильтр и делитель светового потока (обычно призму), который делит пучок на два, направляемые через кюветы с исследуемым р-ром и с р-ром сравнения. После кювет параллельные световые пучки проходят через калиброванные ослабители (диафрагмы), предназначенные для уравнивания интенсивностей световых потоков, и попадают на два приемника излучения (фотоэлементы), подключенные по дифференциальной схеме к нуль-индикатору (гальванометр, индикаторная лампа). Недостаток приборов - отсутствие монохроматора, что приводит к потере селективности измерений; достоинства фотометров - простота конструкции и высокая чувствительность благодаря большой светосиле. Измеряемый диапазон оптической плотности составляет приблизительно 0,05-3,0, что позволяет определять мн. элементы и их соед. в широком интервале содержаний - от ~ 10-6 до 50% по массе. Для дополнительного повышения чувствительности и селективности определений существенное значение имеют подбор реагентов, образующих интенсивно окрашенные комплексные соед. с определяемыми веществами, выбор состава р-ров и условий измерений. Погрешности определения составляют около 5%.При т. наз. дифференциальном Фотометрическом анализе оптическая плотность анализируемого р-ра измеряют относительно оптической плотности (которая не должна быть меньше 0,43) раствора сравнения. Последний содержит определяемый компонент в концентрации, близкой к концентрации этого компонента в анализируемом растворе. Это позволяет определять сравнительно большие концентрации в-в с погрешностью 0,2-1% (в случае спектрофотометрии). При фотометрическом титровании получают зависимость оптич. плотности титруемого раствора от объема прибавляемого титранта (кривую титрования). По излому на этой кривой определяют конечную точку титрования и, следовательно, концентрацию исследуемого компонента в растворе.Иногда Фотометрический анализ понимают более широко, как совокупность методов качественного и количественного анализа по интенсивности ИК, видимого и УФ излучения, включающую атомно-абсорбционный анализ, фотометрию пламени, турбидиметрию, нефелометрию, люминесцентный анализ, спектроскопию отражения и мол .-абсорбционный спектральный анализ.[1]
Определение концентрации
По окраске растворов окрашенных веществ можно определять концентрацию того или иного компонента или визуально, или при помощи фотоэлементов -- приборов, превращающих световую энергию в электрическую. В соответствии с этим различают фотометр'ический визуальный метод анализа, называемый часто колориметрическим, и метод анализа с применением фотоэлементов-- собственно фотометрический метод анализа. Фотометрический метод является объективным методом, поскольку результаты его не зависят от способностей наблюдателя, в отличие от результатов колориметрического субъективного метода.
Фотометрический метод анализа -- один из самых старых и распространенных методов физико-химического анализа. Его распространению способствовали сравнительная простота необходимого оборудования, особенно для визуальных методов, высокая чувствительность и возможность применения для определения почти всех элементов периодической системы и большого количества органических веществ. Открытие все новых и новых реагентов, образующих окрашенные соединения с неорганическими ионами и органическими веществами, делает в настоящее время применение этого метода почти неограниченным. Фотометрический метод анализа может применяться для большого диапазона определяемых концентраций. Его используют как для определения основных компонентов различных сложных технических объектов с содержанием до 20--30% определяемого компонента, так и для определения микропримесей в этих объектах при содержании их до 10-3 -- 10-4%. Комбинирование фотометрических методов с некоторыми методами разделения -- хроматографическим, экстракционным позволяет на 1--2 порядка повысить чувствительность определения, доведя «его до 10-5.
В некоторых случаях фотометрический метод может быть применен для одновременного определения в растворе нескольких ионов, хотя, как это будет показано ниже, его возможности ограничены. Очень ценно использование фотометрических методов для решения многих теоретических вопросов аналитической и физической химии [2].
Измерение света
Фотометрия, раздел прикладной физики, занимающийся измерениями света. С точки зрения фотометрии, свет - это излучение, способное вызывать ощущение яркости при воздействии на человеческий глаз. Такое ощущение вызывает излучение с длинами волн от ~0,38 до ~0,78 мкм, причем самым ярким представляется излучение с длиной волны ок. 0,555 мкм (желто-зеленого цвета). Поскольку чувствительность глаза к разным длинам волн у людей неодинакова, в фотометрии принят ряд условностей. В 1931 Международная комиссия по освещению (МКО) ввела понятие «стандартного наблюдателя» как некоего среднего для людей с нормальным восприятием. Этот эталон МКО - не что иное, как таблица значений относительной световой эффективности излучения с длинами волн в диапазоне от 0,380 до 0,780 мкм через каждые 0,001 мкм. Яркость, измеренная в соответствии с эталоном МКО, называется фотометрической яркостью или просто яркостью. фотометрический метод анализа. [3].
Фотометрические методы определения концентрации вещества в растворе.
Метод градуированного графика: Для определения содержания вещества методом градуи-ровочного графика готовят серию из 5-8 стандартных растворов разных концентраций (не менее 3 параллельных растворов для каждой точки).
При выборе интервала концентраций стандартных растворов руководствуются следующими положениями: он должен охватывать область возможных изменений концентраций исследуемого раствора, желательно, чтобы оптическая плотность исследуемого раствора соответствовала примерно середине градуировочной кривой; желательно, чтобы в этом интервале концентраций при выбранных толщины кюветы I и аналитической длины волны л соблюдался основной закон светопоглощения, т. е. график D = /(С) был линейным; интервал рабочих значений D, соответствующий интервалу стандартных растворов, должен обеспечивать максимальную воспроизводимость результатов измерений. При совокупности перечисленных условий измеряют оптические плотности стандартных растворов относительно растворителя и строят график зависимости D = /(С).
Полученная кривая называется градуировочной (градуи-ровочным графиком).Определив оптическую плотность раствора Dx, находят ее значения на оси ординат, а затем на оси абсцисс — соответствующее ей значение концентрации Сх. Этот метод применяют при выполнении серийных фотометрических анализов. Метод добавок: Метод добавок представляет собой разновидность метода сравнения. Определение концентрации раствора этим методом основано на сравнении оптической плотности исследуемого раствора и того же раствора с добавкой известного количества определяемого вещества. Метод добавок обычно применяют для упрощения работы, для устранения мешающего влияния посторонних примесей, в ряде случаев для оценки правильности методики фотометрического определения. Метод добавок требует обязательного соблюдения основного закона светопоглощения. При соблюдении основного закона светопоглощения и постоянной толщине слоя отношение оптических плоскостей исследуемого раствора и исследуемого раствора с добавкой будет равно отношению их концентраций [4].
Аппаратура
Узел источника света состоит из собственного источника света, стабилизатора напряжения и в некоторых случаях контрольных приборов – амперметра и вольтметра для контроля постоянства силы тока и напряжения. В некоторых простейших конструкциях колориметров, например, КОЛ-52, фотометр ФМ и др., стабилизаторы и контрольные приборы отсутствуют. В качестве источников света в зависимости от используемой области спектра применяют различные приборы. Для получения света далёкой ультрафиолетовой области 220-230 нм используют водородную лампу или лампу накаливания для области близкого ультрафиолета и видимой части спектра 320 – 800 нм. В иностранных спектрофотометрах для этой цели применяют вольфрамовые и дейтериевые разрядные лампы. Для получения света видимой области спектра применяют обычные лампы накаливания. Для получения света инфракрасной области спектра применяют глобар-стержень из карбида кремния или штифт Нернста – стержень из смеси окислов редкоземельных элементов. Эти стержни при накаливании их электрическим током до 1200 – 20000С испускают интенсивный поток инфракрасных лучей. При всех фотометрических измерениях необходим устойчивый поток световых лучей. Это обеспечивается в первую очередь стабильным режимом накаливания. Поэтому лучшие модели фотометрических приборов обязательно снабжены стабилизатором напряжения, налагаемого на источник лучистого потока. Контроль за работой стабилизатора целесообразно вести путём измерения силы тока, проходящего через осветитель, или напряжения, которое на него подаётся. В некоторых случаях, когда эти приборы отсутствуют в фабричных моделях, их подсоединяют дополнительно. Кроме того, за стабильностью работы осветителя можно наблюдать и при помощи узла определения интенсивности света. Монохраматизация может осуществлена при помощи: светофильтров, призм и дифракционных решеток [5].
Примеры использования метода для определения тяжелых металлов в природных водах.
На протекание естественных процессов в воде большое влияние оказывает содержание в ней тяжелых металлов. Были проведены исследования, целью которых являлась количественная оценка загрязнения реки Кальмиус тяжелыми металлами. Результаты данного исследования показали, что одним из тяжелых металлов, требующих оперативного контроля, является Сr+6 , поступающий в водоемы со сточными водами гальванических цехов машиностроительных, авиационных, автомобильных заводов, предприятий химической, кожевенной промышленности и пр. В речных загрязненных и слабозагрязненных водах концентрация Сr+6 колеблется от нескольких десятых долей мг/дм3 до нескольких мг/дм3 . Из-за высокой токсичности содержание Сr+6 в водоемах нормировано и не должно превышать ПДК, равной 0,05 мг/дм3 . Одним из обязательных условий контроля содержания Сr+6 в природных водах является оперативность его определения, так как хранение проб невозможно в связи с переходом +6 в анаэробных условиях в Сr+3 .[6,7] Широкое распространение получил метод фотометрического определения Сr+6 с применением дифенилкарбазида, позволяющий оперативно определять содержание Сr+6 в пробах природной воды.Однако, согласно метрологическим характеристикам данного метода, минимально определяемая концентрация Сr+6 составляет лишь 30 мг/дм3 .Поэтому для существенного повышения чувствительности (в 30 раз) применяют экстракционно-фотометрический метод, который заключается в экстракции определяемого вещества с его последующим фотометрическим определением. Этот метод применяется при анализе сложных смесей, когда нужно определить малые количества одних веществ в присутствии больших количеств других, при определении примесей в присутствии основных компонентов, а также в тех случаях, когда непосредственное определение интересующего элемента в смеси связано с большими трудностями. При экстракции малых количеств примесей происходит не только их выделение, но и концентрирование. Поэтому экстракционно-фотометрический метод приобретает особо важное значение в связи с определением малых количеств примесей в веществах высокой степени чистоты, широко применяемых в атомной и полупроводниковой технике. Экстракционно-фотометрические методы анализа являются высокочувствительными методами, они быстро развиваются и очень перспективны. Следовательно, экстракционно-фотометрический метод позволяет определять содержание Сr+6 в поверхностных водах на уровне 1-30 ПДК и может быть использован при оперативном контроле, в том числе в условиях работы передвижной гидрохимической лаборатории. При этом методе можно проводить измерения в потоке воды, проба может последовательно проходить несколько различных кювет, где можно измерить другие параметры, может использоваться установка на участке сброса вод, измерения могут проводится периодически, не нужен постоянный контроль, для определения концентрации хрома в воде впрыскивается избыточное количество экстракта, которое связывает почти 100% ионов хрома, что позволяет более точно провести измерения. Так как в качестве экстракта была выбрана суспензия, то прошедший через нее поток быстро затухает, и поэтому в качестве информативного параметра был выбран отраженный поток, который зависит от длины волны источника излучения и концентрации ионов хрома.
Так как источник излучения частотно зависим и спектр поглощения ограничен, то в качестве источника излучения выбирается светоизлучающий диод (СИД) с длиной волны l=540 нм, что соответствует максимуму спектра поглощения и обеспечивает избирательность метода. Функцию избирательности можно усилить введением дополнительно оптического фильтра на длине волны l=540 нм с полосой пропускания 25±10 нм.
Фотометр представляет собой прибор для канала измерительной автоматизированной системы контроля сточных вод (такие системы обслуживаются раз в 2 недели), в котором измеряется концентрация ионов хрома Сr+6 . Также в данной системе могут быть каналы измерения других величин. Например, на измерение Сr+6 оказывает влияние уровень рН (учет данного фактора позволяет уменьшить погрешность с 6-7% до 3-4%). Для учета и оптимизации уровня рН при измерении концентрации ионов хрома Сr+6 целесообразно вводить в пробу необходимое (дозированное) количество кислоты Н2 SO4 . На измерение рН в свою очередь влияет температура. Поэтому уровень рН и температуры необходимо измерять. В результате имеем многоканальную систему, состоящую, как минимумом, из трех каналов измерения: рН, температуры и концентрации ионов хрома Сr+6
Влияние рН на результаты фотометрического измерения. При уменьшении кислотности среды, т. е. при повышении рН раствора, катионы металла, как правило, взаимодействуют с ОН-ионами, образуя в конечном счете малорастворимые гидроксиды или основные соли. Окрашенное соединение при этом разрушается [6]. Малорастворимое соединение может и не образоваться, тем не менее участие определяемых катионов в сопряженном комплексообразовании с ОН-ионами значительно уменьшает условную константу устойчивости окрашенного комплекса и, следовательно, приводит к уменьшению степени связанности определяемого иона в окрашенное соединение. Особенно сильное влияние наблюдается для малопрочных комплексов, которые при увеличении рН раствора могут быть разрушены полностью. Поэтому реакции образования окрашенных соединений ионов металлов с анионами сильных кислот целесообразно проводить в достаточно кислых средах, где условная константа устойчивости окрашенного комплекса сохраняет свое наибольшее значение. Окрашенные комплексы с анионами слабых кислот. Когда в качестве реагентов используют слабые органические кислоты HR (салициловая кислота, ализарин, диметилглиоксим и др.), изменение рН раствора оказывает очень сильное, хотя внешне и не всегда заметное, влияние. Полнота связывания иона М в окрашенное соединение MRn зависит от концентрации в растворе анионов реагента R– которая в свою очередь зависит от концентрации Н+ в растворе. В кислых растворах концентрация R– бывает невелика, так как равновесие ионизации слабой кислоты HR сильно смещено в сторону недиссоциированной (кислотной) формы реагента. Увеличить концентрацию R– путем повышения общей концентрации реагента не всегда удается, поскольку слабые органические кислоты часто имеют ограниченную растворимость. В этом случае концентрацию увеличивают повышением рН раствора, которое смещает равновесие ионизации кислоты в сторону его солевой формы R. Таким образом, реакции образования окрашенных соединений ионов металлов с анионами слабых кислот следует проводить по возможности в менее кислых средах. Однако уменьшение концентрации Н+ необходимо осуществлять очень осторожно, так как при повышении рН раствора может происходить образование основных солей или гидроксидов определяемых металлов; может изменяться состав окрашенного соединения вследствие ступенчатости комплексообразования. В некоторых случаях, когда влияние конкурирующего комплексообразования ОН-ионов преобладает над влиянием депротонирования реагента, повышение рН раствора может привести к противоположным результатам, т. е. к уменьшению степени связанности иона М в окрашенное соединение. Поэтому максимальный выход светопоглощающего комплекса будет наблюдаться только в определенном интервале значений рН раствора [7].
Литература:
Булатов М.И., Калинкин И.П. Практическое руководство по фотометрическим методам анализа -5-е изд., перераб.- Л.: Химия, 1986. - 432 с.
Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. В двух книгах: кн..1 – М.: Химия, 1990,-480с.
Лаврухина А.К., Юкина Л.В. Аналитическая химия хрома. Серия: «Аналитическая химия элементов», М.: Наука, 1979. - 214с.
Лурье Ю.Ю. Аналитическая химия производственных сточных вод / Ю.Ю. Лурье; М.: ХимияЮ, 1984. - 448с.
Т.Н. Куркова, Е.П. Залецкене Экстракционно-фотометрические реакции – метод анализа природных объектов на содержание галогенид-ионов
Исследование любого пищевого продукта – сложная аналитическая задача из–за индивидуальности и многокомпонентности его состава. В связи с загрязнением окружающей среды одной из важнейших задач аналитической химии является определение малых содержаний следов тяжелых металлов, пестицидов, канцерогенов и т.д. Среди разнообразных физико–химических методов анализа широкое распространение получили фотометрические методы, которые используют для определения физико–химических показателей качества продовольственного сырья и готовых продуктов питания, их пищевой ценности и безопасности. Оптические методы используют для определения большинства химических элементов, сахаров, белков, витаминов, жиров, пектиновых веществ.
Фотометрический метод анализа – один из самых распространенных методов физико-химического анализа. Его распространению способствовали сравнительная простота необходимого оборудования, особенно для визуальных методов, высокая чувствительность и возможность применения для определения почти всех элементов периодической системы и большого количества органических веществ. Открытие новых реагентов, образующих окрашенные соединения с неорганическими ионами и органическими веществами, делает в настоящее время применение этого метода почти неограниченным.
Фотометрический метод анализа может применяться для большого диапазона определяемых концентраций. Его используют как для определения основных компонентов различных сложных технических объектов с содержанием до 20-30% определяемого компонента, так и для определения микропримесей в этих объектах при содержании их до 10 -3 – 10 -4 %. В фотометрических методах используют избирательное поглощение света молекулами анализируемого вещества. Согласно квантовой механике свет представляет собой поток частиц, называемых квантами или фотонами. Энергия каждого кванта определяется длиной волны излучения. В результате поглощения излучения молекула поглощающего вещества переходит из основного состояния с минимальной энергией в более высокое энергетическое состояние. Электронные переходы, вызванные поглощением строго определенных квантов световой энергии, характеризуются наличием строго определенных полос поглощения в электронных спектрах поглощающих молекул. Фотометрический метод включает визуальную фотометрию (колориметрию), фотоколориметрию и спектрофотометрию.
В основе количественного определения лежит закон Бугера – Ламберта – Бера, который устанавливает прямо пропорциональную зависимость между оптической плотностью и концентрацией вещества в исследуемом растворе [1]. Этапы количественного фотометрического анализа включают: перевод определяемого вещества в окрашенную форму; получение спектра поглощения исследуемого вещества и выбор спектральной области, соответствующей максимуму полосы поглощения определяемого компонента; получение зависимости оптической плотности раствора от концентрации вещества, взятого в качестве стандарта при длине волны λmax; определение концентрации вещества. Оптическую плотность растворов измеряют с помощью фотоколориметров и спектрофотометров. Измерение оптической плотности производят по отношению к раствору сравнения.
Фотометрический анализ используется в виноградарстве и виноделии для определения разнообразных органических соединений и минеральных элементов. Разработаны методики фотометрического определения фенолов в колбасных изделиях, белков в молочных продуктах, суммарного содержания сахаров в кондитерских изделиях, крахмала в муке и зерне, β-каротина в соках, кофеина в кофе и чае и др. [2].
Васильев В.Т. Аналитическая химия. В 2 кн. Кн. 2. Физико-химические методы анализа. – М.: Дрофа, 2005. – 383 с.
Коренман Я.И. Практикум по аналитической химии. Анализ пищевых продуктов: В 4-х кн. - Кн.2. Оптические методы анализа. – М.: КолосС, 2005. – 288 с.
Читайте также:
