Осаждение белка солями тяжелых металлов уравнение
Обновлено: 05.10.2024
Реакция высаливания обусловлена дегидратацией макромолекул белка с одновременной нейтрализацией электрического заряда. Высаливание белков сернокислым аммонием может быть использовано для разделения белков друг от друга и получения их в кристаллическом виде. Например, глобулины сыворотки крови, имеющие большой молекулярный вес и меньший заряд легче высаливаются, чем альбумины. Глобулины осаждаются в полунасыщенном, а альбумины - в насыщенном растворе сернокислого аммония.
Высаливание белков – обратимый процесс. Осадок белка может вновь раствориться в воде после уменьшения концентрации солей. При этом белок не теряет своих естественных биологических свойств.
Ход работы.В пробирку поместить 2 мл сыворотки крови и добавить равный объем насыщенного раствора сернокислого аммония, перемешать. Получается полунасыщенный раствор сернокислого аммония, в котором выпадает осадок глобулина.
Осадок отфильтровать через бумажный фильтр в пробирку. К фильтрату добавить сухой сернокислый аммоний до полного насыщения раствора. Выпавший осадок альбумина отфильтровать через бумажный фильтр. Проверить фильтрат на отсутствие белка с помощью биуретовой реакции.
Для доказательства обратимости высаливания, полученные осадки прямо на фильтрах смочить с 2-3 мл дистиллированной воды и отметить их растворение.
Работа № 2. Осаждение белков при кипячении.
При нагревании почти все белки денатурируют и выпадают в осадок. При этом разрушаются водородные связи, происходит изменение вторичной и третичной структуры белка, белок теряет глобулярную форму и на поверхность молекулы, вместо гидрофильных групп, выходят гидрофобные. В сильнокислых и щелочных средах растворы белков при кипячении не коагулируют и могут дать осадок лишь при добавлении какой-нибудь нейтральной соли (NaCl). В этих случаях устойчивость белка в растворе зависит от приобретения положительного заряда в сильно-кислой среде и отрицательного заряда в щелочной. Наиболее легко белки подвергаются тепловой денатурации в изоэлектрической среде.
Клинико-диагностическое значение.Осаждение белков кипячением используется для качественного обнаружения белка в моче.
Ход работы.В 5 пробирок налить по 0,5 мл сыворотки. В 3-ю пробирку добавить 10 капель 1% раствора уксусной кислоты, для создания кислой среды. В 4-ю пробирку 10 капель 1% раствора уксусной кислоты и 5 капель насыщенного раствора поваренной соли. В 5-ю пробирку добавить 5 капель 10% раствора щелочи.
Все пробирки прокипятить. После кипячения во 2-ю пробирку добавить 1-2 капли 1% раствора уксусной кислоты.
Записать в таблицу результаты осаждения белка при кипячении. Отметить появление осадка плюсом, а отсутствие минусом и указать в каждом случае причины появления или отсутствия осадка белка.
| Реакция среды | Нейтральная | Слабокислая | Сильнокислая | Сильнокислая с электролитом | Щелочная |
| Результат | |||||
| Вывод |
Работа № 3. Осаждение белков солями тяжелых металлов.
Осаждение белков солями тяжелых металлов происходит при небольших концентрациях этих солей. Белки при взаимодействии с солями тяжелых металлов (свинца, меди, серебра, ртути и др.) адсорбируют их, образуя с ними солеобразные и комплексные соединения, растворимые в избытке солей. Клиническое значение: способность белка прочно связывать ионы тяжелого металла, в виде нерастворимых осадков в воде, позволяет использовать их как противоядие при отравлении солями ртути, меди, свинца и другими тяжелыми металлами.
А) Осаждение белков медным купоросом.
Налить в пробирку 1 мл раствора белка и по каплям добавить 10% раствор CuSO4 до образования осадка, нерастворимого в воде. При добавлении 10% раствора CuSO4 в большом объеме наблюдают растворение осадка в избытке реактива. Растворение осадка в избытке солей называется адсорбционной пептизацией. Данное явление происходит вследствие возникновения одноименного положительного заряда на частицах белка.
Б) Осаждение белков уксуснокислым свинцом.
К 1,0 мл раствора белка добавить 2-5 капель 5% раствора уксуснокислого свинца до образования осадка.
РЕАКЦИИ ОСАЖДЕНИЯ БЕЛКОВ. ВЫСАЛИВАНИЕ БЕЛКОВ
Важным фактором устойчивости белков в растворе является наличие около частиц белка гидратной оболочки. Если к раствору белка прибавить соль, например (NH4)2SO4, Na2SO4, NaCl и др., то вследствие разрушения водных оболочек частицы белка обычно слипаются друг с другом, укрупняются и выпадают в осадок. Разные белки высаливаются при неодинаковых концентрациях одних и тех же солей. Глобулины, например, осаждаются в полунасыщенном растворе сернокислого аммония, тогда как альбумины — в насыщенном растворе этой соли. Высаливание белков является обратимой реакцией. Денатурации белков при этом не происходит.
Ход работы: Наливают в пробирку 1-1,5 мл раствора белка, добавляют равный объем насыщенного раствора сульфата аммония. Наблюдают выпадение белого хлопьевидного осадка глобулинов. Мутную жидкость фильтруют через сухой складчатый фильтр. К фильтрату добавляют при перемешивании избыток сульфата аммония в порошке до прекращения его растворения. Появляется муть или хлопья выпадающих в осадок альбуминов. К осадку добавляют 2-3 кратное по объему количество воды и убеждаются в способности осадка к растворению.
2. Осаждение белков спиртом.
Спирт дегидратирует белки, вследствие чего происходит их коагуляция, агрегация и осаждение. Реакция осаждения белков спиртом при непродолжительном контакте его с белком обратима.
Ход работы: В пробирку наливают около 2 мл раствора белка, добавляют несколько кристалликов NaCl и по каплям этиловый спирт до образования хлопьев. После оседания хлопьев белка, сливают жидкость над ними, к осадку приливают воду, наблюдая растворение белка.
3. Осаждение белков солями тяжелых металлов.
Соли тяжелых металлов, например СuSO4, HgCl2, (CH3COOH)2Pb др., осаждают белки из растворов необратимо, что связано с образованием белково-металлических нерастворимых в воде комплексных соединений. При этом белки денатурируют. Структуры белка (кроме первичной) полностью разрушаются. Такой белок теряет способность выполнения свойственной ему функции. Изменяются при этом и физико-химические его свойства, белок теряет свою растворимость. Процесс денатурации, как правило, необратим.
Ход работы: В пробирку наливают около 2 мл раствора белка и прибавляют медленно по каплям раствор соли тяжелого металла (1%-ного раствора сульфата меди или 5%-ного раствора ацетата свинца).
Наблюдают коагуляцию белка. Выпавшие хлопья от прибавления воды не растворяются.
4. Осаждение белков органическими кислотами.
Трихлоруксусная кислота является специфическим реактивом на белок. Она осаждает только белки и не осаждает продукты распада белка и аминокислоты, поэтому ею пользуются для полного удаления белков из биологических жидкостей (например, сыворотки крови, молока). В этих условиях продукты распада белков остаются в растворе.
Ход работы: В пробирку наливают 2-3 мл раствора белка и добавляют несколько капель 5%-ного раствора трихлоруксусной кислоты. Наблюдают выпадение осадка белка.
5. Осаждение белков при нагревании.
При нагревании белки денатурируют. Денатурация сопровождается изменением структуры белковых молекул с нарушением соотношения гидрофильных и гидрофобных групп в сторону увеличения последних. Такое изменение структуры молекул приводит к потере нативных свойств белка, в том числе к потере его растворимости.
В пробирку наливают 3-5 мл раствора яичного белка, вставляют в нее термометр и раствор нагревают до образования хлопьев. Замечают, при какой температуре образовались хлопья. Проверяют реакцию на обратимость.
Белок не выпадает в осадок, если среда, в которой он растворен, будет сильнокислая или сильнощелочная. Белковая молекула будет нести определенный заряд — положительный в кислой среде и отрицательный — в щелочной среде. При этом устойчивость белка повышается в результате электростатических сил отталкивания, и белок не выпадает в осадок.
Ход работы: В четыре пробирки налить раствор белка. Во вторую добавить несколько капель разведенной уксусной кислоты, в третью — крепкой ледяной уксусной кислоты, в четвертую — несколько капель щелочи. Все четыре пробирки прокипятить. Отметить изменения.
Пробирку с крепкой уксусной кислотой осторожно нейтрализовать щелочью, отметив изменения.
Интегрированный урок химии и биологии "Белки – основа жизни, их свойства и биологические функции". 10-й класс
Тип урока: Комбинированный урок.
Образовательная
– познакомить учащихся с основными химическими свойствами белков на основе проведения опытов и компьютерной презентации;
– выявить взаимосвязь химии и биологии.
Развивающая
– развивать мышление учащихся и их умение прогнозировать свойства белков на основе самостоятельного проведения опытов, решения задач.
Воспитательная
– формировать научное мировоззрение учащихся на примере интеграции естественных наук, лежащих в основе строения организма;
– воспитывать самостоятельность, познавательный интерес, аккуратность и дисциплинированность;
– способствовать сотрудничеству учащихся друг с другом;
– способствовать сотрудничеству учителя с учащимися.
Задачи урока: (Слайд №2)
– раскрыть ведущую роль белков в строении и жизнедеятельности клетки;
– объяснить строение молекул белка;
– изучить химические свойства белков;
Предполагаемые результаты обучения:
– учащиеся должны знать: состав белков, уровни организации белковой молекулы, свойства и функции белков;
– учащиеся должны уметь: проводить реакции подтверждающие свойства белков, качественные реакции на белки, объяснять функции белков в организме.
По характеру познавательной деятельности: исследовательский.
По виду источников знаний: словесно-наглядно-практический.
По форме совместной деятельности учителя и учащихся : беседа.
По стимулированию контроля и самоконтроля за эффективностью учебно-познавательной деятельности:
– контроль за проведением практического эксперимента;
– фронтальный (устный) контроль;
– тестовый контроль.
Оборудование: штатив с пробирками, спиртовка, держатель для пробирок, спички, инструкция к работе, пипетка, компьютер, видеопроектор, видео-презентация, карты-инструкции к выполнению лабораторных работ.
Реактивы: Хлорид натрия (раствор), соляная кислота (раствор), гидроксид натрия (20% раствор), этиловый спирт, дистиллированная вода, сульфат меди (II) (2%), азотная кислота (концентрированная), нитрат серебра, яичный белок.
План урока: (Слайд №3)
– Организационный момент;
– проверка домашнего задания;
– изучение нового материала;
– лабораторная работа №1;
– лабораторная работа №2;
– обобщение темы;
– рефлексия;
– домашнее задание;
– итоги урока.
Ход урока
Организационный момент:
Проверка домашнего задания.
Контрольные вопросы:
- Какие соединения называют амфотерными?
- Обладают ли амфотерными свойствами аминокислоты?
- Какие аминокислоты называются незаменимыми? Приведите примеры?
- Какие реакции называются реакциями поликонденсации? Характерны ли реакции поликонденсации для аминокислот?
- Какие соединения называют пептидами?
- Какая группа атомов называется пептидной?
- Напишите уравнения реакции позволяющие осуществить следующие превращения?
Этан —> А —>Уксусный альдегид —> Б —> В Аминоуксусная кислота
Назовите вещества: А, Б, В.
Изучение нового материала:
Вступительное слово учителя:
Образовательные программы разделяют окружающие нас природные явления на отдельные предметы: физику, химию, биологию и другие. Природа представляет собой единое целое. На этом уроке мы установим на примере изучения свойств белков связь между различными предметами.
“С полным основанием можно считать, что белки – самые важные из всех веществ, входящие в состав организма животных и растений” (Л Полинг).
1. История открытия белков(Слайды №5,6)
1888 г. – русский ученый биохимик А.Я.Данилевский на основании своих опытов впервые высказал гипотезу о пептидной связи между остатками аминокислот в белковой молекуле.
1899 г. – немецкие химики Эмиль Фишер и Франц Гофмейстер высказали предположение: в белках аминокислоты связаны за счет аминогруппы одной кислоты и карбоксила другой. Эта гипотеза в 1907г. получила название “полипептидной теории”.
2. Состав белков(Слайды №7-10)
В состав белковых веществ входят элементы: C,H,O,N,P,S. Определить химический состав молекулы белка, помогло изучение продуктов гидролиза. Как установил Фишер, в результате гидролиза получается смесь различных аминокислот. Наиболее часто в составе белков встречаются 20 аминокислот, имеющих различное строение углеродного скелета. Например:
Учитель формулирует определение белков как природных полимеров, молекулы которых построены из остатков аминокислот, соединенных пептидной связью.
3. Физические свойства белков (Слайды №11,12)
Одни белки растворяются в воде с образованием коллоидных растворов (яичный белок), другие нерастворимы (белки покровных тканей – кератин, коллаген, эластин), отдельные белки растворимы в разбавленных растворах солей.
4. Строение белков (Слайд №13)
5. Функции белков(Слайды №14-19)
Значение белков для жизни очень велико и функции их разнообразны.
Строительная – клеточные мембраны, покровные ткани, шерсть, перья, рога, хрящи, волосы.
Транспортная – накопление и транспортировка по организму важнейших веществ.
Энергетическая – запас аминокислот для развития организма.
Двигательная – сократительные белки – основа мышечных тканей.
Защитная – белки-антитела и антитоксины распознают и уничтожают бактерии и “чужеродные” вещества.
Каталитическая – белки– природные катализаторы (ферменты).
Лабораторная работа №1 (Слайд №20)
“Каталитическая активность ферментов в живых тканях”.
Цели: ознакомить с ролью ферментов в клетках, закрепить умение работать с микроскопом, проводить опыты и научить объяснять результаты работы.
Оборудование и реактивы: предметные и покровные стекла, пинцеты, лупы, микроскопы, стеклянные палочки, стаканы с водой, свежеприготовленный 3%-й раствор пероксида водорода, кусочки сырого и вареного картофеля, листья элодеи.
Ход работы
На предметное стекло положите кусочек сырого и вареного картофеля и капните раствор пероксида водорода. Рассмотрите с помощью лупы и сравните активность фермента в живой и мертвой тканях картофеля.
Приготовьте препарат элодеи, рассмотрите его под микроскопом – зарисуйте несколько клеток листа. Капните на препарат элодеи раствор пероксида водорода и снова наблюдайте за состоянием клеток.
Результаты исследований занесите в таблицу (Слайд №21)
Ответьте на вопросы: (Слайд №22)
Какой газ выделяется из клеток листа?
Почему происходит его выделение?
Как проявляется активность фермента в живой и мертвой тканях растений?
Как вы считаете: все ли живые организмы содержат фермент каталазу, обеспечивающий разложение пероксида водорода?
6. Основные химические свойства белков
Задача учащимся: Исходя из строения белков, как многофункциональных веществ, предположите их химические свойства. Известные нам белки обладают различными свойствами. Некоторые из них, например, белки, содержащиеся в волосах, ногтях, перьях птиц, нерастворимы в воде, тогда как другие растворяются. Гидролиз – разрушение первичной структуры белка. В лабораторных условиях этот процесс проводится в присутствии кислот и щелочей. В организме он происходит под действием ферментов, что приводит к образованию аминокислот, из которых в клетках организма образуются белки, характерные для данного организма. (Слайд №23)
Исследуем свойства белков: (Слайд №24)
Опыт №1 Высаливание. Под действием раствора хлорида натрия яичный белок высаливается. Данный процесс обратимый, так как при попадании в чистую воду белок снова растворяется.
Опыт №2 Свертывание белков. В каждую из четырех пробирок приливаем по 2 мл яичного белка. Затем добавляем в первую пробирку – соляную кислоту, во вторую – гидроксид натрия, в третью – этиловый спирт, а четвертую пробирку нагреем на огне. Затем добавляем дистиллированную воду и встряхнем пробирки.
Опыт №3 Наличие белка в различных продуктах определяют с помощью реакции идентификации. Одна из них горение.
Вопросы к проведенным опытам: (Слайд №25)
– какие изменения происходят в структуре белка?
– меняется ли первичная структура?
– почему свернувшийся белок не растворяется в воде?
Белки коагулируют под действием всех этих веществ. При этом структура белка необратимо разрушается. Произошла денатурация. Ученные полагают, что процессы старения связаны с медленно протекающей денатурацией, так как денатурация приводит к нарушению антигенной чувствительности белка, а иногда к полному блокированию ряда иммунологических реакций, нарушению обмена веществ.
Лабораторная работа №2 (Слайд №26)
“Качественные реакции на белки”.
Ксантопротеиновая реакция (обнаружение бензольных ядер в аминокислотных остатках). В пробирку поместите 10 капель раствора яичного белка и 2 капли концентрированной 1:3 азотной кислоты. Смесь осторожно нагрейте до появления желтого осадка и охладите. Добавьте по каплям концентрированный раствор аммиака до появления оранжевой окраски.
Белок + HNO3(Конц.) —> желтое окрашивание.
Вопросы: (Слайд №27)
Какие аминокислоты можно обнаружить с помощью данной реакции?
Можно ли считать данную реакцию – качественной на белок?
Биуретовая реакция (распознавание пептидных связей). (Слайд №28)
Белок + NaOH + CuSO4 —> фиолетовое окрашивание.
Вопросы: (Слайд №29)
Наличие какого структурного фрагмента в молекуле необходимо для положительной биуретовой реакции?
Можно ли считать эту реакцию качественной на белок?
Осаждение белка солями тяжелых металлов. (Слайд №30)
В две пробирки поместите по 10 капель раствора яичного белка. В одну пробирку добавьте каплю 2%-ого раствора сульфата меди (II), в другую – раствор нитрата серебра
В обеих пробирках выпадает осадок.
Данное свойство белка связывать тяжелые металлы используется в медицине. Например, при отравлениях принимают внутрь сырой яичный белок.
Вопрос: (Слайд №31)
Наличие каких функциональных групп обуславливают взаимодействие белка с солями тяжелых металлов?
Выводы: (Слайд №32)
– белки могут быть как растворимы, так и не растворимы в воде, это зависит от их состава и структуры;
– при обработке хлоридом натрия белки высаливаются из раствора – это обратимый процесс;
– кислоты, щелочи, высокая температура разрушают структуру белков что приводит к денатурации – это необратимый процесс;
– распознать белки можно при помощи цветных реакций: при обработке концентрированной HNO3 белки подвергаются денатурации и желтеют, а при обработке раствором NaOH и насыщенным раствором сульфата меди (II) белок становится фиолетовым.
Обобщение темы. (Слайд №33)
Итак, чтобы ответить на вопрос “Что такое жизнь?”, нужно знать что такое белок. Чем больше мы узнаем о белках, тем глубже проникаем в понятие “жизнь”. Насколько многообразны белки, настолько сложна, загадочна и многолика жизнь.
Проверь себя. (Слайд №34)
1. Для всех белков характерны свойства:
а) Растворимость и свертывание; б) Амфотерность и денатурация; в) Гидролиз и растворимость в солях; г) Летучесть и горение.
2. При гидролизе белков образуются:
а) Углеводороды; б) Углеводы; в) Жирные кислоты; г) Аминокислоты.
3. Денатурация белков:
а) Осуществляется при действии ферментов или путем нагревания; б) Приводит к нарушению вторичной структуры белка; в) Приводит к нарушению третичной структуры белка; г) Используется для получения углеводов.
4. При действии концентрированной азотной кислоты на белки появляется окрашивание:
а) Фиолетовое; б) Желтое; в) Зеленое; г) Синее
5. Белки являются продуктом поликонденсации:
а) Углеводородов; б) Жирных кислот; в) Аминокислот; г) Сахаров
Ответы. (Слайд №35)
Рефлексия. (Слайд №36)
Самым интересным на уроке для меня было…
Самым сложным на уроке для меня было…
Сегодня на уроке я узнал…
Итог урока.
Учитель объявляет оценки, комментирует полученные результаты и задает домашнее задание.
Осаждение белка солями тяжелых металлов.
Белки при взаимодействии с солями свинца, меди, ртути, серебра и других тяжелых металлов денатурируются и выпадают в осадок. Однако при избытке некоторых солей наблюдается растворение первоначально образовавшегося осадка. Это связано с накоплением ионов металла на поверхности денатурированного белка и появлением положительного заряда на белковой молекуле.
1) яичный белок, 1% раствор;
2) сульфат меди, 10% раствор;
3) ацетат свинца, 5% раствор;
4) нитрат серебра, 5% раствор.
Классификация белков в зависимости от выполняемых функций:
- ферменты – (от лат. «fermentum» - брожение, закваска) – группа специфических белков, увеличивающих скорость протекания химических реакций в клетках всех живых организмов.
- транспортные – группа белков, выполняющих функцию переноса различных атомов, молекул, ионов как внутри клетки, так и между клетками в многоклеточных организмах.
- структурные – группа белков, отвечающих за поддержание формы и стабильности клеток и тканей.
- регуляторные (гормональные) – группа белков, осуществляющих функции сигнальных веществ (гормонов).
- защитные – группа белков, предохраняющих организм от вторжения других организмов и повреждений.
- запасающие (резервные, пищевые) – группа белков, являющихся ценными пищевыми веществами. У животных – мышечные белки служат резервными питательными веществами, которые мобилизируются при крайней необходимости.
- сократительные (дигательные) – группа белков, ответственных за мышечное сокращение и другие формы биологической подвижности.
16.
Каждый индивидуальный белок, имеющий уникальную первичную структуру и конформацию, обладает и уникальной функцией, отличающей его от bqcx остальных белков. Набор индивидуальных белков выполняет в клетке множество разнообразных и сложных функций.
Необходимое условие для функционирования белков - присоединение к нему другого вещества, которое называют "лиганд". Лигандами могут быть как низкомолекулярные вещества, так и макромолекулы. Взаимодействие белка с лигандомвысокоспецифично, что определяется строением участка белка, называемого центром связывания белка с лигандом или активным центром.
А. Активный центр белков и избирательность связывания его с лигандом
Активный центр белков - определённый участок белковой молекулы, как правило, находящийся в её углублении ("кармане"), сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга.
Высокая специфичность связывания белка с лигандом обеспечивается комплементарностью структуры активного центра белка структуре лиганда (рис. 1-25).
Под комплементарностью понимают пространственное и химическое соответствие взаимодействующих молекул. Лиганд должен обладать способностью входить и пространственно совпадать с конформацией активного центра. Это совпадение может быть неполным, но благодаря конформационной лабильности белка активный центр способен к небольшим изменениям и "подгоняется" под лиганд. Кроме того, между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре. Связи между лигандом и активным центром белка могут быть как нековалентными (ионными, водородными, гидрофобными), так и ковалентными.

Рис. 1-25. Взаимодействие белка с лигандом. А и Б - некомплементарное взаимодействие и разрушение связей между белком и лигандом; В - комплементарное взаимодействие белка с лигандом.
1. Характеристика активного центра
Активный центр белка - относительно изолированный от окружающей белок среды участок, сформированный аминокислотными остатками. В этом участке каждый остаток благодаря своему индивидуальному размеру и функциональным группам формирует "рельеф" активного центра.
Объединение таких аминокислот в единый функциональный комплекс изменяет реакционную способность их радикалов, подобно тому, как меняется звучание музыкального инструмента в ансамбле. Поэтому аминокислотные остатки, входящие в состав активного центра, часто называют "ансамблем" аминокислот.
Уникальные свойства активного центра зависят не только от химических свойств формирующих его аминокислот, но и от их точной взаимной ориентации в пространстве. Поэтому даже незначительные нарушения общей конформации белка в результате точечных изменений его первичной структуры или условий окружающей среды могут привести к изменению химических и функциональных свойств радикалов, формирующих активный центр, нарушать связывание белка с лигандом и его функцию. При денатурации активный центр белков разрушается, и происходит утрата их биологической активности.
Часто активный центр формируется таким образом, что доступ воды к функциональным группам его радикалов ограничен, т.е. создаются условия для связывания лиганда с радикалами аминокислот.
В некоторых случаях лиганд присоединяется только к одному из атомов, обладающему определённой реакционной способностью, например присоединение О2 к железу миоглобина или гемоглобина. Однако свойства данного атома избирательно взаимодействовать с О2 определяются свойствами радикалов, окружающих атом железа в составе тема. Гем содержится и в других белках, таких как цитохромы. Однако функция атома железа в цитохромах иная, он служит посредником для передачи электронов от одного вещества другому, при этом железо становится то двух-, то трёхвалентным.
Центр связывания белка с лигандом часто располагается между доменами. Например, протеолитический фермент трипсин, участвующий в гидролизе пептидных связей пищевых белков в кишечнике, имеет 2 домена, разделённых бороздкой. Внутренняя поверхность бороздки формируется аминокислотными радикалами этих доменов, стоящими в полипептидной цепи далеко друг от друга (Сер177, Гис40, Асп85).
Разные домены в белке могут перемещаться друг относительно друга при взаимодействии с лигандом, что облегчает дальнейшее функционирование белка. В качестве примера можно рассмотреть работу гексокиназы, фермента, катализирующего перенос фосфорного остатка с АТФ на молекулу глюкозы (при её фосфорилировании). Активный центр гексокиназы располагается в расщелине между двумя доменами (рис. 1-26) При связывании гексокиназы с глюкозой окружающие её домены сближаются, и субстрат оказывается в "ловушке", что облегчает его дальнейшее фосфорилирование.
Основное свойство белков, лежащее в основе их функций, - избирательность присоединения к определённым участкам белковой молекулы специфических лигандов.
2. Многообразие лигандов
- Лигандами могут быть неорганические (часто ионы металлов) и органические вещества, низкомолекулярные и высокомолекулярные вещества;
- существуют лиганды, которые изменяют свою химическую структуру при присоединении к активному центру белка (изменения субстрата в активном центре фермента);
- существуют лиганды, присоединяющиеся к белку только в момент функционирования (например, О2, транспортируемый гемоглобином), и лиганды, постоянно связанные с белком, выполняющие вспомогательную роль при функционировании белков (например, железо, входящее в состав гемоглобина).
В тех случаях, когда аминокислотные остатки, формирующие активный центр, не могут обеспечить функционирование данного белка, к определённым участкам активного центра могут присоединяться небелковые молекулы. Так, в активном центре многих ферментов присутствует ион металла (кофактор) или органическая небелковая молекула (кофермент). Небелковую часть, прочно связанную с активным центром белка и необходимую для его функционирования, называют "простатическая группа". Миоглобин, гемоглобин и цитохромы имеют в активном центре простетическую группу - гем, содержащий железо (более подробно гемсодержащие белки описаны в разделе 4, а кофакторы и коферменты - в разделе 2).
Соединение протомеров в олигомерном белке - пример взаимодействия высокомолекулярныхлигандов. Каждый протомер, соединённый с другими протомерами, служит для них лигандом, так же как они для него.
Иногда присоединение какого-либо лиганда изменяет конформацию белка, в результате чего формируется центр связывания с другими лигандами. Например, белок кальмодулин после связывания с четырьмя ионами Са 2+ в специфических участках приобретает способность взаимодействовать с некоторыми ферментами, меняя их активность.

Рис. 1-26. Связывание гексокиназы с глюкозой.
3. Сродство активного центра лиганду
Скорость взаимодействия белка с лигандом определяется концентрациями белка и лиганда в растворе, а также степенью комплементарности белка и лиганда.
Константа диссоциации - характеристика сродства активного центра лиганду.
· Так как взаимодействие белка с лигандом - обратимый процесс, то его можно описать следующим уравнением:
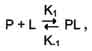
где Р - белок, L - лиганд, PL - комплекс белка с лигандом, К1 - константа скорости связывания белка с лигандом, К-1 - константа скорости распада комплекса PL.
Когда скорости образования и распада комплекса равны, говорят о том, что система находится в состоянии равновесия:
Соотношение констант распада [PL] комплекса и его образования называется константой диссоциации (Кдисс) комплекса [PL]. Чем меньше Кдисс , тем больше молекул лиганда связано с белком, тем больше комплементарность между Р и L и тем больше сродство лиганда к белку. То есть между Кдисс и сродством лиганда к белку имеется обратно пропорциональная связь.
Иногда при описании процесса связывания белка с лигандом используют величину, обратную Кдисс, называемую константой связывания (Ксв) или ассоциации.
Между Ксв. и сродством лиганда к белку существует прямо пропорциональная зависимость.
Зависимость насыщения белка лигандом от концентрации лиганда при постоянной концентрации белка
· При постоянной концентрации белка увеличение концентрации лиганда приводит к росту концентрации комплекса [PL]. Эта зависимость носит характер гиперболической кривой (рис. 1-27). Кривая стремится к максимуму, когда при некоторой концентрации лиганда все молекулы белка находятся в связанном с лигандом состоянии (происходит насыщение белка лигандом). Степень насыщения белка лигандом можно выразить следующим уравнением: степень насыщения = [PL]/[P0]?100 (где Р0 - концентрация белка до добавления лиганда).
· При полунасыщении белка лигандом концентрации [PL] и [Р] равны, и из уравнения Кдисс, приведённого выше, следует, что Кдисс = [L], т.е. Кдисс численно равна концентрации лиганда, при которой 50% белка находится в комплексе с лигандом. Поэтому по кривой насыщения можно найти Кдисс и оценить сродство данного белка лиганду.
Зависимость между образованием комплекса [PL] и концентрацией белка при избытке лиганда
· Как было сказано выше, при возрастающей концентрации лиганда насыщение белка ограничено его концентрацией. При избытке лиганда все молекулы белка находятся в составе комплекса [PL]. Однако, если увеличивать концентрацию белка, то количество [PL] начнёт увеличиваться пропорционально концентрации белка. Концентрацию комплекса [PL] можно регистрировать, например

Рис. 1-27. График насыщения белка лигандом.
· с помощью измерения поглощения света. Учитывая, что его количество пропорционально концентрации белка, можно на основании построенного графика определять концентрацию белка в растворе (рис. 1-28).
В основе функционирования любого белка лежит его способность к избирательному взаимодействию с каким-либо другим веществом — лигандом. Лигандом может быть как низкомолекулярное вещество, так и макромолекула, в том числе другой белок. Лиганд присоединяется к определенному участку на поверхности белковой молекулы — центру связывания (активный центр).
Активный центр белков – определённый участок белковой молекулы, как правило, находящийся в её углублении, сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга.
Высокая специфичность связывания белка с лигандом обеспечивается комплементарностью структуры активного центра белка и структуры лиганда.
Под комплементарностью понимают пространственное и химическое соответствие взаимодействующих молекул. Лиганд должен обладать способностью входить и пространственно совпадать с конформацией активного центра. Это совпадение может быть неполным, но благодаря конформационной лабильности белка, активный центр способен к небольшим изменениям и «подгоняется» под лиганд. Кроме того, между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре. Связи между лигандом и активным центром белка могут быть как нековалентными (ионными, водородными, гидрофобными), так и ковалентными.
Тот факт, что ферменты обладают высокой специфичностью, позволил в 1890 г. выдвинуть гипотезу, согласно которой активный центр фермента комплементарен субстрату, т.е. соответствует ему как "ключ замку". После взаимодействия субстрата ("ключ") с активным центром ("замок") происходят химические превращения субстрата в продукт. Активный центр при этом рассматривался как стабильная, жёстко детерминированная структура.
В 1959 г. был предложен другой вариант гипотезы "ключ-замок", объясняющий события в активном центре фермента. По этой гипотезе активный центр является гибкой структуройпо отношению к субстрату. Субстрат, взаимодействуя с активным центром фермента, вызывает изменение его конформации, приводя к формированию фермент-субстратного комплекса, благоприятного для химических модификаций субстрата. При этом молекула субстрата также изменяет свою конформацию, что обеспечивает более высокую эффективность ферментативной реакции. Эта "гипотеза индуцированного соответствия" впоследствии получила экспериментальное подтверждение.
19.Четвертичная структура белков
Количество и взаиморасположение полипептидных цепей в пространстве называют "четвертичная структура белков".Отдельные полипептидные цепи в таком белке носят название протомеров, или субъединиц. Белок, содержащий в своём составе несколько протомеров, называют олигомерным.
1. Количество протомеров в структуре
олигомерных белков
В состав олигомерных белков может входить от двух до нескольких десятков протомеров, хотя наиболее часто встречают белки, содержащие от двух до четырёх полипептидных цепей (димерные, тетрамерные белки).Так, фермент гексокиназа содержит в своём составе 2 протомера; белок эритроцитов гемоглобин и фермент лактатдегидрогеназа - 4 протомера; Некоторые олигомерные белки содержат идентичные протомеры (например, гексокиназа), другие состоят из разных протомеров. Олигомерные белки имеют большую молекулярную массу. Белки с молекулярной массой более 50 000 Д практически всегда содержат несколько мономерных полипептидных цепей. По сравнению с индивидуальными мономерными белками олигомеры выполняют более сложные функции.
2. Сборка протомеров в олигомерный белок.
Комплементарность протомеров
"Узнавание" и присоединение отдельных протомеров олигомерного белка происходят благодаря формированию на их поверхности контактных участков. Последние состоят из радикалов аминокислот, собранных в данном месте в процессе образования третичной структуры белка. Совокупность этих радикалов формирует уникальные поверхности, способные с высокой специфичностью объединяться друг с другом. Таким образом, взаимодействие протомеров осуществляется во многих точках контактирующих поверхностей, с образованием десятков слабых связей. Благодаря этому контактные поверхности соединяются с высокой специфичностью, и ошибки формирования четвертичной структуры белков практически исключены. Комплементарность - универсальный принцип, свойственный живой природе и лежащий в основе узнавания и соединения не только протомеров, но и других (не обязательно белковых) молекул.
Кооперативность
Кооперативное связывание
Когда субстрат связывается с активным центром одной субъединицы фермента, остальные субъединицы активируются. Лиганды могут иметь некооперативный, положительный или отрицательный кооперативный эффект.(Примером положительной кооперативности может служить связывание кислорода гемоглобином.)Отрицательная кооперативность означает противоположное — в момент связывания лиганда белком, сродство белка к лиганду снижается. Примером может служить взаимодействие между глицеральдегид-3-фосфатом и ферментом глицеральдегид-3-фосфат дегидрогеназой.
Кооперативность, явление кооперативности — это такие изменения состояния системы, взаимодействие элементов которой усиливается с течением процесса изменения так, что существенно ускоряет его ход в целом (положительная кооперативность). Таким образом, сила взаимодействия атомов или молекул возрастает по мере нарастания изменений в системе, делая их коллективно согласованными
3. ОСОБЕННОСТИ ФУНКЦИОНИРОВАНИЯ ОЛИГОМЕРНЫХ БЕЛКОВ НА ПРИМЕРЕ ГЕМОГЛОБИНА.
Олигомерные белки проявляют свойства, отсутствующие у мономерных белков. Влияние четвертичной структуры на функциональные свойства белка можно рассмотреть, сравнивая строение и функции двух родственных гемсодержащих белков: миоглобина и гемоглобина. Оба белка имеют общее эволюционное происхождение, сходную конформацию отдельных полипептидных цепей и сходную функцию (участвуют в транспорте кислорода), но миоглобин - мономерный белок, а гемоглобин - тетрамер. Наличие четвертичной структуры у гемоглобина придаёт этому белку свойства, отсутствующие у миоглобина.
Процесс необратимого осаждения белков. Денатурация, обратимость процесса.
Необратимое осаждение белков связано с глубокими нарушениями структуры белков (вторичной и третичной) и потерей ими нативных свойств. Такие изменения белков можно вызвать кипячением, действием концентрированных растворов минеральных и органических кислот, солями тяжелых металлов.
(При действии солей тяжелых металлов происходит денатурация белковой молекулы. Осаждение денатурированного белка происходит из-за адсорбции частиц металла на поверхности белковой частицы. Свойства белков осаждаться солями тяжелых металлов используется в медицинской практике. Белки (в составе молока, яйца) применяют в качестве противоядия при отравлении солями тяжелых металлов. Белок ограничивает всасывание ионов металла, образуя с ними нерастворимые комплексы.)
Денатурация белков (лат. denaturatus — лишенный природных свойств; от de- — приставка, означающая отделение, удаление + natura — природа, естество) — термин биологической химии, означающий потерю белками их естественных свойств (растворимости, гидрофильности и др.) вследствие нарушения пространственной структуры их молекул.
Ренатурация — процесс, обратный денатурации, при котором белки возвращают свою природную структуру.(При нагревании двухцепочечных молекул ДНК до темп-ры ок. 100°С водородные связи между основаниями разрываются, и комплементарные цепи расходятся — ДНК денатурирует. Однако при медленном охлаждении комплементарные цепи могут вновь соединяться в регулярную двойную спираль. Эта способность ДНК к Р. используется для получения искусств, гибридных молекул ДНК (т. н. молекулярная гибридизация)
Нативная структура белка и ее разрушения. Признаки денатурации.
Функционально активную конформацию белка называют "нативная структура".
Денатурация белков - это разрушение их нативной конформации, вызванное разрывом слабых связей, стабилизирующих пространственные структуры, при действии денатурирующих агентов. Денатурация сопровождается потерей биологической активности белка.
Признаки денатурации:
1.Уникальная трехмерная структура каждого белка разрушается, и все молекулы одного белка приобретают случайную конформацию, т. е. отличную от других таких же молекул.
2. Радикалы аминокислот, формирующие активный центр белка, оказываются пространственно удаленными друг от друга, т. е. разрушается специфический центр связывания белка с лигандом.
3. Гидрофобные радикалы, обычно находящиеся в гидрофобном ядре глобулярных белков, при денатурации оказываются на поверхности молекулы, тем самым создаются условия для агрегации белков. Агрегаты белков выпадают в осадок.
4. При денатурации белков не происходит разрушения их первичной структуры. Вспомните условия, в которых происходит гидролиз пептидных связей.
Осаждение белков солями тяжелых металлов, механизм, особенности, значение для клиники.
При действии солей тяжелых металлов происходит денатурация белковой молекулы. Осаждение денатурированного белка происходит из-за адсорбции частиц металла (свинца, меди, ртути, серебра и других) на поверхности белковой частицы.
Особенности:Однако при избытке некоторых солей наблюдается растворение первоначально образовавшегося осадка. Это связано с накоплением ионов металла на поверхности денатурированного белка и появлением положительного заряда на белковой молекуле.
В клинике:свойства белков осаждаться солями тяжелых металлов используется в медицинской практике. Белки (в составе молока, яйца) применяют в качестве противоядия при отравлении солями тяжелых металлов. Белок ограничивает всасывание ионов металла, образуя с ними нерастворимые комплексы.
Читайте также:
