Осаждение белков тяжелыми металлами
Обновлено: 05.07.2024
Белки при взаимодействии с солями тяжелых металлов (медь, железо, свинец, цинк, серебро, ртуть и др.) денатурируются и образуют нерастворимые в воде комплексные соединения, которые выпадают в осадок. Возникновение нерастворимых в воде комплексов обусловлено адсорбцией тяжелого металла на поверхности белковой молекулы. В избытке солей первоначально образовавшиеся осадки растворяются (за исключением солей AgNO3 и HgCl2), что связано с адсорбцией тяжелого металла на поверхности коллоидных частиц и появлением положительного заряда на молекуле белка (адсорбционная пептизация). На способности белков образовывать нерастворимые осадки с солями тяжелых металлов основывается использование белков в качестве противоядия при отравлении тяжелыми металлами (ртутные, свинцовые отравления), пока соли этих металлов еще не успели всосаться. При использовании белков (яичный белок, молоко) в качестве противоядий при отравлении следует давать их в больших количествах, учитывая то, что при избытке некоторых солей образуются с белками комплексные растворимые соединения. В случае отравления ртутными солями необходимо помнить, что осадок белка, образующийся при воздействии Hg 2+ , может раствориться в присутствии поваренной соли.
Со свежеприготовленным гидроксидом меди (II) все -аминокислоты в мягких условиях дают хорошо кристаллизующиеся внутрикомплексные (хелатные) соли меди (II) синего цвета:
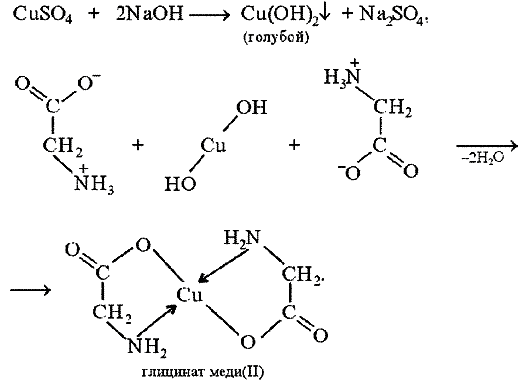
глицинат меди (II)
В таких солях ион меди координационными связями соединен с аминогруппами.
Реактивы и материалы: раствор яичного белка или разбавленная сыворотка крови, сернокислая медь, 5% раствор, уксуснокислый свинец, 5% раствор, азотнокислое серебро, 3% раствор.
Оборудование и посуда: штатив с пробирками, капельницы, пипетки, стеклянные палочки.
Порядок выполнения работы
В три пробирки наливают по 10 капель раствора белка.
В первую добавляют 1—2 капли 5% раствора сернокислой меди, во вторую 1—2 капли 5% раствора уксуснокислого свинца и в третью 1—2 капли 3% раствора азотнокислого серебра. Выпадает осадок белка во всех трех пробирках.
В каждую из трех пробирок добавляют избыток соответствующего осадителя, и раствор перемешивают стеклянной палочкой. В первой и второй пробирках наблюдается растворение осадка (пептизация). В третьей пробирке растворения осадка не происходит.
2.3. Осаждение белков алкалоидными реактивами
Алкалоидные Реактивы и материалы: осаждают как белки, так и алкалоиды — азотистые основания растений. Объясняется это наличием в белке азотистых гетероциклических группировок, аналогичных тем, которые находятся в молекулах алкалоидов (пиррольные, индольные, юшдазольные). Осаждение белков алкалоидными реактивами протекает в кислой среде и обусловлено образованием нерастворимых солеобразных соединений с основными азотистыми группами белков. При этом происходит адсорбция аниона осадителя, например [Fe(CN)6] 4- , на белковой молекуле, являющейся вследствие подкисления катионом. Белки, обладающие основным характером (протамины, гистоны), осаждаются алкалоидными реактивами в нейтральной среде.
Реактивы и материалы: раствор яичного белка или разбавленная водой сыворотка крови, уксусная кислота, 10% раствор, уксусная кислота, 1% раствор, железистосинеродистый калий, 5% раствор, вольфрамовокислый натрий, 10% раствор, танин, насыщенный раствор, пикриновая кислота, насыщенный раствор, раствор йодной ртути в йодистом калии
Осаждение белков тяжелыми металлами
Белки представляют главнейшую составную часть пищи человека, и потому количественное определение белковой фракции пищи и изучение ее аминокислотного состава дает важный материал для суждения о питательной ценности пищевых продуктов и пищу в целом.
Белки в то же время, как наименее устойчивое пищевое вещество, легко подвергаются распаду в результате воздействия бактериальных ферментов (реже ферментов самой пищи-аутолиз), что ведет к порче продуктов.
Белки сначала распадаются на протеазы, пептоны, пептиды, которые, не накапливаясь, распадаются на аминокислоты. В дальнейшем происходит расщепление аминокислот ,которое может идти различными путями: декарбоксилированием, дезаминированием, обоими этими путями совместно в результате образуются азотистые основания(аммиак, амины) жирные кислоты, свободные углеводороды и пр. Конечными продуктами распада и превращения белков являются сероводород, аммиак, меркаптаны, фенол, индол, скатол и др.
Необходимо, однако, указать, что по отдельным химическим показателям нельзя судить о порче белковых продуктов питания. Так, накопление аминокислот не дает еще представления о порче, например, мяса. То же можно сказать о положительных качественных реакциях на аммиак и сероводород, которые обнаруживаются иногда и в совершенно свежем мясе. Методы, основанные на качественном обнаружении типичных продуктов гниения белка – индола, скатола, фенола, меркаптанов, не имеют практического значения, так как эти продукты обнаруживаются лишь тогда, когда развитие гнилостного распада не вызывает уже сомнения по одним органолептическим показателям.
Вот несмотря на большую давность вопроса о способах обнаружения порчи белковых продуктов питания, особенно на ранних стадиях протеолиза, этот вопрос не нашел еще своего разрешения, и в литературе появляются все новые и новые предложения по этому поводу.
Нет сомнения в том, что только в комплексах методов, слагающихся из органолептических, химических и микробиологических исследований, нужно искать разрешение вопроса.
ОПРЕДЕЛЕНИЕ БЕЛКОВОЙ ФРАКЦИИ ПИЩИ
Качественные реакции на белок
Для качественного обнаружения белка предложено много реакций( цветный и осадочные ).
Цветные реакции
Б и у р е т о в а я р е а к ц и я.К раствору белка добавляют равный объем 10% раствора едкого натра и затем по каплям 0,1% раствор сернокислой меди. Жидкость приобретает фиолетовое окрашивание, переходящее в красное, если, наряду с белками , имеются альбумозы и пептоны. Реакция обусловлена наличием в белковой молекуле группировок
—CO—NH, т.е. пептидных связей. Продукты гидролиза белка ( аминокислоты и амиды) после достаточного разбавления этого эффекта не дают эффекта и потому биуретовой реакцией можно пользоваться для установления конца гидролиза белка.
Появление сине-фиолетового окрашивания при описанной реакции обусловлено образованием Сu—Na – комплексной соли биурета.
Следует избегать прибавления избытка медного купароса, так как голубая получающегося гидрата окиси меди может маскировать реакцию.
Кроме белков, биуретовую реакцию дают: биурет (NH2—СО—HN—СО—NH2),
оксамид (H2N—СО—СО—NH2), глицинамид (H2N—СH2—СО—NH2),малонамид
(H2N—СО—СH2—СО—NH2), а также следующие аминокислоты а достаточно концентрированных растворах: гистидин, серин и треонин. Таким образом, биуретовая реакция не является строго специфичной для полипептидных цепей.
Присутствие в исследуемом растворе MgSO4 и (NH4) 2SO4 препятствует биуретовой реакции. При налички аммонийных солей следует употреблять большой избыток едкой щелочи.
Н и н г и д р и н о в а я р е а к ц и я. К 3мл нейтрального водного раствора белка добавляют 1 мл свежеприготовленного 0,1% раствора нингидрина(трикетогидринденгидрата);
Смесь нагревают до кипения и через минуту охлаждают. Появляется синее окрашивание. Объясняется это ем, что нингидрин дает окрашивание(обычно синее) с любой α- аминокислотой, а так как любой белок содержит α-аминокислоты, то нингидриновая реакция получается со всеми без исключения белками. Химизм реакции можно представить в следующем виде:

Восстановленный нингидрин с аммиаком и второй молекулой нингидрина образует окрашенный в синий цвет продукт конденсации.
Нужно иметь в виду, что аммонийные соли и β-аланин также дают положительную нингидриновую реакцию. Добавление аскорбиновой кислоты повышает чувствительность реакции.
К с а н т о п р о т е и н о в а я р е а к ц и я.К раствору белка приливают концентрированной азотной кислоты(уд. вес. 1,4); при этом белок выпадает в осадок. При нагревании осадок частью растворяется и жидкость окрашивается в желтый цвет. При этом происходит образование нитросоединений циклических аминокислот: тирозина и триптофана, которые содержатся в подавляющем большинстве белков.
Если полученный желтый раствор охладить, а затем осторожно добавить немного раствора едкой щелочи или аммиака, то появляется красновато-оранжевое окрашивание, обусловленное образованием солей нитроновых кислот.
Р е а к ц и я А д а м к е в и ч а. Аминокислота триптофан в кислой среде, взаимодействуя с альдегидами кислот, образует продукты конденсации красно-фиолетового цвета.
К одной капле белка прибавляют 10 капель уксусной кислоты. Наклонив пробирку, осторожно по стенке добавляют по каплям 0,5 мл серной кислоты так, чтобы жидкости не смешивались. При стоянии пробирки на границе жидкостей появляется красно-фиолетовое кольцо.
Р е а к ц и я Ф о л я. Аминокислоты, содержащие сульфгидрильные группы - SH, подвергаются щелочному гидролизу с образованием сульфида натрия Na2S. Последний, взаимодействуя с плюмбитом натрия (образуется в ходе реакции между ацетатом свинца и NaOH), образует осадок сульфида свинца PbS черного или бурого цвета.
К 5 каплям раствора белка прибавляют 5 капель реактива Фоля и кипятят 2-3 мин. После отстаивания 1-2 мин. появляется черный или бурый осадок.
Реакции осаждения
Для белков характерны реакции осаждения солями и гидратами окисей тяжелых металлов и некоторыми кислотами. Приведем важнейшие из этих реакций.
Осаждение белков тяжелыми металлами
Осаждение белков солями тяжелых металлов производится обычно в нейтральном млм слабокислом растворе. Полноте осаждения часто способствует присутствие солей щелочных металлов—К SO4, MgSO4 и др.
Следует иметь ввиду, что во многих случаях образующиеся осадки могут растворяться в избытке реактива.
Х л о р н о е ж е л е з о и у к с у с н о е ж е л е з о осаждают белки из их растворов; осадок легко растворяется в избытке хлорного железа.
Х л о р н а я р т у т ь (сулема) осаждает белки и продукты частичного гидролиза их- пептоны.
У к с у с н р к и с л ы й с в и н е ц - нейтральный и основной (свинцовый уксус) является хорошим осадителем белков.
Г и д р а т о к и с и м е д и и г и д р а т о к и с и ц и н к а осаждают белки.
Гидрат окиси цинка, кроме белков, осаждает еще глутатион, мочевую кислоту и креатинин.
Процесс необратимого осаждения белков. Денатурация, обратимость процесса.
Необратимое осаждение белков связано с глубокими нарушениями структуры белков (вторичной и третичной) и потерей ими нативных свойств. Такие изменения белков можно вызвать кипячением, действием концентрированных растворов минеральных и органических кислот, солями тяжелых металлов.
(При действии солей тяжелых металлов происходит денатурация белковой молекулы. Осаждение денатурированного белка происходит из-за адсорбции частиц металла на поверхности белковой частицы. Свойства белков осаждаться солями тяжелых металлов используется в медицинской практике. Белки (в составе молока, яйца) применяют в качестве противоядия при отравлении солями тяжелых металлов. Белок ограничивает всасывание ионов металла, образуя с ними нерастворимые комплексы.)
Денатурация белков (лат. denaturatus — лишенный природных свойств; от de- — приставка, означающая отделение, удаление + natura — природа, естество) — термин биологической химии, означающий потерю белками их естественных свойств (растворимости, гидрофильности и др.) вследствие нарушения пространственной структуры их молекул.
Ренатурация — процесс, обратный денатурации, при котором белки возвращают свою природную структуру.(При нагревании двухцепочечных молекул ДНК до темп-ры ок. 100°С водородные связи между основаниями разрываются, и комплементарные цепи расходятся — ДНК денатурирует. Однако при медленном охлаждении комплементарные цепи могут вновь соединяться в регулярную двойную спираль. Эта способность ДНК к Р. используется для получения искусств, гибридных молекул ДНК (т. н. молекулярная гибридизация)
Нативная структура белка и ее разрушения. Признаки денатурации.
Функционально активную конформацию белка называют "нативная структура".
Денатурация белков - это разрушение их нативной конформации, вызванное разрывом слабых связей, стабилизирующих пространственные структуры, при действии денатурирующих агентов. Денатурация сопровождается потерей биологической активности белка.
Признаки денатурации:
1.Уникальная трехмерная структура каждого белка разрушается, и все молекулы одного белка приобретают случайную конформацию, т. е. отличную от других таких же молекул.
2. Радикалы аминокислот, формирующие активный центр белка, оказываются пространственно удаленными друг от друга, т. е. разрушается специфический центр связывания белка с лигандом.
3. Гидрофобные радикалы, обычно находящиеся в гидрофобном ядре глобулярных белков, при денатурации оказываются на поверхности молекулы, тем самым создаются условия для агрегации белков. Агрегаты белков выпадают в осадок.
4. При денатурации белков не происходит разрушения их первичной структуры. Вспомните условия, в которых происходит гидролиз пептидных связей.
Осаждение белков солями тяжелых металлов, механизм, особенности, значение для клиники.
При действии солей тяжелых металлов происходит денатурация белковой молекулы. Осаждение денатурированного белка происходит из-за адсорбции частиц металла (свинца, меди, ртути, серебра и других) на поверхности белковой частицы.
Особенности:Однако при избытке некоторых солей наблюдается растворение первоначально образовавшегося осадка. Это связано с накоплением ионов металла на поверхности денатурированного белка и появлением положительного заряда на белковой молекуле.
В клинике:свойства белков осаждаться солями тяжелых металлов используется в медицинской практике. Белки (в составе молока, яйца) применяют в качестве противоядия при отравлении солями тяжелых металлов. Белок ограничивает всасывание ионов металла, образуя с ними нерастворимые комплексы.
Работа № 1. Высаливание белков сыворотки крови сернокислым аммонием.
Реакция высаливания обусловлена дегидратацией макромолекул белка с одновременной нейтрализацией электрического заряда. Высаливание белков сернокислым аммонием может быть использовано для разделения белков друг от друга и получения их в кристаллическом виде. Например, глобулины сыворотки крови, имеющие большой молекулярный вес и меньший заряд легче высаливаются, чем альбумины. Глобулины осаждаются в полунасыщенном, а альбумины - в насыщенном растворе сернокислого аммония.
Высаливание белков – обратимый процесс. Осадок белка может вновь раствориться в воде после уменьшения концентрации солей. При этом белок не теряет своих естественных биологических свойств.
Ход работы.В пробирку поместить 2 мл сыворотки крови и добавить равный объем насыщенного раствора сернокислого аммония, перемешать. Получается полунасыщенный раствор сернокислого аммония, в котором выпадает осадок глобулина.
Осадок отфильтровать через бумажный фильтр в пробирку. К фильтрату добавить сухой сернокислый аммоний до полного насыщения раствора. Выпавший осадок альбумина отфильтровать через бумажный фильтр. Проверить фильтрат на отсутствие белка с помощью биуретовой реакции.
Для доказательства обратимости высаливания, полученные осадки прямо на фильтрах смочить с 2-3 мл дистиллированной воды и отметить их растворение.
Работа № 2. Осаждение белков при кипячении.
При нагревании почти все белки денатурируют и выпадают в осадок. При этом разрушаются водородные связи, происходит изменение вторичной и третичной структуры белка, белок теряет глобулярную форму и на поверхность молекулы, вместо гидрофильных групп, выходят гидрофобные. В сильнокислых и щелочных средах растворы белков при кипячении не коагулируют и могут дать осадок лишь при добавлении какой-нибудь нейтральной соли (NaCl). В этих случаях устойчивость белка в растворе зависит от приобретения положительного заряда в сильно-кислой среде и отрицательного заряда в щелочной. Наиболее легко белки подвергаются тепловой денатурации в изоэлектрической среде.
Клинико-диагностическое значение.Осаждение белков кипячением используется для качественного обнаружения белка в моче.
Ход работы.В 5 пробирок налить по 0,5 мл сыворотки. В 3-ю пробирку добавить 10 капель 1% раствора уксусной кислоты, для создания кислой среды. В 4-ю пробирку 10 капель 1% раствора уксусной кислоты и 5 капель насыщенного раствора поваренной соли. В 5-ю пробирку добавить 5 капель 10% раствора щелочи.
Все пробирки прокипятить. После кипячения во 2-ю пробирку добавить 1-2 капли 1% раствора уксусной кислоты.
Записать в таблицу результаты осаждения белка при кипячении. Отметить появление осадка плюсом, а отсутствие минусом и указать в каждом случае причины появления или отсутствия осадка белка.
| Реакция среды | Нейтральная | Слабокислая | Сильнокислая | Сильнокислая с электролитом | Щелочная |
| Результат | |||||
| Вывод |
Работа № 3. Осаждение белков солями тяжелых металлов.
Осаждение белков солями тяжелых металлов происходит при небольших концентрациях этих солей. Белки при взаимодействии с солями тяжелых металлов (свинца, меди, серебра, ртути и др.) адсорбируют их, образуя с ними солеобразные и комплексные соединения, растворимые в избытке солей. Клиническое значение: способность белка прочно связывать ионы тяжелого металла, в виде нерастворимых осадков в воде, позволяет использовать их как противоядие при отравлении солями ртути, меди, свинца и другими тяжелыми металлами.
А) Осаждение белков медным купоросом.
Налить в пробирку 1 мл раствора белка и по каплям добавить 10% раствор CuSO4 до образования осадка, нерастворимого в воде. При добавлении 10% раствора CuSO4 в большом объеме наблюдают растворение осадка в избытке реактива. Растворение осадка в избытке солей называется адсорбционной пептизацией. Данное явление происходит вследствие возникновения одноименного положительного заряда на частицах белка.
Б) Осаждение белков уксуснокислым свинцом.
К 1,0 мл раствора белка добавить 2-5 капель 5% раствора уксуснокислого свинца до образования осадка.
Осаждение белка солями тяжелых металлов.
Белки при взаимодействии с солями свинца, меди, ртути, серебра и других тяжелых металлов денатурируются и выпадают в осадок. Однако при избытке некоторых солей наблюдается растворение первоначально образовавшегося осадка. Это связано с накоплением ионов металла на поверхности денатурированного белка и появлением положительного заряда на белковой молекуле.
1) яичный белок, 1% раствор;
2) сульфат меди, 10% раствор;
3) ацетат свинца, 5% раствор;
4) нитрат серебра, 5% раствор.
Классификация белков в зависимости от выполняемых функций:
- ферменты – (от лат. «fermentum» - брожение, закваска) – группа специфических белков, увеличивающих скорость протекания химических реакций в клетках всех живых организмов.
- транспортные – группа белков, выполняющих функцию переноса различных атомов, молекул, ионов как внутри клетки, так и между клетками в многоклеточных организмах.
- структурные – группа белков, отвечающих за поддержание формы и стабильности клеток и тканей.
- регуляторные (гормональные) – группа белков, осуществляющих функции сигнальных веществ (гормонов).
- защитные – группа белков, предохраняющих организм от вторжения других организмов и повреждений.
- запасающие (резервные, пищевые) – группа белков, являющихся ценными пищевыми веществами. У животных – мышечные белки служат резервными питательными веществами, которые мобилизируются при крайней необходимости.
- сократительные (дигательные) – группа белков, ответственных за мышечное сокращение и другие формы биологической подвижности.
16.
Каждый индивидуальный белок, имеющий уникальную первичную структуру и конформацию, обладает и уникальной функцией, отличающей его от bqcx остальных белков. Набор индивидуальных белков выполняет в клетке множество разнообразных и сложных функций.
Необходимое условие для функционирования белков - присоединение к нему другого вещества, которое называют "лиганд". Лигандами могут быть как низкомолекулярные вещества, так и макромолекулы. Взаимодействие белка с лигандомвысокоспецифично, что определяется строением участка белка, называемого центром связывания белка с лигандом или активным центром.
А. Активный центр белков и избирательность связывания его с лигандом
Активный центр белков - определённый участок белковой молекулы, как правило, находящийся в её углублении ("кармане"), сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга.
Высокая специфичность связывания белка с лигандом обеспечивается комплементарностью структуры активного центра белка структуре лиганда (рис. 1-25).
Под комплементарностью понимают пространственное и химическое соответствие взаимодействующих молекул. Лиганд должен обладать способностью входить и пространственно совпадать с конформацией активного центра. Это совпадение может быть неполным, но благодаря конформационной лабильности белка активный центр способен к небольшим изменениям и "подгоняется" под лиганд. Кроме того, между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре. Связи между лигандом и активным центром белка могут быть как нековалентными (ионными, водородными, гидрофобными), так и ковалентными.

Рис. 1-25. Взаимодействие белка с лигандом. А и Б - некомплементарное взаимодействие и разрушение связей между белком и лигандом; В - комплементарное взаимодействие белка с лигандом.
1. Характеристика активного центра
Активный центр белка - относительно изолированный от окружающей белок среды участок, сформированный аминокислотными остатками. В этом участке каждый остаток благодаря своему индивидуальному размеру и функциональным группам формирует "рельеф" активного центра.
Объединение таких аминокислот в единый функциональный комплекс изменяет реакционную способность их радикалов, подобно тому, как меняется звучание музыкального инструмента в ансамбле. Поэтому аминокислотные остатки, входящие в состав активного центра, часто называют "ансамблем" аминокислот.
Уникальные свойства активного центра зависят не только от химических свойств формирующих его аминокислот, но и от их точной взаимной ориентации в пространстве. Поэтому даже незначительные нарушения общей конформации белка в результате точечных изменений его первичной структуры или условий окружающей среды могут привести к изменению химических и функциональных свойств радикалов, формирующих активный центр, нарушать связывание белка с лигандом и его функцию. При денатурации активный центр белков разрушается, и происходит утрата их биологической активности.
Часто активный центр формируется таким образом, что доступ воды к функциональным группам его радикалов ограничен, т.е. создаются условия для связывания лиганда с радикалами аминокислот.
В некоторых случаях лиганд присоединяется только к одному из атомов, обладающему определённой реакционной способностью, например присоединение О2 к железу миоглобина или гемоглобина. Однако свойства данного атома избирательно взаимодействовать с О2 определяются свойствами радикалов, окружающих атом железа в составе тема. Гем содержится и в других белках, таких как цитохромы. Однако функция атома железа в цитохромах иная, он служит посредником для передачи электронов от одного вещества другому, при этом железо становится то двух-, то трёхвалентным.
Центр связывания белка с лигандом часто располагается между доменами. Например, протеолитический фермент трипсин, участвующий в гидролизе пептидных связей пищевых белков в кишечнике, имеет 2 домена, разделённых бороздкой. Внутренняя поверхность бороздки формируется аминокислотными радикалами этих доменов, стоящими в полипептидной цепи далеко друг от друга (Сер177, Гис40, Асп85).
Разные домены в белке могут перемещаться друг относительно друга при взаимодействии с лигандом, что облегчает дальнейшее функционирование белка. В качестве примера можно рассмотреть работу гексокиназы, фермента, катализирующего перенос фосфорного остатка с АТФ на молекулу глюкозы (при её фосфорилировании). Активный центр гексокиназы располагается в расщелине между двумя доменами (рис. 1-26) При связывании гексокиназы с глюкозой окружающие её домены сближаются, и субстрат оказывается в "ловушке", что облегчает его дальнейшее фосфорилирование.
Основное свойство белков, лежащее в основе их функций, - избирательность присоединения к определённым участкам белковой молекулы специфических лигандов.
2. Многообразие лигандов
- Лигандами могут быть неорганические (часто ионы металлов) и органические вещества, низкомолекулярные и высокомолекулярные вещества;
- существуют лиганды, которые изменяют свою химическую структуру при присоединении к активному центру белка (изменения субстрата в активном центре фермента);
- существуют лиганды, присоединяющиеся к белку только в момент функционирования (например, О2, транспортируемый гемоглобином), и лиганды, постоянно связанные с белком, выполняющие вспомогательную роль при функционировании белков (например, железо, входящее в состав гемоглобина).
В тех случаях, когда аминокислотные остатки, формирующие активный центр, не могут обеспечить функционирование данного белка, к определённым участкам активного центра могут присоединяться небелковые молекулы. Так, в активном центре многих ферментов присутствует ион металла (кофактор) или органическая небелковая молекула (кофермент). Небелковую часть, прочно связанную с активным центром белка и необходимую для его функционирования, называют "простатическая группа". Миоглобин, гемоглобин и цитохромы имеют в активном центре простетическую группу - гем, содержащий железо (более подробно гемсодержащие белки описаны в разделе 4, а кофакторы и коферменты - в разделе 2).
Соединение протомеров в олигомерном белке - пример взаимодействия высокомолекулярныхлигандов. Каждый протомер, соединённый с другими протомерами, служит для них лигандом, так же как они для него.
Иногда присоединение какого-либо лиганда изменяет конформацию белка, в результате чего формируется центр связывания с другими лигандами. Например, белок кальмодулин после связывания с четырьмя ионами Са 2+ в специфических участках приобретает способность взаимодействовать с некоторыми ферментами, меняя их активность.

Рис. 1-26. Связывание гексокиназы с глюкозой.
3. Сродство активного центра лиганду
Скорость взаимодействия белка с лигандом определяется концентрациями белка и лиганда в растворе, а также степенью комплементарности белка и лиганда.
Константа диссоциации - характеристика сродства активного центра лиганду.
· Так как взаимодействие белка с лигандом - обратимый процесс, то его можно описать следующим уравнением:
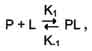
где Р - белок, L - лиганд, PL - комплекс белка с лигандом, К1 - константа скорости связывания белка с лигандом, К-1 - константа скорости распада комплекса PL.
Когда скорости образования и распада комплекса равны, говорят о том, что система находится в состоянии равновесия:
Соотношение констант распада [PL] комплекса и его образования называется константой диссоциации (Кдисс) комплекса [PL]. Чем меньше Кдисс , тем больше молекул лиганда связано с белком, тем больше комплементарность между Р и L и тем больше сродство лиганда к белку. То есть между Кдисс и сродством лиганда к белку имеется обратно пропорциональная связь.
Иногда при описании процесса связывания белка с лигандом используют величину, обратную Кдисс, называемую константой связывания (Ксв) или ассоциации.
Между Ксв. и сродством лиганда к белку существует прямо пропорциональная зависимость.
Зависимость насыщения белка лигандом от концентрации лиганда при постоянной концентрации белка
· При постоянной концентрации белка увеличение концентрации лиганда приводит к росту концентрации комплекса [PL]. Эта зависимость носит характер гиперболической кривой (рис. 1-27). Кривая стремится к максимуму, когда при некоторой концентрации лиганда все молекулы белка находятся в связанном с лигандом состоянии (происходит насыщение белка лигандом). Степень насыщения белка лигандом можно выразить следующим уравнением: степень насыщения = [PL]/[P0]?100 (где Р0 - концентрация белка до добавления лиганда).
· При полунасыщении белка лигандом концентрации [PL] и [Р] равны, и из уравнения Кдисс, приведённого выше, следует, что Кдисс = [L], т.е. Кдисс численно равна концентрации лиганда, при которой 50% белка находится в комплексе с лигандом. Поэтому по кривой насыщения можно найти Кдисс и оценить сродство данного белка лиганду.
Зависимость между образованием комплекса [PL] и концентрацией белка при избытке лиганда
· Как было сказано выше, при возрастающей концентрации лиганда насыщение белка ограничено его концентрацией. При избытке лиганда все молекулы белка находятся в составе комплекса [PL]. Однако, если увеличивать концентрацию белка, то количество [PL] начнёт увеличиваться пропорционально концентрации белка. Концентрацию комплекса [PL] можно регистрировать, например

Рис. 1-27. График насыщения белка лигандом.
· с помощью измерения поглощения света. Учитывая, что его количество пропорционально концентрации белка, можно на основании построенного графика определять концентрацию белка в растворе (рис. 1-28).
В основе функционирования любого белка лежит его способность к избирательному взаимодействию с каким-либо другим веществом — лигандом. Лигандом может быть как низкомолекулярное вещество, так и макромолекула, в том числе другой белок. Лиганд присоединяется к определенному участку на поверхности белковой молекулы — центру связывания (активный центр).
Активный центр белков – определённый участок белковой молекулы, как правило, находящийся в её углублении, сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга.
Высокая специфичность связывания белка с лигандом обеспечивается комплементарностью структуры активного центра белка и структуры лиганда.
Под комплементарностью понимают пространственное и химическое соответствие взаимодействующих молекул. Лиганд должен обладать способностью входить и пространственно совпадать с конформацией активного центра. Это совпадение может быть неполным, но благодаря конформационной лабильности белка, активный центр способен к небольшим изменениям и «подгоняется» под лиганд. Кроме того, между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре. Связи между лигандом и активным центром белка могут быть как нековалентными (ионными, водородными, гидрофобными), так и ковалентными.
Тот факт, что ферменты обладают высокой специфичностью, позволил в 1890 г. выдвинуть гипотезу, согласно которой активный центр фермента комплементарен субстрату, т.е. соответствует ему как "ключ замку". После взаимодействия субстрата ("ключ") с активным центром ("замок") происходят химические превращения субстрата в продукт. Активный центр при этом рассматривался как стабильная, жёстко детерминированная структура.
В 1959 г. был предложен другой вариант гипотезы "ключ-замок", объясняющий события в активном центре фермента. По этой гипотезе активный центр является гибкой структуройпо отношению к субстрату. Субстрат, взаимодействуя с активным центром фермента, вызывает изменение его конформации, приводя к формированию фермент-субстратного комплекса, благоприятного для химических модификаций субстрата. При этом молекула субстрата также изменяет свою конформацию, что обеспечивает более высокую эффективность ферментативной реакции. Эта "гипотеза индуцированного соответствия" впоследствии получила экспериментальное подтверждение.
19.Четвертичная структура белков
Количество и взаиморасположение полипептидных цепей в пространстве называют "четвертичная структура белков".Отдельные полипептидные цепи в таком белке носят название протомеров, или субъединиц. Белок, содержащий в своём составе несколько протомеров, называют олигомерным.
1. Количество протомеров в структуре
олигомерных белков
В состав олигомерных белков может входить от двух до нескольких десятков протомеров, хотя наиболее часто встречают белки, содержащие от двух до четырёх полипептидных цепей (димерные, тетрамерные белки).Так, фермент гексокиназа содержит в своём составе 2 протомера; белок эритроцитов гемоглобин и фермент лактатдегидрогеназа - 4 протомера; Некоторые олигомерные белки содержат идентичные протомеры (например, гексокиназа), другие состоят из разных протомеров. Олигомерные белки имеют большую молекулярную массу. Белки с молекулярной массой более 50 000 Д практически всегда содержат несколько мономерных полипептидных цепей. По сравнению с индивидуальными мономерными белками олигомеры выполняют более сложные функции.
2. Сборка протомеров в олигомерный белок.
Комплементарность протомеров
"Узнавание" и присоединение отдельных протомеров олигомерного белка происходят благодаря формированию на их поверхности контактных участков. Последние состоят из радикалов аминокислот, собранных в данном месте в процессе образования третичной структуры белка. Совокупность этих радикалов формирует уникальные поверхности, способные с высокой специфичностью объединяться друг с другом. Таким образом, взаимодействие протомеров осуществляется во многих точках контактирующих поверхностей, с образованием десятков слабых связей. Благодаря этому контактные поверхности соединяются с высокой специфичностью, и ошибки формирования четвертичной структуры белков практически исключены. Комплементарность - универсальный принцип, свойственный живой природе и лежащий в основе узнавания и соединения не только протомеров, но и других (не обязательно белковых) молекул.
Кооперативность
Кооперативное связывание
Когда субстрат связывается с активным центром одной субъединицы фермента, остальные субъединицы активируются. Лиганды могут иметь некооперативный, положительный или отрицательный кооперативный эффект.(Примером положительной кооперативности может служить связывание кислорода гемоглобином.)Отрицательная кооперативность означает противоположное — в момент связывания лиганда белком, сродство белка к лиганду снижается. Примером может служить взаимодействие между глицеральдегид-3-фосфатом и ферментом глицеральдегид-3-фосфат дегидрогеназой.
Кооперативность, явление кооперативности — это такие изменения состояния системы, взаимодействие элементов которой усиливается с течением процесса изменения так, что существенно ускоряет его ход в целом (положительная кооперативность). Таким образом, сила взаимодействия атомов или молекул возрастает по мере нарастания изменений в системе, делая их коллективно согласованными
3. ОСОБЕННОСТИ ФУНКЦИОНИРОВАНИЯ ОЛИГОМЕРНЫХ БЕЛКОВ НА ПРИМЕРЕ ГЕМОГЛОБИНА.
Олигомерные белки проявляют свойства, отсутствующие у мономерных белков. Влияние четвертичной структуры на функциональные свойства белка можно рассмотреть, сравнивая строение и функции двух родственных гемсодержащих белков: миоглобина и гемоглобина. Оба белка имеют общее эволюционное происхождение, сходную конформацию отдельных полипептидных цепей и сходную функцию (участвуют в транспорте кислорода), но миоглобин - мономерный белок, а гемоглобин - тетрамер. Наличие четвертичной структуры у гемоглобина придаёт этому белку свойства, отсутствующие у миоглобина.
Читайте также:
