Осаждение гидроксидов металлов при действии аммиака на растворы солей
Обновлено: 05.10.2024
Гидроксиды могут проявлять амфотерные свойства и растворяться в кислотах и щелочах. В кислой среде гидроксиды играют роль оснований и динамическое равновесие, существующее в насыщенном водном растворе в системе Ме(ОН)n(тв) – Н2О можно определить уравнением:
Ме(ОН)n(тв) Û Ме n+ +nOH - (10.35)
Ионное произведение (константа) воды:
Подставляя (10.39) в (10.37) и логарифмируя, получим
lg CМе n+ = lg L – n pH – n lg Kw . (10.40)
Пользуясь уравнением (40), можно вычислить остаточную (равновесную) концентрацию металла в растворе при различных значениях рН среды, а также рассчитать величину рН, при которой начинается и заканчивается осаждение гидроксида при известных начальной и заданной конечной концентрациях металла.
Из уравнения (10.40) видно, что равновесная концентрация металла определяется его индивидуальными свойствами (L) и значением рН раствора. Для выщелачивания гидроксидов рН среды следует понижать, для выделения металла из раствора в форме гидроксида – увеличивать.
Результаты вычислений (уравнение 10.40) удобно представить в виде диаграммы в координатах «CМе n+ - рН» или «lg CМе n+ - рН» (рис.2.3).
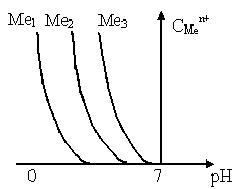 | 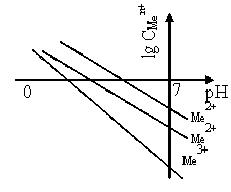 |
| Рисунок 10.1 - Зависимость равновесной концентрации металла от рН среды (кислая среда) |
Наклон линий в полулогарифмической диаграмме определяется степенью окисления металла, а расположение линии зависит от величины L соответствующего гидроксида.
Ряд металлов образуют гидроксиды, которые растворяются в щелочной среде (например, P, V, W, Mo). В этих условиях гидроксиды можно рассматривать как кислоты и представить их в виде: Ме (ОН)n Û HnMeOn
В этом случае равновесная концентрация металла является функцией L и рН среды:
lg CMeOn n- = lg L + n pH . (10.43)
Графическое отображение уравнения (10.43) имеет вид, изображённый на рисунок 10.2
Характер полулогарифмических диаграмм наглядно показывает возможность разделения металлов осаждением гидроксидов. При определенном значении рН раствора одни металлы могут находиться в растворе, а другие – выделяться в твердую фазу в форме гидроксидов с достаточно малыми остаточными концентрациями в растворе. При этом, например, в кислой среде, прежде всего начнет осаждаться гидроксид того металла, рН гидратообразование которого меньше (раствор кислее) и следовательно, растворимость его меньше.
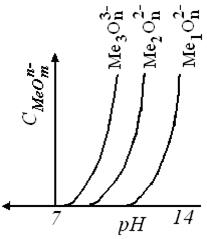 | 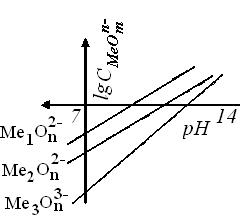 |
| Рисунок 10.2 - Зависимость равновесной концентрации металла от рН среды (щелочная среда) |
Чистые гидроксиды металлов осаждаются лишь из разбавленных растворов или из растворов с малой величиной активности ионов металла, образующего гидроксид.
При соблюдении определенных условий (тонком регулировании рН раствора) подобным осаждением гидроксидов удается осуществить разделение весьма близких по свойствам элементов (например, редкоземельные элементы).
При разделении РЗЭ на фракции тонкое регулирование рН достигается пропусканием через раствор воздуха в смеси с аммиаком (воздух первоначально проходит через раствор аммиака). Медленному изменению рН способствует присутствие азотнокислого аммония, что приводит к образованию буферной смеси NH4NO3 + NH4OH.
Иногда в производственной практике в результате гидролиза при определенном рН осаждаются основные соли. Так, при нейтрализации содой азотнокислых или солянокислых растворов, содержащие редкоземельные элементы, осаждаются основные карбонаты Me(OH)CO3 · n H2O (где Ме – La, Ce, Pr, Nd) в смеси с нормальными карбонатами.
7.1. Осаждение и соосаждение (совместное осаждение)
Реакции осаждения наиболее часто используются в аналитической химии для идентификации и определения катионов и анионов. Осаждение проводят следующим образом: к нескольким каплям исследуемого раствора, обычно в центрифужной пробирке, прибавляют пипеткой (не касаясь стенок пробирки!) указанное число капель реагента, предварительно создав надлежащие условия. Затем содержимое пробирки тщательно перемешивают стеклянной палочкой и, если нужно, нагревают на водяной бане.
При использовании реакций осаждения для обнаружения ионов нет необходимости в том, чтобы осаждение было количественным. Часто достаточно одной капли реа
гента, чтобы можно было судить о присутствии или отсутствии того или иного иона. Одним из универсальных осадителей являются гидроксид-ионы. Задача осаждения гидроксидов металлов сводится к созданию и поддержанию определенного значения рН среды.
Для осаждения гидроксидов металлов обычно используют гидроксиды натрия (калия), аммиак. Нередко образование гидроксидов металлов наблюдается и при действии солей слабых кислот, таких, как карбонат натрия (калия), карбонат аммония, сульфид аммония. Вследствие гидролиза их растворы имеют щелочную реакцию. Поэтому, если растворимость гидроксида меньше, чем растворимость карбоната или сульфида, то при действии данных реагентов выпадает гидроксид.
Методы осаждения основаны на применении реакций осаждения, связанных с образованием малорастворимых соединений. Эти методы дают возможность количественно определять анионы, осаждаемые катионами Ag + , Ba 2+ , Hg + , Pb 2+ , Zn 2+ и др., а также катионы, образующие малорастворимые соединения с Cl - , Br - , I - , CN - , SCN - , SO4 2- , CrO4 2- , PO4 3- , [Fe(CN)6] 3- и др.
В растворе соединения KtaAnb произведение активностей катионов и анионов (ПР) сохраняется неизменным, строго определенным:
Условием выпадения осадка из раствора является выполнение неравенства:
т.е. растворимость электролита приобретает максимальное значение в насыщенном растворе, свободном от посторонних ионов. Если исходная концентрация ионов А до осаждения равна сА, а равновесная концентрация после осаждения равна [A], то:
где L – равновесная концентрация осадителя.
Подставим уравнение (7.2) в уравнение (7.1), получим:
Иногда растворы содержат настолько малые количества анализируемого вещества, что при любых концентрациях осадителя условие выпадения осадка соблюдаться не будет. В таких случаях в раствор вводят посторонний катион (или анион) и осаждают его соответствующим реагентом. На осадке в процессе его образования соосаждаются следы определяемых ионов.
Соосаждение с неорганическими и органическими соосадителями представляет собой один из эффективных способов концентрирования элементов. Причин соосаждения может быть несколько: окклюзия, адсорбция, образование твердых растворов, внесение центров кристаллизации, ионообменные процессы.
Большая Энциклопедия Нефти и Газа
Большие значения рН требуются для осаждения гидроксидов с большими значениями ПР. В отличие от солей слабых кислот осаждение малорастворимых солей одноосновных кислот ( AgCl, AgBr, Agl) почти не зависит от рН раствора. Но влияние избытка кислоты необходимо учитывать из-за таких явлений, как солевой эффект или возможность комплексообразования. Малорастворимые сульфаты из кислых растворов осаждаются менее полно, чем из нейтральных или щелочных. Это более заметно у сульфатов свинца, стронция и кальция и в меньшей степени у сульфата бария. [17]
Гидроксид натрия, нужный для осаждения гидроксида / магния, вносится с обратным рассолом. [18]
Если при титровании необходимо предотвратить осаждение гидроксидов металлов или их основных солей, в титруемый раствор добавляют дополнительные комплексанты, например цитрат, тартрат-ионы или триэтанол-амин. Если титрование удобно проводить при рН 9 - 10, то обычно добавляют буферную смесь аммиака с хлоридом аммония сравнительно высокой концентрации. Такая буферная смесь не только поддерживает требуемое значение рН, но и поставляет комплексант ( аммиак) для тех металлов, которые образуют ам-минокомплексы. Ионы некоторых металлов, например железа ( III), висмута и тория, титруют в кислой среде. [19]
Кроме того, аммиак предотвращает осаждение гидроксида цинка вследствие образования аммиачных комплексов. [21]
Производство железооксидного катализатора включает стадии осаждения гидроксида железа ( II) аммиачной водой из раствора сульфата желе-за ( П), окисления Fe ( OH) 2 до Fe ( OH) 3 и последующего обезвоживания его при прокаливании. [22]
Предварительно определите среду раствора при осаждении гидроксида , чтобы отградуировать рН - метр по соответствующим буферным растворам. [23]
Следует учитывать, что при осаждении гидроксидов щелочью при добавлении ее раствора к раствору соответствующей соли в местах, куда попадают капли осаждающего реактива, создаются повышенные значения рН и выпадает осадок, который при перемешивании часто не растворяется. [24]
В табл. 4.2 представлены значения рН осаждения гидроксидов металлов и остаточные концентрации ионов металлов в сточной воде. [25]
При работе с редкоземельными элементами вследствие осаждения гидроксидов пик исследуемого элемента может даже исчезнуть. [26]
Спиро в 1938 г. разработал способ осаждения гидроксида магния из вод морей и океанов, содержащих около 0 4 % MgCl2 и 0 2 % MgSO4, названный им методом наращивания ( см. гл. При обычных условиях осаждения образующиеся в этой системе частицы Mg ( OH) 2 имеют ничтожно малые размеры, характерные для коллоидных частиц, а осадок является псевдоаморфным и имеет характер золя. [27]
Какая концентрация гидроксид-иона необходима для начала осаждения гидроксида магния из 0 01 F раствора сульфата магния. [28]
Как и при осаждении кристаллических осадков, осаждение гидроксида железа ( III) ведут при нагревании и в присутствии электролита-коагулятора, так как аморфный осадок гидроксида железа Fe ( OH) 3 легко может давать коллоидные растворы. [29]
Как и при осаждении кристаллических осадков, осаждение гидроксида железа ( III) ведут при нагревании и в присутствии электролита-коагулятора, так как аморфный осадок гидроксида железа Fe ( ОН) з легко может давать коллоидные растворы. [30]
Полученную пульпу направляют в сгустители для осаждения гидроксида алюминия , который затем промывают декантацией и отфильтровывают на вакуум-фильтрах. Фильтрат в дальнейшем направляют на упаривание и выщелачивание новых порций боксита. Таким образом осуществляют циркуляцию раствора едкого натра, содержащего значительное количество алюмината. Для получения оксида алюминия гидроксид подвергают прокаливанию ( кальцинации) при 1200 С, которое проводят во вращающихся печах. Топливом служит жидкое горючее или природный газ. [3]
Одной из классических гравиметрических методик является осаждение гидроксидов алюминия , хрома или железа при добавлении водного раствора аммиака к растворам, содержащим один из этих элементов. В результате реакции образуется, однако, объемистый и студенистый осадок, чем объясняются многочисленные трудности при фильтровании и промывании, а также возможность соосаждения других катионов и анионов. [4]
Приготовление катализатора включает следующие этапы: осаждение гидроксида алюминия из водного раствора алюмината и его синерезис; сушку и формование таблеток А1гОз; введение фтора с последующими сушкой и прокаливанием; пропитку носителя водным раствором соединения платины и последующую термообработку в атмосфере воздуха и водорода. [5]
Так, буферные смеси NH4OH NH4C1 используют для осаждения гидроксида алюминия , который при действии только одного раствора аммиака частично растворяется в избытке аммиака. Эту же буферную смесь применяют, если необходимо удержать гидро-ксид магния в растворе ( с. Ацетатный ( СНзСООН-ь CH3COONa) и формиатный ( HCOOH HCOONa) буферы используют при осаждении ионов цинка сероводородом. Многие цветные реакции с органическими реактивами можно успешно применять только при определенном значении рН раствора. [6]
Допускается вводить неосветленные растворы перед осветлительными фильтрами станций обработки воды, добавляя в воду фторсодержащие реагенты только после полного завершения коагуляции и осаждения гидроксида алюминия . [7]
Кроме того, в нескольких исследованиях, в которых данные о растворимости были получены для интервала рН, не совпадающего с интервалом рН осаждения гидроксида алюминия , рассчитанное произведение растворимости среднего фосфата было значительно больше. [9]
Оксид алюминия с высокой пористостью ( 2 - 4 см3 / г) и удельной поверхностью ( 200 - 500 м2 / г) может быть получен, если осаждение гидроксида алюминия проводить при температуре 50 С из раствора алюмината натрия галогеногидринами, например этилен - и пропиленхлоргидрином или моно - и дихлор-гидринглицеринами. [10]
К раствору соли алюминия приливают раствор гидроксида натрия. Наблюдают осаждение гидроксида алюминия . Осадок растворяют в избытке раствора щело чи. Затем избыток щелочи нейтрализуют, для этого в пробирку приливают немного раствора МШС. Алюминат натрия почти полностью гидро-лизуется и гидррксид алюминия снова выпадает в осадок. Объясняют, какое действие оказывает раствор NH4C1 и почему в конце опыта необходимо нагревать пробирку. [11]
К раствору соли алюминия приливают раствор гидроксида натрия. Наблюдают осаждение гидроксида алюминия . Осадок растворяют в избытке раствора щелочи. Затем избыток щелочи нейтрализуют, для этого в пробирку приливают немного раствора NH4C1 и нагревают ее. Алюминат натрия почти полностью гидро-лизуется и гидроксид алюминия снова выпадает в осадок. Объясняют, какое действие оказывает раствор NH tCl и почему в конце опыта необходимо нагревать пробирку. [12]
В большинстве случаев эффективность разделения при использовании описанного метода осаждения также значительно выше. Так, при обычном осаждении гидроксида алюминия аммиаком необходимо поддерживать значение рН в очень узком интервале, иначе в силу амфотерности гидроксида алюминия осаждение пройдет не количественно. [13]
Для создания и поддержания величины рН к исследуемому раствору добавляют ту или иную буферную смесь. Так, аммиачная буферная система используется для осаждения гидроксида алюминия , который при применении чистого раствора аммиака частично растворяется в его избытке. [14]
При обработке технической воды и технологических суспензий алюминиевыми коагулянтами этот интервал может быть значительно расширен. Эти данные хорошо согласуются со значениями рН осаждения гидроксида алюминия . [15]
Аммиак: получение и свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:

Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :

У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:

Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:

Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание . При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например , аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов , образуя нерастворимые гидроксиды.
Например , водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например , хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
Гидроксид меди (II) растворяется в избытке аммиака:
5. Аммиак горит на воздухе , образуя азот и воду:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя , например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием . С металлами реагирует только жидкий аммиак.
Например , жидкий аммиак реагирует с натрием с образованием амида натрия:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например , аммиак окисляется хлором до молекулярного азота:
Пероксид водорода также окисляет аммиак до азота:
Оксиды металлов , которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например , оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Читайте также:
