Переход металла из жидкого состояния в твердое кристаллическое называется
Обновлено: 05.07.2024
Любое вещество может находиться в трех агрегатных состояниях: твердом, жидком, газообразном. Возможен переход из одного состояния в другое, если новое состояние в новых условиях является более устойчивым, обладает меньшим запасом энергии.
С изменением внешних условий свободная энергия изменяется по сложному закону различно для жидкого и кристаллического состояний. Характер изменения свободной энергии жидкого и твердого состояний с изменением температуры показан на рис. 3.1.
Рис.3.1. Изменение свободной энергии в зависимости от температуры
В соответствии с этой схемой выше температуры ТS вещество должно находиться в жидком состоянии, а ниже ТS – в твердом.
При температуре равной ТS жидкая и твердая фаза обладают одинаковой энергией, металл в обоих состояниях находится в равновесии, поэтому две фазы могут существовать одновременно бесконечно долго. Температура ТS – равновесная илитеоретическая температура кристаллизации.
Для начала процесса кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Это возможно при охлаждении жидкости ниже температуры ТS. Температура, при которой практически начинается кристаллизация называетсяфактической температурой кристаллизации.
Охлаждение жидкости ниже равновесной температуры кристаллизации называется переохлаждением, которое характеризуется степенью переохлаждения ():
Степень переохлаждения зависит от природы металла, от степени его загрязненности (чем чище металл, тем больше степень переохлаждения), от скорости охлаждения (чем выше скорость охлаждения, тем больше степень переохлаждени).
Рассмотрим переход металла из жидкого состояния в твердое.
При нагреве всех кристаллических тел наблюдается четкая граница перехода из твердого состояния в жидкое. Такая же граница существует при переходе из жидкого состояния в твердое.
Кристаллизация – это процесс образования участков кристаллической решетки в жидкой фазе и рост кристаллов из образовавшихся центров.
Кристаллизация протекает в условиях, когда система переходит к термодинамически более устойчивому состоянию с минимумом свободной энергии.
Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах время – температура. Кривая охлаждения чистого металла представлена на рис. 3.2.
Рис.3.2. Кривая охлаждения чистого металла
– теоретическая температура кристаллизации;
. – фактическая температура кристаллизации.
Процесс кристаллизации чистого металла:
До точки 1 охлаждается металл в жидком состоянии, процесс сопровождается плавным понижением температуры. На участке 1 – 2 идет процесс кристаллизации, сопровождающийся выделением тепла, которое называется скрытой теплотой кристаллизации. Оно компенсирует рассеивание теплоты в пространство, и поэтому температура остается постоянной. После окончания кристаллизации в точке 2 температура снова начинает снижаться, металл охлаждается в твердом состоянии.
Механизм и закономерности кристаллизации металлов.
При соответствующем понижении температуры в жидком металле начинают образовываться кристаллики – центры кристаллизации или зародыши. Для начала их роста необходимо уменьшение свободной энергии металла, в противном случае зародыш растворяется.
Минимальный размер способного к росту зародыша называется критическим размером, а зародыш – устойчивым.
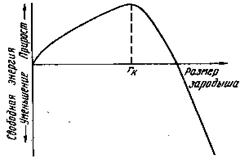
Переход из жидкого состояния в кристаллическое требует затраты энергии на образование поверхности раздела жидкость – кристалл. Процесс кристаллизации будет осуществляться, когда выигрыш от перехода в твердое состояние больше потери энергии на образование поверхности раздела. Зависимость энергии системы от размера зародыша твердой фазы представлена на рис. 3.3.
Зародыши с размерами равными и большими критического растут с уменьшением энергии и поэтому способны к существованию.
Рис.3.3. Зависимость энергии системы от размера зародыша твердой фазы
Механизм кристаллизации представлен на рис.3.4.
Рис.3.4. Модель процесса кристаллизации
Центры кристаллизации образуются в исходной фазе независимо друг от друга в случайных местах. Сначала кристаллы имеют правильную форму, но по мере столкновения и срастания с другими кристаллами форма нарушается. Рост продолжается в направлениях, где есть свободный доступ питающей среды. После окончания кристаллизации имеем поликристаллическое тело.
Качественная схема процесса кристаллизации может быть представлена количественно кинетической кривой (рис.3.5).
Рис. 3.5. Кинетическая кривая процесса кристаллизации
Процесс вначале ускоряется, пока столкновение кристаллов не начинает препятствовать их росту. Объем жидкой фазы, в которой образуются кристаллы уменьшается. После кристаллизации 50 % объема металла, скорость кристаллизации будет замедляться.
Таким образом, процесс кристаллизации состоит из образования центров кристаллизации и роста кристаллов из этих центров.
В свою очередь, число центров кристаллизации (ч.ц.) и скорость роста кристаллов (с.р.) зависят от степени переохлаждения (рис. 3.6).
Рис. 3.6. Зависимость числа центров кристаллизации (а) и скорости роста кристаллов (б) от степени переохлаждения
Размеры образовавшихся кристаллов зависят от соотношения числа образовавшихся центров кристаллизации и скорости роста кристаллов при температуре кристаллизации.
При равновесной температуре кристаллизации ТS число образовавшихся центров кристаллизации и скорость их роста равняются нулю, поэтому процесса кристаллизации не происходит.
Если жидкость переохладить до температуры, соответствующей т.а, то образуются крупные зерна (число образовавшихся центров небольшое, а скорость роста – большая).
При переохлаждении до температуры соответствующей т.в – мелкое зерно (образуется большое число центров кристаллизации, а скорость их роста небольшая).
Если металл очень сильно переохладить, то число центров и скорость роста кристаллов равны нулю, жидкость не кристаллизуется, образуется аморфное тело. Для металлов, обладающих малой склонностью к переохлаждению, экспериментально обнаруживаются только восходящие ветви кривых.
Условия получения мелкозернистой структуры
Стремятся к получению мелкозернистой структуры. Оптимальными условиями для этого являются: максимальное число центров кристаллизации и малая скорость роста кристаллов.
Размер зерен при кристаллизации зависит и от числа частичек нерастворимых примесей, которые играют роль готовых центров кристаллизации – оксиды, нитриды, сульфиды.
Чем больше частичек, тем мельче зерна закристаллизовавшегося металла.
Стенки изложниц имеют неровности, шероховатости, которые увеличивают скорость кристаллизации.
Мелкозернистую структуру можно получить в результате модифицирования, когда в жидкие металлы добавляются посторонние вещества – модификаторы,
По механизму воздействия различают:
1. Вещества не растворяющиеся в жидком металле – выступают в качестве дополнительных центров кристаллизации.
2. Поверхностно - активные вещества, которые растворяются в металле, и, осаждаясь на поверхности растущих кристаллов, препятствуют их росту.
Строение металлического слитка
Схема стального слитка, данная Черновым Д.К., представлена на рис.3.7.
Рис. 3.7. Схема стального слитка
Слиток состоит из трех зон:
1. мелкокристаллическая корковая зона;
2. зона столбчатых кристаллов;
3. внутренняя зона крупных равноосных кристаллов.
Кристаллизация корковой зоны идет в условиях максимального переохлаждения. Скорость кристаллизации определяется большим числом центров кристаллизации. Образуется мелкозернистая структура.
Жидкий металл под корковой зоной находится в условиях меньшего переохлаждения. Число центров ограничено и процесс кристаллизации реализуется за счет их интенсивного роста до большого размера.
Рост кристаллов во второй зоне имеет направленный характер. Они растут перпендикулярно стенкам изложницы, образуются древовидные кристаллы – дендриты (рис. 3.8). Растут дендриты с направлением, близким к направлению теплоотвода.
Рис.3.8. Схема дендрита по Чернову Д.К.
Так как теплоотвод от незакристаллизовавшегося металла в середине слитка в разные стороны выравнивается, то в центральной зоне образуются крупные дендриты со случайной ориентацией.
З оны столбчатых кристаллов в процессе кристаллизации стыкуются, это явление называетсятранскристаллизацией.
Для малопластичных металлов и для сталей это явление нежелательное, так как при последующей прокатке, ковке могут образовываться трещины в зоне стыка.
В верхней части слитка образуется усадочная раковина, которая подлежит отрезке и переплавке, так как металл более рыхлый (около 15…20 % от длины слитка)
Методы исследования металлов: структурные и физические
Металлы и сплавы обладают разнообразными свойствами. Используя один метод исследования металлов, невозможно получить информацию о всех свойствах. Используют несколько методов анализа.
Определение химического состава.
Используются методы количественного анализа.
1. Если не требуется большой точности, то используют спектральный анализ.
Спектральный анализ основан на разложении и исследовании спектра электрической дуги или искры, искусственно возбуждаемой между медным электродом и исследуемым металлом.
Зажигается дуга, луч света через призмы попадает в окуляр для анализа спектра. Цвет и концентрация линий спектра позволяют определить содержание химических элементов.
Используются стационарные и переносные стилоскопы.
2. Более точные сведения о составе дает рентгеноспектральный анализ.
Проводится на микроанализаторах. Позволяет определить состав фаз сплава, характеристики диффузионной подвижности атомов.
Изучение структуры.
Различают макроструктуру, микроструктуру и тонкую структуру.
1. Макроструктурный анализ – изучение строения металлов и сплавов невооруженным глазом или при небольшом увеличении, с помощью лупы.
Осуществляется после предварительной подготовки исследуемой поверхности (шлифование и травление специальными реактивами).
Позволяет выявить и определить дефекты, возникшие на различных этапах производства литых, кованных, штампованных и катанных заготовок, а также причины разрушения деталей.
Устанавливают: вид излома (вязкий, хрупкий); величину, форму и расположение зерен и дендритов литого металла; дефекты, нарушающие сплошность металла (усадочную пористость, газовые пузыри, раковины, трещины); химическую неоднородность металла, вызванную процессами кристаллизации или созданную термической и химико-термической обработкой; волокна в деформированном металле.
2. Микроструктурный анализ – изучение поверхности при помощи световых микроскопов. Увеличение – 50…2000 раз. Позволяет обнаружить элементы структуры размером до 0,2 мкм.
Образцы – микрошлифы с блестящей полированной поверхностью, так как структура рассматривается в отраженном свете. Наблюдаются микротрещины и неметаллические включения.
Для выявления микроструктуры поверхность травят реактивами, зависящими от состава сплава. Различные фазы протравливаются неодинаково и окрашиваются по разному. Можно выявить форму, размеры и ориентировку зерен, отдельные фазы и структурные составляющие.
Кроме световых микроскопов используют электронные микроскопы с большой разрешающей способностью.
Изображение формируется при помощи потока быстро летящих электронов. Электронные лучи с длиной волны (0,04…0,12 ) ·10 -8 см дают возможность различать детали объекта, по своим размерам соответствующе межатомным расстояниям.
Просвечивающие микроскопы. Поток электронов проходит через изучаемый объект. Изображение является результатом неодинакового рассеяния электронов на объекте. Различают косвенные и прямые методы исследования.
При косвенном методе изучают не сам объект, а его отпечаток – кварцевый или угольный слепок (реплику), отображающую рельеф микрошлифа, для предупреждения вторичного излучения, искажающего картину.
При прямом методе изучают тонкие металлические фольги, толщиной до 300 нм, на просвет. Фольги получают непосредственно из изучаемого металла.
Растровые микроскопы. Изображение создается за счет вторичной эмиссии электронов, излучаемых поверхностью, на которую падает непрерывно перемещающийся по этой поверхности поток первичных электронов. Изучается непосредственно поверхность металла. Разрешающая способность несколько ниже, чем у просвечивающих микроскопов.
3. Для изучения атомно-кристаллического строения твердых тел (тонкое строение) используются рентгенографические методы, позволяющие устанавливать связь между химическим составом, структурой и свойствами тела, тип твердых растворов, микронапряжения, концентрацию дефектов, плотность дислокаций.
Физические методы исследования
1. Термический анализ основан на явлении теплового эффекта. Фазовые превращения в сплавах сопровождаются тепловым эффектом, в результате на кривых охлаждения сплавов при температурах фазовых превращений наблюдаются точки перегиба или температурные остановки. Данный метод позволяет определить критические точки.
При нагреве металлов и сплавов происходит изменение объема и линейных размеров – тепловое расширение. Если изменения обусловлены только увеличением энергииколебаний атомов, то при охлаждении размеры восстанавливаются. При фазовых превращениях изменения размеров – необратимы.
Метод позволяет определить критические точки сплавов, температурные интервалы существования фаз, а также изучать процессы распада твердых растворов.
3 .Магнитный анализ.
Используется для исследования процессов, связанных с переходом из паромагнитного состояния в ферромагнитное (или наоборот), причем возможна количественная оценка этих процессов.
КРИСТАЛЛИЗАЦИЯ
чивому состоянию с меньшей энергией Гиббса (свободной энергией) G, т.е. когда энергия Гиббса кристалла меньше, чем энергия Гиббса жидкой фазы (рис.10). Если превращение происходит с небольшим изменением объема, то G=U-TS, где U – внутренняя энергия системы, T – абсолютная температура, S – энтропия.
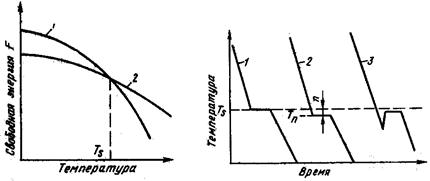
Рис.10 Изменение свободной энергии жидкого (1) и кристаллического (2) состояния в зависимости от температуры
Рис.11. Кривые охлаждения при кристаллизации: теоретический (1) и реальный (2) процессы кристаллизации, (3) – процесс кристаллизации со скачкообразным повышением температуры кристаллизации
Выше температуры Тs меньшей свободной энергией обладает вещество в жидком состоянии, ниже этой температуры – вещество в твердом состоянии. Тs – есть равновесная (теоретическая) температура кристаллизации, при которой металл в обоих состояниях находится в равновесии. Для начала кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Это возможно при некотором переохлаждении жидкости. Температура, при которой практически начинается кристаллизация, называется фактической температурой кристаллизации. Разность между теоретической и фактической температурой кристаллизации есть величина или степень переохлаждения.
Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах температура – время (рис.11). Охлаждение металла в жидком состоянии сопровождается плавным понижением температуры и может быть названо простым
охлаждением, так как при этом нет качественного изменения состояния. При достижении температуры кристаллизации на кривой температура – время появляется горизонтальная площадка, связанная с выделением скрытой теплоты кристаллизации. По окончании кристаллизации, т.е. полного перехода в твердое состояние, температура снова начинает снижаться, а твердое кристаллическое вещество охлаждается. Теоретически процесс кристаллизации изображен кривой 1. Кривая 2 показывает реальный процесс кристаллизации с переохлаждением. Кривая 3 иллюстрирует процесс кристаллизации для некоторых металлов, когда из-за большого переохлаждения скрытая теплота выделяется в первый момент настолько бурно, что температура кристаллизации скачкообразно повышается.
Процесс кристаллизации состоит из двух элементарных процессов: возникновение зародышей, или центров кристаллизации и рост кристаллов из этих центров. Схематически процесс зарождения и роста кристаллов показан на рис.12. По мере развития процесса кристаллизации в нем участвует все большее число кристаллов. Поэтому процесс вначале ускоряется, а затем, когда взаимное столкновение растущих кристаллов начинает препятствовать их росту, замедляется. Кроме того, при столкновении и срастании кристаллов их правильная форма нарушается. Поэтому реальные зерна имеют неправильную форму.
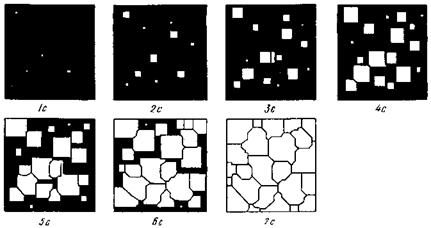
Рис.12. Модель процесса кристаллизации. Под рисунком указано время течения процесса в секундах
Процесс кристаллизации, как уже было сказано выше, может протекать только при условии уменьшения свободной энергии.
Рис.13. Изменение свободной энергии в зависимости от размера зародыша, rк – критический размер зародыша
Поэтому размер возникшего зародыша должен быть больше некоторого rk (рис.13), называемого критическим (устойчивым) размером.
Кроме самопроизвольного (гомогенного) образования зародышей кристаллизации может происходить и гетерогенное образование, когда в расплавленном материале присутствуют частички примесей, имеющих одинаковую кристаллическую решетку с исходным материалом. Эти примесные частицы и будут центрами кристаллизации.
Кристаллы, образующиеся в процессе затвердевания металла, могут иметь различную форму в зависимости от скорости охлаждения, характера и количества примесей. Чаще всего в процессе кристаллизации образуются разветвленные (древовидные) кристаллы, получившие название дендритов (рис.14).
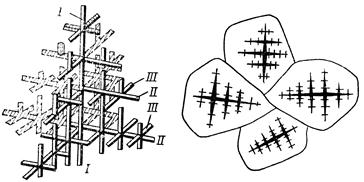
Рис.14. Схема роста кристалла и образования зерна: а – дендрит с осями I, II, III порядка; б – зерна из дендритов
При образовании кристаллов их развитие идет в основном в направлении, перпендикулярном к плоскостям с максимальной плотностью упаковки атомов. Это приводит к тому, что первоначально образуются длинные ветви, так называемые оси первого (I) порядка. Одновременно с удлинением осей первого порядка на их ребрах зарождаются и растут перпендикулярные к ним такие же ветви второго (II) порядка и т.д. Дендритное строение характерно для литого материала.
Структура литого слитка состоит из трех основных зон (рис.15). Первая зона – наружная мелкозернистая корка 1, состоящая из дезориентированных мелких кристаллов – дендритов. При первом соприкосновении со стенками формы в тонком прилегающем слое жидкого металла возникает сильное переохлаждение, сопровождающееся зарождением большого числа центров кристаллизации, что приводит к образованию мелкозернистой структуры. Вторая зона – зона столбчатых кристаллов 2. Степень переохлаждения меняется. В результате из небольшого числа центров кристаллизации начинают расти нормально ориентированные к поверхности корки столбчатые кристаллы. Третья зона – зона равноосных кристаллов 3. Температура застывающего металла почти полностью уравнивается во всем объеме слитка, что и вызывает образование равноосной структуры.
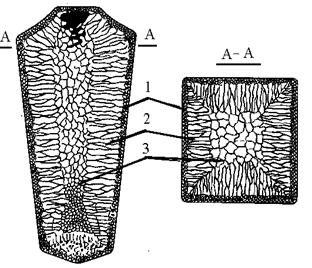
Рис.15. Схема строения стального слитка:
1 – мелкозернистая корка, 2 – столбчатые кристаллы, 3-равноосные кристаллы
Жидкий металл имеет больший объем, чем закристаллизовавшийся, поэтому залитый в форму металл в процессе кристаллизации сокращается в объеме, что приводит к образованию пустот, называемых усадочными
раковинами. Усадочная раковина обычно окружена наиболее загрязненной частью металла, в котором после затвердевания образуются микро- и макропоры и пузыри.
Резюме
Кристаллизацией называется переход металла из жидкого состояния в твердое (кристаллическое). Кристаллизация протекает в условиях, когда система переходит к термодинамически более устойчивому состоянию.
Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах время – температура.
Процесс кристаллизации состоит из двух элементарных процессов: возникновение зародышей, или центров кристаллизации и рост кристаллов из этих центров.
Процесс образования зародышей кристаллизации может происходить самопроизвольно (гомогенное образование), а может идти и по гетерогенному пути образования.
Чаще всего в процессе кристаллизации образуются разветвленные (древовидные) кристаллы, получившие название дендритов.
Кристаллизовавшийся слиток имеет три основных зоны.
Первая зона – наружная мелкозернистая корка, состоящая из дезориентированных мелких кристаллов – дендритов. Вторая зона – зона столбчатых кристаллов. Третья зона – зона равноосных кристаллов.
В процессе кристаллизации происходит образование пустот, называемых усадочными раковинами. Усадочная раковина обычно окружена наиболее загрязненной частью металла, в котором после затвердевания образуются микро- и макропоры и пузыри.
Вопросы для повторения
1. Что такое кристаллизация? В каких условиях происходит этот процесс? Объяснить термодинамику процесса.
2. Какие элементарные процессы составляют процесс кристаллизации?
3. Что представляют собой образовавшиеся кристаллы? Какие основные зоны затвердевшего слитка Вы знаете?
Процесс кристаллизации металлов
При температуре Тп величины свободных энергий жидкого и твердого состояния равны. Процесс кристаллизации протекает при температуре, меньшей Тп. Для начала затвердевания необходимо переохлаждение (разность энергий). Переохлаждение тем больше, чем больше скорость изменения.
Процесс кристаллизации происходит в два этапа: образование зародышей кристаллов; рост образовавшихся кристаллов.
В реальных металлах центрами кристаллизации являются тугоплавкие частицы и стенки литейной формы.
В чистых металлах центрами кристаллизации служат области с дальним порядком расположения атомов (кластеры), т.е. их строение близко к строению кристаллической решетки.
Чем больше скорость охлаждения (степень переохлаждения), тем более мелкозернистая структура образуется. Если скорость охлаждения порядка 10 5 -10 6 градусов в секунду, получается аморфная структура.
5.Строение металлического слитка. Особенности строения литого и деформированного металла.
Кристаллизация стального слитка идет в три стадии. Сначала на поверхности слитка образуется зона мелких кристаллов за счет влияния холодных стенок формы, которые обеспечивают в начальный момент времени высокую скорость охлаждения. Затем растут большие кристаллы, вытянутые по направлению отвода теплоты (столбчатые кристаллы). В середине слитка, где наблюдается наименьшая степень переохлаждения, образуются большие равновесные кристаллы. При некоторых условиях (перегретый жидкий металл, малое содержание примесей) зона крупных равновесных кристаллов почти исчезает. Структура слитка состоит практически из одних столбчатых кристаллов - транскристаллическая.
Зона столбчатых кристаллов обладает наибольшей плотностью, но в местах стыка столбчатых кристаллов собираются нерастворимые примеси, и такие слитки часто расьтрескиваются при обработке давлением.
В верхней части слитка, затвердевающей в последнюю очередь, концентрируется усадочная раковина. Там содержится много количества усадочных пор. Слиток имеет неоднородный состав. По направлению от поверхности к центру и снизу вверх увеличивается концентрация углерода и вредных примесей: серы и фосфора. Химическая неоднородность по отдельным зонам слитка называется зональной ликвацией. Она отрицательно влияет на механические свойства.
Пластическая деформация металлов и сплавов как тел поликристаллических, имеет некоторые особенности по сравнению с пластической деформацией монокристалла. Деформация поликристаллического тела складывается из деформации отдельных зерен и деформации в приграничных объемах.
Плоскости скольжения зерен произвольно ориентированны в пространстве, поэтому под влиянием внешних сил напряжения в плоскостях скольжения отдельных зерен будут различны. Деформация начинается в отдельных зернах, в плоскостях скольжения которых возникают максимальные касательные напряжения. Соседние зерна будут разворачиваться и постепенно вовлекаться в процесс деформации. Деформация приводит к изменению формы зерен: зерна получают форму, вытянутую в направлении наиболее интенсивного течения металла (поворачиваются осями наибольшей прочности вдоль направления деформации.
Металл приобретает волокнистое строение. Волокна с вытянутыми вдоль них неметаллическими включениями являются причиной неодинаковости свойств вдоль и поперек волокон. Одновременно с изменением формы зерен в процессе пластической деформации происходит изменение ориентировки в пространстве их кристаллической решетки.
Деформированный металл находится в неравновесном состоянии. Переход к равновесному состоянию связан с уменьшением искажений в кристаллической решетке, снятием напряжений, что определяется возможностью перемещения атомов.
При повышении температуры металла в процессе нагрева после пластической деформации диффузия атомов увеличивается и начинают действовать процессы разупрочнения, приводящие металл в более равновесное состояние – возврат и рекристаллизация.
Возврат. Небольшой нагрев вызывает ускорение движения атомов, снижение плотности дислокаций, устранение внутренних напряжений и восстановление кристаллической решетки
Рекристаллизация – процесс зарождения и роста новых недеформированных зерен при нагреве наклепанного металла до определенной температуры.
Нагрев металла до температур рекристаллизации сопровождается резким изменением микроструктуры и свойств. Нагрев приводит к резкому снижению прочности при одновременном возрастании пластичности. Также снижается электросопротивление и повышается теплопроводность.
1 стадия – первичная рекристаллизация (обработки) заключается в образовании центров кристаллизации и росте новых равновесных зерен с неискаженной кристаллической решеткой. Новые зерна возникают у границ старых зерен и блоков, где решетка была наиболее искажена. Количество новых зерен постепенно увеличивается и в структуре не остается старых деформированных зерен.
Движущей силой первичной рекристаллизации является энергия, аккумулированная в наклепанном металле. Система стремится перейти в устойчивое состояние с неискаженной кристаллической решеткой.
2 стадия – собирательная рекристаллизация заключается в росте образовавшихся новых зерен.
Движущей силой является поверхностная энергия зерен. При мелких зернах поверхность раздела большая, поэтому имеется большой запас поверхностной энергии. При укрупнении зерен общая протяженность границ уменьшается, и система переходит в более равновесное состояние.
Основными факторами, определяющими величину зерен металла при рекристаллизации, являются температура, продолжительность выдержки при нагреве и степень предварительной деформации
С повышением температуры происходит укрупнение зерен, с увеличением времени выдержки зерна также укрупняются. Наиболее крупные зерна образуются после незначительной предварительной деформации 3…10 %. Такую деформацию называют критической. И такая деформация нежелательна перед проведением рекристаллизационного отжига.
Практически рекристаллизационный отжиг проводят дпя малоуглеродистых сталей при температуре 600…700 o С, для латуней и бронз – 560…700 o С, для алюминевых сплавов – 350…450 o С, для титановых сплавов – 550…750 o С.
Основные положения. Кристаллизация – это процесс перехода вещества из жидкого состояния в твердое, кристаллическое
Кристаллизация – это процесс перехода вещества из жидкого состояния в твердое, кристаллическое. В расплавленном металле нет дальнего порядка: расстояния между атомами не являются постоянными, объемы с упорядоченным расположением атомов то возникают, то снова исчезают (рис. 1, а). В процессе кристаллизации устанавливается дальний порядок: атомы располагаются на определенных расстояниях по каждому пространственному направлению, образуя кристаллическую решетку (рис. 1, б). Такое упорядоченное расположение возникает за счет равновесия сил притяжения и отталкивания между атомами и соответствует минимуму энергии взаимодействия атомов в металле.
Рис. 1. Расположение атомов в жидком (а) и твердом (б) металле
Процесс кристаллизации может идти самопроизвольно, а может вызываться какими-то искусственными причинами.
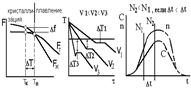
Самопроизвольно идут только те термодинамические процессы, которые приводят к уменьшению свободной энергии системы. (Свободная энергия F – это изменяемая часть полной энергии системы.) С повышением температуры металла его свободная энергия как в жидком, так и в твердом состоянии снижается, но с разной скоростью: свободная энергия жидкого металла снижается быстрее (рис. 2). Поэтому кривые зависимости свободной энергии от температуры пересекаются при какой-то температуре TS. При любой температуре ниже TS меньшим уровнем свободной энергии обладает твердый металл, поэтому, если охладить расплав до температурыT1 < TS, начнется кристаллизация. И наоборот, при температурах выше TS устойчиво жидкое состояние, поскольку жидкий металл имеет меньший уровень свободной энергии. Значит, нагрев доT2 > TSприведет к плавлению.
Рис. 2. Зависимости свободной энергии металла от температуры
Температура TS, при которойсвободная энергия металла в твердом и жидком состоянии одинакова, называется теоретической температурой кристаллизации. При этой температуре жидкость и кристаллы находятся в равновесии, поэтому металл одновременно находится и в жидком и в твёрдом агрегатном состоянии.
Чтобы кристаллизация осуществилась, необходимо некоторое переохлаждение относительно теоретической температурой кристаллизации. В таком случае образование кристаллов дает выигрыш в свободной энергии, что и является стимулом процесса. Поэтому на самом деле кристаллизация всегда происходит при температуре ниже TS. Реальная температура кристаллизации TРвсегда меньше теоретической. Разность между теоретической и реальной температурой кристаллизации называется степенью переохлаждения ΔT:
ΔT = TS – TР.
Измеряя температуру металла в процессе кристаллизации, можно получить кривую охлаждения (рис. 3). Это график в координатах «температура – время». На этой кривой имеется горизонтальный участок, соответствующий переходу металла из жидкого состояния в твердое. Постоянная температура на этом участке поддерживается за счет выделения скрытой теплоты кристаллизации.
Рис. 3. Кривая охлаждения расплавленного металла
Степень переохлаждения при кристаллизации не является постоянной величиной. Она увеличивается с увеличением скорости охлаждения металла. В реальных заводских условиях изготовления отливок степень переохлаждения обычно не превышает 20–30°, но для очень чистых металлов может достигать нескольких сотен градусов.
Механизм процесса кристаллизации можно представить в виде двух элементарных процессов:
1) Образование в жидкости центров кристаллизации (зародышей, мельчайших твердых частиц).
2) Рост кристаллов из образовавшихся зародышей.
Скорости этих элементарных процессов зависят от степени переохлаждения ΔT или скорости охлаждения металла V. Эта зависимость показана на рис. 4.
Рис. 4. Зависимость скорости процесса кристаллизации
от степени переохлаждения
Как уже говорилось, в большинстве случаев процессы кристаллизации металла на металлургических заводах, в литейных цехах происходят при сравнительно небольших степенях переохлаждения (левая часть графика на рис. 4).
Из приведенной на рис. 4 зависимости видно, что при малых скоростях охлаждения и малых степенях переохлаждения (например, ΔT1 и V1) получается небольшая скорость образования зародышей (с.з.1). Следовательно, в кристаллизующейся жидкости образуется небольшое число центров кристаллизации и из них вырастает небольшое число кристаллов, что приводит к появлению крупнозернистой структуры после затвердевания металла. Схематически это показано на рис. 5.
Рис. 5. Кристаллизация при медленном охлаждении:
а – начало процесса; б –окончание процесса
Если же кристаллизация происходит при больших скоростях охлаждения и больших степенях переохлаждения (ΔT2, V2), то в жидкости образуется большое количество центров кристаллизации (с.з.2) и из них, соответственно, вырастает большое число кристаллов. Металл при этом получается мелкозернистый (рис. 6).
Рис. 6. Кристаллизация при быстром охлаждении:
Столкновение растущих кристаллов приводит к потере ими правильной огранки. Такие потерявшие правильную форму кристаллы называются зернами.
При очень маленькой скорости охлаждения (крайняя левая точка на рис. 4) может возникнуть один-единственный центр кристаллизации, из которого вырастет один кристалл (монокристалл). Необходимые в электронике монокристаллы полупроводников выращивают путем очень медленного вытягивания затравки из расплава.
При огромных скоростях охлаждения (крайняя правая точка на рис. 4) достигаются такие большие степени переохлаждения, что тепловое движение атомов в металле замедляется, атомы не успевают образовать дальний порядок, выстроиться в кристаллическую решетку. Жидкое, неупорядоченное состояние металла оказывается как бы «замороженным». Металл становится твердым, но не имеет кристаллического строения. Это аморфный металл или металлическое стекло. Аморфные металлы широко применяются в современной аудиотехнике благодаря уникальным магнитным свойствам.
Поскольку структура металла определяет его свойства, рассмотренные закономерности кристаллизации могут быть использованы для формирования необходимых свойств металла при отливке деталей.
Мелкозернистый металл обладает более высоким сопротивлением деформации и большей вязкостью. Дело в том, что границы зерен являются барьером для развития деформации и для роста трещины. В металле с мелким зерном суммарная поверхность зерен в единице объема больше, чем в крупнозернистом. Поэтому и сопротивление мелкозернистого металла деформированию и разрушению больше. Чтобы разрушить металл с мелким зерном требуется затратить больше энергии.
Поэтому при отливке деталей, испытывающих значительные нагрузки при эксплуатации, целесообразно проводить процесс кристаллизации при высокой скорости охлаждения, чтобы получить мелкозернистую структуру. Если необходимую скорость кристаллизации обеспечить не удается (в отливках большой массы), то для измельчения зерна в жидкий металл вводят небольшие добавки примесей в виде мелких нерастворимых в расплаве частиц, увеличивая тем самым число центров кристаллизации. Такой процесс называется модифицированием, а вводимые добавки – модификаторами.
В качестве модификаторов обычно применяются мелкие частицы карбидов, оксидов (Сr7С3, VC, ТiC, Al2О3 и др.) и некоторые вещества, облегчающие образование зародышей в жидкости (В, Mg и др.). Измельчению зерна способствует также вибрация кристаллизующегося металла.
Следует иметь в виду, что при получении отливок затвердевание металла в форме происходит с разными скоростями охлаждения в различных ее частях. Скорость охлаждения уменьшается от стенки формы к центральной ее части, при этом меняется и направление теплоотвода в местах роста кристаллов. В результате полученный слиток имеет неодинаковое строение по сечению, а значит, и разные свойства (рис. 7). Поверхностный слой будет мелкозернистый (т. е., с высокими механическими свойствами), а центральная часть слитка ‑ крупнозернистая.
Размер этих зон существенно меняется в зависимости от состава металла и условий кристаллизации.
Конспект урока "Кристаллизация металлов и сплавов"
Цель: изучить механизм и закономерности кристаллизации; рассмотреть строение металлического слитка, научиться строить кривые охлаждения.
Основные понятия:
· Фактическая температура кристаллизации
План лекции:
1. Кристаллизация металлов и сплавов.
2. Механизм и закономерности кристаллизации металлов.
3. Условия получения мелкозернистой структуры.
4. Строение металлического слитка.
5. Кривая охлаждения железа.
1. Кристаллизация металлов и сплавов.
С изменением внешних условий свободная энергия изменяется по сложному закону различно для жидкого и кристаллического состояний. Характер изменения свободной энергии жидкого и твердого состояний с изменением температуры показан на рис. 1.

Рис.1. Изменение свободной энергии в зависимости от температуры
При температуре равной ТS жидкая и твердая фаза обладают одинаковой энергией, металл в обоих состояниях находится в равновесии, поэтому две фазы могут существовать одновременно бесконечно долго. Температура ТS – равновесная или теоретическая температура кристаллизации.
Для начала процесса кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Это возможно при охлаждении жидкости ниже температуры ТS. Температура, при которой практически начинается кристаллизация называется реальная температурой кристаллизации.
Охлаждение жидкости ниже равновесной температуры кристаллизации называется переохлаждением, которое характеризуется степенью переохлаждения:
Степень переохлаждения зависит от природы металла, от степени его загрязненности (чем чище металл, тем больше степень переохлаждения), от скорости охлаждения (чем выше скорость охлаждения, тем больше степень переохлаждении).
Кристаллизация – это процесс образования участков кристаллической решетки в жидкой фазе и рост кристаллов из образовавшихся центров.
Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах время – температура. Кривая охлаждения чистого металла представлена на рис. 2.

Рис.2. Кривая охлаждения чистого металла
Процесс кристаллизации чистого металла:
До точки 1 охлаждается металл в жидком состоянии, процесс сопровождается плавным понижением температуры. На участке 1 – 2 идет процесс кристаллизации, сопровождающийся выделением тепла, которое называется скрытой теплотой кристаллизации. Оно компенсирует рассеивание теплоты в пространство, и поэтому температура остается постоянной. После окончания кристаллизации в точке 2 температура снова начинает снижаться, металл охлаждается в твердом состоянии.
2. Механизм и закономерности кристаллизации металлов.
При соответствующем понижении температуры в жидком металле начинают образовываться кристаллики – центры кристаллизации или зародыши. Для начала их роста необходимо уменьшение свободной энергии металла, в противном случае зародыш растворяется.
Минимальный размер способного к росту зародыша называется критическим размером, а зародыш – устойчивым.
Переход из жидкого состояния в кристаллическое требует затраты энергии на образование поверхности раздела жидкость – кристалл. Процесс кристаллизации будет осуществляться, когда выигрыш от перехода в твердое состояние больше потери энергии на образование поверхности раздела. Зависимость энергии системы от размера зародыша твердой фазы представлена на рис. 3.

Рис.3. Зависимость энергии системы от размера зародыша твердой фазы
Механизм кристаллизации представлен на рис.4.

Рис.4. Модель процесса кристаллизации
Качественная схема процесса кристаллизации может быть представлена количественно кинетической кривой (рис.5).

Рис.5. Кинетическая кривая процесса кристаллизации
Процесс вначале ускоряется, пока столкновение кристаллов не начинает препятствовать их росту. Объем жидкой фазы, в которой образуются кристаллы, уменьшается. После кристаллизации 50 % объема металла, скорость кристаллизации будет замедляться.
В свою очередь, число центров кристаллизации (ч.ц.) и скорость роста кристаллов (с.р.) зависят от степени переохлаждения (рис. 6).

Рис. 6. Зависимость числа центров кристаллизации (а) и скорости роста кристаллов (б) от степени переохлаждения
Если жидкость переохладить до температуры, соответствующей т.а, то образуются крупные зерна (число образовавшихся центров небольшое, а скорость роста – большая).
При переохлаждении до температуры соответствующей т.в – мелкое зерно (образуется большое число центров кристаллизации, а скорость их роста небольшая).
3. Условия получения мелкозернистой структуры.
Мелкозернистую структуру можно получить в результате модифицирования, когда в жидкие металлы добавляются посторонние вещества – модификаторы,
1. Вещества, не растворяющиеся в жидком металле – выступают в качестве дополнительных центров кристаллизации.
4. Строение металлического слитка.
Схема стального слитка, данная Черновым Д.К., представлена на рис.7.

Рис. 7. Схема стального слитка
Кристаллизация корковой зоны идет в условиях максимального переохлаждения. Скорость кристаллизации определяется большим числом центров кристаллизации. Образуется мелко
Рост кристаллов во второй зоне имеет направленный характер. Они растут перпендикулярно стенкам изложницы, образуются древовидные кристаллы – дендриты (рис. 8). Растут дендриты с направлением, близким к направлению теплоотвода.

Рис.8. Схема дендрита по Чернову Д.К.
Зоны столбчатых кристаллов в процессе кристаллизации стыкуются, это явление называется транскристаллизацией.
5. Аллотропия или полиморфные превращения.
Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропией или полиморфизмом.
Каждый вид решетки представляет собой аллотропическое видоизменение или модификацию.
Примером аллотропического видоизменения в зависимости от температуры является железо (Fe).
Fe: ;
;
; (высокотемпературноеПревращение одной модификации в другую протекает при постоянной температуре и сопровождается тепловым эффектом. Видоизменения элемента обозначается буквами греческого алфавита в виде индекса у основного обозначения металла.
Примером аллотропического видоизменения, обусловленного изменением давления, является углерод: при низких давлениях образуется графит, а при высоких – алмаз.
Используя явление полиморфизма, можно упрочнять и разупрочнять сплавы при помощи термической обработки.
6. Кривая охлаждения железа.
Порядковый номер железа в таблице Менделеева – 26, атомная масса - A= 55,85 а.е.м. (атомные единицы массы). Радиус атома - R = 1,27А. Температура плавления - Тпл = 1539 0 С. Плотность – 7,68 г/см 3 .
Железо существует в двух аллотропических модификациях: объемноцентрированного куба ( Fe a ) и гранецентрированного куба ( Fe g ). Из кривой охлаждения чистого железа (рис.9) видно, что Fe a существует в двух интервалах температур : ниже 911 0 С и от 1392 до 1539 0 С. Достигнув при охлаждении температуры 1392 0 С, Fe a претерпевает аллотропическое превращение, в процессе которого кристаллическая решетка объемно-центрированного куба при постоянной температуре перестраивается в решетку гранецентрированного куба Fe g . Второе аллотропическое превращение в процессе охлаждения происходит при температуре 911 0 С, когда Fe g (решетка гранецентрированного куба) перестраивается в объемноцентрированную кубическую решетку Fe a .
При температуре 768 0 С, называемой точкой Кюри, железо испытывает магнитное превращение: ниже 768 0 С железо становится магнитным. Магнитное превращение есть особый вид превращения и имеет ряд особенностей, отличающих его от аллотропического превращения.
Читайте также:
