Плавление металла какое это явление
Обновлено: 03.05.2024
Плавление — это процесс превращения вещества из твёрдого состояния в жидкое.
Наблюдения показывают, что если измельчённый лёд, имеющий, например, температуру –10 °С, оставить в тёплой комнате, то его температура будет повышаться. При 0 °С лёд начнет таять, а температура при этом не будет изменяться до тех пор, пока весь лёд не превратится в жидкость. После этого температура образовавшейся изо льда воды будет повышаться.
Это означает, что кристаллические тела, к которым относится и лед, плавятся при определённой температуре, которую называют температурой плавления. Важно, что во время процесса плавления температура кристаллического вещества и образовавшейся в процессе его плавления жидкости остаётся неизменной.
В описанном выше опыте лёд получал некоторое количество теплоты, его внутренняя энергия увеличивалась за счёт увеличения средней кинетической энергии движения молекул. Затем лёд плавился, его температура при этом не менялась, хотя лёд получал некоторое количество теплоты. Следовательно, его внутренняя энергия увеличивалась, но не за счёт кинетической, а за счёт потенциальной энергии взаимодействия молекул. Получаемая извне энергия расходуется на разрушение кристаллической решетки. Подобным образом происходит плавление любого кристаллического тела.
Аморфные тела не имеют определённой температуры плавления. При повышении температуры они постепенно размягчаются, пока не превратятся в жидкость.
Кристаллизация
Кристаллизация — это процесс перехода вещества из жидкого состояния в твёрдое состояние. Охлаждаясь, жидкость будет отдавать некоторое количество теплоты окружающему воздуху. При этом будет уменьшаться её внутренняя энергия за счёт уменьшения средней кинетической энергии его молекул. При определённой температуре начнётся процесс кристаллизации, во время этого процесса температура вещества не будет изменяться, пока всё вещество не перейдет в твёрдое состояние. Этот переход сопровождается выделением определённого количества теплоты и соответственно уменьшением внутренней энергии вещества за счёт уменьшения потенциальной энергии взаимодействия его молекул.
Таким образом, переход вещества из жидкого состояния в твёрдое состояние происходит при определённой температуре, называемой температурой кристаллизации. Эта температура остаётся неизменной в течение всего процесса плавления. Она равна температуре плавления этого вещества.

На рисунке приведён график зависимости температуры твёрдого кристаллического вещества от времени в процессе его нагревания от комнатной температуры до температуры плавления, плавления, нагревания вещества в жидком состоянии, охлаждения жидкого вещества, кристаллизации и последующего охлаждения вещества в твёрдом состоянии.
Удельная теплота плавления
Различные кристаллические вещества имеют разное строение. Соответственно, для того, чтобы разрушить кристаллическую решётку твёрдого тела при температуре его плавления, необходимо ему сообщить разное количество теплоты.
Удельная теплота плавления — это количество теплоты, которое необходимо сообщить 1 кг кристаллического вещества, чтобы превратить его в жидкость при температуре плавления. Опыт показывает, что удельная теплота плавления равна удельной теплоте кристаллизации.
Удельная теплота плавления обозначается буквой λ. Единица удельной теплоты плавления — [λ] = 1 Дж/кг.
Значения удельной теплоты плавления кристаллических веществ приведены в таблице. Удельная теплота плавления алюминия 3,9*10 5 Дж/кг. Это означает, что для плавления 1 кг алюминия при температуре плавления необходимо затратить количество теплоты 3,9*10 5 Дж. Этому же значению равно увеличение внутренней энергии 1 кг алюминия.
Чтобы вычислить количество теплоты Q, необходимое для плавления вещества массой m, взятого при температуре плавления, следует удельную теплоту плавления λ умножить на массу вещества: Q = λm .
Эта же формула используется при вычислении количества теплоты, выделяющегося при кристаллизации жидкости.

Конспект урока «Плавление и кристаллизация. Удельная теплота плавления».
ПЛАВЛЕНИЕ
переход в-ва из кристаллич. (твёрдого) состояния в жидкое, происходит с поглощением теплоты (фазовый переход I рода). Гл. хар-ками П. чистых в-в явл. температура плавления (Tпл) и теплота плавления (Lпл).
Темп-pa П. зависит от внеш. давления р; на диаграмме состояния чистого в-ва эта зависимость изображается кривой плавления (кривой сосуществования тв. и жидкой фаз, AD или AD' на рис. 1). П. сплавов и тв. растворов происходит, как правило, в определённом интервале темп-р (исключение составляют сплавы с пост. Tпл — эвтектики).
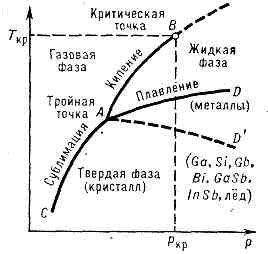
Рис. 1. Диаграмма состояния чистого в-ва (р — давление, T — темп-pa). Линии AD и AD' — кривые плавления, по линии AD' плавятся в-ва с аномальным изменением объёма при плавлении. Точка А — тройная точка; В — критич. точка.
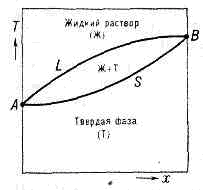
Рис. 2. Диаграмма состояния системы (напр., Cu—Ni), образующей непрерывный ряд жидких и твёрдых растворов. Жидкий раствор устойчив выше линии ликвидуса L, твёрдый — ниже линии солидуса S; между линиями L и S заключена двухфазная область равновесия твёрдых и жидких фаз.
Зависимость темп-ры начала и окончания П. сплава от его состава при данном давлении изображается на диаграммах состояния спец. линиями (кривые л и к в и д у с а и с о л и д у с а, рис. 2). У ряда высокомол. соединений (напр., в-в, способных образовывать жидкие кристаллы) переход из тв. крист. состояния в изотропное жидкое происходит постадийно (в нек-ром температурном интервале), каждая стадия характеризует определённый этап разрушения крист. структуры.
Наличие определённой темп-ры П.— важный признак крист. строения тв. тел. По этому признаку их легко отличить от аморфных тв. тел, к-рые не имеют фиксированной Tпл. Аморфные тв. тела переходят в жидкое состояние постепенно, размягчаясь при повышении темп-ры (см. АМОРФНОЕ СОСТОЯНИЕ).
Самую высокую темп-ру П. среди чистых металлов имеет вольфрам (3410°С), самую низкую — ртуть (-38,9°С). К особо тугоплавким соединениям относятся TiN (3200°C), HfN (3580°C), ZrC (3805°C), ТаС (4070°С), HfC (4160°C) и др. Как правило, для в-в с высокой Тпл характерны более высокие значения Lпл. Примеси, присутствующие в крист. в-вах, снижают Тпл. Этим пользуются на практике для получения сплавов с низкой Тпл (напр., у т. н. сплава Вуда, состоящего из 50% Bi, 25% Pb, 12,5% Sn и 12,5% Cd, Tпл=68°С) и охлаждающих смесей (напр., смесь из льда (42,8%) и К2СО3 (57,2%) плавится при -46°С).
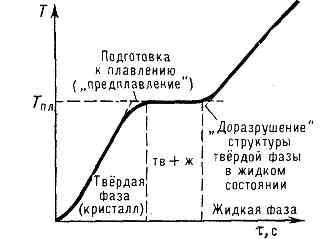
Рис. 3. Остановка изменения темп-ры при плавлении крист. тела. По оси абсцисс отложено время t, пропорциональное равномерно подводимому к телу кол-ву теплоты.
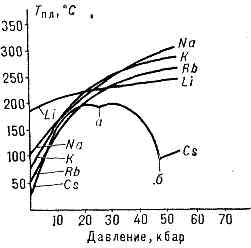
Рис. 4. Изменение темп-ры плавления Тпл (°С) щелочных металлов с увеличением давления р (кбар). Изломы на кривой плавления Cs указывают на существование у него при высоких давлениях двух полиморфных превращений (а и б).
Нагреть кристалл до Т>Тпл в обычных условиях не удаётся (см. ПЕРЕГРЕВ), тогда как при кристаллизации сравнительно легко достигается значит. переохлаждение расплава.
Хар-р зависимости Тпл от давления р определяется направлением объёмных изменений (DVпл) при П. (см. КЛАПЕЙРОНА — КЛАУЗИУСА УРАВНЕНИЕ). В большинстве случаев П. в-в сопровождается увеличением их объёма (обычно на неск. %). Если это имеет место, то возрастание давления приводит к повышению Тпл (рис. 4). Однако у нек-рых в-в (см. рис. 1) при П. происходит уменьшение объёма. Темп-ра П. этих в-в при увеличении давления снижается.
П. сопровождается изменением физ. св-в в-ва: увеличением энтропии, что отражает разупорядочение крист. структуры; ростом теплоёмкости; электрич. сопротивления (исключение составляют нек-рые полуметаллы (Bi, Sb) и полупроводники (Ge), в жидком состоянии обладающие более высокой электропроводностью). Практически до нуля падает при П. сопротивление сдвигу (в расплаве не могут распространяться поперечные упругие волны), уменьшается скорость распространения звука (продольных волн) и т. д.
Согласно мол.-кинетич. представлениям, П. осуществляется след. образом. При подведении к крист. телу теплоты увеличивается энергия колебаний (амплитуда колебаний) его атомов, что приводит к повышению темп-ры тела и способствует образованию в кристалле разл. дефектов (незаполненных узлов крист. решётки — вакансий, нарушений периодичности решётки внедрившимися между её узлами атомами и др.; (см. ДЕФЕКТЫ В КРИСТАЛЛАХ). В мол. кристаллах может происходить частичное разупорядочение взаимной ориентации осей молекул, если молекулы не обладают сферич. симметрией. Постепенный рост числа дефектов и их объединение характеризуют стадию предплавления. С достижением Тпл в кристалле создаётся критич. концентрация дефектов, начинается П.— крист. решётка распадается на легкоподвижные субмикроскопич. области. Подводимая при П. теплота идёт не на нагрев тела, а на разрыв межатомных связей и разрушение дальнего порядка в кристаллах (см. ДАЛЬНИЙ И БЛИЖНИЙ ПОРЯДОК). В самих же субмикроскопич. областях ближний порядок в расположении атомов при П. существенно не меняется (координационное число расплава при Тпл в большинстве случаев остаётся тем же, что и у кристалла). Этим объясняются меньшие значения теплот плавления Lпл по сравнению с теплотами парообразования и сравнительно небольшое изменение ряда физ. свойств в-в при их П.
Процесс П. играет важную роль в природе (П. снега и льда на поверхности Земли, П. минералов в её недрах и т. д.), в науке и технике (производство чистых металлов и сплавов, литьё в формы и др.).
Физический энциклопедический словарь. — М.: Советская энциклопедия . Главный редактор А. М. Прохоров . 1983 .
- переход вещества изкристаллич. твёрдого состояния в жидкое. П. происходит с поглощением теплакак фазовый переход1-го рода, оно состоит в позиционном разупорядочениисистемы: регулярное пространственное расположение атомов (молекул) сменяетсянерегулярным при незначит. изменении ср. расстояний между ними. ТемператураП. Т пл зависит от давления Р. Для двух- и многоатомныхмолекул при П. наблюдается также ориентационное разупорядочение, у нек-рыхвеществ оно предшествует П.
Линия фазового равновесия кристалл - жидкость, 0. Но для воды, Ga,Bi, Sb, нек-рых сплавов dT пл/dP < 0 в окрестноститройной точки А. При плавлении энтропия S возрастает, S= S ж - S крист > 0, т. е. теплота плавления .= Т положительна.(Известно исключение, относящееся к 3 Не при Т < 0,32К. Оно связано с явлением преимущественного ориентац. упорядочения ядерныхспинов в жидкой фазе.) Тогда, согласно Клапейрона - Клаузиуса уравнению,dP/dT = знак dP/dT совпадает со знаком скачка объёма v ж - v крист Для нормально плавящихсявеществ объём при П. увеличивается, T пл при атм. давлении, 0. Стационарное состояние обеспечивается подводом тепла к границераздела фаз при постоянном внеш. давлении. П. - результат конкуренции двухфаз, каждая из к-рых устойчива по отношению к малым возмущениям..
П. сопровождается скачкообразным изменением S,v и внутр. энергии при медленном изобарич. нагревании образца. ПриП. не только теряется регулярность структуры (дальний порядок в расположенииатомов), но существенно изменяется в среднем и координация соседних атомов(ближний порядок).
Зависимость между Т и Р налинии П. приближённо передаётся эмпирич. ур-нием ( Р/Р 0)+1 = ( Т/Т п) с . Здесь с
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия . Главный редактор А. М. Прохоров . 1988 .
Фазовая диаграмма воды.
Плавлению (и кристаллизации) соответствует ветвь левее и выше тройной точки,
сублимации — ветвь левее и ниже тройной точки.
Плавле́ние —это процесс перехода тела [источник не указан 1003 дня] из кристаллического твёрдого состояния в жидкое. Плавление происходит с поглощением удельной теплоты плавления и является фазовым переходом первого рода.
Способность плавиться относится к физическим свойствам вещества [1]
При нормальном давлении, наибольшей температурой плавления среди металлов обладает вольфрам (3422 °C), среди простых веществ - углерод (по разным данным 3500 — 4500 °C [2] ) а среди произвольных веществ — карбид тантала-гафния Ta4HfC5 (4216 °C). Можно считать, что самой низкой температурой плавления обладает гелий: при нормальном давлении он остаётся жидким при сколь угодно низких температурах.
Многие вещества при нормальном давлении не имеют жидкой фазы. При нагревании они путем сублимации сразу переходят в газообразное состояние.
Содержание
Плавление смесей и твёрдых растворов
У сплавов, как правило, нет определённой температуры плавления; процесс их плавления происходит в конечном диапазоне температур. На диаграммах состояния «температура — относительная концентрация» имеется конечная область сосуществования жидкого и твёрдого состояния, ограниченная кривыми ликвидуса и солидуса. Аналогичная ситуация имеет место и в случае многих твёрдых растворов.
Фиксированной температуры плавления нет также у аморфных тел; они переходят в жидкое состояние постепенно, размягчаясь при повышении температуры.
Кинетика плавления

Природа плавления
Поясним вначале, почему при некоторой температуре тело предпочитает разорвать часть межатомных связей и из упорядоченного состояния (кристалл) перейти в неупорядоченное (жидкость).
Как известно из термодинамики, при фиксированной температуре тело стремится минимизировать свободную энергию . Состояние с минимальной энергией — это кристаллическое твёрдое тело. При повышении температуры, второе слагаемое становится всё важнее, и при некоторой температуре оказывается выгоднее разорвать некоторые связи. При этом обычная энергияДинамика плавления
В динамике, плавление происходит следующим образом. При повышении температуры тела увеличивается амплитуда тепловых колебаний его молекул, и время от времени возникают дефекты решетки. Каждый такой дефект требует определённого количества энергии, поскольку он сопровождается разрывом некоторых межатомных связей. Стадия рождения и накопления дефектов называется стадией предплавления. Кроме того, на этой стадии, как правило, возникает квази-жидкий слой на поверхности тела. При некоторой температуре концентрация дефектов становится столь большой, что приводит к потере ориентационного порядка в образце.
Плавление в двумерных системах
В двумерных или квази-двумерных системах кристалл является гораздо более шатким объектом, чем в трёхмерном случае, а именно у двумерного кристалла нет дальнего позиционного порядка. (Для сравнения: в одномерном случае кристалл при конечной температуре вообще не может быть стабильным!) Как выяснилось, это приводит к тому, что плавление двумерного кристалла происходит в два этапа. Вначале кристалл переходит в так называемую гексатическую фазу, в которой теряется ближний позиционный порядок, но сохраняется ориентационный, а затем происходит потеря и ориентационного порядка и тело становится жидким.
Молекулярная физика. Плавление и кристаллизация.
Переход вещества из твердого кристаллического состояния в жидкое называется плавлением. Чтобы расплавить твердое кристаллическое тело, его нужно нагреть до определенной температуры, т. е. подвести тепло. Температура, при которой вещество плавится, называется температурой плавления вещества.
Обратный процесс — переход из жидкого состояния в твердое — происходит при понижении температуры, т. е. тепло отводится. Переход вещества из жидкого состояния в твердое называется отвердеванием, или кристаллизацией. Температура, при которой вещество кристаллизуется, называется температурой кристаллизации.
Опыт показывает, что любое вещество кристаллизуется и плавится при одной и той же температуре.
На рисунке представлен график зависимости температуры кристаллического тела (льда) от времени нагревания (от точки А до точки D) и времени охлаждения (от точки D до точки K). На нем по горизонтальной оси отложено время, а по вертикальной — температура.

Из графика видно, что наблюдение за процессом началось с момента, когда температура льда была -40 °С, или, как принято говорить, температура в начальный момент времени tнач = -40 °С (точка А на графике). При дальнейшем нагревании температура льда растет (на графике это участок АВ). Увеличение температуры происходит до 0 °С — температуры плавления льда. При 0°С лед начинает плавиться, а его температура перестает расти. В течение всего времени плавления (т.е. пока весь лед не расплавится) температура льда не меняется, хотя горелка продолжает гореть и тепло, следовательно, подводится. Процессу плавления соответствует горизонтальный участок графика ВС. Только после того как весь лед расплавится и превратится в воду, температура снова начинает подниматься (участок CD). После того, как температура воды достигнет +40 °С, горелку гасят и воду начинают охлаждать, т. е. тепло отводят (для этого можно сосуд с водой поместить в другой, больший сосуд со льдом). Температура воды начинает снижаться (участок DE). При достижении температуры 0 °С температура воды перестает снижаться, несмотря на то, что тепло по-прежнему отводится. Это идет процесс кристаллизации воды — образования льда (горизонтальный участок EF). Пока вся вода не превратится в лед, температура не изменится. Лишь после этого начинает уменьшаться температура льда (участок FK).
Вид рассмотренного графика объясняется следующим образом. На участке АВ благодаря подводимому теплу средняя кинетическая энергия молекул льда увеличивается, и температура его повышается. На участке ВС вся энергия, получаемая содержимым колбы, тратится на разрушение кристаллической решетки льда: упорядоченное пространственное расположение его молекул сменяется неупорядоченным, меняется расстояние между молекулами, т.е. происходит перестройка молекул таким образом, что вещество становится жидким. Средняя кинетическая энергия молекул при этом не меняется, поэтому неизменной остается и температура. Дальнейшее увеличение температуры расплавленного льда-воды (на участке CD) означает увеличение кинетической энергии молекул воды вследствие подводимого горелкой тепла.
При охлаждении воды (участок DE) часть энергии у нее отбирается, молекулы воды движутся с меньшими скоростями, их средняя кинетическая энергия падает — температура уменьшается, вода охлаждается. При 0°С (горизонтальный участок EF) молекулы начинают выстраиваться в определенном порядке, образуя кристаллическую решетку. Пока этот процесс не завершится, температура вещества не изменится, несмотря на отводимое тепло, а это означает, что при отвердевании жидкость (вода) выделяет энергию. Это как раз та энергия, которую поглотил лед, превращаясь в жидкость (участок ВС). Внутренняя энергия у жидкости больше, чем у твердого тела. При плавлении (и кристаллизации) внутренняя энергия тела меняется скачком.
Металлы, плавящиеся при температуре выше 1650 ºС, называют тугоплавкими (титан, хром, молибден и др.). Самая высокая температура плавления среди них у вольфрама — около 3400 °С. Тугоплавкие металлы и их соединения используют в качестве жаропрочных материалов в самолетостроении, ракетостроении и космической технике, атомной энергетике.
Подчеркнем еще раз, что при плавлении вещество поглощает энергию. При кристаллизации оно, наоборот, отдает ее в окружающую среду. Получая определенное количество теплоты, выделяющееся при кристаллизации, среда нагревается. Это хорошо известно многим птицам. Недаром их можно заметить зимой в морозную погоду сидящими на льду, который покрывает реки и озера. Из-за выделения энергии при образовании льда воздух над ним оказывается на несколько градусов теплее, чем в лесу на деревьях, и птицы этим пользуются.
Плавление аморфных веществ .
Наличие определенной точки плавления — это важный признак кристаллических веществ. Именно по этому признаку их можно легко отличить от аморфных тел, которые также относят к твердым телам. К ним, в частности, относятся стекла, очень вязкие смолы, пластмассы.
Аморфные вещества (в отличие от кристаллических) не имеют определенной температуры плавления — они не плавятся, а размягчаются. При нагревании кусок стекла, например, сначала становится из твердого мягким, его легко можно гнуть или растягивать; при более высокой температуре кусок начинает менять свою форму под действием собственной тяжести. По мере нагревания густая вязкая масса принимает форму того сосуда, в котором лежит. Эта масса сначала густая, как мед, затем — как сметана и, наконец, становится почти такой же маловязкой жидкостью, как вода. Однако указать определенную температуру перехода твердого тела в жидкое здесь невозможно, поскольку ее нет.
Причины этого лежат в коренном отличии строения аморфных тел от строения кристаллических. Атомы в аморфных телах расположены беспорядочно. Аморфные тела по своему строению напоминают жидкости. Уже в твердом стекле атомы расположены беспорядочно. Значит, повышение температуры стекла лишь увеличивает размах колебаний его молекул, дает им постепенно все большую и большую свободу перемещения. Поэтому стекло размягчается постепенно и не обнаруживает резкого перехода «твердое—жидкое», характерного для перехода от расположения молекул в строгом порядке к беспорядочному.
Теплота плавления .
Теплота плавления — это количество теплоты, которое необходимо сообщить веществу при постоянном давлении и постоянной температуре, равной температуре плавления, чтобы полностью перевести его из твердого кристаллического состояния в жидкое. Теплота плавления равна тому количеству теплоты, которое выделяется при кристаллизации вещества из жидкого состояния. При плавлении вся подводимая к веществу теплота идет на увеличение потенциальной энергии его молекул. Кинетическая энергия не меняется, поскольку плавление идет при постоянной температуре.
Изучая на опыте плавление различных веществ одной и той же массы, можно заметить, что для превращения их в жидкость требуется разное количество теплоты. Например, для того чтобы расплавить один килограмм льда, нужно затратить 332 Дж энергии, а для того чтобы расплавить 1 кг свинца — 25 кДж.
Физическая величина, показывающая, какое количество теплоты необходимо сообщить кристаллическому телу массой 1 кг, чтобы при температуре плавления полностью перевести его в жидкое состояние, называется удельной теплотой плавления.
Удельную теплоту плавления измеряют в джоулях на килограмм (Дж/кг) и обозначают греческой буквой λ (лямбда).
Удельная теплота кристаллизации равна удельной теплоте плавления, поскольку при кристаллизации выделяется такое же количество теплоты, какое поглощается при плавлении. Так, например, при замерзании воды массой 1 кг выделяются те же 332 Дж энергии, которые нужны для превращения такой же массы льда в воду.
Чтобы найти количество теплоты, необходимое для плавления кристаллического тела произвольной массы, или теплоту плавления, надо удельную теплоту плавления этого тела умножить на его массу:
Количество теплоты, выделяемое телом, считается отрицательным. Поэтому при расчете количества теплоты, выделяющегося при кристаллизации вещества массой m, следует пользоваться той же формулой, но со знаком «минус»:
Теплота сгорания .
Теплота сгорания (или теплотворная способность, калорийность) — это количество теплоты, выделяющейся при полном сгорании топлива.
Для нагревания тел часто используют энергию, выделяющуюся при сгорании топлива. Обычное топливо (уголь, нефть, бензин) содержит углерод. При горении атомы углерода соединяются с атомами кислорода, содержащегося в воздухе, в результате чего образуются молекулы углекислого газа. Кинетическая энергия этих молекул оказывается большей, чем у исходных частиц. Увеличение кинетической энергии молекул в процессе горения называют выделением энергии. Энергия, выделяющаяся при полном сгорании топлива, и есть теплота сгорания этого топлива.
Теплота сгорания топлива зависит от вида топлива и его массы. Чем больше масса топлива, тем больше количество теплоты, выделяющейся при его полном сгорании.
Физическая величина, показывающая, какое количество теплоты выделяется при полном сгорании топлива массой 1 кг, называется удельной теплотой сгорания топлива. Удельную теплоту сгорания обозначают буквой q и измеряют в джоулях на килограмм (Дж/кг).
Количество теплоты Q, выделяющееся при сгорании m кг топлива, определяют по формуле:
Чтобы найти количество теплоты, выделяющееся при полном сгорании топлива произвольной массы, нужно удельную теплоту сгорания этого топлива умножить на его массу.
Читайте также:
