Плавление металлов и строение расплавов
Обновлено: 04.10.2024
При нагревании металла до температуры плавления происходит нарушение правильности его структуры. Это характеризуется возрастанием в металле перемещающихся атомов. Дальнейшее повышение температуры приводит к плавлению металла.
Тепловое расширение приводит к такому увеличению расстояния между атомами при котором устойчивость кристаллической решетки в определенный момент теряется внезапно, наступает быстрый обрыв связей между атомами, резкая перестройка структуры.Если атом В занимается положение посередине, то наступит такой момент, когда он будет испытывать воздействие от атомов А и С и в конце концов оторвется и переместится от А и С или наоборот. Таким образом происходит разрыв связей между атомами. И начинается процесс плавления.
Если рассматривать два атома, то кривые, изображающие изменения потенциалов и сила притяжения (а) и сил отталкивания (в) между атомами, в зависимости от расстояния между ними будут иметь вид, представленный на рис.
0 соответствует наиболее устойчивому положению атомов.
Строение жидкого металла. Дальний и ближний порядок. – (Уравнение состояния жидкости.) – (Тепловое движение атомов в жидкости.)Обозначим через z число атомов разных видов, например А и В, окружающих каждый атом, а через число соседних атомов, принадлежащих к какому – либо одному сорту атомов. Тогда z – z 1 определяет число атомов другого сорта. Степенью ближнего порядка будет отношение:
а) При z 1 =z все атомы разноименные и η=1 здесь имеет место полный ближний порядок расположения атомов. б) При z 1 =z половина всех окружающих атомов разноименные, а η=0 т.е ближний порядок исчезает. в) При z 1 =0 отсутствуют разноименные атомы, т.е. происходит разделение атомов А и атомов В, или распад раствора на оба компонента. Введенные понятия дальнего и ближнего порядка имеют существенное значение для правильного представления о различии между твердым и жидким состоянием у чистых металлов. При твердом кристаллическом состоянии металла атомы правильно расположены в узлах решетки. В процессе плавления металла это порядок исчезает. Структура и свойства жидкого металла подобны структуре и свойствам его в твердом состоянии. В доказательство этого могут быть приведены следующие соображения:
1. При плавлении происходит небольшое увеличение объема, которое у металлов не превышает 10%.
2. Обычно теплота плавления очень мала по сравнению с теплотой испарения. Отсюда следует, что силы сцепления между частицами при плавлении ослабляются незначительно.
3. При плавлении теплоемкость почти не изменяется или увеличивается в небольших размерах. Это говорит о том, что характер теплового движения в жидкости существенно не меняется практически он такой же, как и в твердых телах, т.е. в основном сводится к колебаниям частиц около которых положений равновесия.
4. Жидкость обладает текучестью; это основная особенность жидкости отмечает ее скорее количественно, чем качественно от твердого тела.
5. Рентгенографические исследования, проведенные в последние годы показали, что живности вблизи точки плавления имеют расположение частиц, сходное с тем правильным расположением, которое они имеют при кристаллизации. Таким образом, экспериментально доказано, что вблизи точки плавления в жидкости сохраняется ближний порядок в расположении частиц, наблюдаются как бы микрокристаллики, подобные исходным.
8. Плавление металлов и строение расплавов
Плавление – это физический процесс перехода металла из твердого состояния в жидкое расплавленное. Плавление – процесс, обратный кристаллизации, происходит при температуре выше равновесной, т. е. при перегреве. Поскольку жидкий металл обладает большей внутренней энергией, чем твердый, при кристаллизации выделяется теплота. Между теплотой Q и температурой кристаллизации Тк существует определенная связь. Степень перегрева при плавлении металлов не превышает нескольких градусов.
В жидком состоянии атомы вещества из-за теплового движения перемещаются беспорядочно, в жидкости имеются группировки атомов небольшого объема, в их пределах расположение атомов аналогично расположению в решетке кристалла. Эти группировки неустойчивы, они рассасываются и снова появляются в жидкости. При переохлаждении жидкости некоторые крупные группировки становятся устойчивыми и способными к росту. Эти устойчивые группировки атомов называют центрами кристаллизации (зародышами). Для осуществления процесса плавления необходимо наличие некоторого перегрева над равновесной температурой, т. е. термодинамического потенциала. Выше равновесной температуры более устойчив жидкий металл, он имеет меньший запас свободной энергии. Ниже этой температуры более устойчив твердый металл. При равновесной температуре свободные энергии жидкого и твердого состояния одинаковы, поэтому при этой температуре обе фазы (жидкая и твердая) могут сосуществовать одновременно и притом бесконечно долго. Равновесная температура очень близка к температуре плавления Тпл, с которой ее часто сравнивают. При охлаждении переход из жидкого состояния в твердое сопровождается образованием кристаллической решетки, т. е. кристаллизацией. Чтобы вызвать кристаллизацию, жидкий металл нужно переохладить до температуры ниже температуры плавления.
Жидкости, находящиеся при температуре, близкой к температуре плавления называются расплавами. Расплавы бывают металлическими, ионными, полупроводниковыми, органическими и высокополимерными. В зависимости от того, какие химические соединения образуют расплавы, выделяют солевые, оксидные, оксидно-силикатные и другие расплавы.
Большинство расплавов имеют в составе искосаэдрические частицы.
В процессе плавления химические связи в расплавах подвергаются видоизменению. В полупроводниках наблюдается образование металлической проводимости, у некоторых галогенидов вместо ионной проводимости происходит снижение электрической проводимости из-за образования расплава с молекулярным составом. Уровень температуры также влияет на тип связи в расплавах.
Среднее координационное число и межатомные расстояния также являются характеристиками расплавов. В процессе плавления металлов происходит уменьшение координационного числа примерно на 10–15 %. В тоже время межатомные расстояния остаются прежними. При плавлении полупроводников происходит увеличение их координационного числа в 1,5 раза, расстояние между атомами также увеличивается. Многокомпонентные расплавы характеризуются неравновесными, метастабильными состояниями, которые имеют взаимосвязь со структурой первоначальных твердых фаз.
Во многих случаях встречается отставание (гистерезис) свойств расплавов в процессе изменения температуры. На свойства и строения расплавов оказывают влияние следующие факторы: температура, время выдержки, скорость колебания температуры, тот материал, из которого создан контейнер, а также наличие примесей.
Состав расплавов отличается своей сложностью. В ионных расплавах могут содержаться простые или комплексные ионы, недиссоциированные и полимерные молекулы, а также свободные объемы. Силикатные расплавы могут содержать изолированные кремнекислородные тетраэдры и образуемые ими цепи, кольца, сетки и каркасы.
Однозначная модель структуры расплавов формируется достаточно сложно, т. к. расплавы содержат разные виды частиц и связи. Основная функция моделей: определение и интерпретация свойств расплавов, а также расчет свойств.
Расплавы в металлургической области подразделяются на промежуточные, побочные и конечные продукты. Используя расплавы в качестве электролитов, в металлургии производят и рафинируют металлы, а также осуществляют нанесение покрытий. Многие сплавы образуются в виде расплавов. Монокристаллы и эпитаксиальные пленки выращиваются из расплавов. В качестве катализаторов принято использовать металлические, солевые и оксидные расплавы. Солевые расплавы применяют в отжиговых и закалочных ваннах, высокотемпературных топливных элементах, в качестве теплоносителей, флюсов в процессе пайки и сварки металлов, реакционных сред в неорганическом и органическом синтезе, а также как поглотители, экстрагенты и т. д. Некоторые расплавы используются для получения силикатных, фторидных и иных специальных стеков и аморфных металлов.
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРес
Строение древесины
Строение древесины Сделав только поперечный срез, можно четко рассмотреть строение древесины. Каждый брусок необтесанного дерева имеет кору – это кожа дерева, которая не используется в работе, ее обязательно снимают. Под корой располагается зона роста дерева, которая
ЛЕКЦИЯ № 1. Строение древесины
ЛЕКЦИЯ № 1. Строение древесины 1. Виды древесных пород и части дерева Растущие деревья имеют следующие составные части: корни, ствол, ветви, листья. Корневая система деревьев выполняет функции поставщика влаги и питательных веществ из почвы по стволу и ветвям к листьям.
2. Макроскопическое строение древесины
2. Макроскопическое строение древесины При поперечном разрезе ствола дерева можно установить главные макроскопические признаки: заболонь, ядро, годичные слои, сердцевинные лучи, сосуды, смоляные ходы и сердцевинные повторения.У молодых деревьев всех пород древесина
1. Строение металлов
1. Строение металлов Металлы и их сплавы – основной материал в машиностроении. Они обладают многими ценными свойствами, обусловленными в основном их внутренним строением. Мягкий и пластичный металл или сплав можно сделать твердым, хрупким, и наоборот. Для того чтобы
Свойства расплавов стекол
Свойства расплавов стекол К свойствам расплавов стекломассы относятся вязкость, связанная с ней скорость твердения, поверхностное натяжение и кристаллизация, а также теплоемкость, теплопроводность, электрическая проводимость. Значение этих свойств при производстве
§ 3.3 Строение атомов и периодический закон Менделеева
§ 3.3 Строение атомов и периодический закон Менделеева Свойства простых тел, а также формы и свойства соединений элементов, находятся в периодической зависимости (или, выражаясь алгебраически, образуют периодическую функцию) от их атомных весов. Д.И. Менделеев Считается,
§ 3.6 Строение ядер
§ 3.6 Строение ядер Чем больше в ядре должно поместиться нуклонов, тем больше должна быть площадь поверхности ядра, где происходят присоединения то протонов, то нейтронов… Этим особенностям лучше всего отвечает форма ядра в виде двух пирамид Хеопса, соединённых
§ 4.14 Строение вещества и химическая связь
§ 4.14 Строение вещества и химическая связь Что, наконец, представляется нам затверделым и плотным, То состоять из начал крючковатых должно несомненно, Сцепленных между собой наподобие веток сплетённых. В этом разряде вещей, занимая в нём первое место, Будут алмазы
Глава 32 Строение Пространства – Времени
Глава 32 Строение Пространства – Времени «Действие есть кривизна Мира» Павел Дмитриевич Успенский, 1911 год Мы уже предполагали аналогии квантового строения микромира и макромира, при определенных условиях. Далее, будет показаны законы резонансного строения нашего
2. Зеренное строение металлов. Границы зерен и субзерен
2. Зеренное строение металлов. Границы зерен и субзерен Металлы – это поликристаллические тела, они состоят из мелких кристаллов. Характеризуются металлическими свойствами и составляют 50 % всех химических элементов. Строение металлов и их сплавов кристаллическое.В
10. Строение слитка и аморфные сплавы
10. Строение слитка и аморфные сплавы Строение стального слитка впервые дано в 1878 г. Д.К. Черновым. Структура литого слитка состоит из трех основных зон. Первая зона – наружная мелкозернистая корка, которая состоит из дезориентированных мелких кристаллов –
Общая характеристика металлургических расплавов
Современные технологические процессы массового производства черных и ряда цветных металлов связаны с наличием жидких фаз:
– оксидной (шлак), в основном, в процессах черной металлургии;
– сульфидной (штейн), в процессах цветной металлургии.
При взаимодействии расплавов между собой и с газовой фазой идут химические реакции:
– науглероживания и обезуглероживания;
– дефосфорации (обесфосфоривания) и др.
При разработке технологии проведения плавки — получения металлического сплава заданного состава необходимо знать:
– закономерности перераспределения различных элементов между металлургическими фазами,
– уметь рассчитывать термодинамическую активность компонентов в металлургических расплавах,
– оценивать влияние различных факторов на полноту перехода элементов из одних фаз в другие,
– оценивать скорости процессов.
В основе этих знаний лежат:
– представления о строении (структуре) расплавов и природе сил, действующих между структурными единицами расплава,
– данные о физико-химических свойствах расплавов (вязкости, электропроводности и др.).
Под структурой расплава понимают взаимное расположение в пространстве составляющих его частиц.
Структура расплава взаимосвязана:
– с электронной природой частиц, величиной сил взаимодействия между частицами;
– с физико-химическими свойствами расплава.
По вышеуказанным признакам металлические расплавы существенно отличаются от расплавленных шлаков (и штейнов). Эти жидкости рассматривают раздельно.
Металлические расплавы
Структура расплавов
Для металлических расплавов характерны значительные силы взаимодействия между атомами. Как следствие – отщепление валентных электронов и их коллективизация. Межчастичные связи – это взаимодействия катионов с коллективом свободных электронов.
Температура расплавов в обычных металлургических процессах незначительно превышает их температуру плавления (исключения – электронная, плазменная плавки). В этом случае жидкости по своим свойствам и строению близки к твердым телам, но не к газам.
Экспериментальные факты.
1. Относительное увеличение объема металлов при плавленииметаллов не более
6 %. Объем при испарении увеличивается в десятки раз.
Значит, средние расстояния между атомами при плавлении изменяются мало.
2. Теплота плавления существенно меньше теплоты испарения.
| , | Mn | Cu | Cr | Fe |
| 14,6 | 13 | 16,4 | 15,4 | |
| 231 | 304,6 | 315,9 | 352,5 |
Значит, силы сцепления между атомами при плавлении ослабляются относительно мало.
Значит, порядок в жидкости нарушается при плавлении относительно мало.
3. Теплоемкости металлов при плавлении изменяются незначительно.
| Mn | Ni | Cr | Fe | Al |
| 46,4 | 35,8 | 42,7 | 41,8 | 32,6 |
| 46,0 | 35,8 | 40,6 | 34,1 | 29,3 |
Значит, с учетом (1–2) в жидкости сохраняется характер теплового движения, свойственный твердому металлу.
4. При жидкость проявляет твердость, хрупкость и малую сжимаемость (кратковременные трещины).
5. Рентгенограммы жидкостей сходны с рентгенограммами микрокристаллических тел (с размерами кристалликов ~ 1 нм (10 –9 м).
Для жидкостей характерен ближний порядок и отсутствие дальнего порядка.
Прямое изучение структуры жидких металлов весьма затруднено и практически невозможно. Особенно это относится к железу и его сплавам, имеющим высокую температуру плавления. Поэтому предложенные модели жидкого состояния основываются на косвенных данных и теоретических предположениях. В значительной мере они гипотетические. Рассмотрим некоторые из них.
Согласно модельной теории свободного объема жидкость состоит из объема составляющих ее частиц и «свободного объема», образовавшегося вследствие скачкообразного уменьшения плотности при плавлении. При этом образуются как бы отдельные ячейки, в которых, вследствие свободного объема, происходит колебание частиц. Принимается, что каждая частица колеблется в своей ячейке независимо от других. Определяется средний потенциал взаимодействия частицы с окружающими ее частицами («стенками ячейки») и рассчитывается сумма состояний всей системы.
Модель свободного объема оказалась полезной для описания явлений переноса. Так А.И. Бачинский принял, что динамическая вязкость жидкости обратно пропорциональна величине свободного объема:
где VЖ и Vтв — объемы 1 моля жидкости и твердого тела; α — постоянная для данной жидкости.
Это правило хорошо согласуется с опытными данными.
Особое значение для развития представлений о жидком состоянии имеет теория Я.И. Френкеля (1926 г.), так называемая дырочная теория, получившая развитие и в работах других исследователей. Согласно этой теории при нагреве, тем более при плавлении, увеличение объема происходит не только за счет увеличения расстояния между частицами, но и, главным образом, за счет возникновения добавочных вакантных узлов — «дырок». Количество этих дырок при нагреве металла увеличивается постепенно, а при плавлении – скачкообразно вследствие потери устойчивости в расположении частиц. Значительное увеличение количества дырок при плавлении вызывает резкое увеличение коэффициентов диффузии, осуществляемой через вакантные места, и повышение растворимости.
Радиус образуемых дырок или полостей имеет размер порядка десятых нанометра, т.е. такого же порядка, как и параметр решетки. Так как возникновение дырок или полостей равновероятно в любой группе частиц, они непрерывно появляются в одних местах и исчезают в других.
Увеличение амплитуды колебаний частиц и расстояний между ними, а также образование большого количества дырок сильно искажают правильное расположение атомов в пространственной решетке при плавлении. При этом нарушается дальний порядок в расположении атомов, но сохраняется ближний порядок, т.е. характерное для кристаллов правильное расположение атомов в равновесных положениях в «узлах решетки» на некотором расстоянии от произвольно выбранного центрального атома. С учетом ближнего порядка строение жидкости иногда называют квазикристаллическим.
Ближний порядок распространяется на небольшие расстояния, оцениваемые примерно в 1. 2 нм. С возрастанием расстояния от произвольно выбранного центрального атома возрастает степень неопределенности в относительном расположении более отдаленных атомов.
Тепловое движение частиц в жидкости вблизи температуры плавления также подобно движению в кристаллах. Оно состоит из колебаний возле центров равновесия и относительно редких скачков из одногo центра равновесия в другой. В случае несферических молекул к этому добавляются вращение частиц.
Средняя продолжительность оседлой жизни в положении подвижного равновесия в узле квазикристаллической решетки, т.с. длительность задержки между перескоками (τ) согласно уравнению (1) пропорциональна периоду колебаний ( ,с) вблизи этого положения равновесия и сильно зависит от температуры, причем уменьшается с ростом последней:
где – время «оседлой жизни» частиц; – период колебаний частиц; – энергия активации «скачка» частицы; – постоянная Больцмана; – температура.
Следовательно, в жидкости колебание атомов около некоторого среднего положения не изменяется в течение от 10 до 1000 колебаний.
Значительное число совершающихся в жидкости скачков частиц с места на место и, соответственно, малая, по сравнению с перемещением в кристаллах, продолжительность оседлой жизни вызывает проявление основного внешне видимого свойства жидкостей — их текучести. Значительное повышение температуры жидкости над точкой плавления вызывает резкое уменьшение времени оседлой жизни частиц и приближение характера их движения к наблюдаемому в газе.
Следовательно, общим для конденсированного состояния, в каком находятся жидкость и кристаллы, является то, что энергия межчастичного взаимодействия в нем превалирует над энергией теплового движения. В газе — наоборот.
С учетом теплового движения частиц наличие или отсутствие порядка их расположения в кристаллах или жидкости следует рассматривать в зависимости от времени, в течение которого протекает процесс или производится наблюдение.
Для последующего сравнения рассмотрим сначала кристаллическую решетку. С целью изучения ближнего порядка в такой решетке выберем в ней небольшой объем металла. Вследствие лишь редких нарушений в расположении частиц при возникновении дефектов структуры, которыми можно пренебречь, все тепловое движение частиц в этом объеме сводится к колебаниям атомов возле регулярно расположенных узлов решетки. Поэтому, в зависимости от времени наблюдения или протекания процесса, необходимо учитывать возможность фиксации в такой решетке одной из двух структур:
– мгновенного порядка в расположении атомов в кристалле при среднем времени оседлой жизни атомов меньше периода колебания (τo)
– и среднего порядка при τ>>τo.
Мгновенный порядок, характерный для физических процессов, протекающих за время, меньшее периода колебания атомов (например, процесса рассеяния электронов), нерегулярный. Но в кристаллах, где амплитуда колебания атомов в решетке значительно меньше параметра решетки, степень нерегулярности в расположении атомов небольшая.
Средний порядок регулярный с характерной трансляционной повторяемостью. Он определяет большинство свойств кристаллов.
При рассмотрении жидкости, в которой вблизи температуры плавления τ значительно больше τo и значительную часть теплового движения частиц составляют перескоки из одного центра равновесия в другой, в зависимости от времени наблюдения t следует различать три типа структур по степени разупорядоченности частиц.
1. Мгновенную структуру без заметного упорядочения кристаллического типа для быстро протекающих процессов при to. Такой характер структуры высокой степени неупорядоченности обусловлен тем, что в данных условиях фиксируется не среднее положение атомов в центрах их колебаний, а мгновенные положения. Вместе с тем размах нерегулярных тепловых колебаний атомов в жидкости сравним с межатомными расстояниями.
2. Среднюю структуру ближнего окружения произвольно выбранного атома, существующую при τ >>t >> τo. При таком времени в небольшой группе соседних атомов
(n ≈ 1 – 20) средние центры их колебания останутся практически неподвижными (как отмечалось, в кристаллах такое усреднение приводит к полному порядку). Возникает кратковременная квазикристаллическая структура небольших групп атомов, наиболее близкая к структуре твердых тел. Время существования такой упорядоченной структуры невелико — порядка t/n. С течением времени она изменяется.
3. При t > τ вследствие непрерывного изменения структуры ее квазикристалличность теряется. Остается лишь средняя структура радиального ближнего порядка. Именно эта структура, существенная для медленных и равновесных процессов, наблюдается на кривых, экспериментально полученных при определении рассеяния атомами рентгеновских лучей или нейтронов. Хотя за время их получения (десятки минут и часы) положение атомов меняется, среднестатистическое распределение их остается постоянным.
Из представлений о квазикристаллическом строении жидкости не следует, что в ней имеются кристаллы. Имеет место лишь упорядочение, которое удовлетворительно описывает модель строения, предложенная К.У. Стюартом. Он предположил, что упорядочение структуры сохраняется не только в ближайшем окружении некоторых атомов, названных в данный момент центральными, но сохраняется в пределах отдельных групп частиц, из которых состоит жидкость. Эти группы он назвал сиботаксисами (от греческого hibotos), что по смыслу соответствует используемому в настоящее время слову «кластер» англ. cluster-гроздь, группа. Кластеры не имеют четких границ. Они непрерывно появляются и исчезают. При этом атомы, принадлежащие к одному кластеру, переходят к другому, вновь возникающему. В местах соединений кластеров наблюдается разупорядочение их поверхностных слоев. Поэтому в каждый данный момент времени порядок в расположении частиц убывает от центра кластера к его поверхности. Время существования кластеров и их размеры зависят от состава жидкости и температуры.
Развивая теорию кластеров (сиботаксисов), Б.А. Баум с сотрудниками разработали квазихимическую модель строения жидких металлов. Эта модель представляет интерес для изучения тонкостей, в которых одновременно имеется несколько типов межчастичных взаимодействий, вызывающих появление микронеоднородности в их строении. К таким жидкостям относятся сталь и ферросплавы.
В отличие от описанной модели кластеров (сиботаксисов) в квазихимической модели учтены особенности силовых полей конкретных атомов жидкости, т.е. различная энергия взаимодействия атомов разной химической природы.в бинарных и более сложных системах. Это вызывает появление кластеров разных составов, строения и продолжительности существования. При этом учтены равноправность двух типов движения частиц — колебаний возле центров равновесия и перескоков между этими центрами, а также существенная роль межатомного притяжения в формировании конденсированного (жидкого, кристаллического) состояния.
Особое внимание неравноценности межатомных связей как причины неоднородности явилось для авторов модели основанием для названия ее квазихимической.
При описании квазихимической модели жидкости ее авторы, в качестве примера, рассматривают расплав железа с небольшим количеством атомов углерода. В таком расплаве существуют атомные связи Fe – Fe и Fe – С, причем последние сильнее первых. Это вызывает искажение электронной структуры атомов железной матрицы, охватывающей несколько координационных сфер вокруг атома примеси.
В результате примесь по сравнению с атомом матрицы имеет избыточный заряд. Внутри координационной сферы происходит перераспределение электронов. В том числе из недостроенных З-d-оболочек, допускающих образование направленных связей.
Модель жидкости, предложенная Дж. Берналом, основана на предположении, что различие между кристаллическим и жидким состояниями заключается в разных системах упаковки частиц, представляющих собой симметричные сферы. В кристаллах структура упорядоченная, регулярная и атомы находятся в строго фиксированных положениях. В жидкости, вследствие большего удельного объема (меньшей плотности), атомы не так жестко связаны между собой и находятся не в таких строго фиксированных положениях, как в кристаллах, т.е. структура нерегулярная.
Вследствие нефиксированности структуры жидкость можно переохладить ниже температуры кристаллизации. Этим она существенно отличается от кристаллов, которые перегреть выше температуры плавления невозможно.
В жидкости, как и в кристаллах, атомы между собой связаны. Но в кристаллах в результате теплового движения атомы колеблются возле некоторых центров равновесия, не меняя соседей (точнее говоря, редко их меняя). В жидкости же в результате такого движения часто происходит обмен соседями.
Таким образом, согласно Берналу, кристаллы имеют регулярную и связанную структуру, жидкости — нерегулярную и связанную структуру, газы — нерегулярную и несвязанную структуру.
Отмечая значительный вклад приведенных модельных представлений в развитие теорий жидкого состояния, следует признать, что они, все же, позволяют лишь весьма грубо описать свойства жидкости. Полное количественное описание свойств жидкости, представляющей собой систему огромного количества взаимодействующих между собой частиц, дает лишь использование методов статической физики.
Плавление твердых тел
Примером фазового перехода первого рода являются плавление и кристаллизация твердых тел. Процесс плавления играет важную роль в природе (плавление снега и льда на поверхности Земли, плавление минералов в её недрах и т.д.) и в технике (производство металлов и сплавов, литьё в формы и др.).
Плавление — это процесс перехода тела из кристаллического твёрдого состояния в жидкое.
Главными характеристиками плавления чистых веществ являются температура плавления (Тпл) и теплота (теплота плавления Qпл), которая необходима для осуществления процесса плавления.
В процессе плавления температура кристалла остается постоянной. Эта температура и называется температурой плавления Тпл.. У каждого вещества своя температура плавления. Температура плавления для данного вещества зависит от атмосферного давления. Самую высокую температуру плавления среди чистых металлов имеет вольфрам (3410 °С), самую низкую –
ртуть (–38,9 °С).
Постоянство температуры объясняется тем, что при плавлении вся подводимая теплота идет на разупорядочение регулярного пространственного расположения атомов (молекул) в кристаллической решетке. Для большинства кристаллов (кроме воды, и некоторых сплавов) температура плавления растет с увеличением внешнего давления, так как для отдаления атомов друг от друга при большем давлении требуется большая энергия тепловых движений, т. е. более высокая температура.
Расплавленное вещество обладает большим запасом внутренней энергии, чем в твердом состоянии. Оставшаяся часть теплоты плавления расходуется на совершение работы по изменению объема тела при его плавлении. При плавлении объем большинства кристаллических тел увеличивается (на 3-6%), а при отвердевании уменьшается. Но, существуют вещества, у которых при плавлении объем уменьшается, а при отвердевании - увеличивается. К ним относятся, например, вода и чугун, кремний и некоторые другие. Именно поэтому лёд плавает на поверхности воды, а твердый чугун - в собственном расплаве.
Плавление происходит с поглощением скрытой теплоты фазового перехода – теплоты плавления Qпл..
Удельная теплота плавления qпл. показывает, какое количество теплоты необходимо для полного превращения 1 кг вещества из твердого состояния в жидкое, взятого при температуре плавления: qпл. = Qпл./m, Дж/кг.
Плавление сопровождается изменением физических свойств вещества: увеличением энтропии, что отражает разупорядочение кристаллической структуры вещества; ростом теплоёмкости, электрического сопротивления. Практически до нуля падает при плавлении сопротивление сдвигу, уменьшается скорость распространения звука (продольных волн) и т.д.
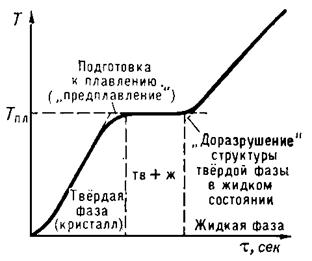
Рис. 1. Остановка температуры при плавлении кристаллического тела.
По оси абсцисс отложено время τ, пропорциональное равномерно подводимому к телу количеству теплоты.
Согласно молекулярно-кинетическим представлениям, плавление осуществляется следующим образом. При подведении к кристаллическому телу теплоты увеличивается энергия колебаний (амплитуда колебаний) его атомов, что приводит к повышению температуры тела и способствует образованию в кристалле различного рода дефектов (незаполненных узлов кристаллической решётки — вакансий; нарушений периодичности решётки атомами, внедрившимися между её узлами, и др. В молекулярных кристаллах может происходить частичное разупорядочение взаимной ориентации осей молекул, если молекулы не обладают сферической формой. Постепенный рост числа дефектов и их объединение характеризуют стадию предплавления. С достижением Тпл в кристалле создаётся критическая концентрация дефектов, начинается плавление— кристаллическая решётка распадается на легкоподвижные субмикроскопические области. Подводимая при плавлении теплота идёт не на нагрев тела, а на разрыв межатомных связей и разрушение дальнего порядка в кристаллах. В самих же субмикроскопических областях ближний порядок в расположении атомов при плавлении существенно не меняется. Этим объясняются меньшие значения теплот плавления Qпл по сравнению с теплотами парообразования и сравнительно небольшое изменение ряда физических свойств веществ при их плавлении. По мере возрастания температуры молекулы движутся все интенсивнее. При нагревании возрастает не только молекулярно-кинетическая энергия тела, но и потенциальная энергия взаимодействия его атомов, поскольку при увеличении амплитуды колебаний атомы отходят друг от друга на большее расстояние и сближаются на меньшее расстояние, благодаря чему энергия взаимодействия их электрических зарядов возрастает. С повышением температуры наступает, наконец, такой момент, когда поддержание порядка среди сильно раскачивающихся атомов становится невозможным, и с этого момента начинается разрушение кристаллической решетки, в результате чего исчезает и дальний порядок. Твердое тело плавится.
У аморфных тел изменение температуры со временем не имеет участка с постоянной температурой, а только точку перегиба. Увеличение температуры твердого аморфного тела сопровождается непрерывным уменьшением его вязкости.
Обратный переход вещества в твердое состояние возможен как из жидкого, так и из газообразного состояния. И в том и в другом случае такой переход осуществляется из состояния, лишенного симметрии, в состояние, в котором симметрия существует (это относится к дальнему порядку, который имеет место в кристаллах и которого нет ни в жидкостях, ни в газах). Поэтому переход в твердое состояние должен происходить скачком при определенной температуре, в отличие от перехода жидкость–пар, который может происходить непрерывно. Процесс образования твердого тела при охлаждении жидкости есть процесс образования кристалла (кристаллизация) и происходит он при определенной температуре – температуре кристаллизации. Так как при таком превращении энергия системы уменьшается, то такой переход должен сопровождаться выделением энергии в виде теплоты кристаллизации. Из закона сохранения энергии следует, что теплота плавления и теплота кристаллизации должны быть равны друг другу.
Читайте также:
