Почему be и mg не щелочноземельные металлы
Обновлено: 20.09.2024
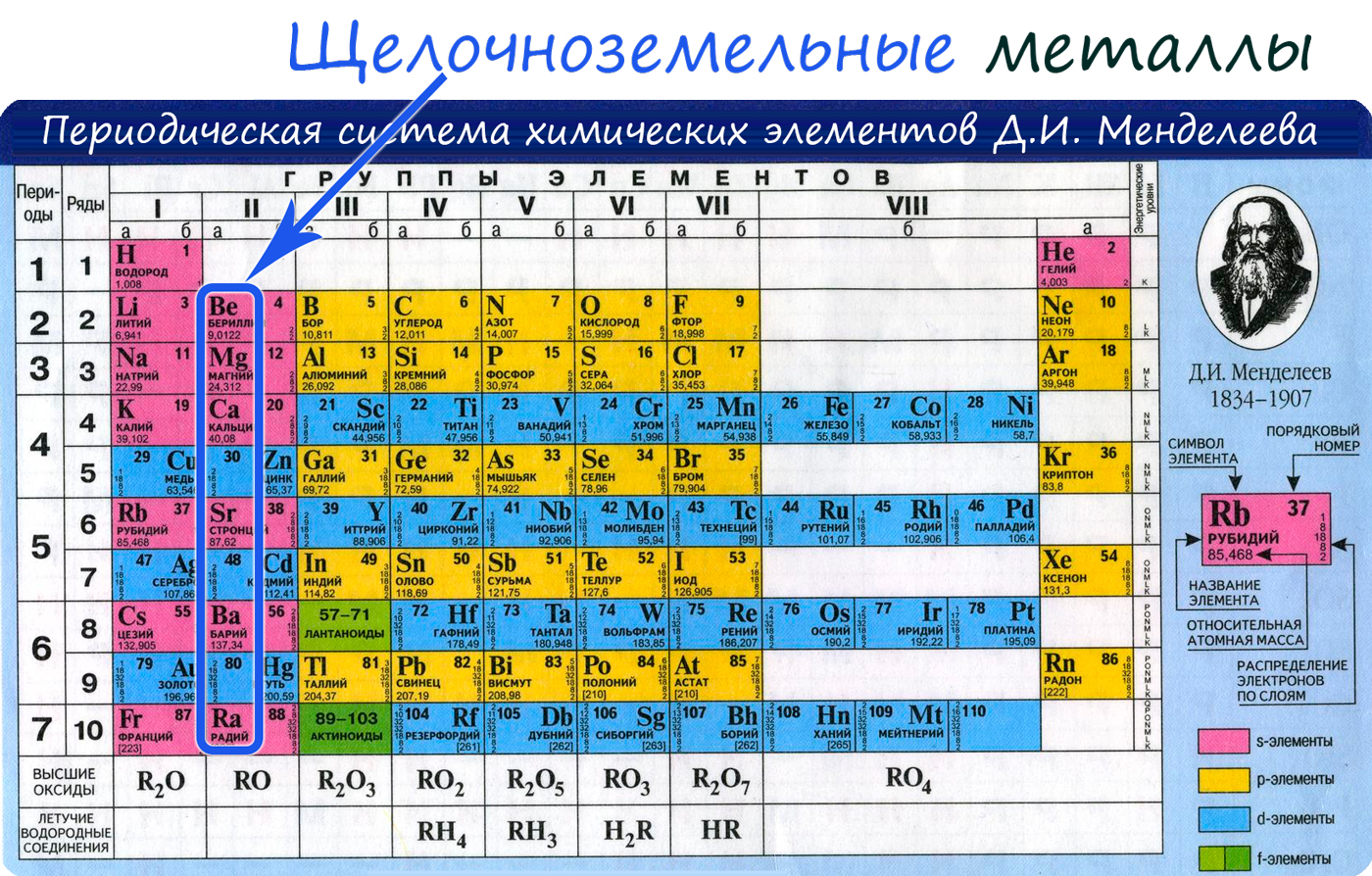
К щелочноземельным металлам относят химические элементы: двувалентные металлы, составляющие IIА группу:
Бериллий Be
магний Mg
кальций Ca,
стронций Sr,
барий Ba и
радий Ra.
Хотя бериллий Be по свойствам больше похож на алюминий, а магний Mg проявляет некоторые свойства щелочноземельных металлов, но в целом отличается от них.
Все щелочноземельные металлы — вещества серого цвета и гораздо более твердые, чем щелочные металлы.
Бериллий Be устойчив на воздухе. Магний и кальций (Mg и Ca) устойчивы в сухом воздухе. Стронций Sr и барий Ba хранят под слоем керосина.
Общая характеристка щелочноземельных металлов
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение:
- атомного радиуса,
- металлических, основных, восстановительных свойств,
- реакционной способности.
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.

Электронные конфигурации у данных элементов схожи, все они содержат 2 электрона на внешнем уровне ns 2 :
Be — 2s 2
Mg —3s 2
Ca — 4s 2
Sr — 5s 2
Ba — 6s 2
Ra — 7s 2
Нахождение в природе щелочноземельных металлов
Как правило, щелочноземельные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др.
Основные минералы, в которых присутствуют щелочноземельные металлы:

Способы получения щелочноземельных металлов
Магний
- Магний получают электролизом солей, чаще всего хлоридов: расплавленного карналлита (KCl·MgCl26H2O) или хлорида магния с добавками хлорида натрия при 720–750°С:
- восстановлением прокаленного доломита в электропечах при 1200–1300°С:
2(CaO · MgO) + Si → 2Mg + Ca2SiO4
Кальций
Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
Барий
Барий получают алюмотермическим способом — восстановление оксида бария алюминием в вакууме при 1200 °C:
Химические свойства щелочноземельных металлов
Качественные реакции
- Окрашивание пламени солями щелочных металлов
Цвет пламени:

Sr — карминово-красный (алый)

Взаимодействие с простыми веществами — неметаллами
С кислородом
С кислородом взаимодействуют при нагревании с образованием оксидов
С галогенами
Щелочноземельные металлы реагируют с галогенами при нагревании с образованием галогенидов .
С водородом
Щелочноземельные металлы реагируют с водородом при нагревании с образованием гидридов:
Бериллий с водородом не взаимодействует.
Магний реагирует только при повышенном давлении:
С серой
Щелочноземельные металлы при нагревании взаимодействуют с серой с образованием сульфидов сульфидов:
Ca + 2C → CaC2 (карбиды)
С азотом
При комнатной температуре с азотом взаимодействует только магний с образованием нитрида:
Остальные щелочноземельные металлы реагируют с азотом при нагревании.
С углеродом
Щелочноземельные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
Бериллий при нагревании с углеродом с образует карбид — метанид:
С фосфором
Щелочноземельные металлы при нагревании взаимодействуют с фосфором с образованием фосфидов:
Взаимодействие со сложными веществами
С водой
Кальций, стронций и барий взаимодействуют с водой при комнатной температуре с образованием щелочи и водорода:
Магний реагирует с водой при кипячении, а бериллий с водой не реагирует.
С кислотами
с концентрированной серной:
с разбавленной и концентрированной азотной:
С водными растворами щелочей
В водных растворах щелочей растворяется только бериллий:
С солями
В расплаве щелочноземельные металлы могут взаимодействовать с некоторыми солями:
Запомните! В растворе щелочноземельные металлы взаимодействуют с водой, а не с солями других металлов.
С оксидами
Щелочноземельные металлы могут восстанавливать из оксидов такие неметаллы как кремний, бор, углерод:
2Ca + SiO2 → 2CaO + Si
Магний сгорает в атмосфере углекислого газа с образованием оксида магния и сажи (С):
Щелочноземельные металлы
К щелочноземельным металлам относятся металлы IIa группы: бериллий, магний, кальций, стронций, барий и радий. Отличаются легкостью, мягкостью и сильной реакционной способностью.
Общая характеристика
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционная способность. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
- Be - 2s 2
- Mg - 3s 2
- Ca - 4s 2
- Sr - 5s 2
- Ba - 6s 2
- Ra - 7s 2
Природные соединения
- Be - BeO*Al2O3*6SiO2 - берилл
- Mg - MgCO3 - магнезит, MgO*Al2O3 - шпинель, 2MgO*SiO2 - оливин
- Ca - CaCO3 - мел, мрамор, известняк, кальцит, CaSO4*2H2O - гипс, CaF2 - флюорит

Получение
Это активные металлы, которые нельзя получить электролизом раствора. С целью их получения применяют электролиз расплавов, алюминотермию и вытеснением их из солей другими более активными металлами.
MgCl2 → (t) Mg + Cl2 (электролиз расплава)
CaO + Al → Al2O3 + Ca (алюминотермия - способ получения металлов путем восстановления их оксидов алюминием)

Химические свойства
Все щелочноземельные металлы (кроме бериллия и магния) реагируют с холодной водой с образованием соответствующих гидроксидов. Магний реагирует с водой только при нагревании.
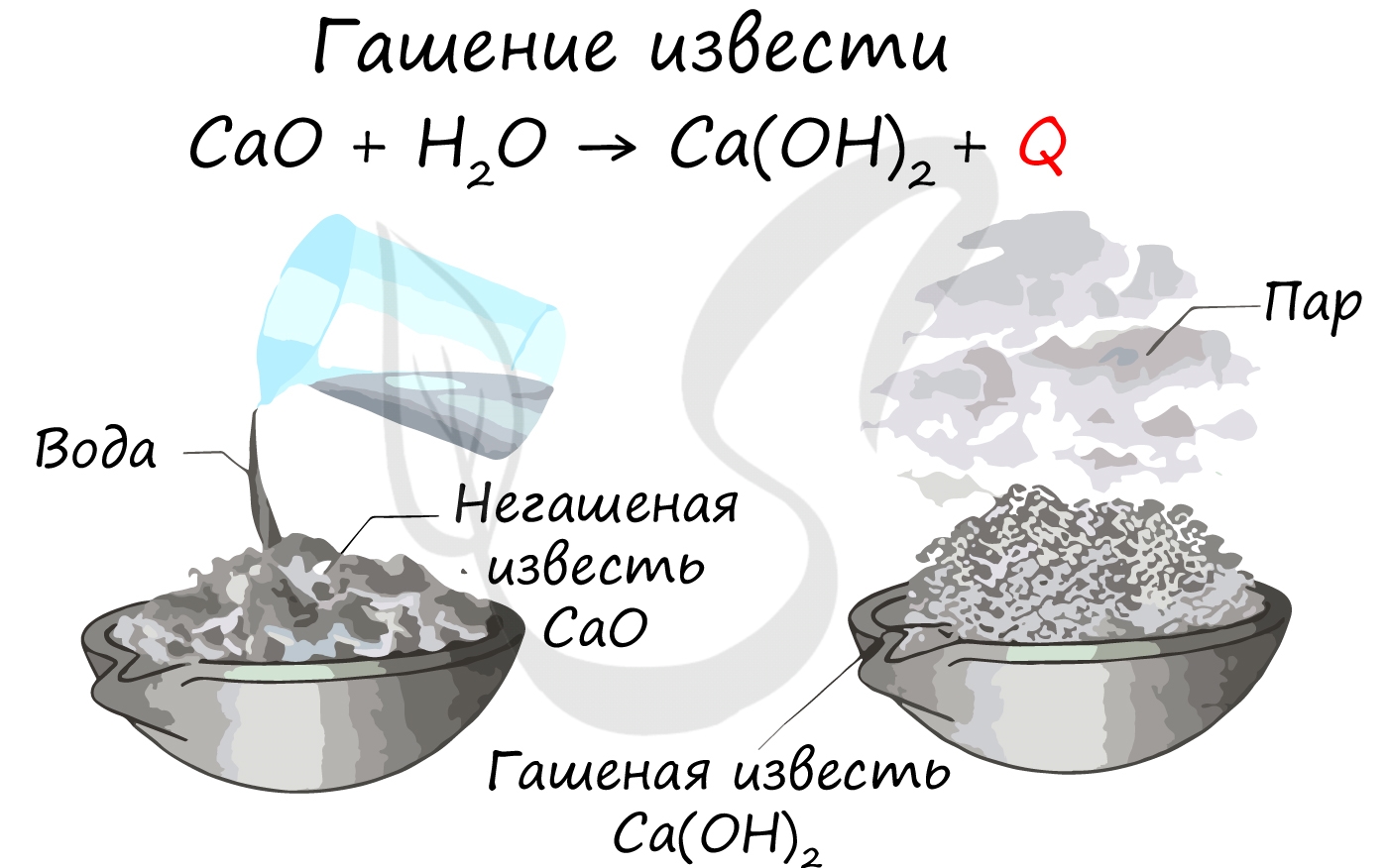
Щелочноземельные металлы - активные металлы, стоящие в ряду активности левее водорода, и, следовательно, способные вытеснить водород из кислот:
Хорошо реагируют с неметаллами: кислородом, образуя оксиды состава RO, с галогенами (F, Cl, Br, I). Степень окисления у щелочноземельных металлов постоянная +2.
Mg + O2 → MgO (оксид магния)
При нагревании реагируют с серой, азотом, водородом и углеродом.
Mg + S → (t) MgS (сульфид магния)
Ca + H2 → (t) CaH2 (гидрид кальция)
Ba + C → (t) BaC2 (карбид бария)

Ba + TiO2 → BaO + Ti (барий, как более активный металл, вытесняет титан)
Оксиды щелочноземельных металлов
Имеют общую формулу RO, например: MgO, CaO, BaO.
Оксиды щелочноземельных металлов можно получить путем разложения карбонатов и нитратов:
Рекомендую взять на вооружение общую схему разложения нитратов:

Проявляют преимущественно основные свойства, все кроме BeO - амфотерного оксида.
- Реакции с кислотами и кислотными оксидами
В нее вступают все, кроме оксида бериллия.
Амфотерные свойства оксида бериллия требуют особого внимания. Этот оксид проявляет двойственные свойства: реагирует с кислотами с образованием солей, и с основаниями с образованием комплексных солей.
BeO + NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Если реакция проходит при высоких температурах (в расплаве) комплексная соль не образуется, так как происходит испарение воды:
BeO + NaOH → Na2BeO2 + H2O (бериллат натрия)

Гидроксиды щелочноземельных металлов
Проявляют основные свойства, за исключением гидроксида бериллия - амфотерного гидроксида.
Получают гидроксиды в реакции соответствующего оксида металла и воды (все кроме Be(OH)2)
Основные свойства большинства гидроксидов располагают к реакциям с кислотами и кислотными оксидами.

Реакции с солями (и не только) идут в том случае, если соль растворимы и по итогам реакции выделяется газ, выпадает осадок или образуется слабый электролит (вода).
Гидроксид бериллия относится к амфотерным: проявляет двойственные свойства, реагируя и с кислотами, и с основаниями.
Жесткость воды
Жесткостью воды называют совокупность свойств воды, зависящую от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов, сульфатов и хлоридов.
Различают временную (карбонатную) и постоянную (некарбонатную) жесткость.
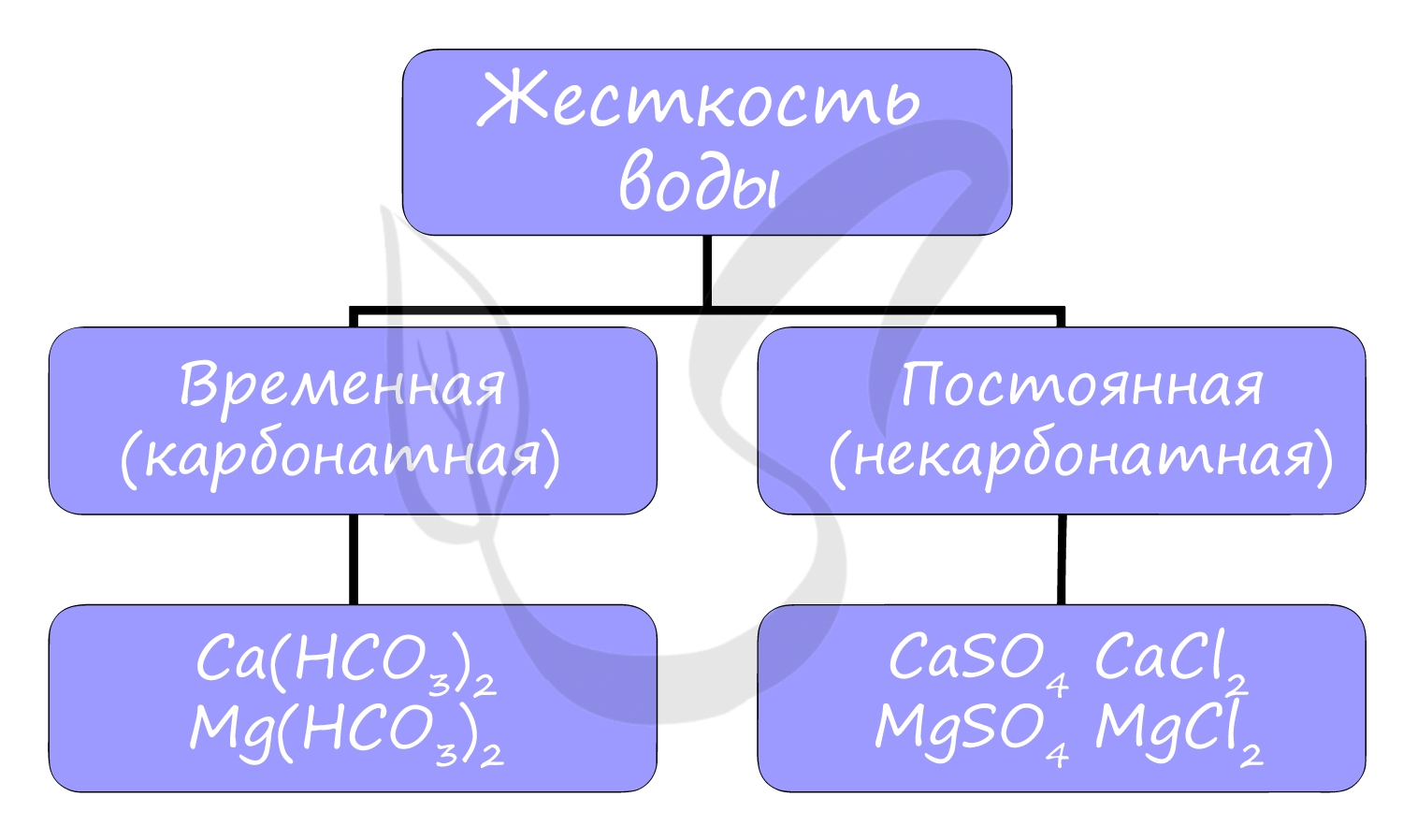
Вероятно, вы часто устраняете жесткость воды у себя дома, осмелюсь предположить - каждый день. Временная жесткость воды устраняется обычным кипячением воды в чайнике, и известь на его стенках - CaCO3 - бесспорное доказательство устранения жесткости:
Также временную жесткость можно устранить, добавив Na2CO3 в воду:
С постоянной жесткостью бороться кипячением бесполезно: сульфаты и хлориды не выпадут в осадок при кипячении. Постоянную жесткость воды устраняют добавлением в воду Na2CO3:
Жесткость воды можно определить с помощью различных тестов. Чрезмерно высокая жесткость воды приводит к быстрому образованию накипи на стенках котлов, труб, чайника.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Бериллий, магний и щелочноземельные металлы
К главной подгруппе второй группы относятся металлы: бериллий, магний, кальций, стронций, барий, радий.
Щелочноземельные металлы - кальций, стронций, барий, радий.
НАХОЖДЕНИЕ В ПРИРОДЕ
В земной коре содержится бериллия - 0,00053%, магния - 1,95%, кальция - 3,38%, стронция - 0,014%, бария - 0,026%, радий - искусственный элемент.
Встречаются в природе только в виде соединений - силикатов, алюмосиликатов, карбонатов, фосфатов,
MgCO3 – магнезит; CaCO3 • MgCO3 – доломит; KCl • MgSO4 • 3H2O – каинит; KCl • MgCl2 • 6H2O – карналлит
CaCO3 – кальцит (известняк, мрамор и др.); Ca3(PO4)2 – апатит, фосфорит; CaSO4 • 2H2O – гипс; CaSO4 – ангидрит; CaF2 – плавиковый шпат (флюорит)
SrSO4 – целестин; SrCO3 – стронцианит; Ba BaSO4 – барит; BaCO3 – витерит
Физические свойства
Щелочноземельные металлы (по сравнению со щелочными металлами) обладают более высокими t°пл. и t°кип, плотностями и твердостью.
Химические свойства
Очень реакционноспособны, сильные восстановители. Активность металлов и их восстановительная способность увеличивается в ряду: Be–Mg–Ca–Sr–Ba
Возможная степень окисления +2.
1. Взаимодействие с водой.
В обычных условиях поверхность Be и Mg покрыты инертной оксидной пленкой, поэтому они устойчивы по отношению к воде, но с горячей водой магний образует основание Mg(OH) 2.
В отличие от них Ca, Sr и Ba растворяются в воде с образованием гидроксидов, которые являются сильными основаниями:
Ве + H 2 O → ВеO+ H 2
Ca + 2H 2 O → Ca(OH) 2 + H 2
2. Взаимодействие с кислородом.
Все металлы образуют оксиды RO, барий образует пероксид – BaO2:
2Mg + O 2 → 2MgO
Ba + O 2 → BaO 2
3. Взаимодействие с неметаллами:
Be + Cl 2 → BeCl 2 (галогениды)
Ba + S → BaS (сульфиды)
3Mg + N 2 → Mg 3 N 2 (нитриды)
Ca + H 2 → CaH 2 (гидриды)
Ca + 2C → CaC 2 (карбиды)
3Ba + 2P → Ba 3 P 2 (фосфиды)
Бериллий и магний сравнительно медленно реагируют с неметаллами.
4. Взаимодействие с кислотами:
Ca + 2HCl → CaCl 2 + H 2
Mg + H 2 SO 4 (разб.) → MgSO 4 + H 2
5. Качественная реакция на катионы щелочноземельных металлов – окрашивание пламени в следующие цвета:
Ca 2+ - темно-оранжевый; Sr 2+ - темно-красный; Ba 2+ - светло-зеленый
Катион Ba 2+ обычно открывают обменной реакцией с серной кислотой или ее солями:
BaCl 2 + H 2 SO 4 → BaSO 4 ↓ + 2HCl
Ba 2+ + SO 4 2- → BaSO 4 ↓ Сульфат бария – белый осадок, нерастворимый в минеральных кислотах.
Почему бериллий и магний не являются щелочноземельными металлами?
Почему бериллий и магний не являются щелочноземельными металлами?

Потому что по хим.
Свойствам сильно отличаются от остальных в подгруппе : кальция, стронция и бария.
В своё время "щелочноземельными" назвали металлы 2 группы, которые реагируют с водой и дают щелочь.
Be с водой не реагирует.
Mg реагирует при ну крайне медленно, а растворимость Mg(OH)2 в воде так мала, что назвать раствор щелочью язык не поворачивается.

Биологическое значение щелочных металлов (Бериллий, магний, кальций)?
Биологическое значение щелочных металлов (Бериллий, магний, кальций).

К щелочноземельным металлам не относится кальций стронций барий бериллий?
К щелочноземельным металлам не относится кальций стронций барий бериллий.

Являются ли магний и кремний металлами?
Являются ли магний и кремний металлами?
Щелочноземельным металлом является 1) Be 2) Mg 3) Sr 4) Na?
Щелочноземельным металлом является 1) Be 2) Mg 3) Sr 4) Na.

Наиболее активным металлом является :1?
Наиболее активным металлом является :

Укажите наиболее активный металл : натрий, магний, алюминий, кремнийУкажите наименее активный металл : магний, кальций, барий, бериллий?
Укажите наиболее активный металл : натрий, магний, алюминий, кремний
Укажите наименее активный металл : магний, кальций, барий, бериллий.
Строение атомов бериллия и магния щелочноземельных металлов?
Строение атомов бериллия и магния щелочноземельных металлов.

Какое свойство не является общим для всех щелочноземельных металлов?
Какое свойство не является общим для всех щелочноземельных металлов?

Помогите пожалуйста, срочно?
Помогите пожалуйста, срочно!
1. Электронное строение внешнего энергетического
уровня атомов щелочноземельных металлов.
Степень окисления бериллия, магния и
Вид связи в кристалле бария :
А) ковалентная полярная
В) ковалентная неполярная
Выберите ряд элементов, относящихся к
Щелочноземельные металлы в химических реакциях являются А) изоляторами
В) восстановителями Г) не изменяют степень окисления
С какими из перечисленных веществ реагируют
Щелочноземельные металлы находятся в природе в виде
Б) в самородном виде
Про щелочноземельные металлы пожалуйста срочно?
Про щелочноземельные металлы пожалуйста срочно.
Вы открыли страницу вопроса Почему бериллий и магний не являются щелочноземельными металлами?. Он относится к категории Химия. Уровень сложности вопроса – для учащихся 5 - 9 классов. Удобный и простой интерфейс сайта поможет найти максимально исчерпывающие ответы по интересующей теме. Чтобы получить наиболее развернутый ответ, можно просмотреть другие, похожие вопросы в категории Химия, воспользовавшись поисковой системой, или ознакомиться с ответами других пользователей. Для расширения границ поиска создайте новый вопрос, используя ключевые слова. Введите его в строку, нажав кнопку вверху.
Я про алюминийАлюминий – легкий, прочный и пластичный металл. Это один из самых востребованных металлов, и по темпам роста потребления он давно и с большим отрывом оставил позади сталь, никель, медь и цинк. Алюминий без преувеличений можно назвать ..
Тому що рН показує ступінь концентрації катіонів гідрогену у воді, що є дуже важливим для косметики.

1. дано N(NH3) = 4. 816 * 10 ^ 23 - - - - - - - - - - - - - - - - - - - - - - - - - - - - - V(NH3) - ? N(NH3) / N(A) = V(NH3) / Vm V(NH3) = N(NH3) * Vm / N(A) = 4. 816 * 10 ^ 23 * 22. 4 / 6. 02 * 10 ^ 23 = 15. 58 L ответ 15. 58 л 2) дано m(O2)..
Соотвественно правильным ответом будет являться : 4) KCl ; 5) AgCl ; 6) NH4Cl.
Дано W(O) = 47 % - - - - - - - - - - - - - - - - E - ? Е - это неизвестный элемент W(O) = Ar(O) * n / M(X2O3) * 100% 47% = 16 * 3 / 2x + 48 * 100% 94x + 2256 = 4800 X = 27 - это алюминий Al2O3 ответ алюминий.
Напиши нормально не понятно или сфоткай.
В SO3 32 / (32 + 3 * 16) = 0, 4 или 40 %.
Реакции есть на фотографии.
4HCl + MnO2 = MnCl2 + Cl2 + 2H2O соляная кислота отдаёт в свободном виде половину имеющегося хлора. M(Cl общ. ) = 1000 * 0, 365 * 0, 9726 = 355 г масса выделившегося хлора = 355 / 2 = 177, 5 г.

Типы химической реакции соединение, разложение замещение.
© 2000-2022. При полном или частичном использовании материалов ссылка обязательна. 16+
Сайт защищён технологией reCAPTCHA, к которой применяются Политика конфиденциальности и Условия использования от Google.
Читайте также:
