Почему d элементы являются металлами
Обновлено: 04.10.2024
d-Элементы входят в состав побочных подгрупп. В отличие от главных подгрупп при движении в побочных подгруппах сверху вниз восстановительная активность уменьшается. У элементов данных подгрупп на последнем энергетическом уровне находятся один или два электрона, поэтому эти элементы относятся к металлам. Большинство из них являются основными конструкционными металлами. У f-элементов происходит заполнение f-подуровня.
Участие d-подуровня в образовании химических связей приводит к появлению дополнительных валентностей и соответственно к многообразию химических соединений, образуемых данными металлами. Устойчивость большинства валентных возможностей данных элементов определяется возможностью образования энергетически выгодных электронных конфигураций – наполовину или полностью заполненных s-, р-, d- и f-подуровней. Большинство переходных металлов и их соединений характеризуются определенной окраской. Данные металлы образуют большое количество комплексных соединений.
К d-металлам I группы относятся: медь (Сu), серебро (Аg) и золото (Аu). Электронная конфигурация валентной зоны данных элементов имеет вид
(n-1)d 10 ns 1 . Теоретически рассматриваемые элементы должны проявлять степень окисления +1, но участие в образовании связей двух d-электронов повышает их степень окисления до +3. Наиболее устойчивые степени окисления для меди +2, серебра +1, а золота +3.
Медь – вязкий металл светло-розового цвета, легко прокатываемый в тонкие листы. Медь хорошо проводит теплоту и электрический ток, уступая в этом отношении только серебру. Чистые металлы являются очень мягкими и пластичными, поэтому на практике используются в виде сплавов. Важными сплавами меди являются латунь (сплав меди с цинком) и бронза (оловянная, алюминиевая, кремниевая и другие). Некоторые специальные латуни и медноникелевые сплавы (мельхиор и нейзильбер) устойчивы к коррозии в морской воде. Серебро используется в виде сплава с медью, а золото – в сплавах с серебром или медью.
Золото, в сравнении с медью и серебром, характеризуется аномально высокой плотностью 19,3 г/см 3 , которая примерно в два раза выше плотности меди и серебра. Такая особенность присуща всем металлам, расположенным в периодической таблице после лантаноидов, и является следствием так называемого «лантаноидного сжатия».
Медь – химически стойкий металл, но в присутствии влаги и углекислого газа покрывается зеленым налетом (СuОН)2СО3. Серебро и золото на воздухе не окисляются.
В ряду напряжений медь, серебро и золото стоят после водорода и не
восстанавливают водород из соляной и разбавленной серной кислот. Однако в присутствии кислорода медь растворяется в этих кислотах с образованием соответствующих солей двухвалентной меди:
В азотной кислоте и концентрированной серной медь и серебро растворяются:
Золото в данных условиях не растворяется, а растворяется только в смеси азотной и соляной кислот (1:3).
Медь, серебро и золото в присутствии кислорода растворяются в щелочных растворах цианидов. Например,
Особенностью d-металлов, в том числе меди, серебра и золота, является их способность к образованию комплексных соединений:
Серебро легко взаимодействует с сероводородом и другими соединениями серы с образованием на поверхности черного сульфида Аg2S.
Важнейшие соединения данных металлов следующие:
CuSO4 – сульфат меди (II). В безводном состоянии белый порошок. При поглощении воды синеет. Водный раствор имеет сине-голубой цвет, вследствие гидратации ионов меди. При кристаллизации образуются синие кристаллы медного купороса CuSO4·5Н2О;
(CuОН)2СО3 – карбонат гидроксомеди(II). Встречается в природе в виде минерала малахита. Все соединения меди ядовиты, поэтому посуду из меди лудят, т.е. покрывают оловом. Медь принадлежит к числу микроэлементов.
АgNО3 – нитрат серебра, называемый ляписом. Применяется в гальванотехнике и медицине. Ионы серебра обладают бактерицидными свойствами.
Золотая кислота Аu(ОН)3 (Н3АuО3) и другие соединения золота легко
Химия s-, р-элементов

В этом уроке изучается положение s-, р-элементов в Периодической системе химических элементов Д. И. Менделеева, особенности строения атомов и их свойства.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Химия s-, р-элементов"
Элементы в периодической системе Менделеева делятся на эс, пэ, дэ и эф-элементы. Это разделение осуществляется на основе того, сколько энэргетических уровней имеет электронная оболочка атома и каким уровнем заканчивается заполнение электронной оболочки электронами.
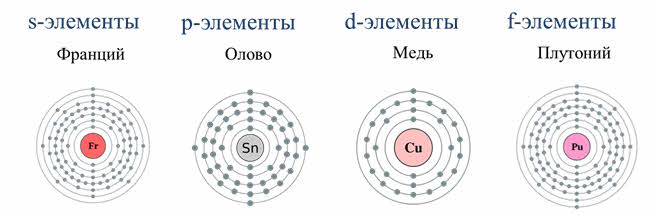
К s-элементам относятся элементы первой А группы – щелочные металлы. Электронная формула щелочных металлов эн-эс-один.
Поэтому для них характерна степень окисления плюс один. Элементы первой А группы обладают сходными свойствами из-за сходного строения электронной оболочки.
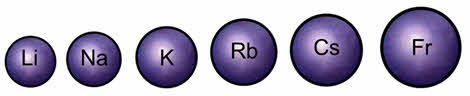
Но при увеличении радиуса в группе от лития к францию связь валентного электрона с ядром ослабевает и уменьшается энэргия ионизации. Атомы щелочных металлов легко отдают свой валентный электрон, поэтому они являются сильными восстановителями.
Из-за высокой химической активности щелочные металлы в природе встречаются только в виде соединений. Простые вещества, образованные элементами первой А группы, представляют собой серебристо-белые металлы, которые легко режутся ножом. Все щелочные металлы относятся к лёгким и легкоплавким металлам.
К эс-элементам относятся также элементы второй A группы, из них кальций, стронций, барий называют щелочноземельными металлами. На внешнем энэргетическом уровне у них по два электрона. Из-за своей высокой химической активности они встречаются в природе только в виде соединений. Металлы второй A группы имеют металлический блеск с различными оттенками: от серого до серебристого, температура плавления их выше, чем у щелочных металлов, плотность их меньше пяти грамм на сантиметр кубический, поэтому их относят к легкоплавким металлам.
К p-элементам относятся 30 элементов от третьей А до восьмой А группы периодической системы; пэ-элементы расположены во втором и третьем малых периодах, а также в четвертом, пятом и шестом больших периодах.
Элементы третьей А-группы имеют один электрон на пэ-орбитали. Начиная с четвёртой А и заканчивая восьмой А группой наблюдается заполнение пэ-подуровня до шести электронов. Общая электронная формула пэ-элементов эн-эс-два-эн-пэ-шесть.
В периодах при увеличении заряда ядра атомные радиусы и ионные радиусы пэ-элементов уменьшаются, энэргия ионизации и сродства к электрону возрастают, электроотрицательность увеличивается, неметаллические свойства элементов усиливаются.
Изменение свойств по периодам
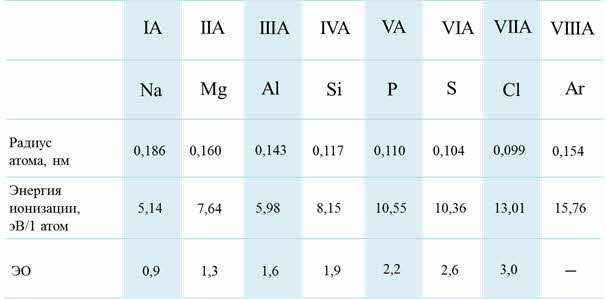
В группах сверху вниз радиусы атомов увеличиваются, энэргия ионизации и сродства к электрону уменьшается, электроотрицательность уменьшается, усиливаются металлические свойства, а неметаллические свойства ослабевают.
Изменение свойств по группам
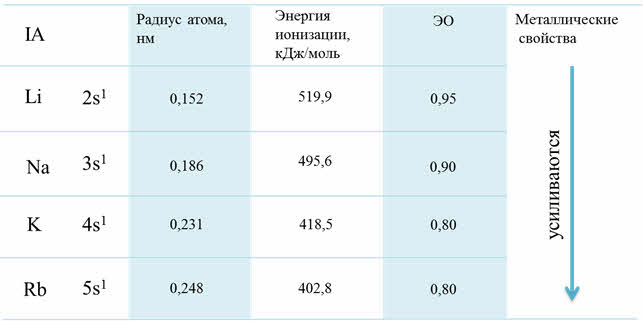
Кроме этого, по периоду с увеличением порядкового номера возрастает высшая степень окисления, а также возможность степеней окисления. Например, у кремния возможны такие степени окисления, как минус четыре, плюс два, плюс четыре; а у хлора – минус один, плюс один, плюс три, плюс пять, плюс семь.
Изменение СО по периоду
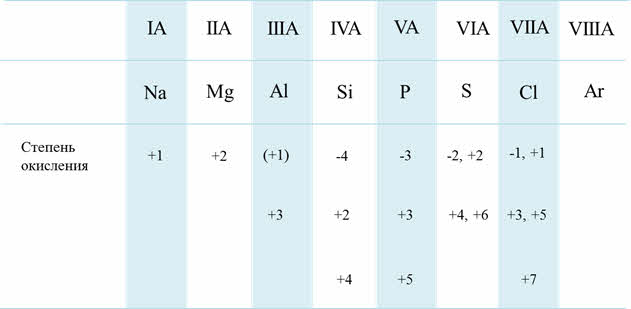
Если рассмотреть от первой до третьей А группы, то можно увидеть, что в группе сверху вниз увеличиваются металлические свойства, а также возрастает активность металлов. Например, во второй A группе металлические свойства и активность бария выражены гораздо сильнее, чем у магния.
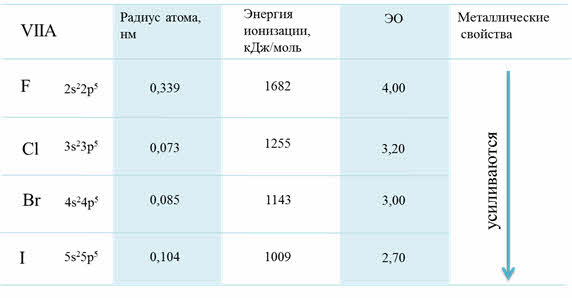
Рассмотрим для примера седьмую A группу – семейство галогенов. В этой группе сверху вниз радиус атома увеличивается, энергия ионизации уменьшается и электроотрицательность также уменьшается.
Возрастание активности металла
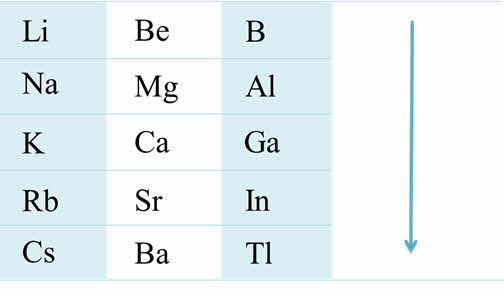
Если рассмотреть группы от четвёртой А до седьмой А, то можно проследить, что в этих группах сверху вниз уменьшается активность неметаллов, уменьшается стабильность соединений в высшей степени окисления, возрастает стабильность соединений в более низкой степени окисления. Например, в пятой A группе висмут проявляет металлические свойства и для него, в отличие от фосфора, наиболее характерна степень окисления плюс три.
Изменение свойств в VIIA группе
Благородные газы – элементы восьмой A группы. У них завершён внешний энэргетический уровень, причём у гелия два электрона на внешнем уровне, он относится к эс-элементам, а все остальные благородные газы относятся к пэ-элементам.

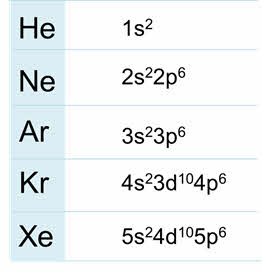
Радиус атомов у благородных газов увеличиваются сверху вниз, энергия ионизации уменьшается, плотность сверху вниз увеличивается, также как температура кипения.
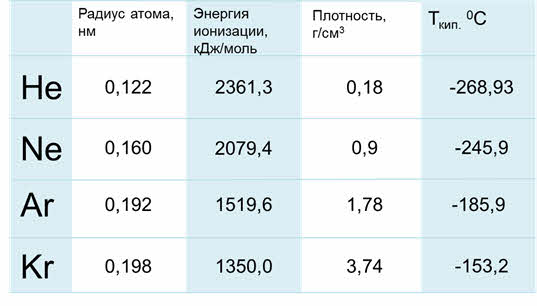
Таким образом, к эс-элементам относятся элементы первой A и второй A группы, к пэ-элементам относятся элементы от третьей до восьмой А группы. Отличительной особенность этих элементов является то, что их валентные электроны расположены на эс- или пэ-подуровне.
По периоду слева направо у них наблюдается уменьшение радиуса атомов, увеличивается энергия ионизации и энергия сродства к электрону, электроотрицательность увеличивается, металлические свойства ослабевают, а усиливаются неметаллические.
В группах сверху вниз наблюдается иная закономерность: радиусы атомов увеличиваются, уменьшается энергия ионизации и энергия сродства к электрону, электроотрицательность уменьшается, металлические свойства усиливаются, а неметаллические ослабевают.
Химия d-, f-элементов
Видеоурок посвящён изучению d-, f-элементов, положению элементов в Периодической системе химических элементов Д. И. Менделеева, особенностям строения атомов и их свойствам.
Конспект урока "Химия d-, f-элементов"
Первым дэ-элементом является скандий, он расположен в четвёртом периоде, третьей бэ группы.

Валентными электронами у скандия являются электроны предвнешнего дэ-подуровня и внешнего эс-подуровня.
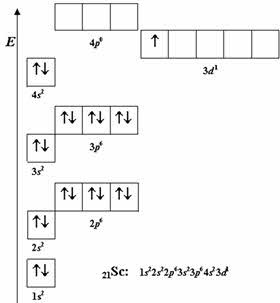
Следующие за скандием девять химических элементов также относятся к дэ–элементам, в атомах которых происходит заполнение три-дэ-подуровня.
Дэ-элементы расположены в побочных подгруппах, которые начинаются с четвёртого периода, их называют переходными элементами, к эф-элементам относятся лантаноиды и актиноиды, они вынесены отдельно и расположены внизу периодической системы Дмитрия Ивановича Менделеева. Лантаноиды находятся вместе с лантаном в шестом периоде в третьей бэ группе, а актиноиды в седьмом периоде третьей бэ группы.
Как было сказано, третья B группа начинается скандием, у которого один электрон на три-дэ-орбитале, у иттрия, лантана и актиния также по одному электрону на дэ-орбитале, так как это элементы третьей бэ группы, и максимальная степень окисления их в соединениях равна плюс трём.

Кроме степени окисления плюс три, для них характерна и степень окисления плюс два.
Лантаноиды – элементы третьей бэ группы, они расположены в шестом периоде, у них начинается заполнение четвёртого-эф-подуровня. Актиноиды – это элементы седьмого периода третьей бэ группы, у них идёт заполнение пятого-эф-подуровня. Они представляют собой радиоактивные элементы, не имеющие стабильных нуклидов. Актиноиды – это редкие элементы.
У элементов четвёртой B группы появляется второй электрон на дэ-подуровне.

К этим элементам относятся: титан, цирконий, гафний. Для этих элементов в соединениях характерны степени окисления: плюс два, плюс три и плюс четыре.
К пятой B группе относятся ванадий, ниобий, тантал.

У них на дэ-подуровне появляется третий электрон, поэтому для них характерны такие степени окисления, как плюс два, плюс три, плюс четыре, плюс пять.
К элементам шестой B группы относятся хром, молибдэн, вольфрам.

У них на дэ-подуровне должно быть по четыре электрона, но у хрома и молибдэна наблюдается такое явление, как «проскок электрона», потому что энергетически более выгодно, когда орбитали наполовину или полностью заполнены. Именно поэтому, у хрома и молибдэна по пять электронов на дэ-подуровне. Для этих элементов возможны степени окисления: плюс два, плюс три, плюс шесть.
Марганец, технеций, рений являются элементами седьмой B группы.

Из них наиболее распространён марганец, а технеций и рений являются редкими элементами. У них на дэ-подуровне по пять электронов, поэтому для них возможны степени окисления: плюс два, плюс три, плюс четыре, плюс шесть, плюс семь.
Восьмая B группа состоит из триады железа – железа, кобальта, никеля и все последующие триады – это платиновые металлы.

На дэ-подуровне у этих элементов от 6 до 8 электронов, поэтому в соединениях для них возможны следующие степени окисления: плюс два, плюс три, плюс четыре, плюс шесть, плюс восемь.
Свойства железа, кобальта и никеля будут очень похожи, а также схожи свойства и у платиновых металлов. Для никеля наиболее характерна степень окисления плюс два, плюс три – для железа и кобальта, плюс четыре – для платины, плюс шесть – для родия и иридия, а плюс восемь – только для осмия.
У элементов первой B группы появляется ещё один электрон.

К этим элементам относятся: медь, серебро, золото. Для элементов этой группы возможны степени окисления плюс один, плюс два, плюс три.
У элементов второй B группы дэ-подуровень полностью заполнен.

Это такие элементы, как цинк, кадмий, ртуть. Для них возможны степени окисления плюс один и плюс два.
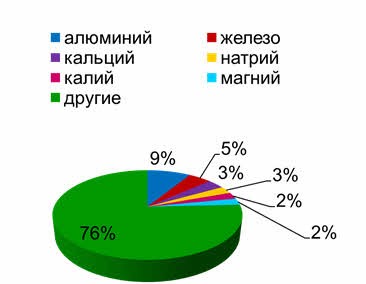
Среди дэ-элементов наиболее распространённым является железо, он занимает четвёртое место после кислорода, кремния и алюминия.

Среди соединений железа наиболее распространены магнетит, или магнитный железняк, гематит, или кровавник, лимонит, пирротин, пирит, сидерит.

Широко распространён такой металл, как титан. Известно около семидесяти минералов титана, к наиболее распространённым относятся ильменит, или титанистый железняк, рутил, анатаз.

Содержание марганца в земной коре составляет одну десятую процента по массе. К наиболее распространённым соединениям марганца относятся: пиролюзит, марганцевая обманка, марганцевый колчедан, родохрозит, или малиновый шпат.

У хрома тоже есть свои минералы. Например, хромистый железняк, или хромит и другие.

У цинка наиболее распространённым соединением является цинковая обманка, или сфалерит. Медь встречается как в самородном состоянии, так и в виде соединений. Таких как медный колчедан, халькозин, или медный блеск.

Наиболее распространёнными соединениями кобальта являются каролит, линнеит, кобальтин.

У молибдэна известно около двадцати минералов, наиболее известные это: молибдэнит, повеллит и др.

А вот вольфрамовые минералы обычно вкраплены в гранитные породы и содержание вольфрама там от одного до двух прооцентов.

Элементы, которые не способны концентрироваться в земной коре и которые не образуют собственных минералов, называются рассеянными. К ним относятся гафний, рений, кадмий, лантаноиды.
Ртуть встречается в природе в большинстве сульфидных минералов. Наибольшее промышленное значение имеет киноварь.

Серебро, как и золото, в основном встречаются в самородном состоянии.

Платиновые металлы встречаются в природе в рассеянном состоянии. Платина, иридий, палладий встречаются как в самородном состоянии, так и в составе интэрметаллидов.
Самым редким дэ-элементом на Земле является технеций, он встречается в урановых рудах.
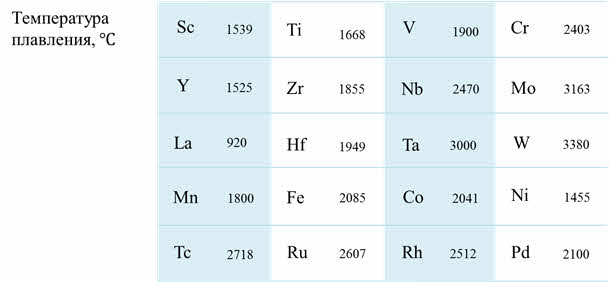
Если сравнивать физические свойства дэ-элементов, то можно заметить следующую закономерность: по периоду слева направо от скандия до хрома температура плавления увеличивается, у марганца температура плавления понижается, и в ряду от марганца до цинка идёт последовательное уменьшение температуры плавления.
По группе сверху вниз также увеличиваются температуры плавления, самым тугоплавким металлом, как известно, является вольфрам.

Плотность от скандия к ванадию увеличиваются, вниз по группе сверху вниз плотность также увеличивается, тяжелыми являются вольфрам, золото, платина, а самым тяжёлым является осмий.

В образовании химической связи могут участвовать электроны эс, пэ, дэ-орбиталей. Но на внешнем энергетическом уровне небольшое число электронов, поэтому в химических реакциях они отдают электроны. Таким образом, все дэ-элементы являются металлами.
Изменение физических свойств d-элементов
Из-за большого числа валентных электронов все дэ-элементы проявляют переменные степени окисления. В отличие от элементов главных подгрупп, устойчивость соединений дэ-элементов в высшей степени окисления возрастает вниз по группе. В отличие от эс- и пэ-элементов для дэ–элементов характерен более широкий набор степеней окисления их атомов в соединениях.
Например, для скандия: плюс три, для титана – плюс три и плюс четыре, для ванадия – плюс два, плюс три, плюс четыре и плюс пять, для хрома – плюс два, плюс три и плюс шесть, для марганца – плюс два, плюс три, плюс четыре, плюс шесть и плюс семь, для железа – плюс два, плюс три, плюс шесть, для кобальта – плюс два и плюс три, для никеля – плюс два, плюс три, для меди – плюс один, плюс два, для цинка – плюс два.

У каждого дэ-металла есть соединения с различными кислотно-основными свойствами. Например, соединения хрома в степени окисления плюс два проявляют основные свойства, в степени окисления плюс три – амфотэрные, а в степени окисления плюс шесть – кислотные.
Так как у дэ-элементов идёт заполнение предвнешних орбиталей, то это приводит к близости химических свойств у ряда элементов, их ещё называют элементами-близнецами. Это от циркония до гафния, от ниобия до тантала, от молибдэна до вольфрама.
Ещё большее сходство обнаруживается у эф-элементов – лантаноидов и актиноидов.
Таким образом, к дэ-элементам относятся 32 элемента периодической системы от четвёртого до седьмого периодов. В третьей-бэ-группе у атомов появляется первый электрон на дэ-орбитали, в последующих бэ-группах дэ-подуровень заполняется до 10 электронов.
С увеличением порядкового номера свойства дэ-элементов изменяются незначительно. У дэ-элементов медленно происходит возрастание атомного радиуса, также они имеют переменную валентность, связанную с незавершенностью предвнешнего дэ-электронного подуровня.
В низших степенях окисления дэ-элементы обнаруживают металлические свойства, при увеличении порядкового номера в бэ группах они уменьшаются.
В растворах дэ-элементы с высшей степенью окисления обнаруживают кислотные и окислительные свойства, при низших степенях окисления – наоборот. Элементы с промежуточной степенью окисления проявляют амфотэрные свойства.
У химических элементов бэ-групп валентными являются электроны как внешнего, так и предвнешнего и даже третьего снаружи уровня, как у эф-элементов. Если у атомов эс-, пэ-элементов увеличение на единицу заряда ядра приводит к добавлению одного электрона на внешний энергетический уровень, то в атомах элементов бэ-групп электроны добавляются не на внешний уровень, а на предвнешний или третий снаружи уровень.
Нужна помощь! Пожалуйста объясните, что такое металлические и неметаллические свойства.
Закономерности, связанные с металлическими и неметаллическими свойствами элементов.
1. При перемещении СПРАВА НАЛЕВО вдоль ПЕРИОДА МЕТАЛЛИЧЕСКИЕ свойства р-элементов УСИЛИВАЮТСЯ. В обратном направлении - возрастают неметаллические.
Это объясняется тем, что правее находятся элементы, электронные оболочки которых ближе к октету. Элементы в правой части периода менее склонны отдавать свои электроны для образования металлической связи и вообще в химических реакциях.
Например, углерод - более выраженный неметалл, чем его сосед по периоду бор, а азот обладает еще более яркими неметаллическими свойствами, чем углерод.
Слева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача.
Наоборот, s-элементы в левой части таблицы имеют мало электронов на внешней оболочке и меньший заряд ядра, что способствует образованию именно металлической связи. За понятным исключением водорода и гелия (их оболочки близки к завершению или завершены!) , все s-элементы являются металлами; p-элементы могут быть как металлами, так и неметаллами, в зависимости от того - в левой или правой части таблицы они находятся.
У d- и f-элементов, как мы знаем, есть "резервные" электроны из "предпоследних" оболочек, которые усложняют простую картину, характерную для s- и p-элементов. В целом d- и f-элементы гораздо охотнее проявляют металлические свойства.
Подавляющее число элементов является металлами и только 22 элемента относят к неметаллам: H, B, C, Si, N, P, As, O, S, Se, Te, а также все галогены и инертные газы.
Некоторые элементы в связи с тем, что они могут проявлять лишь слабые металлические свойства, относят к полуметаллам.
Что такое полуметаллы? Если выбрать из Периодической таблицы p-элементы и записать их в отдельный "блок" (это сделано в “длинной” форме таблицы) , то обнаружится закономерность. Левая нижняя часть блока содержит типичные металлы, правая верхняя - типичные неметаллы. Элементы, занимающие места на границе между металлами и неметаллами, называются полуметаллами.
Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности) . Валентных электронов у них либо недостаточно для образования полноценной "октетной" ковалентной связи (как в боре) , либо они не удерживаются достаточно прочно (как в тeллуре или полонии) из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер.
Некоторые полуметаллы (кремний, германий) являются полупроводниками. Полупроводниковые свойства этих элементов объясняются многими сложными причинами, но одна из них - существенно меньшая (хотя и не нулевая) электропроводность, объясняемая слабой металлической связью. Роль полупроводников в электронной технике чрезвычайно важна.
2. При перемещении СВЕРХУ ВНИЗ вдоль групп УСИЛИВАЮТСЯ МЕТАЛЛИЧЕСКИЕ свойства элементов. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра. Они отделены от ядра более толстой "шубой" из нижних электронных оболочек и электроны внешних уровней удерживаются слабее.
Лекция 15. Общая характеристика d-элементов периодической системы Д.И. Менделеева (2 часа)
1. Особенности d-элементов по сравнению с элементами главных подгрупп.
2. Элементы подгруппы марганца.
3. Элементы подгруппы хрома.
4. Макро- и микроэлементы в земледелии.
15.1 Особенности d-элементов по сравнению с элементами главных подгрупп.
Всего известно 35 d-элементов, из них 30 есть в земной коре, а 5 искусственные и радиоактивные. Все эти элементы называют переходными металлами
d-элементы расположены в периодической системе в больших периодах между s- и p-элементами. Характерной особенностью переходных элементов является то, что в их атомах заполняются орбитали не внешнего слоя, а предвнешнего слоя. У d-элементов валентными являются энергетически близкие девять орбиталей – одна ns-орбиталь, три np-орбитали и пять (n-1) d-орбиталей.
Во внешнем слое у атомов d-элементов находятся 1 – 2 электрона. Остальные валентные электроны расположены в (n-1) d-состоянии, т. е. в предвнешнем слое.
Подобное строение электронных оболочек атомов определяет ряд общих свойств d-элементов:
1. все d-элементы – металлы, отличающиеся от s-металлов меньшей восстановительной способностью и иногда химической инертностью;
2. для большинства d-элементов характерно проявление нескольких степеней окисления, сравнимых по термодинамической устойчивости в обычных условиях. Это значит, что для них характерно большое число окислительно-восстановительных реакций;
3. многие d-элементы в высших степенях окисления проявляют кислотные свойства, в промежуточных амфотерные, а в низших основные;
4. d-элементы способны образовывать разнообразные комплексные соединения;
5. в отличие от соединений s-металлов большинство соединения d-элементов имеют характерные окраски.
15.2 Элементы подгруппы марганца.
В состав этой подгруппы входят марганец Mn, технеций Tc и рений Re.
Валентные орбитали ns 2 (n-1)d 5
Оксид и гидроксид марганца(II) - MnO (серо-зеленые кристаллы) и Mn(OH)2 (осадок телесного цвета) обладают основными свойствами. Оксид марганца (III) Mn2O3 (бурые кристаллы) тоже основной. Ему соответствует гидроксид Mn(OH)3 (черно-коричневого цвета).
Оксид и гидроксид марганца(IV) – MnO2 (черные кристаллы) и Mn(OH)4 – амфотерны, со слабо выраженными основными и кислотными свойствами.
Оксид марганца (VI) MnO3 и, соответствующая ему марганцовистая кислота H2MnO4, в свободном состоянии не получены. Соли этой кислоты (манганаты) в водных раствора окрашены в зеленый цвет.
Mn2O7 (зеленовато-бурая маслянистая жидкость) и HMnO4 (известна только в водных растворах и относится к сильным кислотам) это кислотные соединения. Ангидрид, кислота и ее соли пермаганаты - сильные окислители. Соединения марганца(IV) проявляют окислительно-восстановительную двойственность, а соединения марганца(II) – восстановители.
Элементы подгуппы марганца образуют комплексные соединения: K2[Mn(OH)6], Na2[ReF8], [Mn2(CO)10].
Марганец входит в состав многих металлоферментов растений и животных, без которых не может работать цикл Кребса. Это один из важнейших биохимических циклов любой живой клетки, вырабатывающий энергию и запасащий её в аденозинтрифосфате (АТФ). В качестве марганцевого микроудобрения используют MnSO4 ×H2O.
15.3 Элементы подгруппы хрома.
Шестую побочную подгруппу образуют металлы: хром Cr, молибден Mo, вольфрам W. Валентные орбитали ns 1 (n-1)d 5 .
Степени окисления у хрома +2, +3, +6, 0.
В степени окисления +2 хром образует CrO и Cr(OH)2 основного характера, крайне неустойчивые соединения – сильные восстановители. Самая устойчивая степень окисления для хрома +3. Оксид хрома Cr2O3 и гидроксид Cr(OH)3 – амфотерны. Эти соединения под действием сильных окислителей проявляют восстановительные свойства.
Соединения хрома(VI) – CrO3 и его гидратные формы H2Cr2O7 – дихромовая кислота и H2CrO4 - хромовая кислота проявляют кислотные свойства. Обе кислоты существуют в водном растворе и, при попытке выделить их из раствора, распадаются на хромовый ангидрид и воду. Устойчивы их соли – дихроматы и хроматы. Хроматы устойчивы в щелочной, а дихроматы в кислой среде.
Соединения хрома(VI) являются сильными окислителями.
Для молибдена и вольфрама наиболее характерна степень окисления +6, поэтому их соединения устойчивы, проявляют кислотные свойства (менее выраженные по сравнению с соединениями хрома) и не проявляют окислительных свойств.
Для хрома, молибдена и вольфрама характерно образование комплексных соединений: K3[Сr(OH)6], [Cr(H2O)6]Cl3, H2[WF8], K2[MoCl8] и т.д.
Как микроэлемент хром изучен недостаточно, но его биогенная роль не вызывает сомнений. Он входит в состав некоторых ферментов, осуществляющих окислительно-восстановительные реакции в клетках. Хром входит в состав пепсина, расщепляющего белки в пищеварительном тракте животных, участвуют в регуляции усвоения глюкозы тканями животных.
15.4 Макро- и микроэлементы в земледелии.
Макроэлементы это биогенные элементы, необходимые для нормального функционирования клетки. К ним относятся O, H, N, C. Фосфор и калий не входят в их число, но играют очень важную роль в нормальной жизнедеятельности растительных и животных организмов. Азотные, калийные и фосфорные удобрения необходимо вносить в почву центнерами на гектар, так как азот, фосфор и калий это не восполняемые элементы и то количество, которое есть в природе, не может удовлетворить потребности сельского хозяйства. Кислород, водород, углерод, азот, фосфор и калий получили названия макроэлементов, поскольку они в больших количествах входят в состав живых организмов, а удобрения, в которые они входят, получили названия макроудобрений.
Металлы, которые необходимы для всех живых организмов и содержание которых не превышает 10 -5 %, называют микроэлементами. К микроэлементам относят Mn, Co, Ni, Zn, Mo и в меньшей мере V и Cr. К микроэлементам относится бор.
Металлы-микроэлементы должны обладать определенными свойствами: они должны быть достаточно распространенными и достаточно рассеянными, т.е. быть доступными для усвоения из почв; они должны обладать изменчивостью химических свойств т.е. образовывать комплексы с различными лигандами, иметь различные степени окисления и легко переходить из одной степени окисления в другую. Этими свойствами в полной мере обладают d-элементы. Эти свойства позволяют микроэлементам активизировать ферменты. Микроэлементы подходят к ферментам как ключ к замку. Они комплементарныферментам.
Микроэлементы входят в состав микроудобрений (соли d-элементов), которые вносят в почву килограммами на гектар. Например: кобальт вносят в почву в виде соли CoSO4 ×7H2O и CoCl2 ×6H2O; медь в виде CuSO4 ×5H2O; цинк в виде ZnSO4 ×7H2O; молибден в виде раствора молибдата аммония (NH4)2MoO4.
Роль кобальта: образует каталитически активные центры многих ферментов, необходимые для синтеза ДНК и метаболизма аминокислот.
Роль никеля: стимулирует синтез аминокислот в клетке, ускоряет регенерацию белков плазмы крови, нормализует содержание гемоглобина у больных.
Роль меди: медь входит в состав голубых белков, которые являются переносчиками и хранителями запасов молекулярного кислорода. В растительных организмах усиливает фотосинтез и углеводный обмен.
Роль цинка: известно более ста цинксодержащих ферментов, без которых не возможен гидролиз белков, полисахаридов, липидов, эфиров фосфорной кислоты, АТФ и других биологически важных органических веществ любой клетки.
Молибден – один из важнейших микроэлементов. Он входит во многие ферменты, осуществляющие окислительно-восстановительные превращения в клетке. При недостатке молибдена в почве растения не плодоносят и погибают в результате разнообразных заболеваний.
Лекция 16. Предмет аналитической химии. Качественный и количественный анализ. Аналитический сигнал. Химические, физические и физико-химические методы анализа(самостоятельно)
1. Предмет аналитической химии. Качественный и количественный анализ.
2. Аналитический сигнал. Методы анализа в аналитической химии (химические, физические и физико-химические).
Читайте также:
