Почему литий располагается в начале ряда напряжений металлов
Обновлено: 20.09.2024
Электрохимический ряд активности (ряд напряжений, ряд стандартных электродных потенциалов) металлов — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ 0 , отвечающих полуреакции восстановления катиона металла Me n+ : Me n+ + nē → Me
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительные реакциях в водных растворах.
Содержание
История
Последовательность расположения металлов в порядке изменения их химической активности в общих чертах была известна уже алхимикам [1] . Процессы взаимного вытеснения металлов из растворов и их поверхностное осаждение (например, вытеснение серебра и меди из растворов их солей железом) рассматривались как проявление трансмутации элементов.
Поздние алхимики вплотную подошли к пониманию химической стороны взаимного осаждения металлов из их растворов. Так, Ангелус Сала в работе «Anatomia Vitrioli» (1613) пришёл к выводу, что продукты химических реакций состоят из тех же «компонентов», которые содержались в исходных веществах. Впоследствии Роберт Бойль предложил гипотезу о причинах, по которым один металл вытесняет другой из раствора на основе корпускулярных представлений [2] .
В 1793 году Алессандро Вольта, конструируя гальванический элемент («Вольтов столб»), установил относительную активность известных тогда металлов: Zn, Pb, Sn, Fe, Cu, Ag, Au. «Сила» гальванического элемента оказывалась тем больше, чем дальше стояли друг от друга металлы в этом ряду («ряд напряжений»). Однако Вольта не связал этот ряд с химическими свойствами металлов.
В 1798 году Иоганн Вильгельм Риттер указал, что ряд Вольта эквивалентен ряду окисления металлов (т. е. последовательности уменьшения их сродства с кислородом). Таким образом, Риттер высказал гипотезу о возникновении электрического тока вследствие протекания химической реакции [3] .
В эпоху становления классической химии способность элементов вытеснять друг друга из соединений стала важным аспектом понимания реакционной способности. Й. Берцелиус на основе электрохимической теории сродства построил классификацию элементов, разделив их на «металлоиды» (сейчас применяется термин «неметаллы») и «металлы» и поставив между ними водород.
Не отрицая значительных заслуг Бекетова в становлении современных представлений об ряде активности металлов, следует считать ошибочным бытующее в отечественной популярной и учебной литературе представление о нём как единственном создателе этого ряда. [5] [6] .
Многочисленные экспериментальные данные, полученные в конце XIX века, опровергали гипотезу Бекетова. Так, Уильям Одлинг описал множество случаев «обращения активности». Например, медь вытесняет олово из концентрированного подкисленного раствора SnCl2 и свинец — из кислого раствора PbCl2; она же способна к растворению в концентрированной соляной кислоте с выделением водорода. Медь, олово и свинец находятся в ряду правее кадмия, однако могут вытеснять его из кипящего слабо подкисленного раствора CdCl2.
Бурное развитие теоретической и экспериментальной физической химии указывало на иную причину различий химической активности металлов. С развитием современных представлений электрохимии (главным образом в работах Вальтера Нернста) стало ясно, что эта последовательность соответствует «ряду напряжений» – расположению металлов по значению стандартных электродных потенциалов. Таким образом, вместо качественной характеристики — «склонности» металла и его иона к тем или иным реакциям — Нерст ввёл точную количественную величину, характеризующую способность каждого металла переходить в раствор в виде ионов, а также восстанавливаться из ионов до металла на электроде, а соответствующий ряд получил название ряда стандартных электродных потенциалов.
Теоретические основы
Значения электрохимических потенциалов являются функцией многих переменных и поэтому обнаруживают сложную зависимость от положения металлов в периодической системе. Так, окислительный потенциал катионов растёт с увеличением энергии атомизации металла, с увеличением суммарного потенциала ионизации его атомов и с уменьшением энергии гидратации его катионов.
В самом общем виде ясно, что металлы, находящиеся в начале периодов характеризуются низкими значениями электрохимических потенциалов и занимают места в левой части ряда напряжений. При этом чередование (щелочных и щёлочноземельных металлов отражает явление диагонального сходства. Металлы, расположенные ближе к серединам периодов, характеризуются большими значениями потенциалов и занимают места в правой половине ряда. Последовательное увеличение электрохимического потенциала (от −3,395 В у пары Eu 2+ /Eu [источник не указан 228 дней] до +1,691 В у пары Au + /Au) отражает уменьшение восстановительной активности металлов (свойство отдавать электроны) и усиление окислительной способности их катионов (свойство присоединять электроны). Таким образом, самым сильным восстановителем является металлический европий, а самым сильным окислителем — катионы золота Au + .
В ряд напряжений традиционно включается водород, поскольку практическое измерение электрохимических потенциалов металлов производится с использованием стандартного водородного электрода.
Практическое использование ряда напряжений
Ряд напряжений используется на практике для сравнительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе:
Литий химический элемент

Элемент литий № 3, названный литием (от греческого Агхо — камень), открыт в 1817 г. Шведский химик И.А. Арфведсон, ученик знаменитого Берцелиуса, анализировал минерал, найденный в железном руднике Уто. Он быстро установил, что этот минерал — типичный алюмосиликат, и выяснил, сколько в нем кремния, алюминия и кислорода — на долю этих трех распространеннейших элементов приходилось 96% веса минерала.
Теперь оставалось выяснить химическую природу веществ, составляющих оставшиеся 4%. Эти вещества, будучи отделенными от Si, Al и O2 и растворенными в воде, придавали раствору щелочные свойства.
На этом основании Арфведсон предположил, что в минерале есть некий щелочной металл. Одна из солей этого металла растворялась в воде в шесть раз лучше, чем аналогичные соли калия и натрия. А поскольку в то время были известны лишь два щелочных металла, Арфведсон решил, что открыл новый элемент, подобный натрию и калию.
С виду минерал, в котором нашли новый элемент, был камень как камень, и потому Берцелиус предложил Арфведсону назвать новый элемент литием. Тот, видимо, не стал спорить, ибо это название сохранилось до наших дней. В большинстве европейских языков, как и в латыни, элемент № 3 называется Lithium.
На этом история элемента № 3 не заканчивается. Это очень своеобразный элемент, и не только потому, что литий — первый среди металлов по легкости и удельной теплоемкости, а также по положению в ряду напряжений металлов. Говорить о том, что история лития продолжается, можно хотя бы потому, что некоторые соединения лития, да и сам металл в последнее время приобрели исключительную важность для судеб всего мира.
Поэтому слово «история» в подзаголовках этой статьи нам кажется оправданным.
Как открыли литий
Иоганн Август Арфведсон (1792—1841) — шведский химик, первооткрыватель лития. В 1817 г., занимаясь анализом минерала петалита LiAl(Si4O10), ученый обнаружил присутствие в минерале «огнепостоянной щелочи до с их пор неизвестной природы». Берцелиус предложил назвать ее литионом, поскольку это была первая щелочь, найденная в «царстве минералов». Отсюда и произошло название литий
Когда-то давным-давно, в доисторические времена, происходил синтез элементов Вселенной. Несколько позже, но тоже в неопределенно далеком прошлом шли процессы формирования нашей планеты. На этой стадии литий проник более чем в 150 минералов, из них около 30 стали собственными минералами лития. Промышленное значение приобрели только пять: сподумен LiAl[Si2O6], лепидолит KLi15Al15[Si3AlO10] (F, ОН)2, петалит — минерал, в котором литий обнаружен впервые, LiAl[Si4O10], амблигонит LiAl[PO4] (F, ОН) и циннвальдит KLi (Fe, Mg)Al • [Si3Al10] (F, ОН)2.
Географически промышленные запасы элемента № 3 распределились довольно равномерно: промышленные месторождения минералов лития есть на всех континентах. Важнейшие из них находятся в Канаде, США, СССР, Испании, Швеции, Бразилии, Австралии, а также в странах Южной Африки.
Слово «древняя» здесь употребляется весьма условно — речь пойдет о временах, не столь отдаленных.
Человечество знакомо с литием чуть больше полутора веков, и этот раздел нашего рассказа охватит годы с 1817 по 1920. Это время познания лития как химического индивидуума, время получения и исследования его многих соединений и не очень широкого применения некоторых из них.
Вскоре после открытия Арфведсона новым элементом заинтересовались многие химики. В 1818 г. немецкий химик Л. Гмелин установил, что соли лития окрашивают бесцветное пламя в карминовокрасный цвет. Вскоре сам Арфведсон обнаружил литий в сподумене, позже ставшем важнейшим минералом элемента № 3, и в лепидолите. В 1825 г. Йенс Якоб Берцелиус нашел литий в водах германских минеральных источников. Вскоре выяснилось, что этот элемент есть и в морской воде (710-6%).
Металлический литий впервые получил выдающийся английский ученый Хэмфри Дэви в 1818 г. Тогда и выяснилось, что литий очень легок, почти вдвое легче воды, и что он обладает ярким металлическим блеском. Но этот блеск серебристо-белого лития можно увидеть только в том случае, если металл получают в вакууме: как и все щелочные металлы, литий быстро окисляется кислородом воздуха и превращается в окись — бесцветные кристаллы кубической формы. Li2O легко, но менее энергично, чем окислы других щелочных металлов, соединяется с водой, превращаясь в щелочь — LiOH. И эти кристаллы бесцветны. В воде гидроокись лития растворяется хуже, чем гидроокиси калия и натрия. Как бесцветные кристаллы, выглядят и литиевые соли галогеноводородных кислот.
Иодид, бромид и хлорид лития весьма гигроскопичны, расплываются на воздухе и очень хорошо растворяются в воде. Фторид лития, в отличие от них, в воде растворяется очень слабо и практически совсем не растворяется в органических растворителях. Еще в прошлом веке это вещество начали применять в металлургии как компонент многих флюсов.
В значительных количествах металлический литий первыми получили в 1855 г. (независимо друг от друга) немецкий химик Р. Бунзен и англичанин О. Матиссен. Как и Дэви, они получали литий электролизом, только электролитом в их опытах служил расплав не гидроокиси, а хлорида лития. Этот способ до сих пор остается главным промышленным способом получения элемента № 3. Правда, теперь в электролитическую ванну помещают смесь LiCl и KCl и подбирают такие характеристики тока, чтобы на катоде осаждался только литий. Выделяющийся на аноде хлор — ценный побочный продукт.
Есть и другие способы получения металлического лития, но всерьез конкурировать с электролитическим они пока не могут.
Еще в XIX в. были получены соединения лития с почти всеми элементами периодической системы и с некоторыми органическими веществами. Но практическое применение нашли лишь немногие из них. В 1912—1913 гг. мировое производство лития и его соединений не превышало 40 — 50 т.
В 1919 г. вышла брошюра В.С. Сырокомского «Применение редких элементов в промышленности». Есть в ней, в частности, и такие строки: «Главнейшее применение литий находит в данный момент в медицине, где углекислый и салициловокислый литий служат средством для растворения мочевой кислоты, выделяющейся в организме человека при подагре и некоторых других болезнях. »
Литий в средних веках
«Средние века» истории лития — это всего три десятилетия, 20, 30, 40-е годы нашего века. В эти годы литий и его соединения пришли во многие отрасли промышленности, в первую очередь в металлургию, в органический синтез, в производство силикатов и аккумуляторов.
Литий имеет сродство к кислороду, водороду, азоту. Последнее особенно важно, так как ни один элемент не реагирует с азотом так активно, как литий. Эта реакция, хотя и медленно, идет уже при комнатной температуре, а при 250°С ход ее значительно ускоряется. Литий стал эффективным средством для удаления из расплавленных металлов растворенных в них газов. Небольшими добавками лития легируют чугун, бронзы, монель-металл*2*, а также сплавы на основе магния, алюминия, цинка, свинца и некоторых других металлов.
Установлено, что литий в принципе улучшает и свойства сталей — уменьшает размеры «зерен», повышает прочность, но трудности введения этой добавки (литий практически нерастворим в железе и к тому же он закипает при температуре 1317°С) помешали широкому внедрению лития в производство легированных сталей.
Соединения лития нужны и в силикатной промышленности. Они делают стеклянную массу более вязкой, что упрощает технологию, и, кроме того, придают стеклу большую прочность и сопротивляемость атмосферной коррозии. Такие стекла, в отличие от обычных, частично пропускают ультрафиолетовые лучи, поэтому их применяют в телевизионной технике. А в производстве оптических приборов довольно широко стали использовать кристаллы фтористого лития, прозрачные для ультракоротких волн длиной до 1000 А.
В химической промышленности стали применять металлический литий и литийорганические соединения. В частности, мелкодисперсный элементный литий намного ускоряет реакцию полимеризации изопрена, а бутиллитий — дивинила.
По химическим свойствам литий напоминает не только (и не столько) другие щелочные металлы, но и магний. Литийорганические соединения применяют там же, где и магнийорганические (в реакциях Гриньяра), но соединения элемента № 3 — более активные реагенты, чем соответствующие гриньяровские реактивы.
В годы второй мировой войны стало стратегическим материалом одно соединение лития, известное еще в прошлом веке. Речь идет о гидриде лития — бесцветных кристаллах, приобретающих при хранении голубоватую окраску.
Из всех гидридов щелочных и щелочноземельных металлов гидрид лития — самое устойчивое соединение. Однако, как и прочие гидриды, LiH бурно реагирует с водой. При этом образуются гидроокись лития и газообразный водород. Это соединение стало служить легким (оно действительно очень легкое — плотность 0,776) и портативным источником водорода — для заполнения аэростатов и спасательного снаряжения при авариях самолетов и судов в открытом море. Из килограмма гидрида лития получается 2,8 м 3 водорода.
Примерно в то же время стал быстро расти спрос еще на одно соединение элемента № 3 — его гидроокись. Как оказалось, добавка этого вещества к электролиту щелочных аккумуляторов примерно на одну пятую увеличивает их емкость и в 2 — 3 раза — срок службы.
К началу второй мировой войны производство литиевых концентратов в капиталистических странах достигло 3 тыс. т. Для такого рассеянного элемента, как литий, это много. Но эта же цифра покажется весьма скромной, если сравнить ее с данными 1978 года: более 25 000 т в пересчете на Li2CO3. Этот бурный рост объясняется прежде всего тем, что во второй половине XX века литий стал «атомным» металлом и, если можно так выразиться, разносторонне атомным.
К этому времени уже во многих странах работали ядерные реакторы или, как их тогда называли, атомные котлы. Конструкторов этих котлов по многим причинам не устраивала вода, которую приходилось применять в качестве теплоносителя.
Появились реакторы, в которых избыточное тепло отводилось расплавленными металлами, в первую очередь натрием и калием.
Но по сравнению с этими металлами у лития много преимуществ. Во-первых, он легче. Во-вторых, у него больше теплоемкость. В-третьих, меньше вязкость. В-четвертых, диапазон жидкого состояния — разница между температурами плавления и кипения — у лития значительно шире. Наконец, в-пятых, коррозионная активность лития намного меньше, чем натрия и калия.
Одних этих преимуществ было бы вполне достаточно для того, чтобы сделать литий «атомным» элементом. Но оказалось, что ему суждено стать одним из незаменимых участников реакции термоядерного синтеза.
. Пожалуй, строительство завода по разделению изотопов лития — единственный в своем роде факт из истории американского предпринимательства. Контракт на строительство этого завода заключил банкрот, и тем не менее строительство велось буквально в бешеном темпе. Банкротом был не кто иной, как Комиссия по атомной энергии. Средства, отпущенные на создание «сверхбомбы», были израсходованы полностью, но ничего реального у физиков не получалось. Было это в июле 1951 г. А о том, что при реакции соединения ядер тяжелых изотопов водорода — дейтерия и трития — должна высвободиться энергия, во много раз большая, чем при распаде ядер урана, знали намного раньше. Но на пути этого превращения лежало одно неразрешимое, казалось, противоречие.
Для того чтобы смогли слиться ядра дейтерия и трития, нужна температура порядка 50 млн. градусов. Но для того чтобы реакция пошла, нужно еще, чтобы атомы столкнулись. Вероятность такого столкновения (и последующего слияния) тем больше, чем плотнее «упакованы» атомы в веществе. Расчеты показали, что это возможно только в том случае, если вещество находится хотя бы в жидком состоянии. А изотопы водорода становятся жидкостями лишь при температурах, близких к абсолютному нулю.
Итак, с одной стороны, необходимы сверхвысокие температуры, а с другой — сверхнизкие. И это — в одном и том же веществе, в одном и том же физическом теле!
Водородная бомба стала возможной только благодаря разновидности гидрида лития — дейтериду лития-6. Это соединение тяжелого изотопа водорода — дейтерия и изотопа лития с массовым числом 6.
Дейтерид лития-6 важен по двум причинам: он — твердое вещество и позволяет хранить «сконцентрированный» дейтерий при плюсовых температурах, и, кроме того, второй его компонент — литий-6 — это сырье для получения самого дефицитного изотопа водорода — трития. Собственно, 6Li — единственный промышленный источник получения трития:
63Li + 10n -+ 31H + 42He.Нейтроны, необходимые для этой ядерной реакции, дает взрыв атомного «капсюля» водородной бомбы, он же создает условия (температуру порядка 50 млн. градусов) для реакции термоядерного синтеза.
В США идею использовать дейтерид лития-6 первым предложил доктор Э. Теллер. Но, по-видимому, советские ученые пришли к этой идее раньше: ведь не случайно первая термоядерная бомба в Советском Союзе была взорвана почти на полгода раньше, чем в США, и тем самым был положен конец американской политике ядерного и термоядерного шантажа.
Для атомной техники важно еще одно моноизотопное соединение лития — 7LiF. Ono применяется для растворения соединений урана и тория непосредственно в реакторах.
Кстати, как теплоноситель в реакторах применяется именно лптий-7, имеющий малое сечение захвата тепловых нейтронов, а не природная смесь изотопов элемента № 3.
Вот уже много лет ученые во всем мире работают над проблемой управляемого, мирного термоядерного синтеза, и рано или поздно эта проблема будет решена. Тогда «демилитаризуется» и литий. (Этот странный оборот — производное заголовка зарубежной статьи, попавшейся несколько лет назад на глаза одному из авторов этого рассказа: статья называлась «Литий милитаризуется».) Но независимо от того, как скоро это произойдет, бесспорна справедливость другого высказывания.
Оно заимствовано нами из «Краткой химической энциклопедии»:
Ряд активности металлов

Химия
Что же из себя представляет ряд активности металлов давайте разбираться. Металлы — группа химических элементов, обладающих сходными свойствами. Среди них — электропроводность, пластичность, температурная зависимость сопротивления. По виду металлы можно отличить по характерному блеску, который так и назвали — металлический. Но химические свойства элементов отличаются в зависимости от строения их молекул и кристаллической решетки. Особенно ярко отличия проявляются по отношению взаимодействия с кислотами и щелочами. Всего на данный момент насчитывается 96 металлов. Общие свойства металлов показаны в таблице:
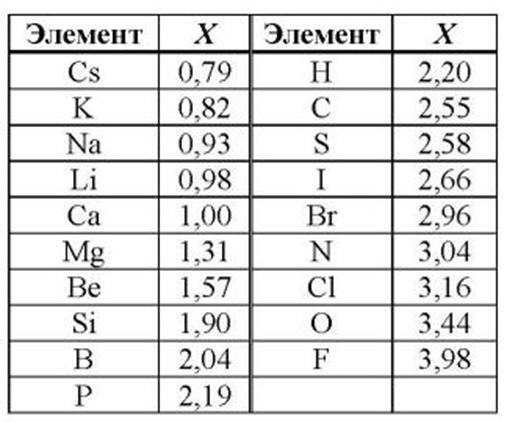
Все металлы в той или иной степени являются восстановителями, то есть, отдают электроны при течении окислительно-восстановительных реакций. Таблица электроотрицательности металлов показывает, какой металл является наиболее активным восстановителем. Если цифра напротив элемента больше 2, то это окислитель с характерными свойствами и выходит из ряда металлов, проявляя типичные свойства неметалла.
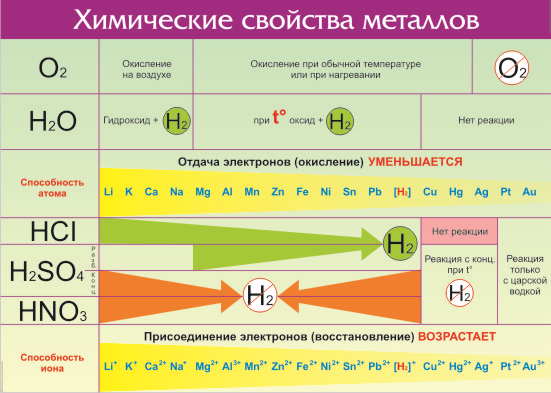
Электрохимический ряд активности металлов показывает, какие из металлов более активные, какие менее. Расположение элементов в горизонтальном ряду слева направо показывает направление снижения восстановительной способности и возрастание окислительной.
Восстановительная способность — свойство отдавать электроны в химических реакциях с водными растворами солей и щелочей.
Окислительная способность — свойство присоединять электроны в реакциях с теми же веществами.

Металлы в правой стороне более слабые восстановители, они вытесняются при реакциях с солевыми растворами металлами, расположенными левее. Пример реакции — Zn + Cu 2+ → Zn 2+ + Cu, которая протекает только в одном направлении. Цинк вытесняет медь, реагируя с водным раствором любой соли меди. Цинковая пластинка, при этом, растворяется, а медная восстанавливается.
Такую последовательность элементов еще называют ряд напряженности металлов, или ряд Бекетова. На всех вариантах записи ряда можно заметить, что последовательность металлов разделена знаком водорода (гидрогена), который металлом никак не является. Это своеобразный маркер, показывающий, что стоящие левее металлы вытесняют водород из водных растворов кислот, не обладающих окислительными свойствами. Некоторые металлы, например, литий, кальций, барий и остальные, стоящи до алюминия, вытесняют водород и при реакции с водой.
2Al +3H2SO4 = Al2(SO4)3 + 3H2↑
Fe + 2HCl = FeCl2 + H2↑
Стоящие правее знака водорода металлы с кислотами-неокислителями не взаимодействуют при нормальных условиях.
Шкала активности металлов широко используется для практических целей, например, в гальванике. Если электроды сделаны из разных металлов, то разрушаться будет тот, который стоит левее. Чем больше промежуток между металлами в ряду, тем активнее проходит процесс коррозии.
Например, метод оцинковки позволяет защитить железо именно потому, что цинк находится левее железа в ряду активности. Пока он не разрушится, то ржавчина на железе не появится. При электролизе, расположенные за водородом металлы осаживаются на катоде, а самые активные, занимающее места до алюминия, выделить из солевых растворов в не получится при нормальных температуре и давлении.
Малоактивные металлы, так называемые переходные элементы с электроотрицательностью в пределах 1,5 – 2. Это:
- Ртуть;
- Олово;
- Серебро;
- Никель;
- Рений;
- Медь;
- Марганец и еще несколько элементов.
К металлам средней активности относятся элементы с числом электроотрицательности от 1 до 1,5. В эту группу входят такие известные элементы, как магний, плутоний, неодим, кальций. Остальные элементы обладают высокой химической активностью. Лидирует в этом списке Франций, который практически не встречается в чистом виде. Из более известных можно назвать калий и натрий, которые приходится хранить в керосине, чтобы они не взаимодействовали с водой и воздухом. Если извлечь их из керосина, то металлы практически мгновенно сгорают.
Реакции кальция и натрия с водой при комнатной температуре выглядят так:
2Na + 2H2O = 2NaOH + H2↑
Сa + 2H2O = Сa(OH)2 + H2↑Стоящие в ряду электронапряжения металлов правее элементы тоже взаимодействуют с водой, но реакция протекает при более высокой температуре с образованием оксида и водорода.
3Fe + 4H2O = Fe3O4 + 4H2↑
Если вступает в реакцию металл и неметалл, то электрический ряд напряжений металлов тоже дает возможность заранее узнать, в каком направлении будет протекать реакция. Скорость реакции зависит как от восстановительной активности металла, так и от окислительных свойств неметалла. Стоящие до водорода металлы реагируют с кислородом уже при комнатной температуре, некоторые — достаточно бурно, например, литий и кальций.
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO.
При таком взаимодействии образуются оксиды. Менее активные металлы, например железо, реагируют с кислородом спокойнее, а некоторые, например, золото и серебро, платина не окисляются вовсе, благодаря чему получили определение благородных.
С хлором реагируют практически все активные металлы с выделением теплоты.
2Fe + 3Cl2 = 2FeCl3
Также выделяется теплота при реакции активных металлов с серой, но начинается она при нагревании. После начала реакции нагрев не нужен — образовавшегося тепла достаточно для поддержания реакции.
2Al + 3S = Al2S3
Внимательно изучив ряд металлов, несложно определить тип реакции при контакте с другими элементами в зависимости от места в последовательности. Также легко назвать основные характеристики металла, как химического элемента, и возможность его использования на практике.
Электрохимический ряд активности металлов
Читайте также:
