Почему металлы являются восстановителями
Обновлено: 21.09.2024
По химическим свойствам металлы являются восстановителями, так как легко отдают свои электроны атомам неметаллов, превращаясь в положительно заряженные ионы — катионы.
Способность атомов металлов отдавать, а их катионов — присоединять электроны может служить мерой их химической активности. Так, алюминий на воздухе очень быстро покрывается оксидной плёнкой, а с золотом заметных изменений не происходит. Цинк активно взаимодействует с соляной кислотой, а серебро — нет. Поэтому алюминий и цинк можно отнести к активным металлам, а золото и серебро — к неактивным.
Ряд активности металлов
Химическую активность разных металлов легко сопоставить, анализируя их поведение в водных растворах солей и кислот. Например, если в раствор сульфата меди(II) опустить цинковую пластинку или железный гвоздь, то практически сразу же на их поверхности появляется красноватый налёт меди. Это свидетельствует о том, что цинк и железо вытесняют медь из раствора. Эти процессы можно представить следующими уравнениями:
Zn 0 + Сu 2+ = Zn 2+ + Cu 0 ;
Fe 0 + Cu 2+ = Fe 2+ + Сu 0 .
В этих реакциях цинк и железо отдают свои электроны ионам меди, то есть они окисляются. Ионы меди принимают электроны, поэтому медь восстанавливается.
Если поступить наоборот и в раствор сульфата цинка поместить медную пластинку, то на ней не произойдёт осаждения цинка. В чём тут причина?
Экспериментальным путём, изучая способность одних металлов вытеснять другие из водных растворов их солей, русский учёный Н. Н. Бекетов расположил металлы в ряд. В нём металлы, находящиеся левее, способны восстанавливать последующие из растворов их солей. Поскольку эта способность металлов связана с их восстановительной активностью, то этот ряд получил название ряда активности металлов.
Ряд активности металлов
Li K Ba Sr Cа Na Mg Al Mn Zn Cr Fe Ni Sn Pb ( H2 ) Cu Hg Ag Pd Pt Au
Чем левее в этом ряду расположен металл, тем большими восстановительными свойствами в водном растворе он обладает, то есть легче отдаёт свои электроны окислителю и переходит в виде катиона в раствор; тем труднее катион этого металла восстанавливается. Цинк и железо легче отдают свои электроны, чем медь, и поэтому восстанавливают Cu 2+ из раствора.
По положению цинка в ряду активности можно прогнозировать, что этот металл способен восстановить из раствора ионы олова, меди и серебра:
Zn 0 + Sn 2+ = Zn 2+ + Sn 0 ;
Zn 0 + 2Ag + = Zn 2+ + 2Ag 0 .
В то же время медь будет восстанавливать только ионы серебра, но не восстановит ионы олова:
Cu 0 + 2Ag + = Cu 2+ + 2Ag 0 .
Это означает, что цинк обладает большей восстановительной способностью. Он легче отдаёт электроны, чем олово, медь и серебро. Поэтому цинк считается более активным металлом, чем эти металлы. В свою очередь, медь — более активный металл, чем серебро.
Ряд активности металлов позволяет не только прогнозировать поведение металлов в реакциях с растворами солей, но и сравнивать их отношение к воде, растворам кислот, а также к неметаллам и ряду других веществ.
Так, слева от водорода расположены металлы, которые вытесняют водород из воды и кислот (то есть восстанавливают ионы водорода Н + ). Металлы, расположенные справа от водорода, такой восстановительной активности в реакциях с растворами кислот не проявляют. Например, цинк реагирует с соляной кислотой, вытесняя водород:
Zn 0 + 2Н + = Zn 2+ + ,
а серебро водород не вытесняет.
Взаимодействие металлов с простыми и сложными веществами
К общим химическим свойствам металлов относят их реакции с неметаллами, водой, кислотами, солями. Для некоторых металлов также характерны реакции с растворами щелочей. Часть металлов вступает в реакции с органическими веществами. Многие перечисленные взаимодействия вам известны из предыдущих глав пособия. Кроме того, вы изучали химические свойства металлов в 9-м классе. Поэтому на данном этапе обучения мы систематизируем известные вам свойства, составив таблицу 31.
Таблица 31. Общие химические свойства металлов
Неметаллы
Щелочные и щёлочноземельные (Са, Sr, Ва, Ra) металлы образуют водород и щёлочь при обычных условиях.
Металлы средней активности, реагируя с парами воды, образуют оксиды.
Образуют нерастворимые основания: магний реагирует с кипящей водой; алюминий реагирует с водой, если с поверхности удалена плёнка оксида, например алюминий амальгамирован
Кислоты
Щелочные металлы реагируют с кислотами-окислителями HNO3(конц), H2SO4(конц) со взрывом. Pb пассивируется в разбавленных HCl, H2SO4. Напомним, что при взаимодействии металлов с кислотами-окислителями HNO3(конц) и H2SO4(конц) водород не выделяется, а образуются продукты восстановления азота и серы
Cоли
Растворы щелочей
В такие реакции вступают цинк, алюминий, бериллий
Отметим, что с водой при нормальных условиях взаимодействуют все металлы s-элементов , кроме бериллия и магния. Магний реагирует с водой при нагревании. Алюминий взаимодействует с водой при комнатной температуре, но только после удаления с его поверхности плёнки оксида алюминия. При этом образуются гидроксиды металлов. Остальные металлы от марганца до водорода в ряду активности взаимодействуют с парами воды при нагревании, образуя, как правило, оксиды металлов. Металлы, находящиеся в ряду напряжений после водорода, не взаимодействуют с водой ни при каких условиях.

Активные металлы (Na, K) вступают в реакции с карбоновыми кислотами, спиртами, фенолами.
Положение металла в ряду активности металлов позволяет прогнозировать его поведение в окислительно-восстановительных реакциях, протекающих в водных растворах.
Атомы металлов во всех химических превращениях являются восстановителями.
Металлы в химических превращениях являются восстановителями и легко отдают свои электроны, превращаясь в положительно заряженные ионы — катионы.
Активность металлов в окислительно-восстановительных реакциях, протекающих в водных растворах, определяется по их положению в ряду активности: чем левее в этом ряду расположен металл, тем большими восстановительными свойствами он обладает и тем труднее катионы этого металла восстанавливаются.
Более активные металлы восстанавливают менее активные металлы из растворов их солей. Металлы, стоящие в ряду напряжений левее водорода, вытесняют его из разбавленных кислот (кроме азотной). Металлы s-элементов, за исключением бериллия и магния, вытесняют водород из воды при обычной температуре.
- Назовите характерные для металлов физические свойства.
- Перечислите p-элементы, которые относятся к элементам-металлам.
- Расставьте коэффициенты в уравнении реакции методом электронного баланса: Cu + HNO3(разб) → Cu(NO3)2 + NO↑ + H2O.
- Составьте уравнения возможных химических реакций с учётом, что медь окисляется до степени окисления +2:

*Самоконтроль
1. В порядке увеличения восстановительной активности металлы расположены в ряду:
- а) Mg, Ca, Na;
- б) Cu, Ag, Hg;
- в) Cа, K, Cs;
- г) Zn, Al, Pb.
2. Реагируют с растворами щелочей:
3. Реагируя с парами воды, образуют оксиды:
4. Масса цинковой пластинки увеличится при погружении её в раствор:
5. На растворение 13 г цинка требуется раствор, содержащий гидроксид натрия массой (г):
Химические свойства металлов

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
Cu, Hg, Ag, Pt, Au
Восстановительная способность металлов в свободном состоянии
Возрастает справа налево
Взаимодействие металлов с кислородом
Быстро окисляются при обычной температуре
Медленно окисляются при обычной температуре или при нагревании
Взаимодействие с водой
Выделяется водород и образуется гидроксид
При нагревании выделяется водород и образуются оксиды
Водород из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с концентрированными азотной и серной кислотами
С кислотами не реагируют, растворяются в царской водке
Взаимодействие с солями
Не могут вытеснять металлы из солей
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей
Взаимодействие с оксидами
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов
Окислительно-восстановительные реакции

Разбираться в ОВР важно, чтобы хорошо сдать ЕГЭ по химии. Какие реакции называются окислительно-восстановительными, их типы, а также примеры окислителей и восстановителей — в нашей подробной статье.
11 класс, ЕГЭ/ОГЭ
Что такое ОВР
Окислительно-восстановительная реакция (ОВР) — это реакция, которая протекает с изменением степеней окисления.
В такой реакции всегда участвуют вещество-окислитель и вещество-восстановитель. Другие вещества могут выступать в качестве среды, в которой протекает данная реакция.
Конечно, в каждом правиле есть исключения. Например, реакция диспропорционирования галогенов в горячем растворе щелочи выглядит так: Br2 + KOH = KBrO3 + KBr + H2O. Здесь и окислителем, и восстановителем является простое вещество бром (Br2).
Теперь посмотрим внимательнее на вещества — участники окислительно-восстановительных реакций.
Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет принимать электроны, тем самым понижая свою степень окисления.
Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет отдавать электроны, тем самым повышая свою степень окисления.
Из определений понятно, что реакция включает два противоположных по действиям явления: процесс окисления и процесс восстановления. Процесс восстановления — это процесс принятия электронов, а процесс окисления — процесс отдачи электронов. Оба процесса протекают одновременно: окислитель восстанавливается, а восстановитель окисляется.
Вот мы и узнали общие закономерности протекания окислительно-восстановительных реакций. Теперь давайте разберемся, какие вещества могут быть окислителями, а какие — восстановителями, и может ли одно вещество проявлять те и другие свойства.
Примеры веществ-окислителей
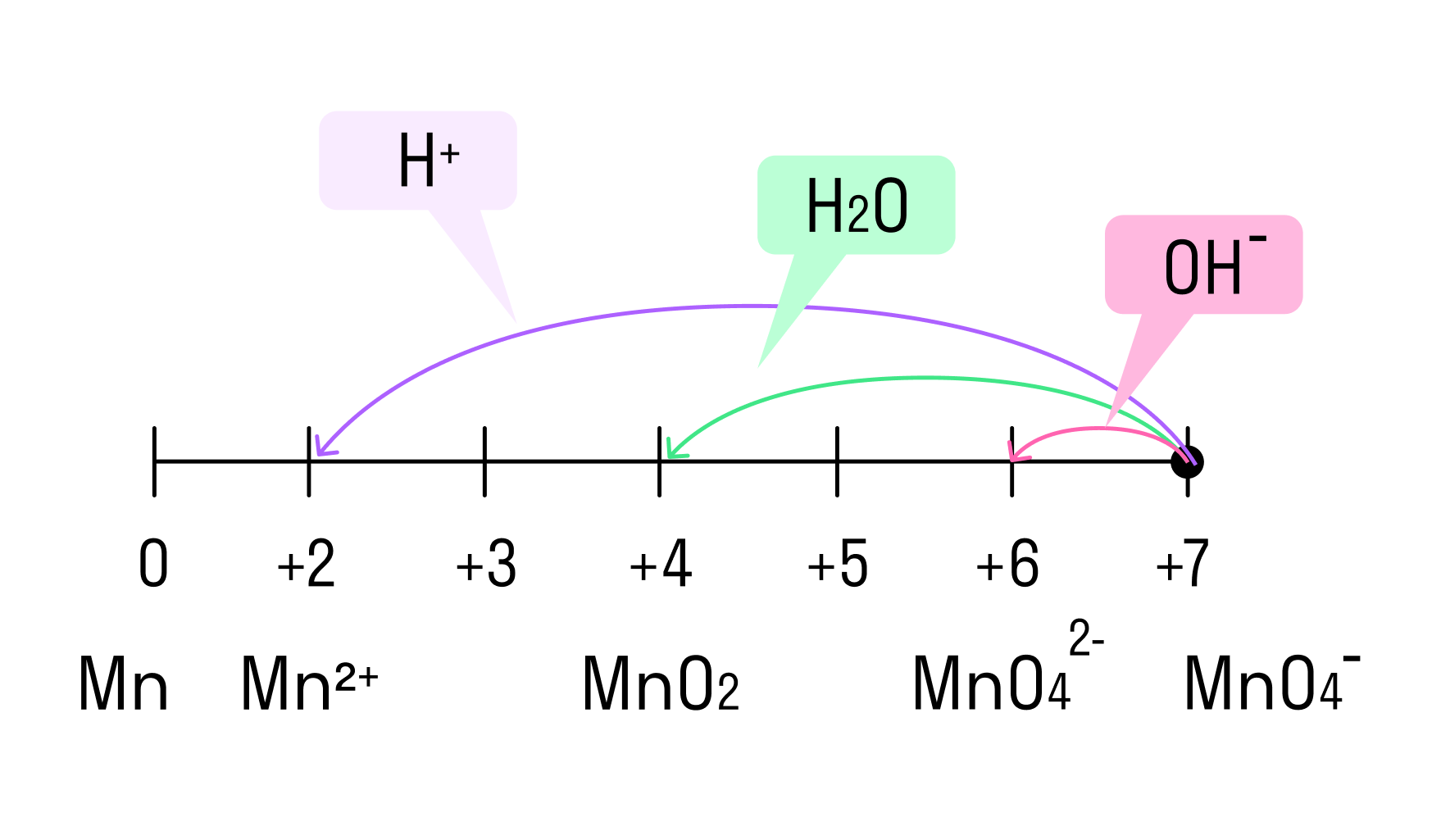
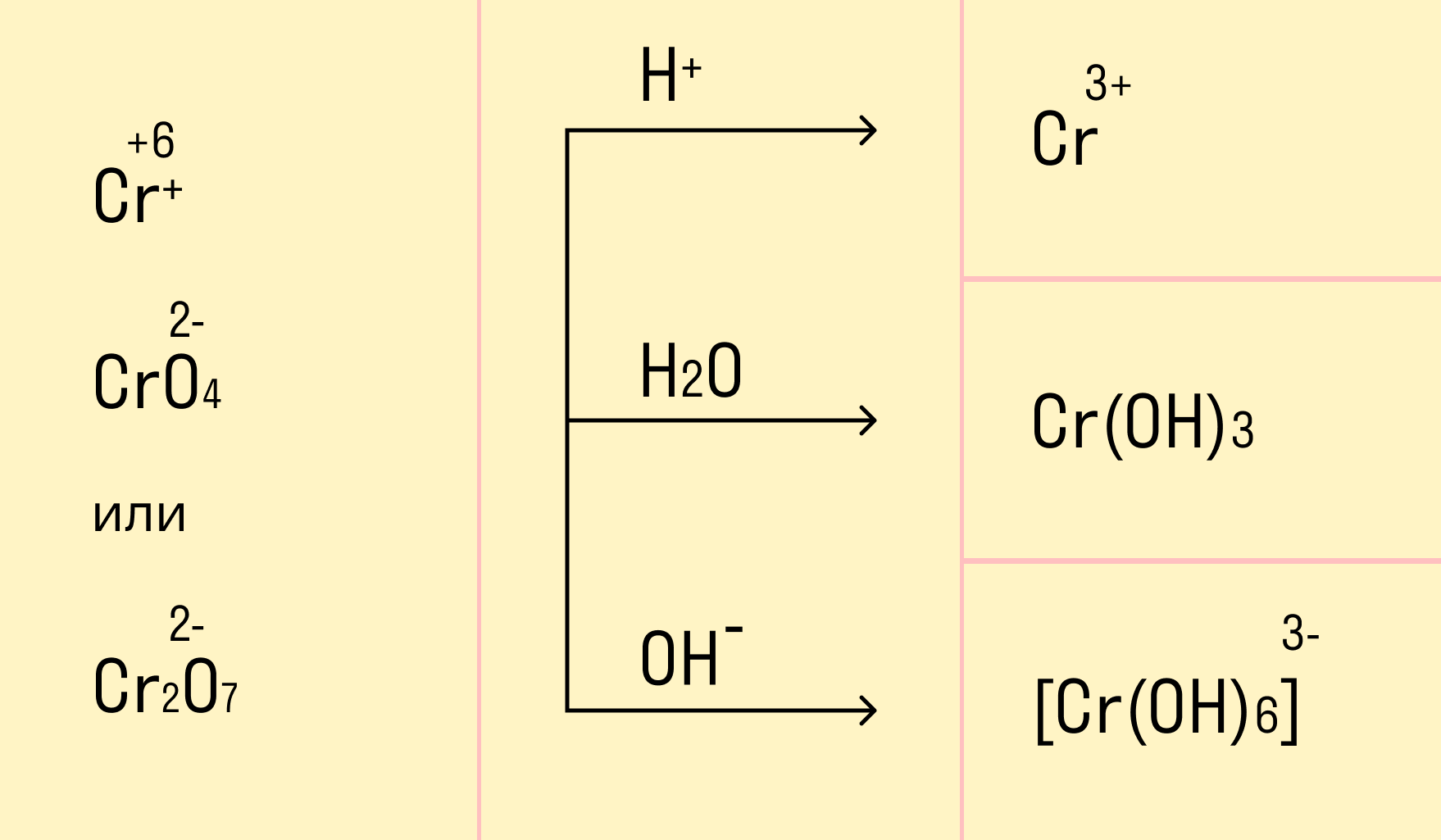
И марганец, и хром в кислой среде (H + ) образуют соли той кислоты, которая образовывала среду. В нейтральной среде (H2O) марганец превращается в оксид бурого цвета, а хром — в серо-зеленый нерастворимый в воде гидроксид. В щелочной среде (OH − ) марганец превращается в манганат (MnO4 2− ), а хром — в комплексное соединение светло-зеленого цвета.
Только окислителями могут быть простые вещества-неметаллы. Например, представители VIIA группы — галогены. Проявляя окислительные свойства в кислой среде, галогены восстанавливаются до соответствующих им галогеноводородных кислот: HF, HCl, HBr, HI. В щелочной среде образуются соли галогеноводородных кислот.
Кислород превращается в анион с устойчивой степенью окисления −2. А сера ведет себя как окислитель по отношению к водороду и металлам, образуя при этом сероводород и сульфиды.
Только окислителями могут быть и протон водорода (H + ) и катионы металлов в их высших степенях окисления при нескольких возможных. Ион Н + при взаимодействии с восстановителями переходит в газообразный водород (H2), а катионы металлов — в ионы с более низкой степенью окисления: 2CuCl2 + 2KI = CuCl + 2KCl + I2.
Рассмотрим как ведут себя сильные кислоты-окислители — азотная и серная. В зависимости от их концентрации меняются и продукты реакции.
Разбавленная азотная кислота никогда не реагирует с металлами с выделением водорода в отличие от разбавленной серной кислоты. Обе эти кислоты реагируют с металлами, стоящими в ряду активности после водорода.
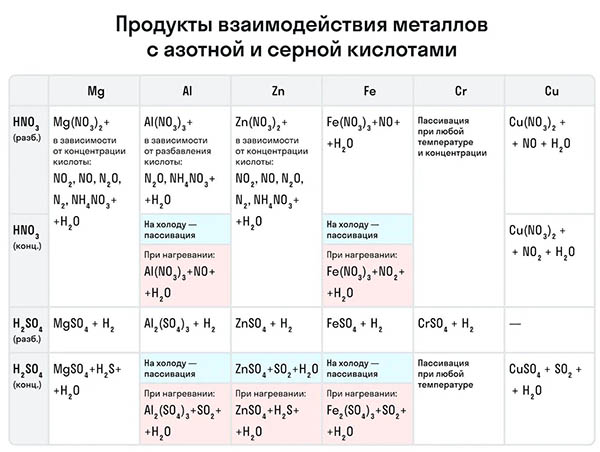
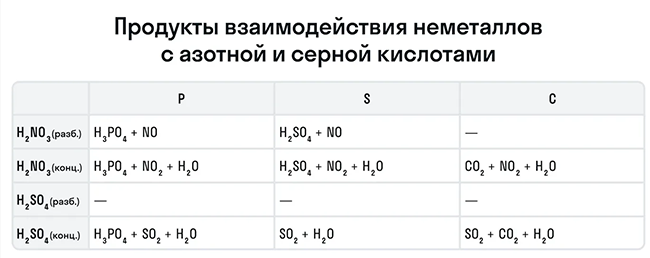
Эти кислоты проявляют окислительные способности и с некоторыми неметаллами, окисляя их до соответствующих кислот в высшей степени окисления неметалла-восстановителя.
Для удобства мы собрали цвета переходов важнейших веществ-окислителей в одном месте.
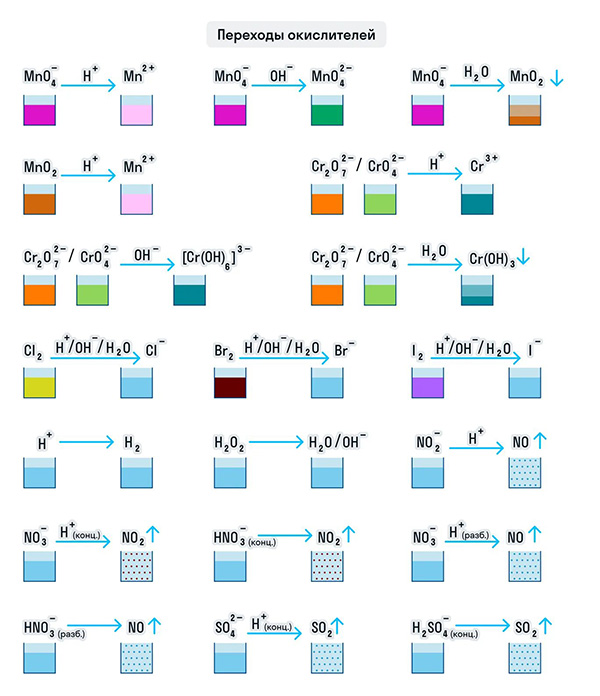
Примеры веществ-восстановителей
Типичными восстановителями могут быть щелочные (IA) и щелочноземельные (IIA) металлы, цинк и алюминий, а также катионы металлов в своих низших степенях окисления при нескольких возможных. Например:
Типичными восстановителями также могут быть бескислородные кислоты и их соли. Например, H2S + 4Cl2 + 4H2O = 8HCl + H2SO4.
Гидриды активных металлов (щелочных и щелочноземельных) тоже являются типичными восстановителями. Например, NaH + H2O = NaOH + H2.
Для удобства мы собрали цвета переходов важнейших веществ-восстановителей в одном месте.

Окислительно-восстановительная двойственность
Окислительно-восстановительная двойственность — это способность атома проявлять как свойства окислителя, так и свойства восстановителя в зависимости от условия протекания химической реакции.
Разберем вещества, атомы которых обладают окислительно-восстановительной двойственностью.
По отношению к водороду и металлам сера играет роль окислителя: S + H2 = H2S.
При взаимодействии с сильными окислителями повышает свою степень окисления до +4 или +6: S + KMnO4 = K2SO4 + MnO2.
Кислородсодержащие соединения серы в степени окисления +4
Сера в сульфитах и сернистой кислоте при взаимодействии с сильными окислителями повышает степень окисления до +6: SO2 + 2HNO3 (конц) = H2SO4 + 2NO2.
С восстановителями соединения серы проявляют окислительные свойства, восстанавливаясь до степени окисления 0 или −2: SO2 + C = CO2 + S.
Пероксид водорода
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии восстановителей может понижать степень окисления до –2: 4H2O2 + PbS = PbSO4 + 4H2O.
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии окислителей может повышать степень окисления до 0: 3H2O2 + 2KMnO4 = 3O2 + 2MnO2 + 2KOH + 2H2O.
Простое вещество йод
Окислительная способность проявляется у йода в реакции с такими восстановителями, как сероводород, фосфор и металлы: I2 + H2S = S + 2HI.
Йод при взаимодействии с более сильными окислителями играет роль восстановителя: I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl.
Азотистая кислота и нитриты
При взаимодействии с более сильными окислителями азот повышает степень окисления до +5 и превращается либо в азотную кислоту из азотистой, либо в нитрат-анион из нитрит-аниона: 5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O.
При взаимодействии с сильными восстановителями обычно происходит восстановление до NO (иногда до других соединений азота в более низких степенях окисления): 2HNO2 + 2HI = 2NO + I2 + 2H2O.
Для удобства мы собрали представителей типичных окислителей и восстановителей в одну схему.

Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции можно поделить на четыре типа:
Рассмотрим каждую по отдельности.
Межмолекулярная ОВР — это реакция, окислитель и восстановитель которой являются различными веществами.
2KI + Br2 = 2KBr + I2, где Br2 — окислитель, а KI — восстановитель (за счёт I −1 ).
Внутримолекулярная ОВР — это реакция, в которой один атом является окислителем, а другой восстановителем в рамках одного соединения.
Пример такой окислительно-восстановительной реакции:
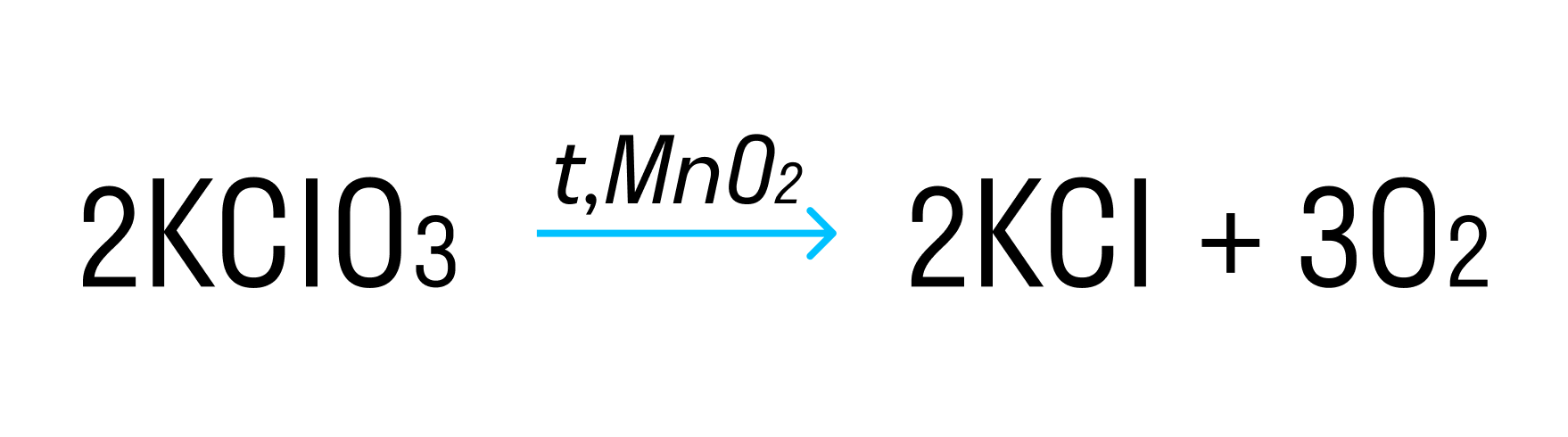
где Cl +5 — окислитель, а O −2 — восстановитель.
Термическое разложение нитратов — это внутримолекулярная ОВР. Вот схема разложения нитратов в зависимости от металла, входящего в состав соли.
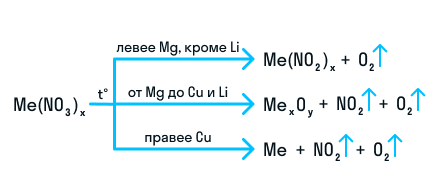
Исключение — разложение нитрата железа (II): 4Fe(NO3)2 = 2Fe2O3 + 8NO2 + O2. Здесь железо окисляется до +3 вопреки правилам. Иначе разлагается при нагревании и нитрат аммония: NH4NO3 = N2O + 2H2O.
Окислительно-восстановительная реакция диспропорционирования — это реакция, в ходе которой один и тот же атом является и окислителем, и восстановителем. Например, 3HNO2 = HNO3 + 2NO + H2O, где N +3 переходит в N +5 , являясь восстановителем, и N +3 переходит в N +2 , являясь окислителем.
Окислительно-восстановительная реакция контрпропорционирования — это реакция, в которой атомы одного и того же химического элемента в разных степенях окисления входят в состав разных веществ, при этом образуя новые молекулы одного и того же продукта.
Основные правила составления ОВР
Подобрать среди исходных веществ окислитель и восстановитель, а также вещество, которое отвечает за среду — при необходимости. Для этого нужно расставить степени окисления элементов и сравнить их окислительно-восстановительные свойства.
Составить уравнение реакции и записать продукты реакции. Следует помнить, что в кислой среде образуются соли одно-, двух- и трехзарядных катионов, а для создания среды чаще всего используют серную кислоту. В кислой среде невозможно образование оснóвных оксидов и гидроксидов, так как они вступят в реакцию с кислотой. В щелочной среде не могут образовываться кислоты и кислотные оксиды, а образуются соли.
Уравнять методом электронного баланса или методом полуреакций.
Составим алгоритм для уравнивания окислительно-восстановительных реакций методом электронного баланса.
Главное условие протекания ОВР — общее число электронов, отданных восстановителем, должно быть равно общему числу электронов, принятых окислителем.
Определите атомы, которые меняют свои степени окисления в ходе реакции.
Выпишите, сколько электронов принял окислитель и отдал восстановитель. Если восстановителей несколько, выписываем все.
Найдите НОК для суммарно отданных/принятых электронов.
Расставьте первые полученные коэффициенты перед окислителем и одним или несколькими восстановителями.
Уравняйте все присутствующие металлы в уравнении реакции.
Уравняйте кислотные остатки.
Уравняйте водород — в обеих частях его должно быть одинаковое количество.

Основным химическим свойством металлов является способность их атомов легко отдавать свои валентные электроны и переходить в положительно заряженные ионы.
Типичные металлы никогда не присоединяют электронов; их ионы всегда заряжены только положительно. Поэтому металлы называются «электроположительными» элементами, в отличие от «электроотрицательных» элементов — металлоидов, для которых более характерна способность при соединять электроны.
Удельный вес и температура плавления некоторых металлов
Почему типичные металлы восстановители
Легко отдавая при химических реакциях свои валентные электроны, типичные металлы являются энергичными восстановителями.
Способность к отдаче электронов проявляется у отдельных металлов далеко не в одинаковой степени. Чем легче металл отдает свои электроны, тем он активнее, тем энергичнее вступает во взаимодействие с другими веществами.
Для сравнительного изучения активности металлов можно воспользоваться различными реакциями. Особенно удобны для этой цели реакции вытеснения металлов из их солей другими металлами. Опустим, например, кусочек цинка в раствор какой-нибудь свинцовой соли. Цинк начинает растворяться, а из раствора выделяется свинец. Реакция выражается уравнением
или в ионной форме
Zn + Pb •• = Pb + Zn ••
Из уравнения видно, что эта реакция является типичной реакцией окисления-восстановления. Сущность ее сводится к тому, что атомы цинка отдают свои валентные электроны ионам Рb •• , тем самым превращаясь в ионы Zn •• , а ионы Рb •• разряжаются и выделяются в виде металлического свинца. Если поступить наоборот, т. е погрузить кусочек свинца в раствор цинковой соли, то никакой реакции не произойдет. Это показывает, что цинк более активен, чем свинец, что его атомы легче отдают, а ионы труднее присоединяют электроны, чем атомы и ионы свинца.
Сравнивая таким же способом активность свинца и меди, легко убедиться, что свинец более активен, чем медь, так как он вытесняет медь из ее солей, а медь не может вытеснять свинец:
Рb + Cu •• = Сu + Рb ••
Следовательно, из трех сравниваемых металлов — цинка, свинца и меди — наиболее активным, легче других отдающим электроны, является цинк, менее активен свинец и еще менее активна медь.
Вытеснение металлов из соединений металлами
Вытеснение одних металлов из их соединений другими металлами впервые было подробно изучено Н. Н. Бекетовым (1865 г.), расположившим металлы по их убывающей химической активности в так называемый «вытеснительный ряд». В настоящее время вытеснительный ряд Бекетова носит название ряда напряжений, так как положение каждого металла в ряду точно определяется величиной электрического напряжения, или разности потенциалов, возникающей при погружении данного металла в раствор его соли. Об измерении этих величин и их значении будет сказано несколько позже.
Для наиболее важных металлов ряд напряжений, как уже было указано , имеет следующий вид:
Уменьшение химической активности нейтральных атомов
К, Na, Са, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
Уменьшение способности ионов к присоединению электронов
В этом ряду помещен и водород, так как он тоже может вытеснять некоторые металлы из растворов их солей и в свою очередь вытесняется многими металлами из растворов кислот.
Определения положения водорода в вытеснительном ряду
Для определения положения водорода в «вытеснительном ряду» Бекетовым производились следующие опыты. В колена изогнутой стеклянной трубки (рис.) помещали отдельно друг от друга раствор соли металла, кислоту и цинк. Трубку запаивали» затем наклоняли ее так, что цинк падал в кислоту и выделяющийся водород действовал под давлением на раствор соли.
Наблюдая явления, происходящие в колене трубки, наполненном раствором соли, можно было судить о том, вытесняется ли металл водородом. На основании проведенных опытов Бекетов пришел к заключению, что в «вытеснительном ряду» водород занимает место после свинца и может вытеснять(восстанавливать) следующие за ним металлы: медь, ртуть, серебро, золото из растворов их солей.
Бекетов был убежден, что реакции вытеснения водорода металлами являются обратимыми и что для каждого металла должно существовать такое давление, при котором направление реакции меняется на обратное, т. е. водород начинает вытеснять металл из раствора его соли.
Взгляды Бекетова получили позднее полное подтверждение.
Рассмотрим, например, реакцию вытеснения водорода цинком:
Константа равновесия этой реакции выражается следующей формулой:
где вместо концентрации водорода взято его давление рн2 в атмосферах. Вычисление показывает, что при обычной температуре К = 36 • 10 24 . Значит, потребовалось бы недостижимое при современной технике давление водорода, чтобы сделать ощутимой обратную реакцию, т. е. вытеснение цинка водородом. При обычном же давлении равновесие реакции практически нацело смещено вправо.
Однако для реакции
Sn + 2H • ⇄ Sn •• + H2
Это значит, что равновесие будет достигнуто, например, при концентрациях: [Sn •• ]= l г-ион/л,[Н • ] = 0,01 г-ион/л и давлении водорода рн2 = 4 ат. Следовательно, при сравнительно небольшом давлении водород может вытеснить олово из раствора его соли.
Электрохимический ряд напряжений
Ряд напряжений дает много общих указаний относительно химического поведения отдельных металлов при реакциях в растворах:
- Каждый металл этого ряда, а также и водород, находящийся под давлением, вытесняет (восстанавливает) все следующие за ним металлы из растворов их солей. В свою очередь сам он может быть вытеснен (восстановлен) любым из металлов, стоящих впереди него.
- Только те металлы, которые стоят в ряду напряжений впереди водорода, могут вытеснять его из разбавленных кислот («солей водорода»). Металлы, стоящие вправо от водорода, не способны вытеснять водород из кислот.
- Чем левее в ряду напряжений стоит металл, тем он активнее, тем больше его восстановительная способность в отношении ионов других металлов, тем легче он сам превращается в ионы, тем труднее восстанавливаются его ионы.
Вы читаете, статья на тему Химические свойства металлов
Похожие страницы:
Вытеснительный ряд металлов Бекетова Рассматривая способы получения водорода, мы уже отмечали, что одни металлы легко вытесняют из воды водород, другие —.
Ряд активности металлов это последовательность в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов. Примером может служить расширенный.
Химические свойства воды Из химических свойств воды прежде всего следует отметить большую устойчивость ее молекул по отношению к нагреванию. Однако.
Водород в природе Водород (Hydrogenium; ат. вес 1,008) в свободном состоянии встречается в природе лишь в незначительных количествах, главным образом.
Содержание статьи1 Химические уравнения и расчеты по ним1.1 Что такое химические уравнения1.2 Для чего нужны химические уравнения1.3 Пример решения химического.
Соединения фосфора с водородом и галогенами С водородом фосфор образует три соединения: РН3 — газообразный фосфористый водород, Р2Н4 — жидкий фосфористый.
Ряд активности металлов
Ряд активности металлов это последовательность в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов.
Примером может служить расширенный ряд активности металлов:

Что такое ряд активности металлов и окислительно-восстановительные реакции
Отправным пунктом при изучении ряда активности металлов следует взять периодическую систему элементов.
Устанавливается, что активность металла определяется степенью лёгкости отдачи атомом электронов: чем легче атомы металла отдают электроны, тем металл является активнее.
Ряд активности металлов показывает их сравнительную активность в реакциях окисления или восстановления (сверху вниз восстановительная активность уменьшается) металл, находящийся в ряду напряжений левее (или выше) водорода, способен вытеснить водород из кислот.

О сравнительной активности металлов можно судить по их положению в периодической системе: внутри периодов при передвижении справа налево нарастает активность металлов, и самые активные металлы (литий, натрий, калий, рубидий, цезий и франций) стоят в начале периодов.
Рис. Трубка для опытов по вытеснению металлов водородом под давлением
В главных подгруппах при передвижении сверху вниз тоже нарастает активность металлов, в чём можно убедиться на примере тех же щелочных металлов.
Ряд Бекетова
Но если металлы стоят в разных периодах и в разных группах, как, например , цинк и свинец, то на основе положения их в периодической системе быстро и правильно охарактеризовать их сравнительную активность довольно трудно.
Это можно выполнить на основе ряда активности металлов, установленного русским учёным Н. Н. Бекетовым и впервые названного им «вытеснительным рядом металлов». Наиболее выдающимся трудом Н. Н. Бекетова являются его «Исследования над явлениями вытеснения одних элементов другими» (Харьков, 1865).
Для наиболее важных металлов ряд активности металлов имеет следующий вид:

1. В этом ряду металлы расположены в определённой системе, а именно в порядке убывающей активности. Из двух металлов, стоящих рядом, легче отдают электроны атомы металла, стоящего левее.
2. Каждый металл этого ряда вытесняет все следующие за ним металлы из растворов их солей, иначе говоря, каждый металл окисляется ионами всех следующих за ним металлов, например :

При этом, как видно из уравнений, металл переходит в состояние иона, а ион — в состояние металла.
3. Если в ряду двигаться слева направо, т. е. от калия к золоту, то способность атомов отдавать электроны будет убывать, т. е. будет убывать восстановительная способность атомов и нарастать окислительная способность ионов металлов. Таким образом, в приведённом ряду активности металлов атомы калия и натрия являются очень сильными восстановителями, а ионы серебра и золота — сильными окислителями.
4. Как следствие из изложенного вытекает, что водород из разбавленных кислот может вытеснять только металлы, которые в ряду стоят левее его. Металлы же, стоящие вправо от водорода, наоборот, вытесняются водородом, находящимся под давлением, из растворов их солей умеренных концентраций:
Для определения места водорода в ряду активности металлов Н. Н. Бекетов производил такие опыты:
В колена изогнутой стеклянной трубки (рис.) помещались раздельно соли металла, кислота и цинк. Трубка запаивалась, потом наклонялась так, что цинк падал в кислоту и выделяющийся водород действовал под давлением на раствор соли. По явлениям, происходящим в колене трубки с раствором соли, можно было судить о том, вытесняется ли металл водородом или нет.
На основании подобных опытов Н. Н. Бекетов пришёл к выводу, что в «вытеснительном ряду» водород должен занимать место после свинца, а за водородом идут медь, ртуть, серебро, золото и платиновые металлы.
5. Из двух металлов, образующих электроды гальванического элемента, отрицательным электродом, катодом, будет тот из них, который стоит левее в ряду, а положительным электродом, анодом, — тот, который стоит правее.
Зависимость окислительно восстановительных реакций в ряду активности металлов
Окислительно-восстановительная реакция в гальваническом элементе протекает тем энергичнее, чем эти металлы дальше отстоят друг от друга в ряду активности металлов.
Следует в заключение подчеркнуть, что ряд активности металлов нельзя рассматривать как абсолютную характеристику свойств металлов, действительную во всех случаях и при всяких условиях.
1) Так, например , в растворах цианистого калия он существенно отличается от обычного ряда, что видно из приводимого ниже сопоставления (при 10°):
а) Обычный ряд: Zn, Fe, Sn, Сu, Ag. Аu;
б) 0,6% раствор KCN: Zn, Сu, Sn, Ag, Аu, Fe;
в) 30% раствор KCN: Zn, Сu, Аu, Ag, Sn, Fe.
При изменившихся условиях активность, например , железа резко снижается, активность меди заметно повышается и т. д.
Пример взаимодействия хлороводорода с серебром
2) Хотя серебро в ряду активности стоит после водорода, но при нагревании металлического серебра в атмосфере хлористого водорода протекает обратимая реакция:
2Ag + 2HCl ⇄ 2AgCl + H2,
причём вытеснение водорода серебром сопровождается выделением тепла. Если эту реакцию проводить в замкнутом сосуде под атмосферным давлением, то при 600° газовая смесь содержит по объёму 92,8 % НСl и 7,2 Н2, а при 700° соответственно 95% и 5%. Подобным же образом протекает реакция при тех же условиях и с медью.
Несмотря на свой относительный характер и имеющиеся некоторые исключения, ряд активности металлов всё же очень важен в практическом отношении, так как в большинстве случаев он позволяет правильно ориентироваться в направлении окислительно-восстановительной реакции при взаимодействии металла с водным раствором того или иного электролита.
Часто задаваемые вопросы ответы о ряде активности металлов?
Что показывает ряд активности металлов?
Это ряд металлов химическая активность(электрохимический потенциал), которых располагается в порядке увеличения силы
Используется для оценки активности металлов в водных растворах, и для процессов, происходящих при электролизе.
Что такое ряд напряжений металлов?
Электрохимический ряд активности металлов (ряд напряжений, ряд стандартных электродных потенциалов) — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ0, отвечающих полуреакции восстановления катиона металла Men + : Men + + nē → Me.
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
Как пользоваться рядом активности металлов?
Это ряд металлов, в котором их химическая активность уменьшается. Это чудесная шпаргалка, которой нужно уметь пользоваться: металлы, которые стоят до водорода, могут вытеснять водород из растворов кислот.
Статья на тему Ряд активности металлов
Содержание статьи1 Химические свойства металлов1.1 Удельный вес и температура плавления некоторых металлов1.2 Почему типичные металлы восстановители1.3 Вытеснение металлов из соединений.
Легкие металлы это Легкими металлами принято называть цветные металлы, имеющие небольшую плотность. К ним относят алюминий, магний, бериллий, кальций, стронций.
Читайте также:
