Почему щелочные металлы называются щелочными
Обновлено: 05.10.2024
Общая характеристика элементов щелочных металлов по их положению в периодической системе.
Нахождение в природе.
Соединения щелочных металлов:
- А) гидроксиды;
- Б) гидриды, пероксиды, оксиды.
Применение щелочных металлов и их соединений.
Задача 1, стр. 126.
Задание на дом: §47, задача 3, стр.127.
Повторим и запомним.
Щелочные металлы образуют главную подгруппу 1 группы и обладают наиболее выраженными металлическими свойствами. Это обусловлено строением атомов щелочных металлов, наружный энергоуровень имеет конфигурацию ns 1 .
От Li к Fr радиусы атомов увеличиваются, восстановительные свойства усиливаются, ионизированные потенциалы уменьшаются.
Взаимодействуют с неметаллами, водой, кислотами. Из соединений натрия и калия большое значение имеют гидроксиды их, сильные электролиты.
Задачи и цель:
Сегодня на уроке мы вместе изучим новую тему, разберем строение элементов атомов щелочных металлов; опираясь на строение рассмотрим способы получения щелочных металлов, выясним, почему щелочные металлы так называются.
Арабская пословица гласит: «Кто путешествует, тот познает.»
Ребята, в ходе экскурсии вы будете и экскурсоводами и экскурсантами. Ответственным за работу экскурсоводов будет главный консультант, он внимательно слушает ответы, оценивает их, анализирует, и если экскурсовод не может ответить на заданный вопрос и другие учащиеся тоже, то тогда отвечает главный консультант.
И так, начнем урок-экскурсию. На столах лежит план нашей экскурсии. Каждый раздел плана – это лаборатория, которая занимается изучением данного вопроса
Ну что ж, первая лаборатория, в которую мы попадаем – это, конечно же, лаборатория по изучению строения элементов щелочных металлов и их простых веществ. Кто будет экскурсоводом в этой лаборатории? Кто даст, осветит общую характеристику щелочным металлам?
Краткий рассказ экскурсовода – это подгруппа лития Li.Na. K.Rb. Fr. Cs. Эти элементы находятся в 1-ой группе главной подгруппе, высшая постоянная валентность равна 1, на наружном энергоуровне 1 e, который слабо притягивается к ядру, поэтому атомы щелочных металлов легко его отдают, проявляя степень окисления +1. Это s-элементы. Простые вещества этих элементов называются щелочными металлами. Молекулы щелочных металлов одноатомные, щелочные металлы сильные восстановители, типичные элементы-металлы. Металлические свойства элементов увеличиваются, химическая активность увеличивается т.к.происходит увеличение размера атомов с возрастанием порядкового номера от Li к Fr.
Вопросы к экскурсоводу:
Почему щелочные металлы имеют одноатомные молекулы?
Какое соединение с кислородом образуют элементы подгруппы лития? Характер соединения.
В то время, когда экскурсовод ведет свой рассказ, на доске двое учащихся строят строение атомов металлов подгруппы лития. Это задание также повторяет класс.
Вывод. Выяснили строение атомов щелочных металлов, знаем, что они легко отдают электроны, очень химически активны. Помня все это, скажите: встречаются ли щелочные металлы в природе в свободном состоянии или нет?
Ответ класса. Нет, только в виде соединений. Какие вы знаете соединения и где они находятся на территории России (на стене висит географическая карта России). Один из учеников называет основные соединения и показывает их месторождение на карте.
Какое месторождение каменной соли называется «солонкой» в России?
Раз щелочных металлов нет в природе в свободном виде, только в виде соединений, то в следующей лаборатории занимаются вопросом получения щелочных металлов, которые нужны для промышленности. Предложите способы получения металлов? Кто желает?
Ответ. Электролизом расплава хлорида натрия расплава щелочи.
У доски и на местах учащиеся одновременно составляют уравнения реакций. Есть ли другие способы?
Есть. Калий можно получать аналогично, но много технических трудностей, поэтому предложили другой способ:
Теперь перейдем в лабораторию, которая занимается изучением физических свойств.
Кто здесь нас ознакомит с работой, которая ведется в данной лаборатории? (Рассказ – в атомах щелочных металлов наблюдается металлическая кристаллическая решетка, а значит имеет место металлическая связь.
Строение кристаллической решетки и объясняет свойства щелочных металлов – металлический блеск, серый цвет, пластичность, электро и теплопроводимость и т.д.)
Как изменяется прочность металлической связи от лития к цезию.
Какие из щелочных металлов наиболее часто используются.
А теперь перейдем в экспериментальную лабораторию, которая занимается изучением химических свойств металлов. Кто будет экскурсоводом в этой лаборатории?
Строение щелочных металлов нам известно, знаем, что они легко отдают свой электрон, т.е. являются восстановителями, т.е очень химически активные вещества.
Посмотрите, как хранятся щелочные металлы? Под слоем керосина, масла, чтобы не было доступа воздуха. Теперь предположим какие химические свойства характерны щелочным металлам? (Учащиеся отвечают на этот вопрос с места, проговаривая уравнения химических свойств.)
После выяснения этого вопроса на доску вывешивается заранее приготовленная опорная схема, по которой задаются вопросы классу.
Какое общее свойство характерно всем приведенным реакциям?
Какое из веществ отдает электроны? Сколько отдается электронов?
Что общего и чем отличаются уравнения химических реакций взаимодействия щелочных металлов с водой и с кислотами?
Зная химические свойства щелочных металлов и неорганических соединений, выполним следующие превращения:
(Данное превращение имеется в плане урока и лежит на столе у учащихся.)
Это превращение выполняется у доски и на местах.
А в это время ученик – лаборант выполняет опыты, подтверждающие химические свойства щелочных металлов и доказывает, почему металлы так называются.
Опыт №1. 2Na + 2H2O = 2NaOH + H2NaОН – щелочь, т.к.фенолфталеин изменяет свою окраску на малиновую.
Опыт №2. 2Na + 2HCl = 2NaCl + H2Осталась еще одна лаборатория, в которой занимаются изучением соединений щелочных металлов.
Какие вы знаете соединения?
Каковы их свойства?
Ответ. Из периодической системы видно, что щелочные металлы образуют основные оксиды R2O, но начиная с натрия при сгорании в избытке кислорода образуются пероксиды (R2O2).
С водородом при нагревании взаимодействуют щелочные металлы и образуются соединения, которые называются гидриды состава MeH. Щелочные металлы бурно и с выделением большого количества теплоты взаимодействуют с водой, образуя щелочь, состава R-OH и восстанавливая воду до водорода.
Свойства щелочей: диссоциируют, взаимодействуют с кислотными оксидами, с растворами солей. Получают щелочи электролизом раствора солей щелочных металлов.
Составляются уравнения химических реакций на доске и на местах.
Вопрос. Как изменяется сила оснований от лития к цезию? (От лития к цезию сила оснований увеличивается т.к. возрастает радиус атома и уменьшается притяжение электронов к ядру.)
Вот мы и посетили все лаборатории, за исключением вопроса применения. Эту лабораторию вы посетите самостоятельно и на следующий урок принесете отчет, который будет состоять из рисунка и письменного отчета.
1-вый ряд – применение солей натрия и калия.
2-ой ряд – применение щелочей.
3-ий ряд – применение щелочных металлов.
Задание на дом (в плане урока).
Слово старшему экскурсоводу.
Выставление оценок за урок.
Подведение итогов.
Некоторым участникам (более сильным) после рассмотрения химических свойств были розданы буклеты с заданиями:
Осуществить превращения
Составить молекулярные уравнения реакций.
Осуществить превращения: Na → NaOH → Na2CO3 → CaCO3 → CaO.
Закончить уравнения:
Na + H2O =
Li + S =
Li + O2 =
NaOH + H2 =
K + Cl2 =
Указать переход электронов в окислительно-восстановительных реакциях.
Урок в 9-м классе "Щелочные металлы"
Обучающие: формирование знаний учащихся о щелочных металлах как типичных металлах, понятия о взаимосвязи строения атомов со свойствами (физическими и химическими).
Развивающие: развитие умений исследовательской деятельности, умения добывать информацию из различных источников, сравнивать, обобщать, делать выводы.
Воспитывающие: воспитание устойчивого интереса к предмету, воспитание таких нравственных качеств как аккуратность, дисциплина, самостоятельность, ответственное отношение к порученному делу.
Методы: проблемные, поисковые, лабораторная работа, самостоятельная работа учащихся.
Оснащение: компьютер, таблица по технике безопасности, диск “Виртуальная лаборатория по химии”
Оборудование: коллекция щелочных металлов, коллекция применения щелочных металлов.
Ход урока
1. Организационный момент.
2. Вводное слово.
Мы изучаем раздел, металлы, и вы знаете, что металлы имеют большое значение в жизни современного человека. На предыдущих уроках мы изучили общие сведения о металлах: положение в периодической таблице, особенности строения атомов, изучили общие физические и химические свойства, а также общие способы получения металлов. Сегодня приступаем к изучению наиболее ярких представителей в химическом отношении, самых активных щелочных металлов. Для того чтобы усвоить материал урока, нам необходимо вспомнить наиболее важные вопросы, которые рассматривали на предыдущих уроках.
3. Актуализация знаний.
- На какие две большие группы происходит деление химических элементов?
- На металлы и неметаллы
- Где находятся металлы в периодической системе Д.И. Менделеева.
- В периодической системе элементы – металлы расположены в начале всех периодов, а также в четных рядах больших периодов побочных подгруппах. Условной границей, отделяющей металлы от неметаллов, служит диагональ, отведенная от бора к астату. Металлы оказываются левее и ниже этой прямой, неметаллы – правее и выше, а элементы, находящиеся вблизи прямой, имеют двойственную природу, их называют амфотерными.
- Какие группы естественных семейств в периодической системе мы знаем?
– Мы знаем особые группы отдельных металлов: щелочные металлы, щелочно-земельные металлы, редкоземельные металлы (иттрий, лантан и лантаноиды).
– Благородные металлы (серебро, золото и шесть платиновых металлов) . Платиновые металлы (платиноиды, рутений, родий, палладий, осмий, иридий, платина) металлы подгруппы алюминия.
– Каковы особенности строения атомов металлов?
- Атомы металлов имеют сравнительно большие атомные радиусы, поэтому их внешние электроны значительно удалены от ядра и слабо сними связаны. И вторая особенность, которая присуща атомам наиболее активных металлов – это наличие на внешнем энергетическом уровне 1-3 электронов.
- Как особенности строения атома влияют на физические свойства?
- Характерные физические свойства металлов металлический блеск, электрическая проводимость, теплопроводность, Связана с особенностью строения кристаллических решеток атомов металлов. В узлах располагаются атомы и положительные ионы металлов, связанные посредством обобществленных внешних электронов, которые принадлежат всему кристаллу, эти электроны компенсируют силы электростатического отталкивания между положительными ионами и тем самым связывают их, обеспечивая устойчивость металлической решетки.
- Как особенности строения металлов влияют на их химические свойства?
- Самое характерное химическое свойство всех металлов – их восстановительная способность, т.е. способность атомов легко отдавать свои внешние электроны, превращаясь в положительные ионы. Металлы не могут быть окислителями, т. е. атомы металлов не могут присоединять к себе электроны.
Учитель: Тема нашего урока “Щелочные металлы”
Задачи нашего урока: Дать общую характеристику щелочным металлам.
Рассмотреть их электронное строение, сравнить физические и химические свойства.
Узнать о важнейших соединениях металлов.
Определить области применения этих соединений.
- Что мы будем изучать в этой теме? Каков наш план урока?
- Мы будем изучать положение щелочных металлов в периодической системе; строение атома щелочных металлов, физические и химические свойства и применение щелочных металлов.
- Положение металлов в периодической системе Д.И. Менделеева.
- Строение атома щелочных металлов.
- Физические свойства.
- Химические свойства.
- Применение щелочных металлов.
Исходя, из полученных ранее знаний ответим на следующие вопросы: Для ответа воспользуемся периодической системой химических элементов Д.И. Менделеева .
1. .Перечислите щелочные металлы
- Это литий, натрий, калий, рубидий, цезий, франций.
2. Почему данные металлы назвали щелочными?
- При взаимодействии с водой они образуют растворимые в воде основания – щелочи.
3. Где располагаются щелочные металлы в ПСХЭ Д.И.Менделеева ?
- Щелочные металлы – это элементы главной подгруппы первой группы Периодической системы Д.И. Менделеева.
4.Почему данные металлы Д.И. Менделеев объединил в одну группу?
- На внешнем энергетическом уровне атомы элементов содержат по одному электрону, находящемся на сравнительно большом удалении от ядра.
5.Почему данные металлы Д.И. Менделеев объединил в одну группу?
- Они легко отдают электроны, поэтому являются очень сильными восстановителями. Во всех соединениях проявляют степень окисления +1.
- Просматриваем кадры виртуальной лаборатории, вы внимательно смотрите и готовите ответы на вопросы.
(Кадры о положение в периодической системе и строение атома)
- Какую степень окисления проявляют щелочные металлы в соединениях?
- Щелочные металлы проявляют степень окисления + 1
- Как изменяются восстановительные свойства щелочных металлов от лития к цезию?
Ученик: От лития к цезию восстановительные свойства усиливаются, активный металл цезий. Это наиболее типичные представители металлов: металлические свойства выражены у них особенно ярко.
- Сделаем вывод о строении атома щелочных металлов.
- Вывод: У щелочных металлов одинаковое количество электронов на внешнем уровне, и они проявляют одинаковую степень окисления.
Учитель: Записать строение атомов щелочных металлов в тетрадь.
Итак, мы рассмотрели положение щелочных металлов в периодической системе, рассмотрели строение атомов щелочных металлов.
- Обратим внимание на коллекцию щелочных металлов, их хранят в керосине, легко режутся ножом и быстро окисляются на воздухе. Исходя из строения атома, познакомимся с физическими свойствами щелочных металлов. Для металлов характерна низкая твердость, вернее мягкость, труднее всего резать литий, тогда как натрий и калий легко поддаются скальпелю. На основании таблицы, сделаем вывод о физических свойствах щелочных металлов.
Некоторые физические свойства щелочных металлов
| металлы | цвет | Радиус,нм | t пл.,С | t кип., C | плотность г/см3 | твердость |
| литий | Серебристо- белый | 155 | 179 | 137 | 0,53 | 0,6 |
| натрий | тот - же | 189 | 97,8 | 883 | 0,97 | 0,4 |
| калий | 236 | 63,7 | 766 | 0,86 | 0,5 | |
| рубидий | 248 | 38,7 | 713 | 1,52 | 0,3 | |
| цезий | золотисто - белый | 267 | 28,5 | 690 | 1,87 | 0,2 |
| франций | В природе не существует в таких количествах, которые достаточны для изучения его свойств. | |||||
- Каков внешний вид и твердость щелочных металлов?
- Щелочные металлы серебристо-белые вещества (режутся ножом), с характерным блеском на свежесрезанной поверхности.
- С возрастанием радиуса атома, от лития к цезию, наблюдается закономерность в их физических свойствах. Обратите внимание на таблицу. Как изменяется плотность щелочных металлов в группе?
- Все они легкие и легкоплавкие плотность их меньше 5 г/см 3 ,
- Сравните щелочные металлы по твердости.
- Самый твердый из щелочных металлов литий, самый легкий цезий.
- Сделаем вывод исходя из физических свойств щелочных металлов.
- По мере увеличения характера изменения физических свойств, возрастает плотность металлов, а твердость, температура плавления и кипения уменьшаются.
Затем учащиеся сравнивают физические показатели плотности металлов и температуры плавления. Делают вывод о зависимости температуры плавления от плотности металла.
Проблема: В каком виде щелочные металлы встречаются в природе?
Почему в природе щелочные металлы в основном существуют в виде соединений?
Ответ: В природе щелочные металлы находятся в виде соединений, потому что обладают высокой химической активностью, которая в свою очередь, зависит от особенностей электронного строения атомов (наличие одного неспаренного электрона на внешнем энергетическом уровне)
- Какие места по распространенности в земной коре занимают элементы натрий и калий?
Натрий шестое, а калий седьмое.
Физкультминутка – отдых глазам.
- Зная общие физические свойства, активность металлов, предположите химические свойства щелочных металлов. С какими веществами взаимодействуют щелочные металлы?
- Щелочные металлы взаимодействуют как с простыми веществами, и сложными. Активно взаимодействуют почти со всеми неметаллами ( с галогенами, водородом, образуя гидриды). Из сложных веществ с водой – образуя растворимые в воде основания – щелочи и с кислотами.
- А теперь на опытах убедимся, в правильности наших предположениях о химических свойствах щелочных металлов.
Лабораторная работа по виртуальной лаборатории
Цель: провести реакции, подтверждающие химические свойства щелочных металлов.
- работать в вытяжном шкафу
- на подносе
- сухими руками
- брать в малых количествах
Работаем с текстом, который читаем по виртуальной лаборатории.
Опыт № 1.Взаимодействие натрия с водой.
Опыт № 2. Взаимодействие лития, натрия, калия с водой.
Опыт № 3. Горение лития.
Опыт № 4. Горение натрия.
Опыт № 5. Горение калия.
Записать уравнения реакции и наблюдения в тетрадь.
- Проверим правильность написания уравнений на доске.
Учитель: Пользуясь учебником, подготовьте рассказ о применении щелочных металлов.
Основные характеристики и свойства щелочных металлов
Название «щелочные металлы» произошло от их способности в реакциях с водой образовывать щелочи — основания, растворимые в воде. Слово «выщелачивать» славянского происхождения. В переводе оно означает «растворять».
Щелочными называют металлы IA группы таблицы Менделеева. Их шесть: литий, натрий, рубидий, калий, цезий, франций. По внешнему виду они представляют собой металлы серебристо-белого цвета, за исключением цезия — он золотисто-желтый. Основные физические свойства простых веществ:
- пластичность;
- мягкость;
- невысокая плотность;
- высокая химическая активность;
- легкая окисляемость;
- электропроводность;
- теплопроводность;
- легкоплавкость.
В связи со способностью быстро окисляться, т.е. вступать в реакцию с кислородом и другими веществами, в природе они встречаются в форме соединений.
Соли щелочных металлов окрашивают пламя спиртовки в различные цвета:
В отличие от этих двух представителей, литий, рубидий, цезий не встречаются в природе часто. Следовательно, они относятся к группе редких металлов. Франций — искусственно полученный элемент, отличающийся радиоактивностью.
Калий и натрий являются участниками водно-солевого, а также кислотно-щелочного баланса организма человека. Эти элементы важны для циркуляторных процессов крови, деятельности энзимов. Для жизнедеятельности растений особенно важен калий.
Щелочные металлы имеют валентность, равную единице (степень окисления +1).
Поскольку данная группа элементов в системе Менделеева следует непосредственно за инертными газами, у атомов щелочных металлов появляется новый энергетический уровень, на котором содержится один электрон. Электронная конфигурация — ns1.
Поскольку любой атом стремится приобрести конфигурацию инертного газа, атомы щелочных металлов способны легко отдать валентные электроны и проявлять восстановительные свойства. Этот факт свидетельствует о невысоких значениях энергии ионизации их атомов, а также о низких значениях электроотрицательности.
Сверху вниз по группе наблюдается увеличение радиуса атомов, снижение электроотрицательности, увеличение восстановительных свойств простых веществ.
Какие элементы относятся к щелочным металлам
Перечень щелочных металлов:
- литий — Li;
- натрий — Na;
- калий — K;
- рубидий — Rb;
- цезий — Zs;
- франций — Fr.
Они занимают IA группу в Периодической системе Д. И. Менделеева.
Электронная формула, в какую группу входят
Строение атомов щелочных металлов, которые расположены в IA группе, можно свести к таблице следующего вида:
В роли окислителей в таких взаимодействиях участвуют простые и сложные вещества. Это могут быть неметаллы, органические соединения, кислоты, соли, оксиды.
Каждый элемент взаимодействует индивидуально.
Оксид в качестве продукта образовывается только в реакциях лития:
4 L i + O 2 = 2 L i 2 O
В случае с натрием в ходе реакции образуется пероксид, а с калием, рубидием, цезием — надпероксид:
2 N a + O 2 = N a 2 O 2
- К реакциям с простыми веществами относится образование галогенидов:
2 N a + C l 2 = 2 N a C l
Рассматривая взаимодействие с H2, S, P, C, Si, необходимо знать, что для протекания данных реакций необходимо нагревание.
Литий реагирует с азотом при комнатной температуре.
- Реакции с водой протекают у щелочных металлов по-разному: литий — спокойно, всплывая на поверхность жидкости, натрий реагирует более активно с образованием пламени, калий, цезий и рубидий реагируют со взрывом. В общем виде
2 M + 2 H 2 O = 2 M O H + H 2 (М – металл)
- В два этапа протекают реакции с кислотами. Металл сначала вступает в реакцию с водой, а после, в момент образования щелочи, она реагирует с разбавленной кислотой и нейтрализуется. Такие реакции часто протекают со взрывом, поэтому на практике проводятся редко.
- В результате реакции с аммиаком образуются амиды:
2 L i + 2 N H 3 = 2 L i N H 2 + H 2
- Взаимодействие с этанолом, фенолами, в ходе которого щелочные металлы замещают атомы водорода в гидроксильной группе ОН этих соединений:
2 N a + 2 C 2 H 5 O H = 2 C 2 H 5 O N a + H 2
- Щелочные металлы могут использоваться для восстановления других металлов, к примеру, алюминия:
3 N a + A l C l 3 = A l + 3 N a C l
Физические свойства щелочных металлов объясняются металлической связью в кристаллической решетке. Для них характерен металлический блеск, отличная ковкость, пластичность, тепло- и электропроводность.
Самым твердым из всей группы является литий, а самая высокая плотность у цезия. Некоторые физические свойства щелочных металлов в сравнении представлены в следующей таблице:
Из таблицы следует, что все элементы получили свое применение благодаря низким температурам плавления (кипения). Их значения снижаются по мере увеличения порядкового номера в Периодической системе Менделеева.
Все металлы, за исключением лития, настолько мягки, что их можно разрезать ножом или на специальном оборудовании раскатать в лист фольги.
Еще одно свойство, которое имеет практическое значение в промышленности — низкая плотность. Плотность лития, натрия и калия ниже плотности воды.
Указанные физические свойства обусловлены слабой связью электронов внешних слоев с атомами щелочных металлов. Поэтому энергия ионизации атомов невысокая, и они при взаимодействии друг с другом образуют металлическую связь.
В периодической таблице в начале каждого периода стоит элемент с низкой температурой плавления (щелочной металл). По мере увеличения порядковых номеров в периоде слева направо этот показатель сначала увеличивается к середине периода (IV А группа), где расположены элементы, образующие преимущественно атомные кристаллические решетки (C, Si).
Затем в конце периода температуры плавления снова уменьшаются, поскольку в VII-VIII группах расположены элементы, простые вещества которых характеризуются молекулярными кристаллическими решетками (галогены, благородные газы).
Меры предосторожности при работе с ними
Из-за высокой химической активности работа со щелочными металлами должна осуществляться с большой осторожностью. Для их хранения выделяются отдельные емкости, которые запаивают и помещают в них слой вазелинового масла или керосина. Тогда предотвращается взаимодействие с воздухом, в частности с кислородом, и исключается горение.
На каждом предприятии, где осуществляются работы с этими химическими элементами и их соединениями, разрабатываются специальные правила безопасности и меры предосторожности, исключающие наступление аварийных ситуаций и производственных травм.
Все сотрудники перед получением допуска к работе должны пройти обязательный производственный инструктаж, который бывает предварительный (перед началом работы) и периодический (через равные промежутки времени — ежеквартально, ежегодно). Они включают качественное изучение требований нормативных документов по безопасности труда и производственному нормированию.
Сотрудники на своих рабочих местах должны находиться в защитной спецодежде, быть оснащены средствами индивидуальной защиты (для органов зрения, дыхания, кожных покровов).
Поскольку растворы щелочных металлов — щелочи, их воздействие на кожу может привести к ожогам и раздражениям. Щелочи при попадании брызг в глаза могут спровоцировать отторжение ветвей глазного нерва и вызвать полную слепоту.
Выше описана возможность бурной реакции металлов с кислородом вплоть до взрыва. Поэтому рабочие места укомплектовываются средствами пожаротушения, которые периодически проходят технические проверки своей исправности. Щелочные металлы нельзя тушить водой, так как они вступают в реакцию с ней.
Натрий и калий можно тушить аргоном и азотом. Аргон эффективнее, поскольку существенно тяжелее воздуха. Литий продолжает гореть в атмосфере азота и диоксида углерода. Для тушения горящего лития разработаны специальные порошковые составы Вексон-D3 на основе различных флюсов и графита с гидрофобизирующими добавками.
С соблюдением техники безопасности проводится и утилизация отходов после работы. Они подвергаются нейтрализации с применением специальных составов, разрешенных для применения компетентными органами.
Получение простых веществ, где применяются
Чистый натрий можно получать путем электролиза расплава хлорида натрия с графитовыми электродами, обладающими инертностью. Поскольку в таком расплаве имеются ионы Na и Cl, в ходе электролиза на катоде восстанавливаются катионы натрия до металлического натрия, а на аноде — окисляются анионы хлора до газообразного хлора.
Металлы IA группы
Эти металлы — очень активные! Именно их кидают в ванны с водой, в результате чего происходят мощщные взрывы.
Щелочные металлы
IA группа называется главной подгруппой первой группы, в которую входят щелочные металлы: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.
Щелочные металлы — серебристо-белые металлы с высокой электро- и теплопроводностью, обладают ковкостью, пластичностью и металлическим блеском.
Главная особенность строения атомов химических элементов IA группы заключается в том, что они содержат один электрон на внешнем энергетическом уровне — их электронная конфигурация ns 1 .
Из этого следует, что атомам щелочных металлов энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа, приобретая при этом степень окисления +1.
Основным способом получения таких металлов является электролиз расплавов солей.
Химические свойства
Их химические свойства крайне логичны:
- как типичные металлы они будут вступать в реакции со своими противоположностями — неметаллами;
- как восстановители — реагировать с окислителями (в том числе восстанавливать металлы и неметаллы из их оксидов);
- как металлы, стоящие в ряду активности до водорода — вступать в реакции вытеснения с водой, кислотами-неокислителями и солями менее активных металлов.
- Реакции с неметаллами
Как типичные восстановители, щелочные металлы могут взаимодействовать со своими противоположностями — неметаллами.
| Гидриды металлов подвергаются необратимому гидролизу |
В реакциях с щелочными металлами кислород образует ряд веществ:
- литий («кандидат от народа»), как и подавляющее большинство металлов, образует оксид;
4Li + O2 = 2Li2O - натрий образует пероксид;
2Na + O2 = Na2O2 - калий и все нижестоящие металлы — надпероксиды/супероксиды.
K + O2 = KO2
- Реакции с водой
В ряду активности щелочные металлы находятся до водорода, поэтому они способны вытеснять водород из воды:
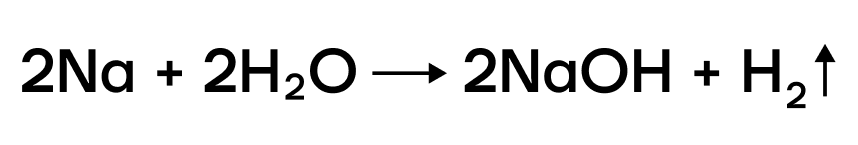
Можно представить воду как HOH, тогда металл (например, натрий) будет замещать один из атомов водорода с образованием NaOH.
За счет крайне низких значений электроотрицательности металлы очень слабо притягивают к себе электроны, а следовательно, у них «легко их украсть». Делаем вывод: в ОВР щелочные металлы проявляют ярко выраженные восстановительные свойства, повышая в реакциях степени окисления.
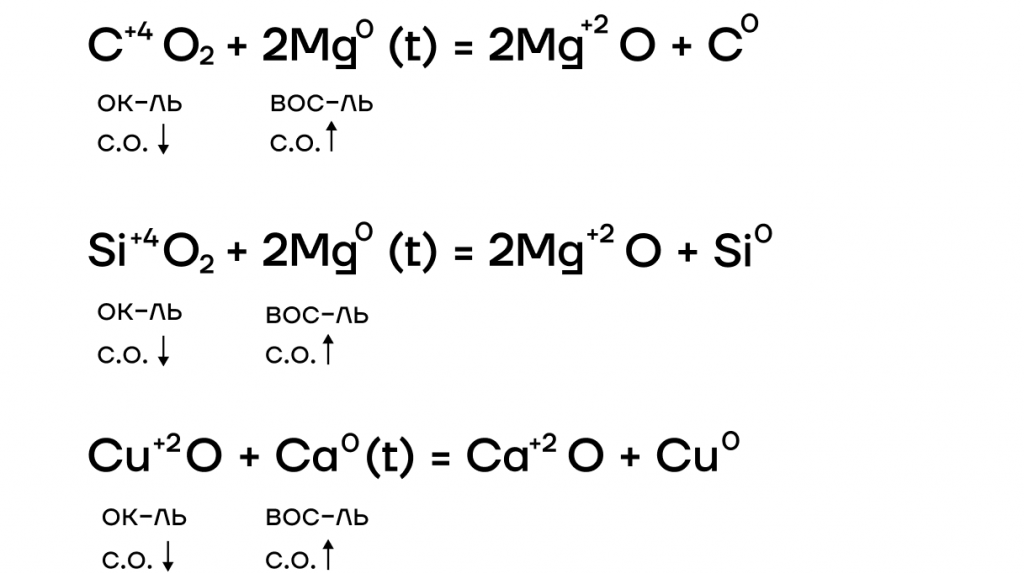
Оксиды щелочных металлов
По физическим свойствам это — бесцветные кристаллические вещества, хорошо растворимые в воде.
Они являются основными оксидами, поэтому:

- вступают в основно-кислотные взаимодействия со своими противоположностями, обладающими кислотными свойствами: кислотами, кислотными оксидами, амфотерными оксидами и гидроксидами:
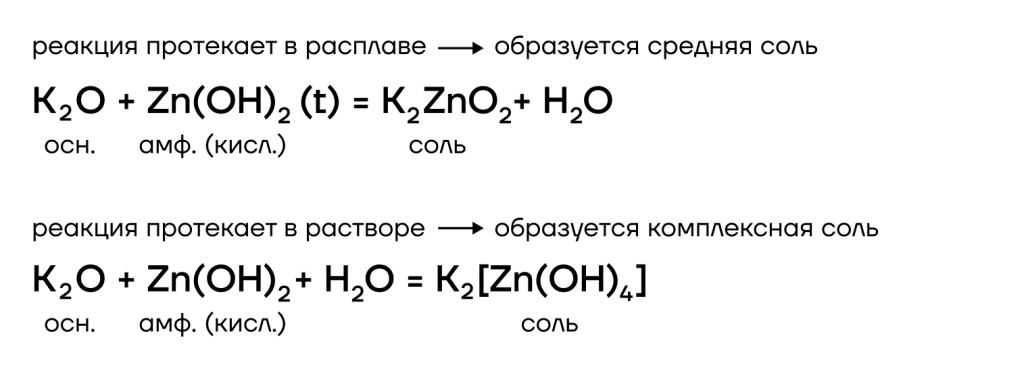
Гидроксиды щелочных металлов
Что же это такое? По-другому их называют щелочами. Они представляют собой бесцветные кристаллические вещества, хорошо растворимые в воде.
По химическим свойствам они являются типичными сильными основаниями, то есть:
- диссоциируют в растворах с образованием гидроксид-анионов. создавая в растворах щелочную среду:
- вступают в основно-кислотные взаимодействия со своими противоположностями (кислотами и кислотными оксидами + амфотерные оксиды и гидроксиды), образуя соли;
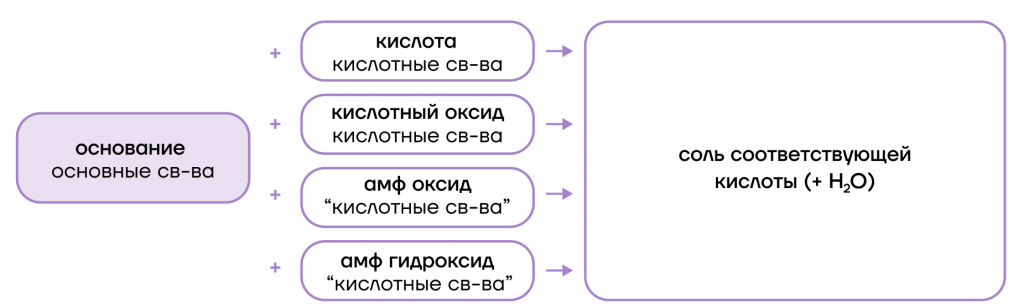
- вступают в реакции ионного обмена с кислотами и солями:
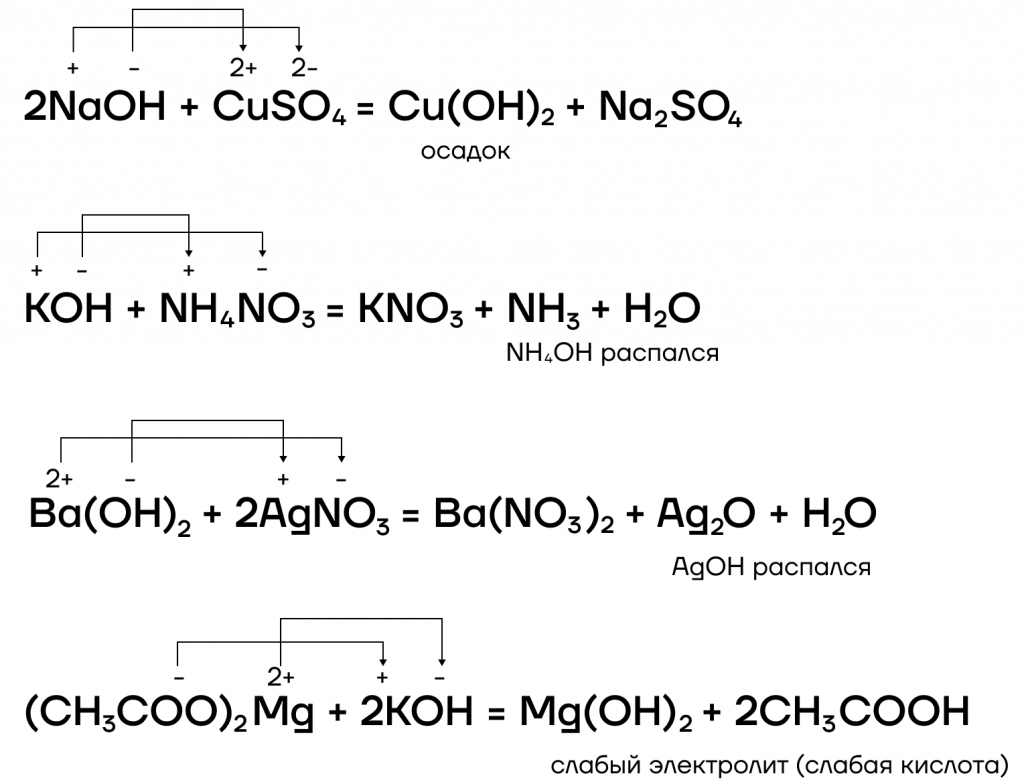
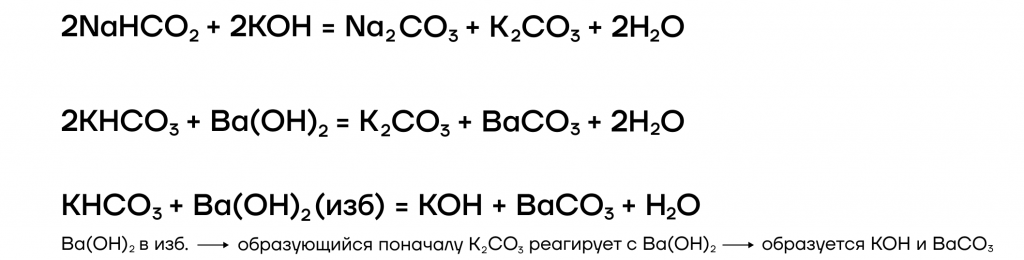
Какие же специфические свойства щелочей существуют? Рассмотрим некоторые из них:
- Окислительно-восстановительные реакции с металлами
Из металлов со щелочами напрямую взаимодействуют только амфотерные бериллий Be, цинк Zn, алюминий Al.
| Эти металлы можно запомнить по аббревиатуре BeZnAl |
А какие соли тогда будут образовываться? В растворе образуются комплексные соли, а в расплаве (t) — средние. В качестве еще одного продукта реакции выделяется газообразный водород.
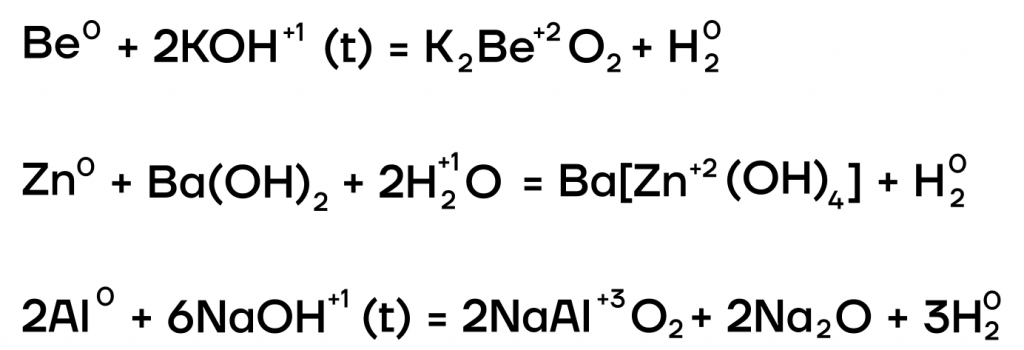
- Окислительно-восстановительные реакции с неметаллами
Неметаллы, которые могут реагировать со щелочами, можно запомнить по «крестообразному» расположению в таблице Менделеева:

Пероксиды щелочных металлов
Что же такое пероксиды? Пероксиды — сложные вещества, которые содержат группу —О—О—, где кислород имеет степень окисления −1.
Фактчек
- Металлы IA группы называются щелочными металлами, которые представлены литием, натрием, калием, рубидием, цезием и францием.
- Постоянная валентность щелочных металлов I, постоянная степень окисления — +1.
- Основной способ получения щелочных металлов — электролиз расплавов солей.
- Щелочные металлы — чрезвычайно активные металлы, могут реагировать с большим рядом простых веществ, с водой.
Проверь себя
Задание 1.
Какой из щелочных металлов имеет самое большое число электронов?
Задание 2.
Щелочные металлы имеют постоянную степень окисления:
Задание 3.
Щелочные металлы образуют с серой соединения, называемые:
- Сульфиты;
- Сульфиды;
- Сульфаты;
- Сульфонаты.
Задание 4.
При реакции калия с кислородом образуется:
- Оксид калия;
- Пероксид калия;
- Супероксид калия;
- Озонид калия
Задание 5.
При внесении солей натрия в пламя оно приобретает окраску:
- Фиолетовую;
- Желтую;
- Небесно-голубую;
- Малиновую
Ответы: 1. — 6; 2. — 1; 3. — 2; 4. — 3; 5. — 2.
Химические свойства металлов и их соединений
Щелочные металлы — общая характеристика, строение атомов, физические и химические свойства
Щелочные металлы — металлы, расположенные в главной подгруппе первой группы периодической системы химических элементов Д.И. Менделеева (в 1 группе в длиннопериодной форме ПСХЭ).
К щелочным металлам относят:
- литий Li;
- натрий Na;
- калий K;
- цезий Cs;
- рубидий Rb;
- франций Fr.
Внешний энергетический уровень щелочных металлов обладает следующей электронной конфигурацией: n s 1 . На внешнем энергетическом уровне расположен 1 s-электрон. Таким образом, для щелочных металлов типичной является степень окисления в соединениях +1.
В ряду L i - N a - K - R b - C s - F r , согласно Периодическому закону, можно выявить следующие закономерности:
- увеличение атомного радиуса;
- усиление металлических свойств;
- ослабление неметаллических свойств;
- снижение степени электроотрицательности.
Общие физические свойства щелочных металлов:
- металлическая кристаллическая решетка у твердого вещества;
- высокая теплопроводность;
- высокая электропроводимость;
- низкие температуры кипения;
- низкие температуры плавления;
- небольшие показатели плотности.
Щелочные металлы являются мягкими веществами с серебристой окраской. На свежем срезе можно наблюдать характерный блеск.
Высокая химическая активность щелочных металлов при контакте с водой, кислородом, в некоторых случаях с азотом ( L i ) , объясняет наличие особых требований к режиму хранения. Материалы помещают под слой керосина. Перед проведением химического опыта от щелочного металла отделяют фрагмент необходимого размера с помощью скальпеля под слоем керосина. Затем в атмосфере аргона удаляют с металлической поверхности продукты, образованные при его реакции с воздухом. После этого фрагмент перемещают в резервуар для проведения реакций.
Одним из ключевых свойств щелочных металлов является высокая степень активности при взаимодействии с водой.
Относительно спокойная реакция без взрыва наблюдается при контакте лития с водой:
2 L i + 2 H 2 O ⟶ 2 L i O H + H 2 ↑ 2 L i + 2 H 2 O ⟶ 2 L i O H + H 2 ↑
Аналогичный химический процесс с натрием сопровождается горением пламенем желтого цвета и небольшим взрывом. Калий проявляет большую активность по сравнению с натрием. При такой реакции происходит сильный взрыв, а пламя приобретает фиолетовую окраску.
Щелочные металлы взаимодействуют с кислородом. В результате горения щелочных металлов в воздушной среде образуются вещества различного состава. Компонентный набор продуктов реакции определяется активностью металла.
Горение лития в воздушной среде приводит к образованию оксида стехиометрического состава:
4 L i + O 2 ⟶ 2 L i 2 O 4 L i + O 2 ⟶ 2 L i 2 O
Натрий горит на воздухе, что сопровождается синтезом пероксида N a 2 O 2 с небольшой добавкой в виде надпероксида N a O 2 :
2 N a + O 2 ⟶ N a 2 O 2 2 N a + O 2 ⟶ N a 2 O 2
Продукты, образованные в процессе горения калия, рубидия и цезия, включают в состав, как правило, надпероксиды:
K + O 2 ⟶ K O 2 K + O 2 ⟶ K O 2
R b + O 2 ⟶ R b O 2 R b + O 2 ⟶ R b O 2
C s + O 2 ⟶ C s O 2 C s + O 2 ⟶ C s O 2
Синтезировать оксиды натрия и калия можно путем повышения температуры смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствии кислорода:
2 N a + 2 N a O H ⟶ 2 N a 2 O + H 2 ↑ 2 N a + 2 N a O H ⟶ 2 N a 2 O + H 2 ↑
2 N a + N a 2 O 2 ⟶ 2 N a 2 O 2 N a + N a 2 O 2 ⟶ 2 N a 2 O
3 K + K O 2 ⟶ 2 K 2 O 3 K + K O 2 ⟶ 2 K 2 O
Кислородные соединения щелочных металлов обладают уникальной особенностью. Закономерно с увеличением радиуса катиона щелочного металла повышается степень устойчивости кислородных соединений, в состав которых входят пероксид-ион ( О 2 ) 2 - и надпероксид-ион ( О 2 ) - .
Тяжелые щелочные металлы способны формировать достаточно устойчивые озониды Э О 3 . Кислородные соединения щелочных металлов обладают различной окраской, интенсивность которой повышается от Li до Cs:
Проявление пероксидами и надпероксидами свойств сильных окислителей:
N a 2 O 2 + 2 N a I + 2 H 2 S O 4 ⟶ I 2 + 2 N a 2 S O 4 + 2 H 2 O N a 2 O 2 + 2 N a I + 2 H 2 S O 4 ⟶ I 2 + 2 N a 2 S O 4 + 2 H 2 O
Интенсивное взаимодействие пероксидов и надпероксидов с водой, что сопровождается формированием гидроксидов:
N a 2 O 2 + 2 H 2 O ⟶ 2 N a O H + H 2 O 2 N a 2 O 2 + 2 H 2 O ⟶ 2 N a O H + H 2 O 2
2 K O 2 + 2 H 2 O ⟶ 2 K O H + H 2 O 2 + O 2 ↑ 2 K O 2 + 2 H 2 O ⟶ 2 K O H + H 2 O 2 + O 2 ↑
Щелочные металлы вступают в химические реакции со многими неметаллами. В процессе нагрева вещества формируют соединения с водородом. В результате образуются гидриды. Щелочные металлы могут взаимодействовать со следующими веществами:
- галогены;
- сера;
- азот;
- фосфор;
- углерод;
- кремний.
В результате таких химических реакций образуются соответственно:
- галогениды;
- сульфиды;
- нитриды;
- фосфиды;
- карбиды;
- силициды.
2 N a + H 2 ⟶ 2 N a H 2 N a + H 2 ⟶ 2 N a H
2 N a + C l 2 ⟶ 2 N a C l 2 N a + C l 2 ⟶ 2 N a C l
2 K + S ⟶ K 2 S 2 K + S ⟶ K 2 S
6 L i + N 2 ⟶ 2 L i 3 N 6 L i + N 2 ⟶ 2 L i 3 N
Последняя реакции протекает при комнатной температуре.
2 L i + 2 C ⟶ L i 2 C 2 2 L i + 2 C ⟶ L i 2 C 2
При повышении температуры происходят химические реакции щелочных металлов с другими металлами. Продуктами данной реакции являются соединения металлов — интерметаллиды.
Активно протекает взаимодействие щелочных металлов с кислотами. Процесс сопровождается взрывом.
Растворение щелочных металлов в жидком аммиаке и его производных — аминах и амидах:
2 N a + 2 N H 3 ⟶ 2 N a N H 2 + H 2 ↑ 2 N a + 2 N H 3 ⟶ 2 N a N H 2 + H 2 ↑
Растворяясь в жидком аммиаке, щелочной металл утрачивает электрон, который сольватируется молекулами аммиака и окрашивает раствор в голубой цвет. Образованные в результате амиды достаточно просто разлагаются водой, что приводит к образованию щелочи и аммиака:
K N H 2 + H 2 O ⟶ K O H + N H 3 ↑ K N H 2 + H 2 O ⟶ K O H + N H 3 ↑
Щелочные металлы вступают в химические реакции с органическими веществами.
При взаимодействии щелочных металлов со спиртами образуются алкоголяты. Если вещество контактирует с карбоновыми кислотами, продуктом реакции являются соли.
2 N a + 2 C H 3 C H 2 O H ⟶ 2 C H 3 C H 2 O N a + H 2 ↑ 2 N a + 2 C H 3 C H 2 O H ⟶ 2 C H 3 C H 2 O N a + H 2 ↑
2 N a + 2 C H 3 C O O H ⟶ 2 C H 3 C O O N a + H 2 ↑ 2 N a + 2 C H 3 C O O H ⟶ 2 C H 3 C O O N a + H 2 ↑
Щелочные металлы распознают по окраске пламени спиртовки, если в него вносить их соединения. По причине небольших потенциалов ионизации щелочных металлов при нагреве металла или его соединений в пламени происходит ионизация атомов. В результате пламя приобретает определенную окраску:
Соединения щелочных металлов, примеры
Получение гидроксидов щелочных металлов связано с применением электролитических способов. Самым крупнотоннажным является получение гидроксида натрия с помощью реакции электролиза концентрированного водного раствора поваренной соли:
2 N a C l + 2 H 2 O ⟶ H 2 ↑ + C l 2 ↑ + 2 N a O H 2 N a C l + 2 H 2 O ⟶ H 2 ↑ + C l 2 ↑ + 2 N a O H
катод: 2 H + + 2 e ⟶ H 2 ↑ 2 H + + 2 e ⟶ H 2 ↑
анод: 2 C l - - 2 e ⟶ C l 2 ↑ 2 C l - - 2 e ⟶ C l 2 ↑
В прошлом для получения щелочи применяли реакцию обмена:
N a 2 C O 3 + C a ( O H ) 2 ⟶ C a C O 3 ↓ + 2 N a O H N a 2 C O 3 + C a ( O H ) 2 ⟶ C a C O 3 ↓ + 2 N a O H
Продуктом данной реакции является щелочь с большой концентрацией соды N a 2 C O ) 3 .
Гидроксиды щелочных металлов представляют собой гигроскопичные вещества с белой окраской, водные растворы которых являются сильными основаниями.
Гидроксиды щелочных металлов, как и все основания, вступают в химические реакции с кислотами, кислотными и амфотерными оксидами, амфотерными гидроксидами:
2 L i O H + H 2 S O 4 ⟶ L i 2 S O 4 + 2 H 2 O 2 L i O H + H 2 S O 4 ⟶ L i 2 S O 4 + 2 H 2 O
2 K O H + C O 2 ⟶ K 2 C O 3 + H 2 O 2 K O H + C O 2 ⟶ K 2 C O 3 + H 2 O
K O H + A l ( O H ) 3 ⟶ K [ A l ( O H ) 4 ] K O H + A l ( O H ) 3 ⟶ K [ A l ( O H ) 4 ]
Если нагреть гидроксиды щелочных металлов, то вещества возгоняются без разложения. Исключение составляет гидроксид лития, который аналогично гидроксидам металлов главной подгруппы II группы, в процессе прокаливания разлагается на оксид и воду:
2 L i O H ⟶ L i 2 O + H 2 O 2 L i O H ⟶ L i 2 O + H 2 O
Гидроксид натрия используют в производстве твердого мыла и других веществ:
- моющих средств синтетического состава;
- волокон искусственного происхождения;
- органических соединений таких, как фенол.
Ценным продуктом, в состав которого входит щелочной металл, является сода N a 2 C O 3 . Большую часть от объемов мирового производства соды получают с помощью методики Сольве. Данный метод был изобретен в начале XX столетия. Принцип технологии заключается в следующем: водный раствор N a C l с добавлением аммиака насыщают углекислым газом при температуре 26—30 °C. В результате синтезируют гидрокарбонат натрия с низкой степенью растворимости, который получил название питьевой соды:
N a C l + N H 3 + C O 2 + H 2 O ⟶ N a H C O 3 ↓ + N H 4 C l N a C l + N H 3 + C O 2 + H 2 O ⟶ N a H C O 3 ↓ + N H 4 C l
С целью нейтрализовать кислотную среду, которая формируется при пропускании углекислого газа через раствор, добавляют аммиак. Таким образом, получают гидрокарбонат-ион ( H C O 3 ) - , который требуется для того, чтобы продукт выпал в осадок. После того, как отделяется питьевая сода, раствор с хлоридом аммония нагревают с известью и выделяют аммиак, что позволяет вернуть его в зону реакции:
2 N H 4 C l + C a ( O H ) 2 ⟶ 2 N H 3 ↑ + C a C l 2 + 2 H 2 O 2 N H 4 C l + C a ( O H ) 2 ⟶ 2 N H 3 ↑ + C a C l 2 + 2 H 2 O
Аммиачный способ производства соды характеризуется наличием единственного отхода в виде хлорида кальция. Данное вещество остается в растворе и обладает ограниченным применением.
С помощью прокаливания гидрокарбоната натрия можно получить кальцинированную, или стиральную, соду Na_CO_ и диоксид углерода, который используют в синтезе гидрокарбоната натрия:
2 N a H C O 3 ⟶ N a 2 C O 3 + C O 2 ↑ + H 2 O 2 N a H C O 3 ⟶ N a 2 C O 3 + C O 2 ↑ + H 2 O
Большую часть произведенной соды потребляют предприятия стекольной промышленности.
Гидрокарбонат калия K H C O 2 по сравнению с малорастворимой кислой солью N a H C O 3 хорошо растворяется в воде. По этой причине карбонат калия, или поташ, K 2 C O 3 получают путем химической реакции углекислого газа с раствором гидроксида калия:
Поташ активно применяют в производстве стекла и жидкого мыла.
Литий является единственным из всех щелочных металлов, для которого не получен гидрокарбонат. Данное обстоятельство объясняется слишком маленьким радиусом иона лития, не позволяющим ему удерживать достаточно крупный ион ( H C O 3 ) - .
Оксиды щелочных металлов, за исключением лития, получают исключительно косвенными методами. В процессе натрий взаимодействует с окислителями в расплаве.
Получение оксида натрия путем реакции натрия с нитратом натрия в расплаве:
Взаимодействие натрия с пероксидом натрия:
Химическая реакция между натрием и расплавом щелочи:
Получение оксида лития путем разложения гидроксида лития:
Оксиды щелочных металлов по описанию являются типичными основными оксидами. Соединения взаимодействуют со следующими веществами:
- кислотные оксиды;
- амфотерные оксиды;
- кислоты;
- вода.
Взаимодействие оксида натрия с оксидом фосфора (V):
Реакция оксида натрия с амфотерным оксидом алюминия:
При взаимодействии оксидов щелочных металлов с кислотами образуются средние и кислые соли (с многоосновными кислотами). К примеру, оксид калия вступает в химическую реакцию с соляной кислотой, что сопровождается образованием хлорида калия и воды:
Можно наблюдать активное взаимодействие оксидов щелочных металлов с водой. Продуктом такой реакции являются щелочи. К примеру, оксид лития взаимодействует с водой, что сопровождается образованием гидроксида лития:
Окисление оксидов щелочных металлов кислородом (за исключением оксида лития) происходит так, что оксид натрия окисляется до пероксида, оксиды калия, рубидия и цезия — до надпероксида. К примеру, уравнение реакции:
Получение и применение щелочных металлов
Существует несколько основных способов получения щелочных металлов:
- электролиз расплавов галогенидов;
- электролиз расплавов гидроксидов;
- восстановление из галогенидов.
Получить щелочные металлы можно с помощью электролиза расплавов их галогенидов. Это основной способ получения данных веществ. Как правило, применяют хлориды, которые образуют природные минералы:
2 L i C l ⟶ 2 L i + C l 2 ↑ 2 L i C l ⟶ 2 L i + C l 2 ↑
катод: L i + + e ⟶ Li L i + + e ⟶ Li
В некоторых случаях оправдано получение щелочных металлов с помощью электролиза расплавов их гидроксидов (гидроксиды зачастую имеют более низкие температуры плавления):
4 N a O H ⟶ 4 N a + 2 H 2 O + O 2 ↑ 4 N a O H ⟶ 4 N a + 2 H 2 O + O 2 ↑
катод: N a + + e ⟶ Na N a + + e ⟶ Na
анод: 4 O H - - 4 e ⟶ 2 H 2 O + O 2 ↑ 4 O H - - 4 e ⟶ 2 H 2 O + O 2 ↑
Щелочной металл удается восстановить из соответствующего хлорида или бромида кальцием, магнием, кремнием и другими восстановителями в процессе повышения температуры в вакуумной среде до 600—900 °C:
2 M C l + C a ⟶ 2 M ↑ + C a C l 2 2 M C l + C a ⟶ 2 M ↑ + C a C l 2
С целью задать химической реакции нужное направление необходимо удалить образованный свободный щелочной металл (M) с помощью отгонки. Таким же способом восстанавливают цирконий из хромата. Известно, что получить натрий можно, если восстановить его из карбоната углем при температуре в 1000 °C с добавлением известняка.
В связи с тем, что щелочные металлы в электрохимическом ряду напряжений расположены слева от водорода, электролитическое получение их из водных растворов солей не представляется возможным. В таком случае продуктами реакции являются соответствующие щелочи и водород.
Читайте также:
