Почему щелочные металлы не встречаются в природе в чистом виде
Обновлено: 15.05.2024
С детства мы знаем, что существуют металлы и неметаллы. Металлы – это твердые вещества, обладающие металлическим блеском, проводящие электрический ток и тепло. Они ковкие, благодаря чему металлические изделия можно использовать во вторичном производстве. Но, оказывается, как химические элементы, металлы сильно отличаются друг от друга. Существуют такие металлы, которые нельзя брать в руки и мочить, потому что это может привести к травмам и серьезным ожогам. О таких металлах поговорим в этой статье.
План урока:
Представители щелочных металлов
Щелочные металлы – это группа высокоактивных металлов. Название происходит от продукта взаимодействия этих веществ с водой, в результате которой образуется щелочь (сложное химическое соединение). Найти в природе такие металлы, сделать из них изделие или просто хранить в виде слитка невозможно. Эти металлы сразу окисляются кислородом воздуха.
К щелочным металлам относятся: литий, натрий, калий, рубидий, цезий, франций.
Строение атомов щелочных металлов
В таблице Менделеева щелочные металлы расположены в первой группе. Такое положение не случайно, а отражает строение атома и химические свойства.
Химические свойства элементов напрямую зависят от строения атома. Атом любого элемента состоят из ядра, имеющего положительный заряд и электронов, образующих энергетически облака вокруг ядра.
Ядро и электроны притягиваются за счет электростатического напряжения. Соответственно, чем меньше у электрона силы сопротивления, тем ближе он будет к ядру. Электроны с большей энергией способны отдаляться на периферию атома.
По мере смены периодом, количество электронов и энергетических уровней будет увеличиваться. Общий параметр атомов всех щелочных металлов является 1 электрон на внешнем энергетическом уровне.
Изменение химических свойств щелочных металлов
По мере продвижения от первого до последнего периода, в атомах щелочных металлов происходит увеличение количества атомов и электронных облаков. Чем дальше атом оказался от ядра, тем меньше притяжение между ними. За счет этого, отдаленный (последний) электрон проще отсоединить от атома. Легкость отщепления электронов определяет реакционную способность. Отщепление электрона приводит к окислению собственного атома и восстановлению окислителя.
Таким образом, восстановительные свойства щелочных металлов увеличиваются сверху вниз в группе. Самый активный металл – цезий.
Внешний вид и физические свойства щелочных металлов
Щелочные металлы обладают всеми характерными свойствами: серебристый цвет (исключение: цезий – золотистого цвета) металлический блеск, электро- и теплопроводность, ковкость, пластичность.
Особенным качеством является мягкость и легкость за счет низкой плотности вещества. Эти металлы можно резать ножом, разминать руками (в перчатках) и ломать.
Нахождение в природе щелочных металлов
Из-за высокой реакционной активности, щелочные металлы не встречаются в природе в виде самородков или чистых залежей. Обнаружить их можно в составе солей. Многие природные минералы содержат ион щелочного металла в своей структуре.
Таблица. Минералы, в состав которых входят ионы щелочных металлов
Как видно из таблицы, чем выше активность элемента, тем ниже его встречаемость в природе. Элемент последнего периода первой группы – франций – вообще не встречается в природе даже в составе минералов. Этот элемент является радиоактивным и является промежуточным продуктом распада Урана-235. Его общее содержание в земной коре оценивается в 380 граммов.
Обнаружение ионов металлов в соединениях
Самый простой способ определения иона металла – окраска пламени. Для соли каждого металла характерен свой цвет:
- Литий – красный,
- Калий – фиолетовый,
- Натрий – желтый,
- Рубидий – розовый,
- Цезий – синий.
Соли франция такой проверке не подвергаются.
Для такой проверки важно, чтобы в пламени не было других примесей, меняющий цвет, иначе проверка будет недостоверна.
Качественные реакции
Обнаружение катионов лития
Обнаружить ионы металлов в соли можно с помощью качественной реакции.
Для обнаружения катионов лития используют фосфорную кислоту. Получившийся белый фосфат лития растворим только в концентрированной азотной кислоте и солях аммония:
В растворимых солях литий можно обнаружить с помощью фторида аммония. При реакции образуется белый нерастворимый осадок фторида лития:
Обнаружение катиона натрия
Ионы натрия можно обнаружить реакцией с комплексной солью гексагидроксостибатом (V). При низких температурах и в нейтральной среде образуется мелкокристаллическая белая соль натрия:
Эту реакцию проводят на предметном стекле. За образованием и формой кристаллов наблюдают под микроскопом или бинокуляром.
Обнаружение катиона калия
В кислой и нейтральной среде ионы калия образуют двойную комплексную соль с гексанитрокабальтатом натрия (III). Эта соль нерастворима в воде и имеет желтый цвет:
Особенность реакции в ее медленном течении. Реакционную смесь оставляют на несколько часов. Для ускорения реакции можно тереть стеклянной палочкой по стенке пробирки. Это приводит к формированию статического электричества, что усиливает притяжение ионов друг к другу.
Еще одним способом обнаружения катионов калия служит реакция с гидротартратом натрия NaHC4H4O6. В этом случае образуется соль белого цвета. Реакцию можно ускорить потиранием стеклянной палочной о поверхность пробирки:
Обнаружение катионов рубидия, цезия
Катионы рубидия и цезия – высокоактивные ионы, поэтому не обнаруживаются качественными реакциями. Все соединения прозрачные и хорошо растворимы в воде. Основными способами их обнаружения в составе соли служит осаждение органическими ароматическими растворами. Способа разделения цезия и рубидия из смеси в настоящее время нет.
Обнаружение ионов франция
Как радиоактивный металл, франций не входит в состав обычных солей. Его обнаружение проводится методом спектрометрии и радиационных приборов.
Химические свойства щелочных металлов
Все металлы являются восстановителями, поэтому они вступают в реакцию с различными окислителями. К таким относятся простые неметаллы и сложные соединения, обладающие окислительными свойствами.
Реакция с простыми неметаллами
Щелочные металлы активно вступают в реакции с галогенами. При этом образуется соответствующий галогенид. С серой, фосфором и водородом с образованием сульфидов, гидридов, фосфидов реагируют только при нагревании:
В реакции с кислородом щелочные металлы образуют пероксиды (кроме лития), повторное окисление которых приводит к образованию оксидов:
Специальных условий для окисления металлов кислородом не требуется, поэтому щелочные металлы хранят под слоем парафина, вазелина или масла без доступа кислорода.
Взаимодействие с водой
Реакция щелочных металлов с водой происходит с выделением большого количества тепла. Выделяющийся в ходе реакции водород может воспламеняться, что в некоторых случаях приводит к взрыву.
Взаимодействие с сильными кислотами
В реакциях щелочных металлов с кислотами образуются соответствующие соли. Особенных проявлений свойств щелочных металлов здесь нет:
Специфические химические свойства лития
В некоторых реакциях литий проявляет отличные от остальных щелочных металлов свойства. Например, это единственный металл, реагирующий с азотом без нагревания:
Нитрид лития подвергается необратимому гидролизу.
В реакции с лития с кислородом образуется оксид лития:
Получение щелочных металлов
Получить щелочные металлы в чистом виде можно только электролизом расплавов их солей:
катод (–) (Na + ): Na + + е = Na 0 ,
анод (–) (Cl – ): Cl – – е = Cl 0 , 2Cl 0 = Cl2;
Если использовать раствор соли, катионы металла будут сразу вступать в реакцию с образованием щелочей:
катод (–) (Na + ; Н + ): H + + е = H 0 , 2H 0 = H2
анод (+) (Cl – ; OН – ): Cl – – е = Cl 0 , 2Cl 0 = Cl2;
Применение соединений щелочных металлов
Основные области применения данных солей – медицина, кулинария, строительство, химическая промышленность.
Наиболее используемый щелочной металл – натрий. Он служит катализатором синтеза металлов, служит теплоносителем в атомных реакторах.
Хлорид натрия – соединение, используемое в каждом доме. Это безопасная соль, используемая в кулинарии. Так же, хлорид натрия применяется в медицине для приготовления физиологических растворов.
Литий и его щелочи служат основой изготовления щелочных батареек. Длительное время это был единственный способ создания портативных энергоносителей.
Калий и натрий используются для изготовления мыла в качестве омыляющего компонента.
Соли калия используются в сельском хозяйстве в качестве удобрения.
Калий, рубидий и натрий используются в атомной промышленности и атомной энергетике. Эти металлы служат катализаторами многих реакций.
Литий добавляется во многие сплавы для улучшения металлических свойств.
Соединения лития, рубидия и цезия используют при изготовлении цветных стекол.
Франций пока не имеет практического применения в связи с высокой радиоактивностью.
§ 14. Щелочные металлы
Строение и свойства атомов. Щелочные металлы — это элементы главной подгруппы I группы (IA группы) Периодической системы Д. И. Менделеева: литий Li, натрий Na, калий К, рубидий Rb, цезий Cs и франций Fr. Франций — редкий радиоактивный элемент.

На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемуся на сравнительно большом удалении от ядра. Они легко отдают этот электрон, поэтому являются очень сильными восстановителями. Во всех своих соединениях щелочные металлы проявляют степень окисления +1. Восстановительные свойства их усиливаются при переходе от Li к Cs, что связано с увеличением радиусов их атомов.
Это наиболее типичные представители металлов: металлические свойства выражены у них особенно ярко.
Щелочные металлы — простые вещества. Серебристо-белые мягкие вещества (режутся ножом), с характерным блеском на свежесрезанной поверхности (рис. 48). Все они лёгкие и легкоплавкие, причём, как правило, плотность их возрастает от лития к цезию, а температура плавления, наоборот, уменьшается (рис. 49).
Щелочные металлы активно взаимодействуют почти со всеми неметаллами. Используя общее обозначение для металлов М, запишем в общем виде уравнения реакций щелочных металлов с неметаллами — водородом, хлором и серой:



При взаимодействии с кислородом натрий образует не оксид, а пероксид:

И только литий образует оксид при взаимодействии с кислородом:

Как вы уже знаете, все щелочные металлы активно взаимодействуют с водой, образуя щёлочи и восстанавливая воду до водорода (рис. 50 и 51):

Скорость взаимодействия щелочного металла с водой будет увеличиваться от лития к цезию (почему?).
Соединения щелочных металлов. В свободном виде в природе щелочные металлы не встречаются из-за своей исключительно высокой химической активности. Некоторые их природные соединения, в частности соли натрия и калия, довольно широко распространены, они содержатся во многих минералах, растениях, природных водах.
Рассмотрим основные соединения щелочных металлов на примере соединений натрия и калия — наиболее важных представителей этой группы элементов.
Оксиды М2O — твёрдые вещества. Имеют ярко выраженные основные свойства: взаимодействуют с водой, кислотами и кислотными оксидами (запишите уравнения соответствующих реакций).
Оксиды натрия Na2O и калия К2O получают, прокаливая пероксиды с соответствующими металлами, например:

Гидроксиды МОН — твёрдые белые вещества. Очень гигроскопичны. Хорошо растворяются в воде с выделением большого количества теплоты. Их относят к щелочам, они проявляют ярко выраженные свойства сильных растворимых оснований: взаимодействуют с кислотами, кислотными оксидами, солями, амфотерными оксидами и гидроксидами (запишите уравнения соответствующих реакций в молекулярной и ионной формах). Гидроксиды щелочных металлов образуются при взаимодействии щелочных металлов или их оксидов с водой (запишите уравнения соответствующих реакций).
Гидроксид натрия NaOH в технике известен под названиями едкий натр, каустическая сода, каустик. Техническое название гидроксида калия КОН — едкое кали.
Оба гидроксида — NaOH и КОН — разъедают ткани и бумагу, поэтому их называют также едкими щелочами.
Едкий натр применяют в больших количествах для очистки нефтепродуктов, в бумажной и текстильной промышленности, для производства мыла и волокон. Едкое кали дороже и применяется реже. Основная область его применения — производство жидкого мыла.
Соли щелочных металлов — твёрдые кристаллические вещества ионного строения. Почти все соли натрия и калия растворимы в воде. Наиболее важные их соли — карбонаты, сульфаты и хлориды.
Na2CO3 — карбонат натрия, образует кристаллогидрат Na2CO3 • 10Н2O, известный под названием кристаллическая сода, которую применяют в производстве стекла, бумаги, мыла. Это средняя соль.
Вам в быту более известна кислая соль — гидрокарбонат натрия NaHCO3 (пищевая сода), которую применяют в пищевой промышленности, в медицине.
К2СO3 — карбонат калия, техническое название — поташ, используют в производстве жидкого мыла и для приготовления тугоплавкого стекла, а также в качестве удобрения.
Na2SO4 • 10H2O — кристаллогидратат сульфата натрия, техническое название — глауберова соль, применяют для производства соды и стекла и в качестве слабительного средства.
NaCl — хлорид натрия, или поваренная соль, хорошо известен вам из курса 9 класса. Хлорид натрия является важнейшим сырьём в химической промышленности, широко применяется в быту (рис. 52).
Ионы натрия и калия очень важны для живых организмов: Na + — главный внеклеточный ион, содержится в крови и лимфе, а К + — основной внутриклеточный ион. Они выполняют разные функции в организме, но предпочитают «работать» вместе. Соотношение концентраций этих ионов регулирует давление крови в живом организме; обеспечивает перемещение растворов солей из корней в листья растений.
Калий поддерживает работу сердечной мышцы, поэтому нехватка калия в организме отрицательно сказывается на здоровье человека. Калий необходим растениям, при его недостатке снижается интенсивность фотосинтеза.

Взрослый человек должен в сутки потреблять с пищей 3,5 г калия. С помощью соединений калия можно устранять отёки. В этом случае нужно увеличить потребление калия до 5 г в сутки.
Больше всего калия содержат курага, соя, фасоль, зелёный горошек, чернослив, изюм и некоторые другие продукты (рис. 53).
Соли калия широко используют в сельском хозяйстве в качестве калийных удобрений.

Соли натрия, как и сам натрий, окрашивают пламя в жёлтый цвет, а калий и его соли — в розово-фиолетовый. Проведём лабораторный опыт.

Открытие щелочных металлов. Литий был открыт шведским химиком А. Арфведсоном в 1817 г. и по предложению Й. Берцелиуса назван литием (от греч. литое — камень), так как, в отличие от калия, который до тех пор находили только в золе растений, он был обнаружен в камне.
Натрий и калий были впервые получены английским химиком и физиком Г. Дэви в 1807 г. при электролизе едких щелочей. Й. Берцелиус предложил назвать элемент № 11 натрием (от араб, натрун — сода), а элемент № 19 по предложению У. Гилберта получил название «калий» (от араб, алкали — щёлочь).

1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.

1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

2. Вычислите объём водорода (н. у.), который может быть получен при растворении в воде 11,5 г натрия, содержащего 2% примесей, если выход водорода составляет 95% от теоретически возможного.
3. Прочитайте сочинение, написанное ученицей 9 класса 531-й школы Москвы Наташей Фроловой (1991).

В большом семиэтажном доме, в подъезде щелочных металлов, на втором этаже жил Литий — самый лёгкий и беззаботный металл. Он, как и все щелочные металлы, очень активно взаимодействовал с кислородом, неметаллами, водородом и водой. Как и все, защищался от кислорода, но носил не керосиновую, а вазелиновую «шубу», так как был очень лёгким и всплывал в керосине.
Но всё же Литий не был во всех отношениях похожим на своих собратьев: он был добр, щедр и прост. Он с охотой отдавал свои электроны и кислороду, и азоту, и многим другим элементам. Из-за этих-то особенностей Литий страдал, так как другие щелочные металлы, особенно такие хитрые, как Калий и Натрий, не давали ему прохода. Дело было в том, что, когда щелочные металлы горели в кислороде, каждые их два атома отдавали одной молекуле Кислорода два своих электрона — каждому атому по одному. Остальные электроны они припрятывали до поры до времени. Литий же был честен — отдавал молекуле Кислорода в два раза больше электронов, чем остальные металлы: на четыре атома Лития — четыре электрона. Да и с Азотом Литий взаимодействовал спокойно, при обычной температуре, не то что другие — при нагревании.
И решили Натрий и Калий допытаться у Лития: почему он так поступает? Нет ли в его поведении каких-либо скрытых выгод?
Спрашивает Натрий: «Почему ты, брат Литий, все свои электроны Кислороду отдаёшь? Не лучше ли делать так, как мы?» Отвечал Литий: «Я всегда рад помочь другим, не то что вы — жадничаете. Я рад, что в моём оксиде Кислород имеет свою обычную степень окисления —2, не то что -1 в ваших странных, ни на что не похожих пероксидах». Сказал так и ушёл восвояси. Долго стояли Натрий и Калий в раздумье, но так ничего и не поняли. И сейчас с Кислородом продолжают пероксиды образовывать. А оксиды состава М2O дают лишь тогда, когда их силой заставят, т. е. создадут соответствующие условия — нагреют пероксид (Na2O2) с таким же металлом-«жадиной» (Na)».
Какие химические понятия использовала в художественной форме Наташа?
4. Напишите сочинение о щелочных металлах, положив в основу сюжета превращения этих металлов или какой- либо один химический процесс.
5. В 100 г кураги содержится 2,034 г калия. Сколько граммов кураги нужно съесть, чтобы получить суточную норму калия?
Щелочные металлы
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за их сильной реакционной способности.

Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционной способности. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.

- Li - 2s 1
- Na - 3s 1
- K - 4s 1
- Rb - 5s 1
- Cs - 6s 1
- Fr - 7s 1
Природные соединения
- NaCl - галит (каменная соль)
- KCl - сильвин
- NaCl*KCl - сильвинит

Получение
Получить такие активные металлы электролизом водного раствора - невозможно. Для их получения применяют электролиз расплавов при высоких температурах (естественно - безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид, натрий - пероксид, калий, рубидий и цезий - супероксиды.
K + O2 → KO2 (супероксид калия)
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления +1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Li + H2 → LiH (в гидридах водород -1)
Na + F2 → NaF (в фторидах фтор -1)
Na + S → Na2S (в сульфидах сера -2)
K + N2 → K3N (в нитридах азот -3)
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда - взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH - натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: ". в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет". Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий - в желтый, калий - в фиолетовый, рубидий - синевато-красный, цезий - синий.

Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из пероксида, так и из супероксида, при желании можно получить оксид:
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание - реакция идет, только если основание растворимо)
Na2O + SO2 → Na2SO3 (обратите внимание - мы сохраняем СО серы +4)
Гидроксиды щелочных металлов
Относятся к щелочам - растворимым основаниям. Наиболее известные представители: NaOH - едкий натр, KOH - едкое кали.
Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции щелочных металлов и их оксидов с водой:
KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде - хлор)

Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке - получается кислая соль)
2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке - получается средняя соль)
KOH + SO2 → KHSO3 (соотношение 1:1 - получается кислая соль)
2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 - получается средняя соль)
С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием окиселов - смешанных оксидов (при высоких температурах - прокаливании).
NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется окисел - смесь двух оксидов: Al2O3 и Na2O, вода испаряется)
Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
В реакциях щелочей с йодом образуется исключительно иодат, так как гипоиодит неустойчив даже при комнатной температуре, не говоря о нагревании. С серой реакция протекает схожим образом:
NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)

NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам - и азотной, и азотистой.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
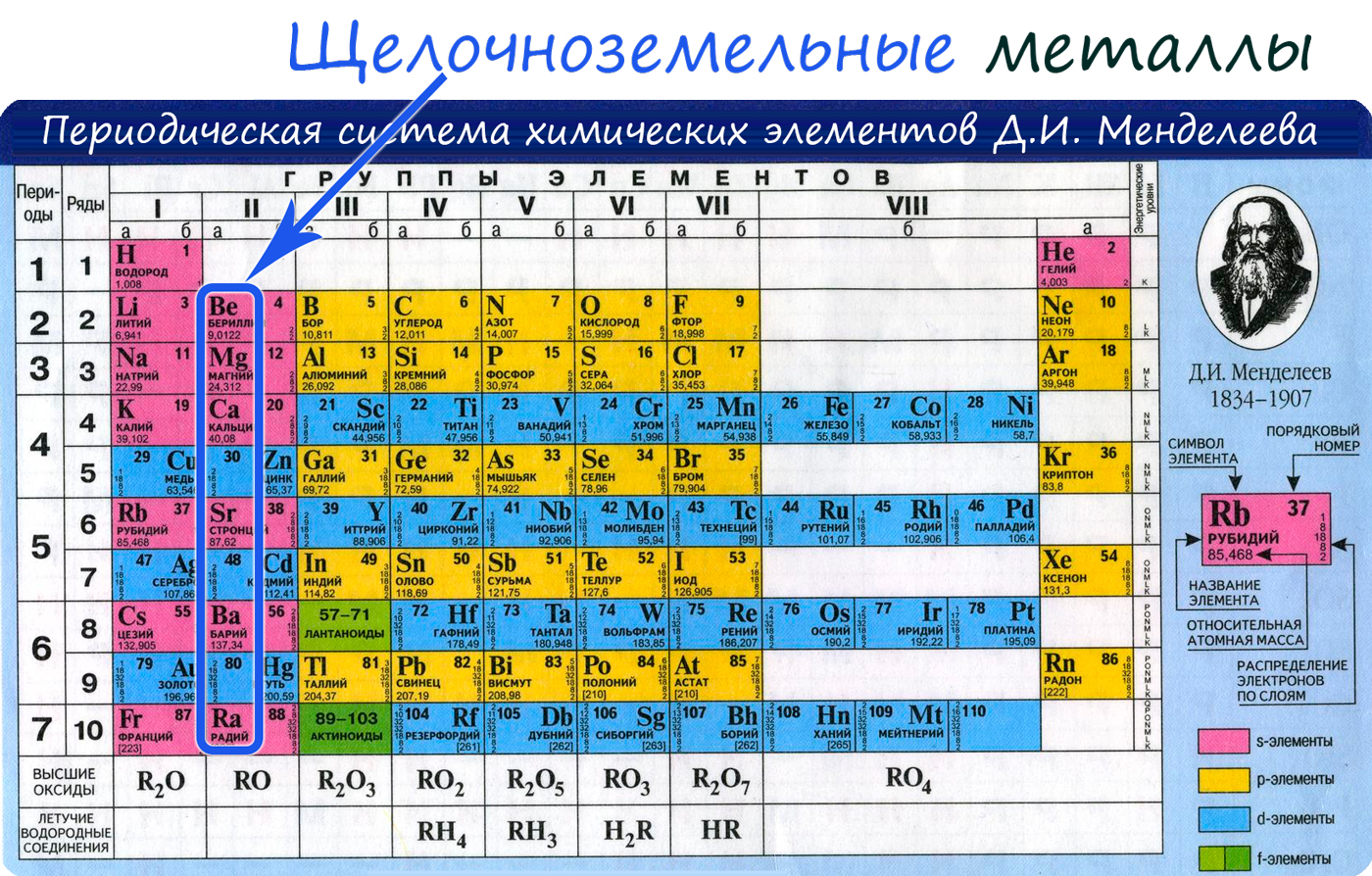
Щелочноземельные металлы
К щелочноземельным металлам относятся металлы IIa группы: бериллий, магний, кальций, стронций, барий и радий. Отличаются легкостью, мягкостью и сильной реакционной способностью.
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционная способность. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
- Be - 2s 2
- Mg - 3s 2
- Ca - 4s 2
- Sr - 5s 2
- Ba - 6s 2
- Ra - 7s 2
- Be - BeO*Al2O3*6SiO2 - берилл
- Mg - MgCO3 - магнезит, MgO*Al2O3 - шпинель, 2MgO*SiO2 - оливин
- Ca - CaCO3 - мел, мрамор, известняк, кальцит, CaSO4*2H2O - гипс, CaF2 - флюорит

Это активные металлы, которые нельзя получить электролизом раствора. С целью их получения применяют электролиз расплавов, алюминотермию и вытеснением их из солей другими более активными металлами.
MgCl2 → (t) Mg + Cl2 (электролиз расплава)
CaO + Al → Al2O3 + Ca (алюминотермия - способ получения металлов путем восстановления их оксидов алюминием)

Все щелочноземельные металлы (кроме бериллия и магния) реагируют с холодной водой с образованием соответствующих гидроксидов. Магний реагирует с водой только при нагревании.
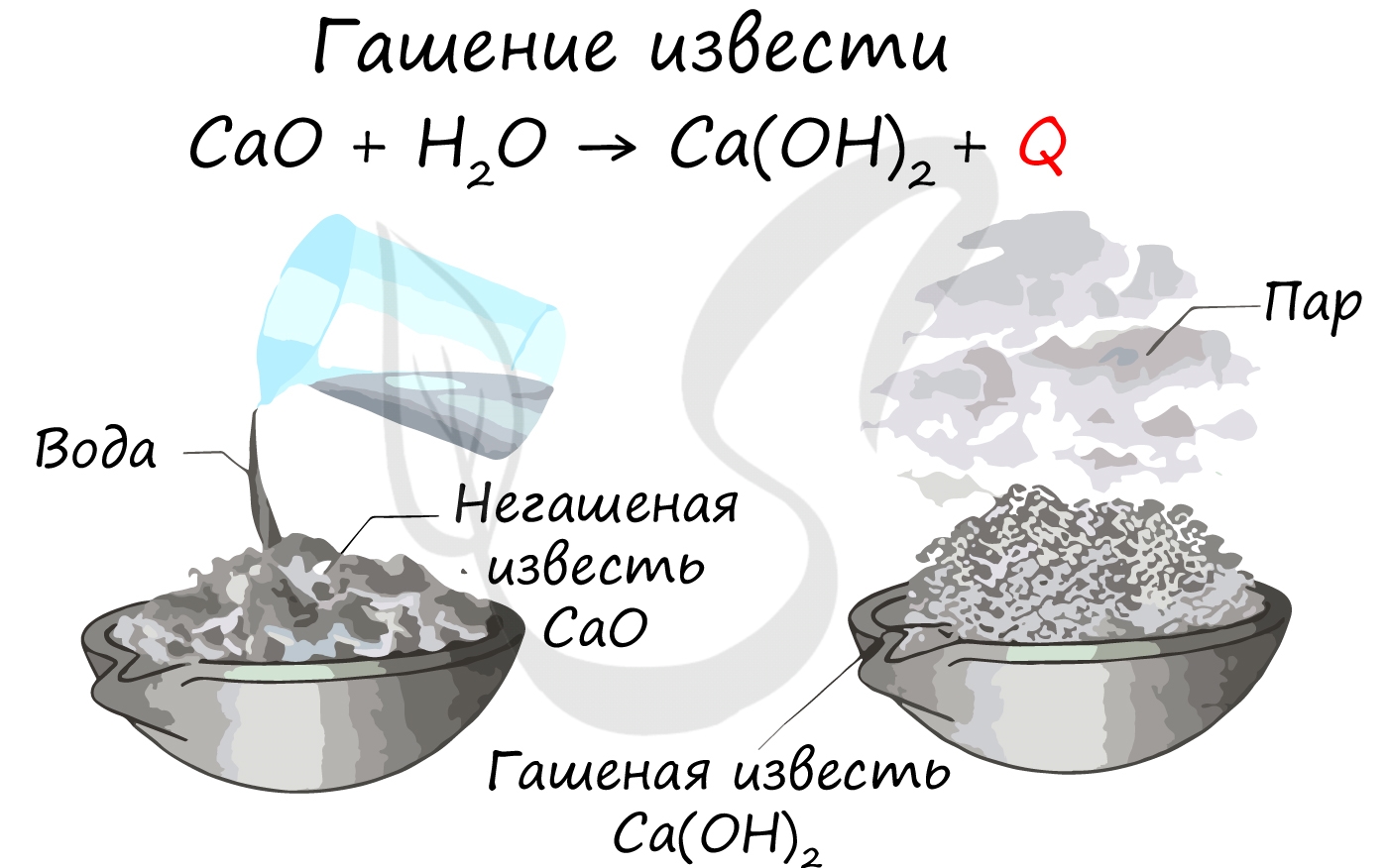
Щелочноземельные металлы - активные металлы, стоящие в ряду активности левее водорода, и, следовательно, способные вытеснить водород из кислот:
Хорошо реагируют с неметаллами: кислородом, образуя оксиды состава RO, с галогенами (F, Cl, Br, I). Степень окисления у щелочноземельных металлов постоянная +2.
Mg + O2 → MgO (оксид магния)
При нагревании реагируют с серой, азотом, водородом и углеродом.
Mg + S → (t) MgS (сульфид магния)
Ca + H2 → (t) CaH2 (гидрид кальция)
Ba + C → (t) BaC2 (карбид бария)

Ba + TiO2 → BaO + Ti (барий, как более активный металл, вытесняет титан)
Оксиды щелочноземельных металлов
Имеют общую формулу RO, например: MgO, CaO, BaO.
Оксиды щелочноземельных металлов можно получить путем разложения карбонатов и нитратов:
Рекомендую взять на вооружение общую схему разложения нитратов:

Проявляют преимущественно основные свойства, все кроме BeO - амфотерного оксида.
- Реакции с кислотами и кислотными оксидами
В нее вступают все, кроме оксида бериллия.
Амфотерные свойства оксида бериллия требуют особого внимания. Этот оксид проявляет двойственные свойства: реагирует с кислотами с образованием солей, и с основаниями с образованием комплексных солей.
BeO + NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Если реакция проходит при высоких температурах (в расплаве) комплексная соль не образуется, так как происходит испарение воды:
BeO + NaOH → Na2BeO2 + H2O (бериллат натрия)

Гидроксиды щелочноземельных металлов
Проявляют основные свойства, за исключением гидроксида бериллия - амфотерного гидроксида.
Получают гидроксиды в реакции соответствующего оксида металла и воды (все кроме Be(OH)2)
Основные свойства большинства гидроксидов располагают к реакциям с кислотами и кислотными оксидами.

Реакции с солями (и не только) идут в том случае, если соль растворимы и по итогам реакции выделяется газ, выпадает осадок или образуется слабый электролит (вода).
Гидроксид бериллия относится к амфотерным: проявляет двойственные свойства, реагируя и с кислотами, и с основаниями.
Жесткость воды
Жесткостью воды называют совокупность свойств воды, зависящую от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов, сульфатов и хлоридов.
Различают временную (карбонатную) и постоянную (некарбонатную) жесткость.
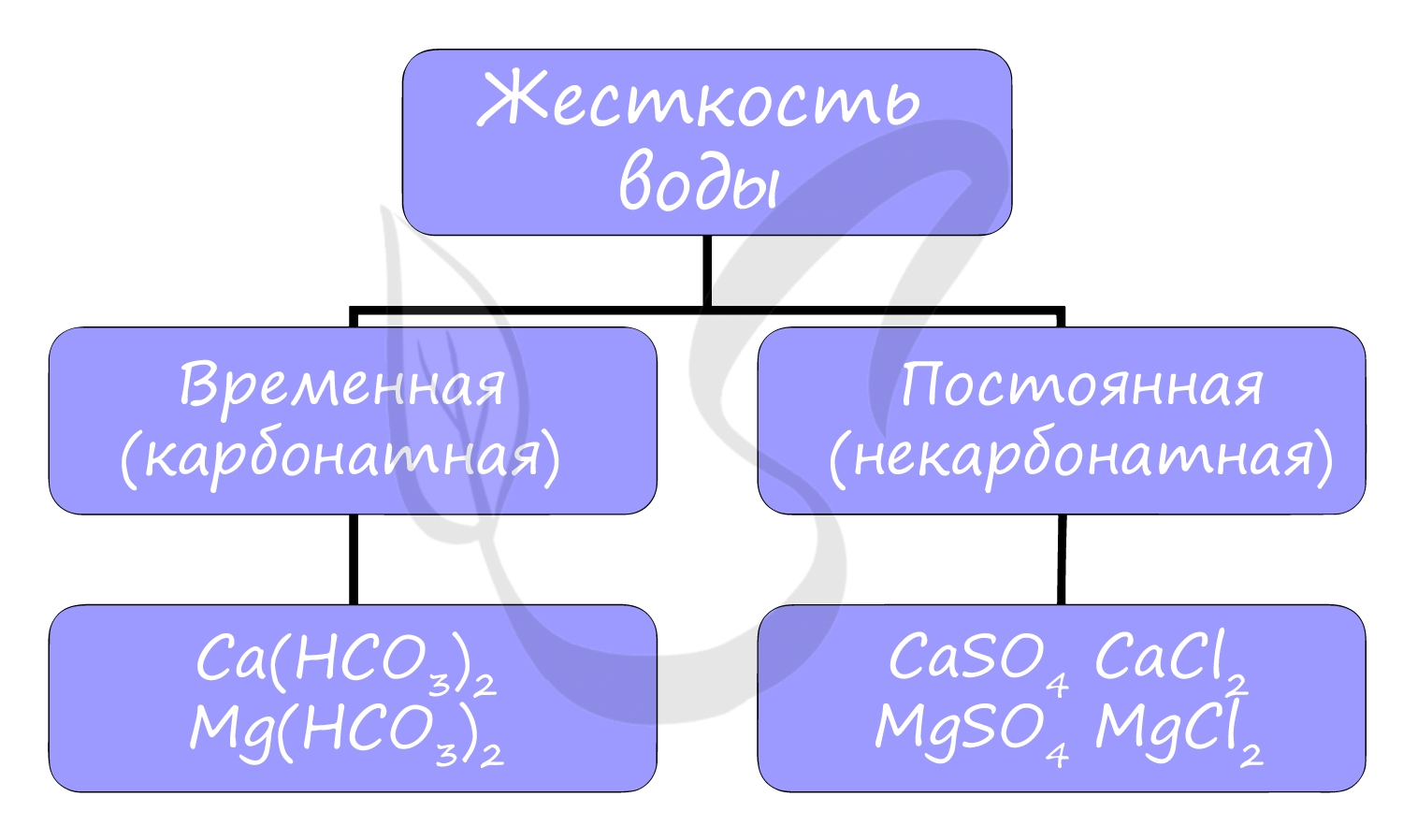
Вероятно, вы часто устраняете жесткость воды у себя дома, осмелюсь предположить - каждый день. Временная жесткость воды устраняется обычным кипячением воды в чайнике, и известь на его стенках - CaCO3 - бесспорное доказательство устранения жесткости:
Также временную жесткость можно устранить, добавив Na2CO3 в воду:
С постоянной жесткостью бороться кипячением бесполезно: сульфаты и хлориды не выпадут в осадок при кипячении. Постоянную жесткость воды устраняют добавлением в воду Na2CO3:
Жесткость воды можно определить с помощью различных тестов. Чрезмерно высокая жесткость воды приводит к быстрому образованию накипи на стенках котлов, труб, чайника.

Презентация по теме Щелочные металлы

Дать общую характеристику элементов I группы главной подгруппы Периодической системы химических элементов Д.И. Менделеева, повторить основные закономерности изменения свойств элементов по вертикали (в группе), металлическую связь и кристаллическую решетку, физические свойства металлов
ЦЕЛЬ УРОКА:

Разминка
Самый распространенный металл в земной коре -
A l
Самый твердый металл -
Самый тяжелый металл -
Основной компонент чугуна и стали -
При обычных условиях этот металл жидкий -
C r
O s
F e
H g
Самый тугоплавкий металл -
W


Увеличивается заряд ядра
Увеличивается радиус атома
Увеличиваются металлические и восстановительные свойства
Растет число энергетических уровней


Запомни!
Степень окисления металлов I группы главной подгруппы в соединениях постоянная и равна +1
NaOH, K2O, Li3PO4,
K2CO3, NaCl, Na2O2
+1
+1
+1
+1
+1
+1

Простые вещества
Серебристо-белые, с характерным металлическим блеском, но быстро тускнеют (окисляются) на воздухе;
Мягкие, легко режутся ножом;
Хорошо проводят тепло и электрический ток;
Легкие (Li, Na, K – легче воды);
Легкоплавкие
температуры плавления и кипения понижаются
плотность металлов увеличивается

Химические свойства
Металлы I группы главной подгруппы –
наиболее активные металлы,
обладают высокой восстановительной способностью
В ряду Li - Na - K - Rb - Cs- Fr
химическая активность увеличивается
Образуют соединения с ионной связью и ионной кристаллической решеткой

Взаимодействуют с неметаллами
Li + S
2 e
Восстановитель
Окислитель
СУЛЬФИД ЛИТИЯ
Na + P
3 e
Восстановитель
Окислитель
ФОСФИД НАТРИЯ
+1
0
0
+1
Li2S
2
Na3 P
3

Взаимодействуют с кислородом
Li + О2
4 e
Восстановитель
Окислитель
ОКСИД ЛИТИЯ
Na + O2
2 e
Восстановитель
Окислитель
ПЕРОКСИД НАТРИЯ
+1
0
0
+1
2Li2O
4
Na2 O2
2

Внимание!
При взаимодействии с кислородом
только литий образует оксид.
Другие металлы I группы главной подгруппы при взаимодействии с кислородом образуют пероксиды и надпероксиды.
ПЕРОКСИД НАТРИЯ
Na O O Na
+1
-1
-1
+1

A знаете ли вы?
При взаимодействии пероксида натрия с углекислым газом протекает процесс, обратный дыханию - углекислый газ связывается, а кислород выделяется:
2Na2О2 + 2СО2 → 2Na2CО3 + О2
На этой реакции основано применение пероксида натрия для получения кислорода на подводных лодках и для регенерации воздуха в закрытых помещениях.

Взаимодействуют с водой
Металлы I группы главной подгруппы реагируют с водой бурно, с выделением теплоты. В результате взаимодействия образуется щелочь и выделяется водород
Так как гидроксиды металлов I группы главной подгруппы образуют щелочи, то их групповое название – ЩЕЛОЧНЫЕ МЕТАЛЛЫ

Взаимодействуют с водой
2Li + 2H2О 2LiOH + H2
2 e
Восстановитель
Окислитель
ГИДРОКСИД ЛИТИЯ
Восстановитель
Окислитель
ГИДРОКСИД НАТРИЯ
+1
0
Na + H2О
2 NaOH + H2
2
2
0
+1
2 e

Хранение щелочных металлов
Так как щелочные металлы легко окисляются и обладают высокой химической активностью, их хранят под слоем керосина
Беречь от воды

Нахождение в природе
Щелочные металлы в природе встречаются только в виде соединений. Почему?
Na Cl
Галит, поваренная соль
Na Cl • K Cl
Сильвинит
K Cl• Mg Cl2• 6H2O
Карналлит
Na2SO4 • 10H2O
Мирабилит, глауберова соль
В океанических
водах
В минералах и горных породах
В живых организмах
Рубидий и цезий встречаются в виде примесей к другим щелочным металлам
Франций содержится в урановых рудах

Получение щелочных металлов
2NaCl (расплав) 2Na + Cl2
Щелочные металлы получают электролизом расплавов хлористых солей
электрический ток

Применение щелочных металлов
В металлургии в качестве восстановителя при получении титана, урана, циркония
и других металлов
В химической промышленности для получения пероксида натрия, гидрида натрия,
моющих средств и др.
В качестве добавок к сплавам,
для улучшения их свойств
В атомной промышленности, ядерной энергетике
Практического значения не имеет, в связи с высокой радиоактивностью
В качестве катализаторов
В электронике, радио-электротехнике
Na
Rb
Fr
K
Li
Cs

Из истории
Литий
Открыт в 1817 году шведским химиком А. Арфведсоном. Но в свободном виде был выделен позднее Г. Дэви путем электролиза щелочи
Натрий Калий
В 1807 году английский химик Г.Дэви впервые получил в свободном виде путем электролиза увлажненных твердых щелочей
Рубидий Цезий
Немецкие химики Р. Бунзен и Г. Кирхгоф с помощью спектрального анализа обнаружили в минералах в 1860 году – цезий, а в 1861 году – рубидий
Франций
Открыт в 1939 году М. Перей при анализе продуктов радиоактивного распада актиния. В 1946 году М. Пере предложила назвать элемент в честь своей родины Франции

Выбери правильный ответ
1. Щелочной металл
a) Mg
a) Ba
a) Al
a) Rb
2. Наиболее ярко выражены металлические свойства
a) Cs
a) Li
a) Fr
a) K
3. При взаимодействии с кислородом образует пероксид
a) Ca
a) Na
a) Li
a) Mg
4. Степень окисления щелочных металлов
a) +2
a) +1
a) +3
a) +4


Выберите свойства характерные для щелочных металлов
А) не взаимодейсвуют с кислородом
Б) в соединениях проявляют переменную степень окисления
В) быстро окисляются
Г) имеют металлическую кристаллическую решетку
Д) при взаимодействии с водой образуют щелочи
Е) хорошие окислители
Рабочие листы и материалы для учителей и воспитателей
Более 3 000 дидактических материалов для школьного и домашнего обучения
Читайте также:
