Получение чистых металлов физика
Обновлено: 20.09.2024
NaCl- каменная или поваренная соль, KCl - сильвин, KCl•MgCl2•6H2O – карналлит.
1. Вытеснение металла более активным металлом. Этот процесс можно проводить:
- в водном растворе – гидрометаллургия
- при высоких температурах – металлотермия
TiCl4 + 4Na → Ti + 4NaCl
2. Восстановление металлов неметаллами - газообразными СО и Н2 или твердым углеродом – пирометаллургия (только при высоких температурах):
МеО + СО ↔ Ме + СО2
3. Электрометаллургия - электролиз либо водных растворов либо расплавов. Этим способом можно выделить металл любой активности, но только из соединений с ионной связью. Ковалентные полярные соединения (TiCl4, ZrCl4) не подвергаются гидролизу. Обычно электролизом получают металлы высокой активности(Na, K, Be, Mg, Al, Ca), которые другими методами получить практически невозможно.
Сплав - макроскопически гомогенная система, обладающая металлическими свойствами и состоящая из двух или более химических элементов. Составной частью сплава может быть любой химический элемент, хотя в значительных количествах в них содержатся только металлы.
При образовании сплавов атомы компонентов координируют свои положения в кристаллической решетке так, чтобы наступило термодинамическое равновесие, т. е. чтобы свободная энергия Гиббса достигала своего наименьшего значения.
Образуя жидкие растворы, в результате кристаллизации которых получаются сплавы, металлы дают системы с разнообразными свойствами. Образование различных типов сплавов зависит от сил взаимодействия между атомами, образующими данный сплав.
Классификация сил взаимодействия и образующихся систем:
1. Отсутствие взаимодействия или очень слабое взаимодействие является причиной того, что эти металлы не образуют гомогенных растворов даже в жидком состоянии и дают расслаивающиеся жидкие фазы из чистых металлов. При охлаждении такой системы образуются два затвердевших слоя различной плотности. Такие системы дают алюминий и свинец, алюминий и кадмий, цинк и свинец. Поэтому эти пары не используются для получения сплавов.
2. Более сильное взаимодействие между атомами металлов приводит к образованию непрерывных или неограниченных жидких растворов, при кристаллизации которых металлы выделяются в свободном состоянии и не образуют твердых растворов. Полученный сплав представляет собой гетерогенную систему из кристаллов отдельных компонентов. Сплавы этого типа в технике встречаются довольно часто.
3. Еще более сильное взаимодействие между атомами металлов приводит к образованию растворов не только в расплавленном состоянии, но и в твердом. При кристаллизации расплава выпадают кристаллы твердого раствора двух или более металлов и сплав получается гомогенным. Такими сплавами являются, например, нержавеющие или жаропрочные стали, содержащие хром, никель и другие добавки в небольших количествах, растворенные в железе.
Твердым раствором называется однородное (гомогенное) кристаллическое вещество переменного состава, в кристаллическую решетку которого входят атомы или ионы нескольких компонентов. Твердые растворы по растворимости компонентов разделяют на непрерывные твердые растворы с постепенно меняющейся концентрацией от 0 до 100% и ограниченные растворы, в которых существует предел растворимости одного металла в другом.
Большое распространение твердых растворов среди сплавов, связано с тем, что большинство растворов построено по металлическому типу, предусматривающему соединение не химическими связями, а притяжением к свободным электронам, находящимся между ними. Связи этого типа мало чувствительны к соблюдению точного количественного соотношения атомов, участвующих в образовании раствора и к их точному расположению в атомных местах. Это благоприятствует образованию разупорядоченных твердых растворов в широком интервале составов. В отличие от этого в неметаллических кристаллах, например таких, как хлористый калий, ионная природа связи требует соблюдения точного соотношения разнородных атомов и строго определенного их расположения.
По физическому строению твердые растворы подразделяют на ряд типов, основными из которых являются растворы замещения и растворы внедрения, а также упорядоченные растворы. Растворы замещения образуются, когда атомы одного металла последовательно замещают в кристаллической решетке атомы другого металла, и постепенно кристаллическая структура одного металла переходит в структуру другого. Например, медь может образовывать непрерывный ряд растворов замещения с никелем.


А) раствор замещения б) раствор внедрения

В) упорядоченный раствор
Растворы внедрения образуются за счет проникновения в межатомное пространство кристаллической решетки данного метала других атомов металлического или неметаллического типа. Эти атомы имеют меньший радиус, чем атомный радиус основного металла, и занимают свободное пространство между узлами решетки. В это пространство могут внедряться атомы неметаллов с радиусом менее 0,1 нм (H, N, C, B). Растворы внедрения чаще всего образуются переходными металлами (d- элементы).
Упорядоченные твердые растворы – растворы, в которых расположение атомов растворенного элемента в кристаллической решетке основного металла имеет определенную закономерность (порядок). Перестройка структуры раствора при переходе из одного упорядоченного состояния в другое влияет на физические и механические свойства сплава. Упорядоченность может быть уменьшена или полностью устранена при пластической деформации. Например, упорядоченные сплавы образуют медь и золото Cu3Au или CuAu.
4. Очень сильное взаимодействие атомов металлов приводит к образованию интерметаллических соединений (интерметаллиды, металлиды). Интерметаллиды – от латинского inter – между и metall металл - химические соединения металлов между собой. К ним также относятся соединения переходных металлов с неметаллами (Н, В, С, N и др.). В таких соединениях металлическая связь, поэтому состав их обычно не отвечает формальной валентности их компонентов и может изменяться в значительных пределах.
Эти соединения имеют свою собственную кристаллическую структуру и свойства. Устойчивость интерметаллидов различна: одни из них могут существовать и в жидкой и в твердой фазах, а другие только в твердой фазе, распадаясь при нагревании. Интерметаллиды образуются в результате взаимодействия металлов при сплавлении, конденсации из пара, при реакциях в твердом состоянии вследствие взаимной диффузии, в результате интенсивной пластической деформации при механическом сплавлении (механоактивации). Для интерметаллидов характерен преимущественно металлический тип связи и специфические металлические свойства и, прежде всего, значительная способность к пластической деформации. Однако среди них имеются также солеобразные соединения с ионной связью, а также соединения с ковалентной и ковалентно-ионной связью. Ионные интерметаллиды обладают свойствами, характерными для солей: высокая температура плавления, пониженная по сравнению с металлами электропроводимость, многие разлагаются водой.
Металлы группы железа и платины при образовании интерметаллидов проявляют нулевую валентность. Это доказывает их магнитное поведение: в чистом виде они парамагнитны (т.е. обладают магнитными свойствами), а в интерметаллических соединениях – диамагнитны (т.е. не обладают магнитными свойствами), т.к. их свободные электроны теперь заполняют d-орбитали).
В сплавах интерметаллиды ведут себя, обычно, как самостоятельные компоненты, характеризуясь определенным составом и температурой плавления.
Примеры некоторых сплавов:
1) Чугун – сплав Fe с С, содержание С выше 2% масс.;
2) Сталь – сплав Fe с С, содержание С менее 2% масс.;
3) Зеркальный чугун – сплав Fe с С (3,5-5,5%) и Mn (5-20%);
4) Марганцовистая сталь – сталь, содержащая марганец; добавление в сталь более 1% марганца делает сталь более твердой и износостойкой, но менее пластичной;
5) Манганин – сплав 11% Mn, 2,5-3,5% Ni и 86% Cu; обладает высоким электросопротивлением и очень малой термоэлектродвижущей силой в паре с медью, поэтому используется для катушек сопротивления; под действием очень высокого давления (15000-30000 атм.) меняет свое сопротивление, поэтому используется в электрических манометрах. Манганины обладают ценным свойством – демпфированием, т.е. поглощают энергию механических колебаний – при ударе по сплаву звук не звучит громко. Самые «тихие» сплавы содержат 70% Mn и 30% Cu и некоторые из них по прочности не уступают стали.
Свойства металлов можно улучшить, подвергая их различным воздействиям: деформируя металл, его можно сделать тверже, подвергая нагреву – более жаропрочным. Чтобы получить металлы с такими свойствами, необходимо придать им определенную кристаллическую структуру!
Атомы в металле плотно упакованы, подобно уложенным в коробке шарам, и стремятся образовать тесно прилегающие плоскости. Характер такого сопряжения плоскостей определяет многие механические свойства металла. Добавление в один металл атомов другого металла (получение сплавов) изменяет характер сопряжения атомных плоскостей, следовательно меняются и механические свойства, особенно прочность. Например, бронза (сплав меди и олова) оказывается прочнее и меди и олова.
Дефекты кристаллической структуры – места, в которых нарушается сопряжение атомных плоскостей, - играют доминирующую роль в объяснении таких свойств металлов, как пластичность, хрупкость, их поведение при высоких температурах.
Германские физики из Исследовательского центра Дрезден-Россендорф и Дрезденского технического университета экспериментально зарегистрировали редкий эффект — сосуществование сверхпроводящего и ферромагнитного состояний — в наноразмерных образцах интерметаллического соединения никеля и висмута Bi3Ni.
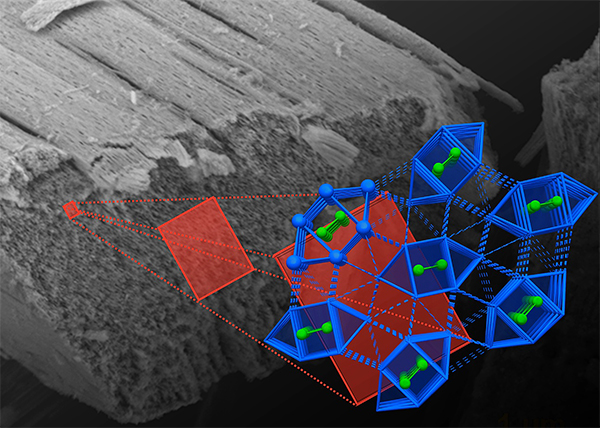
Электронная микрофотография нанонити соединения и структура его кристаллической решетки.
Давно известно, что ферромагнетизм и сверхпроводимость относятся к тем типам упорядочения, которые конкурируют друг с другом. Антагонизм проявляется прежде всего в их отношении к магнитному полю: сверхпроводник стремится вытолкнуть его (этот эффект был отмечен ещё в 1933 году Вальтером Мейснером и Робертом Оксенфельдом), тогда как ферромагнетик концентрирует силовые линии поля в своём объёме.
Для получения металлического материала с повышенной прочностью необходимо создать большое количество центров закрепления дислокаций, причем такие центры должны быть распределены равномерно. Эти требования привели к созданию суперсплавов. Суперсплав представляет собой по крайней мере двухфазную систему, в которой обе фазы отличаются степенью порядка в атомной структуре. В системе Ni - Al может образовываться обычная смесь, т.е. сплав с хаотическим распределением атомов Ni и Al. Этот сплав имеет кубическую структуру, но узлы куба замещаются атомами Ni или Al, беспорядочно. Этот неупорядоченный сплав называют γ-фазой.
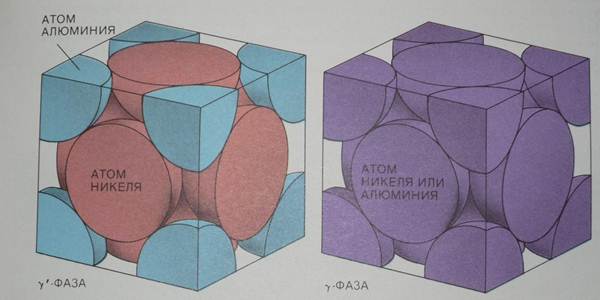
Наряду с γ-фазой в системе Ni — Al может образовываться интерметаллическое соединение Ni3Al тоже с кубической структурой, но упорядоченной. Кубоиды Ni3Al называют γ’-фазой. В γ’-фазе атомы Ni и Al занимают узлы кубической решетки уже по строгому закону: на один атом алюминия приходятся три атома никеля.
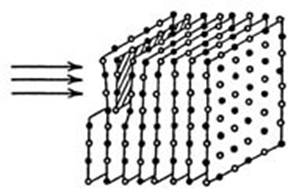
Рис. Схема перемещения дислокаций в упорядоченном кристалле.
В упорядоченной структуре при приложении нагрузки левая атомная плоскость движется и достигает следующей плоскости, но теперь для дальнейшего движения необходимо обменяться местами разным атомам (белые и черные кружки на рис.). Дислокация передвинется вправо при полном взаимообмене белых и черных кружков, но поскольку на соседних позициях окажутся не свойственные данной фазе атомы, то такой процесс энергетически затруднен. Поэтому дислокация в упорядоченной γ¢ - фазе оказываются запрещенными, и эта фаза имеет более высокую прочность, чем γ-фаза.
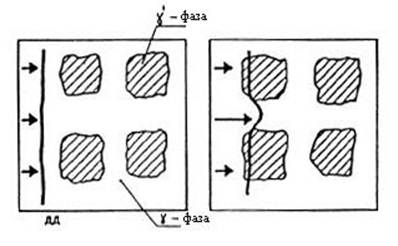
Рис. Схема торможения дислокации включениями другой фазы.
ДД - движущаяся дислокация.
В результате в целом суперсплав оказывается также немного прочнее обычного металла, не содержащего γ¢-фазы.
Таким образом, в суперсплаве отдельные зерна γ¢-фазы неупорядоченным образом распределены в металле, но внутри них существует строгая упорядоченность структуры. Чтобы получить суперсплав, расплавляют никель и смешивают с алюминием. При охлаждении расплавленной смеси сначала затвердевает неупорядоченная γ-фаза (ее температура кристаллизация высока), а затем внутри нее при понижении температуры формируются небольшие по размерам кубоиды γ’-фазы. Варьируя скорость охлаждения, можно регулировать кинетику образования, а значит и размеры включений γ’-фазы. Ni3Al.
Помимо сверхпрочных труднодеформируемых металлических сплавов для современной техники крайне необходимы материалы с совершенно противоположным свойством — легкой деформируемостъю под нагрузкой. Интересным методом создания таких металлических материалов является изготовление структуры с зернами-кристаллитами очень малых размеров (сотни-десятки нанометров). Это связано с тем, что зерна малых размеров труднее деформировать: при нагрузке зерна перекатываются друг по другу, но сами не деформируются.
Получить сплав с микрокристаллическими зернами можно очень быстрым охлаждением сплава (закалка): атомы перемешанных элементов не успевают расслоиться на отдельные фазы (чистые металлы). При этом после охлаждения сплав не находится в состоянии фазового равновесия.
Опыт показывает, что зерна, имеющие размеры менее 5 мкм, под нагрузкой скользят друг по другу без разрушения. Образец, состоящий из таких зерен, выдерживает без разрушения относительное растяжение Δl/l0=10, то есть длина образца увеличивается на 1000% от первоначальной длины. Это — эффект сверхпластичности. При этом деформация осуществляется не как обычно (за счет движения дислокаций), а путем смещения зерен друг относительно друга вдоль своих границ. Чем мельче зерно, тем выше оптимальная скорость деформации. И объясняется это все в конечном итоге деформацией металлических связей в контактах зерен, то есть большим количеством поверхностных дефектов.
С другой стороны в микрокристаллических сплавах поверхность контакта между зернами имеет очень большую площадь (высокое значение поверхностной энергии Гиббса). По законам термодинамики это делает сплав термодинамически неустойчивым: при малейшем нагревании зерна укрупняются. Но и этому отрицательному явлению нашли применение. Сверхпластичный металл можно обрабатывать почти как пластичный, придавая ему желаемую форму, а затем деталь из такого материала подвергают термообработке для укрупнения зерен и быстро охлаждают, после чего эффект сверхпластичности исчезает и деталь используют по назначению.
в конце 1990-х американская компания Superform продемонстрировала, что в режиме сверхпластической формовки из листа обычного алюминиевого сплава можно изготовить кузов автомобиля «Феррари» за одну операцию. Процесс продолжался 16 часов.

Образцы микрокристаллического алюминиевого сплава (Al-Mg-Li) после испытаний на сверхпластичность. Удлинение составляет 1900%
Еще одним детищем быстрой закалки стали аморфные сплавы, то есть такие, в которых атомы расположены беспорядочно, как в жидкости. Первый аморфный сплав Au75Si25 при сверхбыстром охлаждении американцы из Калифорнийского технологического института сделали в 1960 году, однако это была экзотика, а промышленно важный результат был достигнут в 1976 году, когда исследователи из Пенсильванского университета получили в аморфном виде ленту магнитного сплава системы Ni-Fe-P-B. В этом составе оба металла нужны для обеспечения магнитных свойств, а неметаллы как раз и способствуют аморфизации. Довольно скоро стал ясен основный принцип подбора состава для получения аморфного металла: нужно, чтобы он соответствовал эвтектическому превращению при переходе из жидкого состояния в твердое. Суть этого превращения в том, что, обладая неограниченной смешиваемостью в расплаве, участвующие в реакции элементы на дух не переносят друг друга в твердом состоянии и предпочитают при затвердевании выпадать каждый своими собственными кристаллами. Получается эвтектика — механическая смесь таких кристаллов. Если охлаждать быстро, то возникает ситуация, когда ни один из элементов не может решиться покинуть жидкость и создать свой собственный кристалл. В итоге все так и застывает без кристаллизации.
Свойства таких сплавов оказались уникальными. Прежде всего изменился механизм деформации. Вообще-то у кристаллических материалов реальная прочность во много раз меньше теоретической, рассчитанной как энергия одновременного разрыва межатомных связей. При деформации атомные связи не рвутся все сразу, а одна часть кристалла скользит относительно другой, что требует гораздо меньших усилий. В аморфном металле нет ни зерен, ни границ, поэтому такое скольжение там невозможно, и прочность растет в разы. Правда, падает пластичность (а это в первую очередь сопротивление удару), но материал отнюдь не становится хрупким, как стекло, он прекрасно гнется. Например, аморфную ленту можно обернуть вокруг острия бритвы, а потом она распрямится безо всяких следов. Исчезновение границ и химическая однородность обеспечивают прекрасную коррозионную стойкость.
Начнём с коррозии – у аморфного металла, как и предсказывали, уникальная коррозийная стойкость. Кузов машины, сделанный из него, служил бы верой и правдой сотни лет без всяких смазок и покрытий. Это свойство легко объяснимо: нет зёрен в структуре, а стало быть, и их границ, где зарождается ржавчина. Ведь происходит она в основном из-за того же кристаллического строения металла – начинается на поверхностных границах крохотных зёрен-кристалликов, из которых состоит поверхность металла, вгрызается вглубь, постепенно разрушая структуру.
Увы, скоро оказалось, что материал все-таки получается слишком дорогим для повсеместной замены стали: обрабатывать (например, приваривать) его трудно, да и вопросы к структурной стабильности при длительном применении остались. Аморфные сплавы тоже заняли свою небольшую нишу материалов для специальных изделий — упругих мембран, припоев или тех же сердечников трансформаторов.
В настоящее время изготавливают тарелки с нагревательным контуром из тонких металлических лент и, соответственно, возможностью подключения к сети и подогрева пищи прямо в тарелке. В качестве металла для нагревательного элемента использованы золото и аморфный металл.

Таким образом, быстрая закалка – это возможность создать сплав с экзотическим набором элементов, который другими методами никогда бы не удалось соединить вместе в твердом состоянии – и он часто дает поистине революционные результаты.
Что такое металлы и их строение
Определение металлов можно дать с позиций химии, физики и техники.
В химии металлы — это химические элементы, находящиеся в левой части периодической системы элементов Д. И. Менделеева, которые обладают особым механизмом взаимодействия валентных электронов (ионов) с ядром как в самих металлах, так и при вступлении в химические реакции с другими элементами, в том числе с металлами.
Физика характеризует металлы как твердые тела, обладающие цветом, блеском, способностью к плавкости (расплавлению) и затвердеванию (кристаллизации), тепло- и электропроводностью, магнитными и другими свойствами.
В технике металлы — это конструкционные материалы, обладающие высокой обрабатываемостью (ковкостью, штампуемостью, обрабатываемостью резанием, паяемостью, свариваемостью и др.), прочностью, твердостью, ударной вязкостью и рядом других ценных свойств, благодаря которым они находят широкое применение.
Русский ученый М. В. Ломоносов (1711 — 1765), исследуя металлы и неметаллы в своем труде «Первые основания металлургии или рудных дел», дал металлам определение: «Металлом называется светлое тело, которое ковать можно. Таких тел находим только шесть: золото, серебро, медь, олово, железо и свинец». Это определение М. В. Ломоносов дал в 1773 г., когда известны были только шесть металлов.
Из металлов, добываемых из недр земли, получают большую группу конструкционных материалов, применяемых в различных отраслях промышленности. В природе одни металлы встречаются в чистом, самородном виде, другие — в виде оксидов (соединений металла с кислородом), нитридов и сульфидов, из которых состоят различные руды этих металлов.
Самыми распространенными металлами, применяемыми в качестве конструкционных материалов, являются железо, алюминий, медь и сплавы на основе этих металлов.
К металлам относятся более 80 элементов периодической системы Менделеева. Все эти металлы подразделяются на две большие группы: черные металлы и цветные металлы.
Характерными признаками черных металлов являются темно-серый цвет, блеск, высокие плотность и температура плавления, твердость, прочность, вязкость и полиморфизм (аллотропия). По физикохимическим свойствам черные металлы подразделяют на пять групп:
- железистые (железо, кобальт, никель, марганец);
- тугоплавкие (вольфрам, рений, тантал, молибден, ниобий, ванадий, хром, титан и др.);
- урановые — актиниды (уран, торий, плутоний и др.);
- редкоземельные — лантаниды (лантан, церий, иттрий, скандий и др.);
- щелочно-земельные (литий, натрий, калий, кальций и др.).
Из этих пяти групп черных металлов особенно широкое применение в промышленном производстве находят железистые и тугоплавкие металлы.
Железистые металлы, кроме марганца, называют еще ферромагнетиками. Ферромагнетики способны намагничиваться и притягивать металлы своей группы.
К тугоплавким относятся металлы, которые имеют температуру плавления выше температуры плавления железа (1 539 °С): титан — 1 667 °С, ванадий — 1 902 °С, хром — 1 903 °С, молибден — 2 615 °С, ниобий — 2 460 °С, тантал — 2 980 °С, вольфрам — 3 410 °С. Тугоплавкие металлы в основном применяются как легирующие элементы в производстве жаропрочных, жаростойких, теплостойких и специальных сплавов, в том числе твердых сплавов и высоколегированных сталей.
2. Строение металлов
Атомно-кристаллическая структура металлов. Как известно, все вещества состоят из атомов, в том числе и металлы. Каждый металл (химический элемент) может находиться в газообразном, жидком или твердом агрегатных состояниях. Каждое агрегатное состояние будет иметь свои особенности, отличные друг от друга. В газообразном металле расстояние между атомами велико, силы взаимодействия малы и атомы хаотично перемещаются в пространстве; газ стремится к расширению в сторону большего объема. При понижении температуры и давления вещество переходит в жидкое состояние. Свойства жидкого вещества резко отличаются от свойств газообразного. В жидком металле атомы сохраняют лишь так называемый ближний порядок атомов, т. е. в объеме расположено небольшое количество атомов, а не атомы всего объема. При понижении температуры жидкий металл переходит в твердое состояние, которое имеет строгую закономерность расположения атомов.
Если условно провести вертикальные и горизонтальные линии связи через центры атомов, можно увидеть, что у металлов в твердом состоянии атомы расположены в строго определенном порядке и представляют собой множество раз повторяющиеся элементарные геометрические фигуры — параллелепипеды (рис. 1). Наименьшую геометрическую фигуру называют элементарной ячейкой. Элементарные ячейки, расположенные на горизонтальных и вертикальных кристаллографических плоскостях (рис. 2), образуют пространственную кристаллическую решетку.
Рис. 1. Схема расположения элементарных геометрических ячеек в атомных решетках металлов и сплавов
Рис. 2. Расположение кристаллографических плоскостей: 1 и 2 — соответственно горизонтальная и вертикальная кристаллографические плоскости
Элементарные кристаллические решетки характеризуют следующие основные параметры: расстояние между атомами по осям координат (по линиям связи), углы между линиями связи, координационное число — число атомов, находящихся на наиболее близком и равном расстоянии от любого атома в решетке. Форму элементарной ячейки рассматривают по кристаллографическим плоскостям в трех измерениях.
Таким образом, любой металл можно представить не как однородную цельную массу, а как массу, сложенную из множества элементарных ячеек. Блок элементарных атомных кристаллических ячеек образует атомно-кристаллическую ячейку (решетку). Если выделить эту элементарную ячейку, то в зависимости от металла получим следующие типы кристаллических ячеек (рис. 3): куб (К), объемно-центрированный куб (ОЦК), гранецентрированный куб (ГЦК), гексагональная плотноупакованная ячейка (ГПУ), гексагональная простая ячейка (Г) и др.
Простая кубическая ячейка (рис. 3, а) характерна для неметаллов, которые обладают наибольшими плотностью и удельным весом, и имеет восемь атомов, которые расположены в каждой вершине куба.
Объемно-центрированная кубическая ячейка (рис. 3, б ) состоит из восьми атомов, которые расположены по одному атому в каждой вершине куба, и одного, находящегося в центре куба на равных расстояниях от его граней. Эту форму атомной кристаллической ячейки имеют железо модификации Fe-α, ванадий, вольфрам, молибден, тантал и хром, т. е. в основном черные металлы.
Гранецентрированная кубическая ячейка (рис. 3, в) имеет 14 атомов — по одному атому в каждой вершине куба (восемь атомов) и по одному атому в центре каждой грани (шесть атомов). Гранецентрированную кубическую ячейку имеют алюминий, железо модификации Fe-γ, золото, кобальт, медь, никель, платина и серебро, в основном это цветные металлы и часть черных металлов.
Гексагональная плотноупакованная ячейка (рис. 3, г) состоит из 17 атомов. Форма геометрического тела, которую образуют эти атомы, является шестигранной призмой. При этом по шесть атомов расположены в каждой вершине верхнего и нижнего оснований, по одному атому в центре этих оснований и три атома в центре одной их трех граней (через грань). Гексагональную плотноупакованную ячейку имеют бериллий, кадмий, магний, ванадий, тантал.
Простая гексагональная ячейка (рис. 3, д) состоит из 12 атомов, которые расположены в вершинах верхнего и нижнего оснований шестигранной призмы. Такую кристаллическую ячейку имеют ртуть и цинк.
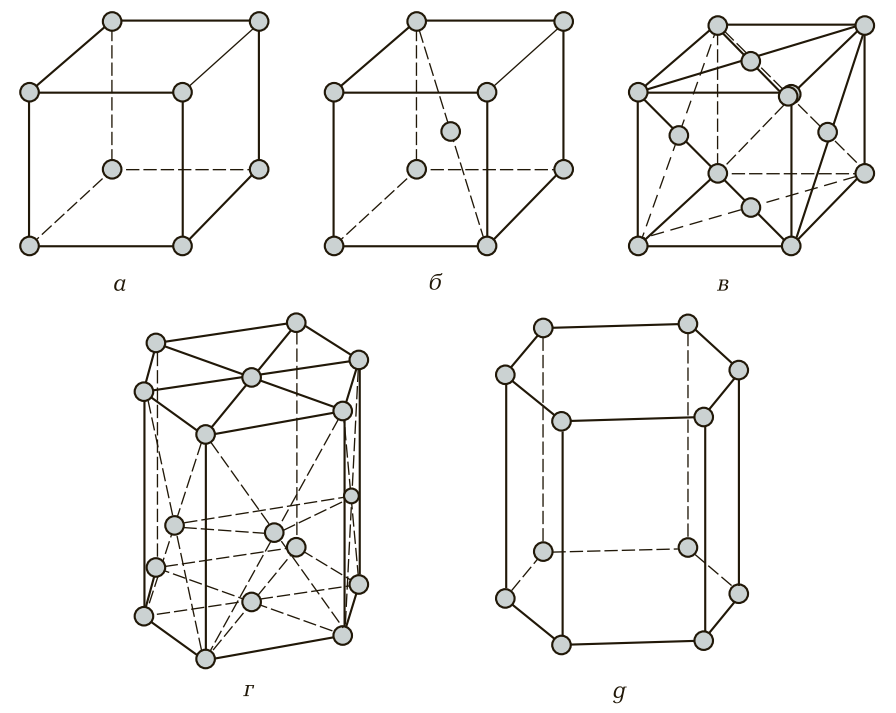
Рис. 3. Геометрические формы элементарных кристаллических ячеек: а — куб; б — объемно-центрированный куб; в — гранецентрированный куб; г — гексагональная плотноупакованная ячейка; д — гексагональная простая ячейка
Связь между атомами в кристаллической решетке и между решетками осуществляется за счет так называемой металлической связи. От прочности этой связи зависят прочность и твердость металлов. Чем выше эта связь, тем бо´льшую прочность и твердость имеют металлы. Механизм связи между атомами в решетке и между решетками имеет сложную физико-химическую природу.
В практике идеальное расположение кристаллических решеток обычно не наблюдается. Кристаллы, образуемые кристаллическими решетками, имеют искаженную геометрическую форму и различную величину.
Анизотропия металлов. Анизотропия (от гр. anisos — неравный и tropos — направление) — неодинаковость физических свойств среды (тела) в различных направлениях. Анизотропия предполагает зависимость свойств металлов от направления по плоскостям атомно-кристаллических решеток. Чем больше в плоскости атомов, тем выше свойства металлов. В горизонтальных плоскостях в любой форме атомно-кристаллических решеток больше, чем в вертикальных плоскостях. Следовательно, прочность металлов, испытанная в горизонтальном направлении, выше, чем в вертикальном. Анизотропия проявляется в процессе обработки конструкционных материалов давлением (проката, волочения, штамповки и других технологических способов получения заготовок и изделий).
На рис. 2 кристаллографические плоскости совпадают с линиями связи, проходящими через атомы металла. Форма элементарной кристаллической ячейки, расстояние между атомами и прочность металлической связи определяют физические, механические и технологические свойства металлов. Если исследуемый металл рассматривать по трем кристаллографическими плоскостям, по линиям связи между атомами, то можно заметить, что свойства по этим трем измерениям будут различны. Число атомов в этих плоскостях неодинаково. Металлическая связь между горизонтально и вертикально расположенными атомами также неодинакова. Это, в свою очередь, приводит к различной прочности металлов в продольном и поперечном направлениях. Например, предел прочности меди в продольном направлении будет в 2 раза больше, чем в поперечном.
Все металлы анизотропны, так как они состоят из кристаллов. Кристаллическое строение металлов обусловливает пластическую деформацию, т. е. изменение внешней формы и размеров под действием нагрузок без разрушения. Способность металлов и сплавов пластически деформироваться положена в основу их обработки давлением (прокатка, волочение, ковка, штамповка и прессование). При обработке давлением, например прокатке (рис. 4, а), происходит перемещение одного слоя атомных решеток по другому по кристаллографическим плоскостям (рис. 4, б).
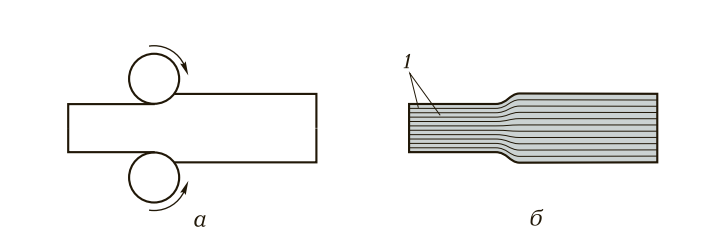
Рис. 4. Схема деформации металлов и сплавов (прокатка): а — деформация; б — скольжение металлов по кристаллографическим плоскостям в процессе деформации; 1 — кристаллографические плоскости
В процессе деформации металла при прокатке происходит не только изменение поперечных и продольных размеров заготовок, но и изменение микроструктуры металла.
Зерна под действием давления прокатных валков искажаются, приобретая продолговатую или пластинчатую форму, а затем преобразуются в волокна. Изменение микроструктуры металла в процессе деформации условно показано на рис. 5.
Процесс кристаллизации. Рассмотрим, как происходит образование кристаллов у чистых металлов. Установлено, что процесс кристаллизации металлов из жидкого состояния в твердое идет в две стадии:
- образование центров кристаллизации;
- рост кристаллов вокруг этих центров (рис. 6).
Рис. 5. Изменение микроструктуры металла в процессе деформации: а — микроструктура металла до деформации; б — микроструктура металла после первой операции деформации; в — микроструктура металла после окончательной деформации
Рис. 6. Процесс кристаллизации металлов и сплавов: а — е — последовательные этапы процесса
Далее вновь появляются новые центры, и происходит рост твердой фазы вокруг первичных и вторичных центров. Процесс происходит до того момента, пока образованные таким образом кристаллы не будут соприкасаться друг с другом и не будет наличия жидкой фазы металла (см. рис. 6, г — е). Когда образование кристалла идет в жидкой фазе (в расплавленном металле), он будет иметь правильную форму, т. е. состоять из определенных геометрических фигур правильной формы. Когда кристаллы начинают соприкасаться друг с другом, а процесс затвердевания еще не закончен, тогда происходят искажения формы зерен. В практике замечено, что когда идет быстрое охлаждение, образуются мелкие зерна — мелкозернистая структура. При медленном охлаждении появление новых центров кристаллизации замедляется, но происходит рост зерна вокруг первичных центров кристаллизации. В этом случае металл будет иметь крупнозернистую структуру.
Процесс образования кристаллов в жидком состоянии и перехода металла в твердое состояние называется первичной кристаллизацией. Величина и форма зерна влияет на механические свойства металлов. Чем зерна мельче и чем правильнее их форма, тем большую твердость и прочность будет иметь металл. Чем зерна больше и чем искаженнее их форма, тем ниже твердость и прочность металла.
Аллотропия металлов. Такие металлы, как железо, кобальт, никель и др., обладают способностью изменять кристаллическую решетку при нагревании в твердом состоянии. Процесс изменения кристаллических решеток в твердом состоянии называется вторичной кристаллизацией, или аллотропией, а состояние вещества (металла) при наличии нескольких кристаллических решеток при изменении параметров (давления, температуры) — аллотропическими модификациями, или полиморфизмом. Такие металлы, как железо, молибден, вольфрам, литий в твердом состоянии при нормальной температуре имеют объемно-центрированную кубическую ячейку; алюминий, медь, серебро в твердом состоянии при нормальной температуре имеют форму гранецентрированной кубической ячейки.
На рис. 7 представлены кривые нагрева и охлаждения металла (на примере марганца). Аллотропные состояния (модификации), имеющие те или иные кубические ячейки, обозначаются греческими буквами. Первоначальное аллотропное состояние при нормальной температуре обозначается буквой α, при дальнейших повышении температуры и перекристаллизации металла — буквами β, γ, δ и т. д. При охлаждении металлов и сплавов процесс аллотропного превращения происходит в обратном порядке, как правило при тех же температурах.
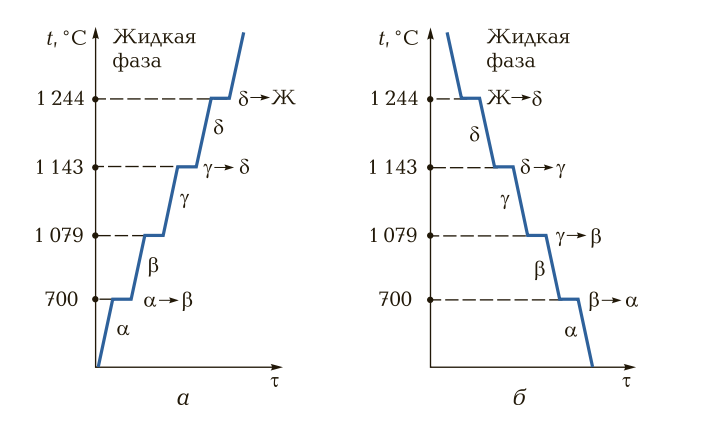
Рис. 7. Кривые нагрева (а) и охлаждения (б) марганца: t — температура; τ — время
Получение чистых металлов физика
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Общая характеристика и способы получения металлов
Значительная химическая активность металлов (взаимодействие с кислородом воздуха, другими неметаллами, водой, растворами солей, кислотами) приводит к тому, что в земной коре они встречаются главным образом в виде соединений: оксидов, сульфидов, сульфатов, хлоридов, карбонатов и т. д. В свободном виде встречаются металлы, расположенные в ряду напряжений правее водорода (Аg, Нg, Рt,Аu, Сu), хотя гораздо чаще медь и ртуть в природе можно встретить в виде соединений.
Минералы и черные породы, содержащие металлы и их соединения, из которых выделение чистых металлов технически возможно и экономически целесообразно, называют рудами.
Получение металлов из руд — задача металлургии.
Металлургия — это и наука о промышленных способах получения металлов из руд, и отрасль промышленности.
Любой металлургический процесс — это процесс восстановления ионов металла с помощью различных восстановителей. Суть его можно выразить так:
Чтобы реализовать этот процесс, надо учесть активность металла, подобрать восстановитель, рассмотреть технологическую целесообразность, экономические и экологические факторы.

В соответствии с этим существуют следующие способы получения металлов:
Пирометаллургия
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов — алюминия, магния.
Например, олово восстанавливают из касситерита SnО2, а медь — из куприта Cu2O
прокаливанием с углем (коксом):
SnО2+ 2С = Sn + 2СО ↑; Cu2O + С = 2Cu+ СО ↑
Сульфидные руды предварительно подвергают обжигу при доступе воздуха, а затем полученный оксид восстанавливают углем:
2ZnS + 302 = 2ZnО + 2SO2 ↑; ZnО + С = Zn + СО ↑
сфалерит (цинковая обманка)
Из карбонатных руд металлы выделяют также путем прокаливания с углем, т. к. карбонаты при нагревании разлагаются, превращаясь в оксиды, а последние восстанавливаются углем:
FeСO3 = FеО + СO2 ↑ ; FеО + С = Fе + СО ↑
сидерит (шпатовый железняк)
Восстановлением углем можно получить Fе, Сu, Zn, Сd, Ge, Sn, Рb и другие металлы, не образующие прочных карбидов (соединений с углеродом).
В качестве восстановителя можно применять водород или активные металлы:
К достоинствам этого метода относится получение очень чистого металла.
2) TiO2+ 2Мg = Тi + 2МgO (магнийтермия)
Чаще всего в металлотермии используют алюминий, теплота образования оксида
которого очень велика (2А1 + 1,5 O2 = Аl2O3 + 1676 кДж/моль). Электрохимический ряд напряжений металлов нельзя использовать для определения возможности протекания реакций восстановления металлов из их оксидов. Приближенно установить возможность этого процесса можно на основании расчета теплового эффекта реакции (Q), зная значения теплот образования оксидов:
где Q1— теплота образования продукта, Q2 -теплота образования исходного вещества.
Доменный процесс (производство чугуна):
C + O2 = CO2, CO2 + C ↔ 2CO
3Fe2O3 + CO = 2(Fe 2 Fe 3 2)O4+ CO2
(Fe 2 Fe 3 2)O4+ CO= 3FeO + CO2
FeO + CO= Fe + CO2
(чугун содержит до 6,67% углерода в виде зерен графита и цементита Fe3C);

Выплавка стали (0,2-2,06% углерода) проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева. Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов. При этом оксиды либо улавливаются в виде отходящих газов (CO2, SO2), либо связываются в легко отделяемый шлак – смесь Ca3(PO4)2 и CaSiO3. Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Гидрометаллургия
Гидрометаллургия — это восстановление металлов из их солей в растворе.
Процесс проходит в два этапа: 1) природное соединение растворяют в подходящем реагенте для получения раствора соли этого металла; 2) из полученного раствора данный металл вытесняют более активным или восстанавливают электролизом. Например, чтобы получить медь из руды, содержащей оксид меди СuО, ее обрабатывают разбавленной серной кислотой:
Затем медь либо извлекают из раствора соли электролизом, либо вытесняют из сульфата железом:
Таким образом, получают серебро, цинк, молибден, золото, уран.
Электрометаллургия
Электрометаллургия — восстановление металлов в процессе электролиза растворов или расплавов их соединений.
Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы. При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов.
Природные соединения металлов:
сильвинит КСl ∙ NaCl, каменная соль NaCl;
серный колчедан FeS2, киноварь HgS, цинковая обманка ZnS;
мел, мрамор, известняк СаСО3, магнезит MgCO3,
доломит CaCO3 ∙ MgCO3;
глауберова соль Na2SO4 ∙ 10 H2O, гипс CaSO4 ∙ 2Н2О;
магнитный железняк Fe3O4, красный железняк Fe2O3, бурый железняк Fe2O3 ∙ Н2О.
чилийская селитра NaNO3;
Минералы и горные породы, содержащие металлы и их соединения и пригодные для промышленного получения металлов, называются рудами.
Отрасль промышленности, которая занимается получением металлов из руд, называется металлургией.
Способы получения металлов из руд.
1. Электрометаллургический способ - это способы получения металлов с помощью электрического тока (электролиза). Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы.
При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов:
NaCl (расплав) D Na+ + Cl-
катод Na+ + e à Na0 ¦ 2
анод 2Cl - - 2e à Cl20 ¦ 1
суммарное уравнение: 2NaCl (распл.) – (э. ток)à 2Na + Cl2
Современный способ получения алюминия был изобретен в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит растворяет Al2O3, как вода растворяет сахар.
Al2O3 (расплав) D Al3+ + AlO33–
катод Al3+ +3e à Al 0 ¦ 4
анод 4AlO33– –12 e à 2Al2O3 +3O2 ¦ 1
суммарное уравнение: 2Al2O3(распл.) – (э. ток)à 4Al + 3O2 .
2. Пирометаллургический способ - это восстановление металлов из их руд при высоких температурах с помощью восстановителей: неметаллических : кокс, оксид углерода (II), водород; металлических: алюминий, магний, кальций.
Алюмотермия :
Fe+32O3 +2Al = 2Fe0 + Al2O3
Получают железо, хром.
Восстановление оксидов металлов водородом (водородотермия ):
Cu +2O + H2 –(t)à Cu0 + H2O
Получают малоактивные металлы – медь, вольфрам.
Получение чугуна:
В вертикальной печи кокс окисляется до СО, затем происходит постепенное восстановление железа из руды:
3Fe2O3 + CO –(t)à 2Fe3O4 + CO2 ,
Fe3O4 + 4CO –(t)à 3FeО + 4CO2
FeO + CO –(t)à Fe+ CO2
Восстановление углём (коксом):
ZnO + C –(t)à Zn + CO
Получают цинк, никель.
3. Гидрометаллургический способ основан на растворении природного соединения с целью получения раствора соли этого металла и вытеснением данного металла более активным. Например, руда содержит оксид меди и ее растворяют в серной кислоте: CuO + H2SO4 = CuSO4 + H2O, затем проводят реакцию замещения:
CuSO4 + Fe = FeSO4 + Cu.
Таким способом получают серебро, цинк, молибден, золото, ванадий.
Если для восстановления требуется оксид металла, то в процессе переработки сначала получают оксид:
а) из сульфида – обжигом в кислороде: 2ZnS + 3O2 = 2ZnO + 2SO2
б) из карбоната – разложением: СаСО3 –(t)à СаО + СО2
Чугун и сталь.

Производство железа основано на карботермическом восстановлении оксидных металлсодержащих руд.
1) Сульфидные и другие руды вначале подвергают окислительному обжигу : 4FeS2 + 11O2 = 2Fe2O3 + 8SO2.
2)Восстановление оксидных руд осуществляется в доменных печах, при этом протекают следующие реакции:
3Fe2O3 + CO –(t)àCO2 + 2Fe3O4, Fe3O4 + CO–(t)àCO2 + 3FeO, FeO + CO–(t)àCO2 + Feили FeO + C –(t)àCO + Fe.

Полученное железо насыщено углеродом. 3)Затем происходит «выжигание» углерода в сталеплавильных или конверторных печах с образованием стали.



Восстановление окислов металлов водородом применяется для по лучения чистых германия, вольфрама, молибдена, висмута и железа; аналогичным путем получается рений из перрената калия.
Исходным материалом для производства германия служит его чистая двуокись, восстановление которой осуществляют в графитовых лодочках, помещенных в трубчатую печь с наружным обогревом. Для уменьшения потерь от улетучивания низшего окисла германия GeO процесс ведут сначала при 600°, затем при 800—900°. В той же печи при температуре выше 960° порошок германия переплавляют в слитки.
Для получения чистого германия необходимо применять лодочки из особо очищенного графита; примеси, содержащиеся в обычном графите, могут попадать в германий, снижая его качество.
Существенное влияние на качество продукта оказывает чистота водорода. Поскольку для восстановления 1 кг германия требуется около 600 л водорода, содержание примесей в последнем должно быть менее 0,002 мг/м3. Очистку водорода от сопутствующих газов — кислорода, азота, сероводорода, углекислоты — производят обычно с помощью титановой стружки, нагретой до 900°. Хорошим сорбентом большинства сопутствующих газов является активированный уголь, охлажденный до температуры жидкого азота; при этом поглощаются также остатки влаги, конденсация которой способствует коагуляции аэрозолей. Очистку от аэрозолей осуществляют пропусканием водорода через несколько слоев фильтровальной бумаги; хорошим материалом для фильтров служит ткань Петрякова.
При соблюдении надлежащих условий получается германий высокой чистоты; однако такой металл еще не пригоден для полупроводниковой техники и требует дополнительного рафинирования приемами, описанными ниже при изложении кристаллофизических методов.
Восстановление водородом является единственным технологическим методом, применяемым в настоящее Бремя в промышленном масштабе для получения чистых вольфрама и молибдена.
Порошки металлического вольфрама и молибдена, полученные при восстановлении водородом хорошо очищенных ангидридов, после обработки металлокерамическим способом дают компактный металл, пригодный для производства изделий (проволоки, листа и др.).
Восстановление окислов углеродом используют главным образом для получения технически чистых металлов, нуждающихся в дальнейшем рафинировании, превращающем их в металлы высокой чистоты. Этот метод применяют для ряда цветных, большинства малых и некоторых редких металлов.
Оригинальным вариантом метода является разработанный К. Болке способ получения ниобия в вакууме по реакции
Приготовленный для этой цели карбид ниобия измельчают в порошок и смешивают с пятиокисью ниобия в требуемом соотношении. Брикеты смеси прокаливают в вакууме при температуре около 1600°. Для полного удаления углерода в виде СО в состав шихты вводят небольшой избыток пятиокиси ниобия, в последующих операциях металлокерамической обработки — главным образом высокотемпературной сварки — избыток пятиокиси ниобия улетучивается в вакууме при температуре ниже точки плавления металла. Этим способом получается компактный ниобий высокой степени чистоты.
Металлотермическое восстановление применяют в производстве титана, цирконня, гафния, тория, ниобия, тантала, урана и других металлов.
Восстановление двуокиси металла кальцием в вакууме или инертном газе используют для получения тория, циркония, гафния и титана.
Восстановление хлоридов магнием применяют в промышленном масштабе для получения титана и циркония.
Важнейшим технологическим процессом производства металлического урана является магние- или кальциетермическое восстановление из чистого тетрафторида, которое осуществляют в тиглях, помещенных в герметически закрытые аппараты (бомбы). Для получения урана, применяемого в атомной энергетике, необходимо пользоваться специально очищенным тетрафторидом и ректифицированным магнием или кальцием.
При всех методах металлотермического восстановления вначале получают технические металлы, обычно загрязненные металлом-восстановителем, которые в дальнейшем рафинируют. Однако по ряду примесей такие металлы могут быть ультрачистыми даже без дополнительного рафинирования; например, технический металлический уран, полученный из хорошо очищенного от редких земель фторида, является ультрачистым по этим примесям.
Электролизом водных растворов или расплавленных сред получают такие чистые редкие металлы, как галлий, торий, тантал, бериллий, цирконий и др.
Галлий чистотой 99,9% получают электролизом раствора галлата натрия, содержащего небольшое количество свободной щелочи. В качестве катода используют жидкий галлий, в качестве анода — графитовый стержень, нержавеющую сталь или никель. Процесс ведут при температуре 45—50°.
Тантал, содержащий сотые доли процента основных примесей, может быть получен электролитическим разложением пятиокиси тантала, растворенной в смеси расплавленных солей К2ТаF7, KF и КСl. Пятиокись тантала в расплаве диссоциирует; при электролизе на катоде выделяется тантал, а на аноде — кислород. Электролиз ведут в тигле из графита, железа или никеля при 750°. Тигель служит анодом, а опушенный в тигель стержень из графита, молибдена или никеля — катодом. Осаждающийся на катоде танталовый порошок счищают, отмывают от солей и сушат.
Электролизом расплавленных солей получают чистый бериллий. В качестве электролита применяют обычно смесь солей ВеСl2 и NaCl в весовом соотношении 1:1, плавящуюся при температуре 215°. Катодом является никелевый тигель, в котором осуществляется процесс, анодом — графитовый стержень, вставленный в тигель через отверстие в крышке. Температура электролита 350°. Металлический бериллий снимают со стенок тигля в горячем состоянии, отжимают от электролита на прессе и промывают.
Читайте также:
