Получение и свойства соединений металлов практическая работа
Обновлено: 21.09.2024
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Практическая работа № 2
«Получение и свойства соединений металлов»
Цель работы: на практике провести реакции по получению и изучению свойств соединений металлов.
Вариант 1: получение гидроксида железа (II) и изучение его свойств
Оборудование и реактивы: штатив для пробирок, пробирки, раствор сульфата железа (II), соляная кислота, гидроксид калия, перекись водорода.
С правилами техники безопасности при проведении практической работы ознакомлен(а) и обязуюсь выполнять
(подпись) Ход работы :
Уравнения реакций в молекулярном, полном и сокращенном ионном виде
- В пробирку с раствором сульфата железа (II) добавьте немного раствора гидроксида калия. Наблюдайте за происходящими изменениями.
- Полученный в первом опыте гидроксид железа (II) разделите на две пробирки. В одну пробирку добавьте раствор соляной кислоты,
- В другую пробирку из второго опыта добавьте раствор перекиси водорода.
Вариант 2: получение гидроксида железа (III) и изучение его свойств
Оборудование и реактивы: штатив для пробирок, пробирки, раствор сульфата железа (III), соляная кислота, гидроксид калия, роданид калия.
- В пробирку с раствором сульфата железа (III) добавьте немного раствора гидроксида калия. Наблюдайте за происходящими изменениями.
- К полученному в предыдущем опыте гидроксиду железа (III) добавьте немного раствора соляной кислоты. Не допускайте попадания кислоты на руки и одежду! Наблюдайте за происходящими изменениями.
- К раствору полученному в опыте 2 добавьте несколько капель (!пипеткой) раствора роданида калия. Наблюдайте за происходящими изменениями.
Вариант 3 (для сдающих ОГЭ по химии)
Задание 1. Для проведения эксперимента предложены следующие реактивы: Fe; растворы FeSO 4 , Fe 2 (SO 4 ) 3 , H 2 SO 4, КOH, H 2 O 2 . Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид железа (III). Результаты оформите в виде следующей таблицы: (для окислительно-восстановительных реакций составьте электронный баланс, для реакций ионного обмена запишите уравнения реакций в молекулярной и ионной форме).
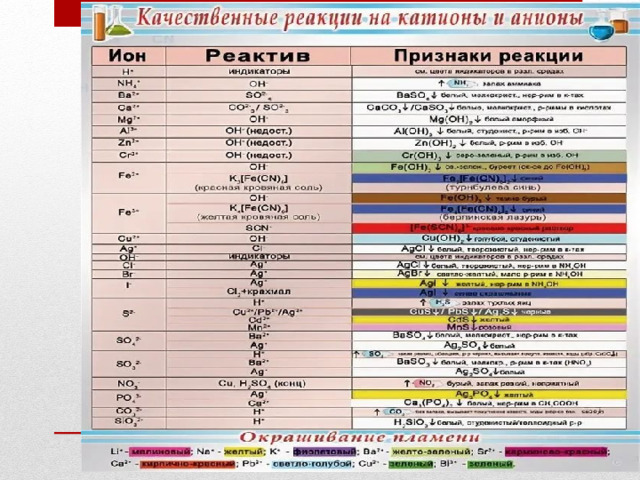
Задание 2. С помощью характерных реакций докажите качественный состав хлорида железа (III).
Определите с помощью предложенных Вам реактивов наличие в исследуемом растворе иона Fe 3+ , а затем иона Cl - .
Проделайте реакции, выбранные вами. Какие характерные признаки вы наблюдаете? Запишите уравнения в молекулярной и ионной форме.
По теме: методические разработки, презентации и конспекты

Работа с учебником «Литература. 6 класс» А.В. Гулина, А.Н. Романовой в условиях внедрения нового стандарта. (практическая работа)
Работа с учебником «Литература. 6 класс» А.В. Гулина, А.Н. Романовой в условиях внедрения нового стандарта: воспитание российской гражданской идентичности: патриотизма, уважения к Отечеству, прошлому.

Практическая работа по теме: Географические координаты для 6 класса. Работу создала Барбашова Наталья Алексеевна учитель МКОУ СОШ № 251 ЗАТО г. Фокино Приморского края
Практическая работа по теме: Географические координаты для 6 класса имеет сформулированную цель, два варианта для прямого и обратного определения координат и пять дополнительных заданий, а так же отве.

Разработка фрагмента практической работы для учащихся 6 класса. Тема обучающей практической работы: Определение географической широты объектов
Определение географической широты объектовПрограммы: Примерная программа основного общего образования по географии "География Земли"(6-7 классы)/ сборник нормативных документов: География: Федеральный.
Разработка фрагмента практической работы для учащихся 7 класса. Тема обучающей практической работы: Выявление по картам особенностей расположения крупных форм рельефа, сопоставляя карту строения земной коры с физической картой
Разработка фрагмента практической работы для учащихся 7 класса.Программы: Примерная программа основного общего образования по географии "География Земли"(6-7 классы)/ сборник нормативных документов: Г.
Разработка фрагмента практической работы для учащихся 8 класса. Тема обучающей практической работы: Определение поясного и местного времени для разных пунктов России
Разработка фрагмента практической работы для учащихся 8 класса.Программы: Примерная программа основного общего образования по географии "География Земли"(6-7 классы)/ сборник нормативных документов: Г.
УЧЕТ ПСИХОФИЗИОЛОГИЧЕСКИХ ОСОБЕННОСТЕЙ УЧАЩИХСЯ В ПРАКТИЧЕСКОЙ РАБОТЕ НА УРОКАХ ТРУДА УЧЕТ ПСИХОФИЗИОЛОГИЧЕСКИХ ОСОБЕННОСТЕЙ УЧАЩИХСЯ В ПРАКТИЧЕСКОЙ РАБОТЕ НА УРОКАХ ТРУДА
Актуальность темы: Знание психики, возрастных, физиологических особенностей и клинического диагноза позволяет организовать более оптимальную корре.

Практическая работа «Практические способы измерения сил»
работа может быть проведена на практическом занятии в 9 классе по образовательной программе РК 2013-14 уч.год .
Инструкции к выполнению практической работы по химии "Получение и свойства соединений металлов" (9 класс)
Инструкция к выполнению практической работы № 2 «Получение и свойства соединений металлов».
1. В тетради для практических работ запишите дату занятия и её название «Получение и свойства соединений металлов».
2. Укажите цель работы: получить соединения металлов и изучить их свойства.
3. Перечислите оборудование и реактивы, находящиеся у вас на рабочих столах.
4. Заготовьте таблицу в соответствии с приведенным образцом.
Уравнения реакций (молекулярный и ионный вид)
6. Данную таблицу заполняйте по этапам, предусмотренными ходом выполнения работы. Она будет служить вам как письменный отчет по результатам практической работы.
7. Приступайте к выполнению работы внимательно прочитав правила ТБ при работе с кислотами и щелочами.
Правила ТБ при работе с щелочами и кислотами.
Кислоты и щелочи способны вызывать сильные химические ожоги, поэтому работать с ними надо очень осторожно, не допуская их контакта с кожей рук, одеждой, бумагой. При проливании этих растворов не паникуйте, немедленно сообщите об этом учителю. Помните, разлитые жидкости самим убирать нельзя!
8. Возьмите пробирку №1 с раствором FeCl 3 из штатива. Прилейте к данному раствору (по каплям) раствор NaOH до появления признака химической реакции. Что наблюдаете? Поставьте пробирку в штатив. Заполните строку (1) в вашей таблице.
9. Возьмите пробирку из штатива с полученным раствором. Добавьте туда по каплям раствор кислоты H 2 SO 4 до появления признака химической реакции. Что наблюдаете? Поставьте пробирку в штатив. Заполните строку (2) в вашей таблице.
10. Опытным путем докажите качественный состав раствора FeSO 4 . Возьмите пробирку №2 из штатива с этим раствором. Разделите эту порцию пополам (для этого возьмите пустую пробирку из штатива).
а). Добавьте в первую часть раствора по каплям раствор хлорида бария BaCl 2 до появления признака химической реакции. Что наблюдаете? Поставьте пробирку в штатив. Заполните строку (3) в вашей таблице.
б). Добавьте во вторую часть раствора (по каплям) раствор щелочи NaOH до появления признака химической реакции. Что наблюдаете? Поставьте пробирку в штатив. Заполните строку (4) в вашей таблице.
11. Напишите вывод к работе. Внимание! Напоминаю, что вывод пишем исходя из цели работы.
12. Приведите рабочее место в порядок. Сдайте тетрадь учителю для проверки.
Инструкция к выполнению практической работы № 2
« Получение и свойства соединений металлов ».
1. В тетради для практических работ запишите дату занятия и её название.
2. Укажите цель работы.
4. Письменный отчёт можете представить в удобной для вас форме (в виде таблицы или составления плана работы). Основные требования к любому виду отчета: а). Описание действий с химическими растворами; б). Наблюдения; в). Уравнения реакций (молекулярный и ионный вид); г). Выводы.
Вспомните не менее трех правил по ТБ при работе с кислотами и щелочами. Запишите их в ваш отчет.
6. Задание №1. Осуществите на практике химические переходы, используя имеющиеся у вас на рабочих столах реактивы и химическую посуду.
7. Задание №2. Опытным путем докажите, что раствор сульфата железа ( II ) содержит ионы Fe 2+ и SO 4 2- .
8. Напишите общий вывод к работе.
9. Приведите рабочее место в порядок. Сдайте тетрадь учителю для проверки.
Урок по теме: «Практическая работа. Получение и свойства соединений металлов»
Тема урока: Практическая работа. Получение и свойства соединений металлов.
Тип урока: обобщение знаний
Цель урока: закрепить на практике получение соединений металлов и их свойства.
Задачи урока:
Образовательные : закрепить знания о химических свойствах соединений металлов; продолжить формировать умение проведения эксперимента; з акрепить знания о реакциях, доказывающих основные и амфотерные свойства гидроксидов.
Развивающие: формирование исследовательского интереса к практической деятельности на уроках химии; развивать умение предполагать результат опыта на основе полученных знаний.
Воспитательные: продолжать формирование химического мировоззрения; повторить правила техники безопасности при работе в химической лаборатории.
План урока
1. Организационный момент –2 мин.
2. Основная часть урока – 38 мин:
1. Коррекция и актуализация ранее изученного материала
2. Организация выполнения практической работы.
3. Обобщение и систематизация учащимися результатов работы.
3. Заключительная часть урока- 5 мин.
Подведение итогов работы на уроке
1. Организационный момент.
Здравствуйте ребята! Сегодня наш урок мне хочется начать со слов великого греческого философа Аристотеля: «Ум заключается не только в знании, но и в умении прилагать знание на деле…».
- Как вы понимаете слова великого философа?
- Итак, чем же мы будем сегодня на уроке заниматься? (выполнять практическую работу)
2. Основная часть урока.
1. Коррекция и актуализация ранее изученного материала.
Но прежде чем перейти к практической работе, мы с вами повторим то, что изучали на прошлых уроках.
Напомните мне, о чем же мы говорили на прошлых уроках (о металлах: щелочных, щелочноземельных, алюминии).
- Что нового мы узнали о металлах?
- Какие же вещества называются металлами? (элементы, имеющие на последнем уровне от 1 до 3 электронов)
Индивидуальная работа по карточкам
1. Показать строение атома алюминия и охарактеризовать его химические свойства. Напишите соответствующие уравнения реакций.
Осуществить превращения схемы и написать уравнения реакций, для первой реакции составить электронный баланс, а для 4 – написать ионные уравнения реакций.
Al ® Al(OH)3 _ ® Al2 O3 ® AlCl3 ® Al(OH)3
В то время пока 4 ученика работают по карточкам, мы с вами повторим все, что мы изучали на прошлых уроках.
Давайте проведем интеллектуальную разминку.
Интеллектуальная разминка.
1. Выберите группу элементов, в которой находятся только металлы:
А ) Al, As, P; Б ) Mg, Ca, Si; В ) K, Ca, Al.
2. Укажите общее в строении атомов K и Li:
А) 2 электрона на последнем электронном слое;
Б) 1 электрон на последнем электронном слое;
В) одинаковое число электронных слоев.
3. Металлический кальций проявляет свойства:
А) окислителя Б) восстановителя;
В) окислителя или восстановителя в зависимости от условий.
4. Дайте общее название приведённым ниже группам веществ:
А) Литий, натрий, калий, рубидий, цезий; (Ответ: щелочные металлы, металлы I группы главной подгруппы)
Б). СаО, Li 2 O , Na2O; (Ответ: основные оксиды)
Мы с вами на уроках говорили, что важны не только сами металлы, но и соединения металлов, а также их свойства, которые в химии отражают с помощью генетических цепочек превращений. Давайте, рассмотрим одну из таких.
Работа у доски.
1. СаО + Н2О = Са(ОН)2 - реакция соединения (гидроксид кальция)
2. Са(ОН)2 + Н NO 3 = Са( NO 3 )2 + Н2О – реакция обмена (нитрат кальция)
3. Са( NO 3 )2 + Na 2 CO 3 = СаСО3↓ + NaNO 3 – реакция обмена (карбонат кальция)
2. Организация выполнения практической работы.
Химия – это наука экспериментальная, поэтому все наши теоретические знания мы должны подтвердить практически. Итак, тема нашего сегодняшнего урока «Практическая работа. Получение и свойства соединений металлов».
Перед вами лежат опорные конспекты, где сегодня вы будете оформлять все наблюдения и выводы по ходу практической работы. Поставьте дату и укажите свою фамилию.
- Давайте, сформулируем цель практической работы (учащиеся высказывают сои предположения)
Итак, цель практической работы: закрепить на практике получение соединений металлов и их свойства.
А теперь можно и приступать к практической части нашего урока. И самое главное это повторить правила по ТБ. Это наши традиционные правила. Давайте вместе их вспомним.
1.
Учащимся запрещается выносить из кабинета и вносить в него любые вещества без разрешения учителя.
2.
Во время работы в кабинете химии учащиеся должны соблюдать чистоту, порядок на рабочем месте, а также четко следовать правилам ТБ.
3.
Не допускается загромождение проходов портфелями и сумками.
4.
Проводите опыты лишь с теми веществами, которые указаны учителем.
5.
Не пробуйте вещества на вкус.
6. Жидкие вещества берем только с помощью пипеток, а если взяли больше необходимого количества ни в коем случае не выливаем опять в склянку с веществом.
7.
При выяснении запаха не подносите сосуд близко к лицу. Для выяснения запаха нужно ладонью руки сделать движение от отверстия сосуда к носу.
8.
Опыты производите только над столом.
9.
В случае пореза, ожога немедленно обращайтесь к учителю.
10.
Обращайтесь бережно с посудой, веществами и лабораторным оборудованием.
11.
Закончив работу, приведите рабочее место в порядок.
Учащиеся ставят росписи в журнале по ТБ.
Выполнение практической работы учащимися. Два варианта практической работы: для сильных и слабых учеников.
3. Обобщение и систематизация учащимися результатов работы.
Хочу вам открыть небольшой секрет. Мы с вами сегодня выполняли разноуровневую практическую работу: кому-то нужно было смешать те вещества, которые указаны, а кому-то нужно было подумать, какие вещества смешивать. Но к выводу мы должны были прийти к одному.
Итак, какой вывод сделала пара…..
Как видите, выводы одинаковые.
3.Заключительная часть
Подведение итогов работы на уроке
- Чему мы сегодня научились на уроке? (получать соединения металлов, изучать их свойства, доказали, что гидроксид алюминия является амфотерным веществом)
Домашнее задание
Ваша задача повторить все химические свойства металлов, о которых мы говорили, а также выполните те задания, которые представлены на листах. Вы можете выбрать то задание, которое считаете выполнимым для вас.
- Что вам сегодня на уроке понравилось?
- Что запомнилось больше всего?
- Были ли затруднения на уроке?
Выставление оценок, благодарность за урок.
Дата:_________
Ф.И. учащегося_________________________________
Практическая работа №2
Получение и свойства соединений металлов
Цель работы : _________________________________________________________________________________________________________________________________________________________________________________________________________
Реактивы : Fe , Fe 2 O 3 , FeSO 4 , NaOH , AlCI 3 , NaOH , HCI .
1. Получите гидрооксид алюминия и докажите его амфотерный характер.
2. Результаты работы оформите в таблицу.
Уравнение реакции в молекулярном и в ионном виде
1)Как можно получить нерастворимое основание?
2)Почему гидрооксид натрия необходимо добавлять по каплям?
3).В чем сущность амфотерности?
1. Получите сульфат железа ( II ) тремя способами с помощью тех реактивов, которые вам выданы.
2. Результаты работы оформите в таблицу. Укажите тип реакций.
С помощью каких реакций можно получить данную соль?
Не забывайте убирать рабочее место, и записывать уравнения реакций.
Если кислота или щелочь попала на кожу, надо немедленно промыть большим количеством проточной воды.
Реактивы: NaOH , AlCI 3 , NaOH , HCI .
Уравнение реакции в молекулярном виде, тип реакции
К хлориду алюминия прилейте гидрокисд натрия и полученный осадок разделите на две пробирки; к одной добавьте соляной кислоты, к другой гидроксида натрия.
Выпадает осадок _____________цвета.
Осадок в кислотах ________________.
Осадок в щелочах ________________.
Гидроксид алюминия носит ______________________________, так как ________
1. Получите сульфат железа ( II ) с помощью тех реактивов, которые вам выданы.
К железу прилейте серной кислоты.
Сульфат железа ( II ) можно получить с помощью_____________________________________
Домашнее задание.
1. Допишите уравнения реакций, расставьте коэффициенты:
2. Осуществите цепочку превращений, расставьте коэффициенты.
Первую реакцию рассмотрите, как ОВР, четвертую и шестую в свете ТЭД.

Курс повышения квалификации
Основы общей и педагогической психологии в деятельности педагога образовательного учреждения
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС

Основы разработки онлайн-курса

«Домашнее обучение. Лайфхаки для родителей»
Краткое описание документа:
Тема урока: Практическая работа. Получение и свойства соединений металлов.Тип урока: обобщение знанийЦель урока: закрепить на практике получение соединений металлов и их свойства. "Задачи урока: Образовательные: закрепить знания о химических свойствах соединений металлов; продолжить формировать умение проведения эксперимента; закрепить знания о реакциях, доказывающих основные и амфотерные свойства гидроксидов.Развивающие: формирование исследовательского интереса к практической деятельности на уроках химии; развивать умение предполагать результат опыта на основе полученных знаний.Воспитательные: продолжать формирование химического мировоззрения; повторить правила техники безопасности при работе в химической лаборатории. "План урока 1. Организационный момент –2 мин.2. Основная часть урока – 38 мин:1. Коррекция и актуализация ранее изученного материала2. Организация выполнения практической работы.3. Обобщение и систематизация учащимися результатов работы.3. Заключительная часть урока- 5 мин. Подведение итогов работы на уроке Домашнее задание Рефлексия
Химия. Практическая работа по теме "Получение и свойства соединений металлов"

Данный документ содержит описание практической работы в виде таблице. Оформление индивидуально. В таблице красным цветом дан ответ. При подготовке таблицы необходимо содержимое двух колонок не выводить на печать. учащиеся сами должны заполнить данные колонки.
Просмотр содержимого документа
«Химия. Практическая работа по теме "Получение и свойства соединений металлов"»
Практическая работа №2
Тема: Получение и свойства соединений металлов.
Инструктаж по Т.Б.
Цель работы: повторить основные вопросы химии металлов. На практике закрепить знания об основных свойствах металлов, качественные реакции по металлам.
Оборудование: наборы химических реактивов и оборудование к практической работе
1)В пробирку с раствором хлорида алюминия добавим по каплям раствор щелочи
2) В другую пробирку с раствором щелочи добавим раствор
Только, после добавления избытка А1С13 выпадет осадок А1(ОН)3.
3)Докажем амфотерный характер А1(ОН)3. Для этого, полученный осадок А1(ОН)3 разделим на 2 пробирки. В одну из пробирок добавим раствор любой сильной кислоты, в другую — раствор щелочи (избыток).
Наблюдаем образование белого осадка гидроксида алюминия.
В данном случае, щелочь присутствует в избытке, поэтому А1(ОН)3 в начале не образуется, идет образование алюмината натрия
В обоих случаях наблюдаем растворение осадка гидроксида алюминия;
Гидроксид алюминия растворяется, как в кислотах, так и в щелочах, поэтому он амфотерен
А1С13 + 3NaOH(недостаток) = 3NaCl + Al(OH)3↓
Al 3+ + 3Сl- + 3Na + + 3ОН - = А1(ОН)3↓ + 3Na + + 3Сl -
А1 3+ + 3ОН - = Al(OH)3↓
А1С13 + 4NaOH(избыток) = NaA1О2 + 3NaCl + 2Н2О
А1 3+ + 3Сl - + 4Na + + 40Н - = Na + +А1О2 - + 3Na + + 3Сl - + 2Н 2 О
А1(ОН)3 +3Н + +3Сl - = А1 3+ +3Сl - + 3Н2О
2. Для доказательства качественного состава СаС12 проведем реакции, характерные для катиона кальция и хлорид-аниона.
Для этого раствор СаС12 разольем на 2 пробирки.
В одну из них добавим раствор карбоната натрия,
В другую пробирку прильем раствор нитрата серебра
Наблюдаем выделение белого
осадка карбоната кальция СаСО3
Наблюдаем выделение белого творожистого осадка.
2Na + + СО3 2- + Са 2+ + 2Сl - = СаСО3↓ + Na + + 2Сl -
Са 2+ + 2Сl - + 2Ag + + 2NО3 - = Ca 2+ + 2NО3 - + 2AgCl↓
3. Необходимо осуществить следующие превращения:Fe → FeCI2 → FeCl3
В пробирку с железными опилками добавим раствор соляной кислоты.
Качественная реакция на ион железа (II):
Качественные реакции на ион железа (III):
а) Прильем к пробирке раствор желтой кровяной соли:
Наблюдаем растворение железа и выделение газообразного водорода
Наблюдаем, образование темно-синего осадка, следовательно, ионы Fe 2+ получены.
Наблюдаем, образование темно-синего осадка берлинской лазури, значит, в растворе присутствуют ионы железа (III).
Fe 0 + 2Н + С1 = Fe 2+ Cl2 + Н2 0 ↑
Fe 0 - 2е = Fe 2+ 2 1 восстановитель
2Н + +2е = Н2 0 2 1 окислитель
красная кровяная соль
3К + +[Fe(CN)6] 3- +Fe 2+ +2Сl - =KFe [Fe(CN)6]↓+2K + + 3Сl -
желтая кровяная соль берлинская лазурь
4К + + Fe 3+ +3Сl - +[Fe(CN)6] 4- =KFe [Fe(CN)6]↓+3K + + 3Сl -
Необходимо получить FeSO4 тремя различными способами:
В пробирку с железными опилками прильем разбавленный раствор серной кислоты.
В пробирку с раствором медного купороса добавим железо.
Наблюдаем растворение железа и выделение водорода
В результате реакции образуется сульфат железа.
Наблюдаем, изменение окраски раствора, из голубого раствор становится светло-зеленым, который быстро желтеет и мутнеет. В результате реакции выделяется красная медь.
Cu 2+ SO4 + Fe° = Fe +2 SO4 + Cu 0 ↓
Голубой светло-зеленый красный
Fe° -2е= Fe 2+ восстановитель
4. Для получения FeSО4 осуществим следующие превращения: FeCl2→ Fe(OH)2 → FeSО4
К раствору хлорида железа прильем раствор щелочи:
К полученному, в предыдущем опыте осадку Fe(OH)2 добавим раствор серной кислоты
В результате реакции образуется осадок гидроксида железа (II) белого цвета.
Fe 2+ + 2Сl - + 2Na + + 2ОH - = 2Na + + 2Сl - + Fe(OH)2↓
5. Для доказательства качественного состава FeSО4 разольем раствор сульфата железа в 2 пробирки.
В одну из них добавим раствор красной кровяной соли:
В другую пробирку, добавим раствор хлорида бария:
Наблюдаем, образование темно-синего осадка, значит, в растворе присутствуют ионы железа — Fe2+.
Наблюдаем, выделение белого осадка сульфата бария BaSО4, значит, в растворе присутствуют сульфат-ионы SО4 2- .
Практическая работа № 2. Получение и свойства соединений металлов
В пробирку с железными опилками добавляется раствор соляной кислоты.
Уравнения реакций. Вывод.
Добавим к полученному хлориду железа (II) щелочи.
Оставим осадок на несколько минут.
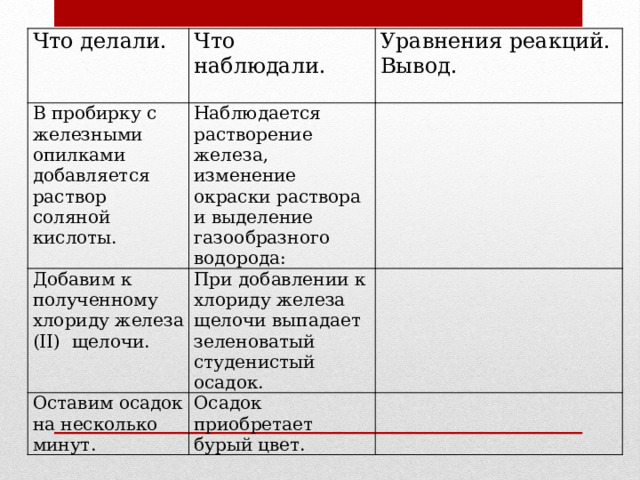
Наблюдается растворение железа, изменение окраски раствора и выделение газообразного водорода:
При добавлении к хлориду железа щелочи выпадает зеленоватый студенистый осадок.
Осадок приобретает бурый цвет.
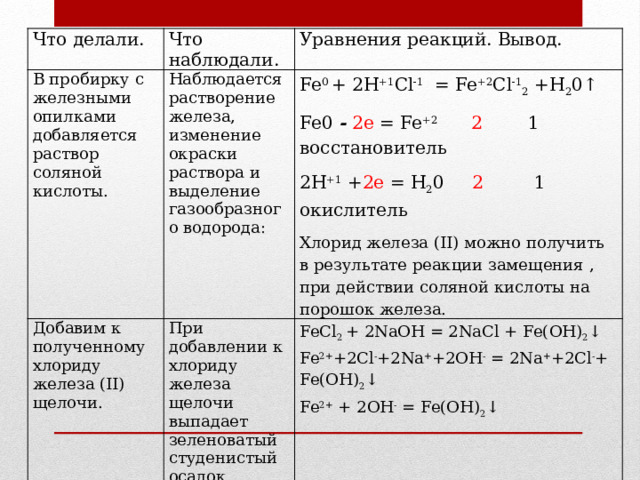
Fe 0 + 2Н +1 Сl -1 = Fe +2 Cl -1 2 +Н 2 0↑
Fe0 - 2е = Fe +2 2 1 восстановитель
FeCl 2 + 2NaOH = 2NaCl + Fe(OH) 2 ↓
2Н +1 + 2е = Н 2 0 2 1 окислитель
Fe 2+ +2Сl - +2Na + +2ОH - = 2Na + +2Сl - + Fe(OH) 2 ↓
На воздухе гидроксид железа (II) превращается в гидроксид железа(III).
Хлорид железа (II) можно получить в результате реакции замещения , при действии соляной кислоты на порошок железа.
Fe 2+ + 2ОH - = Fe(ОH) 2 ↓
4Fe(OH) 2 + 2Н 2 О + О 2 = 4Fe(OH) 3
СаСI 2
Задание 2 ( 8 минут) Проведите реакции, подтверждающие качественный состав хлорида кальция. Запишите уравнения реакций в молекулярной и ионной формах.


Определение ионов кальция

Качественная реакция на хлорид - ионы
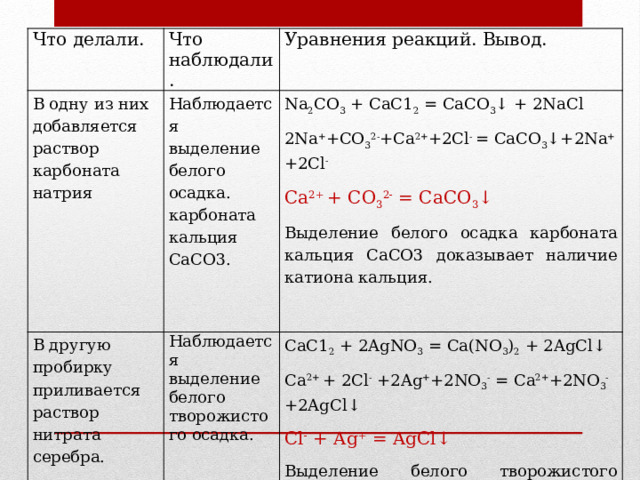
В одну из них добавляется раствор карбоната натрия
Наблюдается выделение белого осадка. карбоната кальция СаСО3.
В другую пробирку приливается раствор нитрата серебра.
Na 2 CО 3 + СаС1 2 = CaCО 3 ↓ + 2NaCl
Наблюдается выделение белого творожистого осадка.
2Na + +СО 3 2- +Са 2+ +2Сl - = СаСО 3 ↓+2Na + +2Сl -
СаС1 2 + 2AgNО 3 = Ca(NО 3 ) 2 + 2AgCl↓
Са 2+ + СО 3 2- = CaCО 3 ↓
Са 2+ + 2Сl - +2Ag + +2NО 3 - = Ca 2+ +2NО 3 - +2AgCl↓
Выделение белого осадка карбоната кальция СаСО3 доказывает наличие катиона кальция.
Выделение белого творожистого осадка – это качественная реакция на хлорид-анион .

Задание 3 (8 минут) Получите сульфат железа (II) не менее чем тремя способами. Уравнения реакций ионного обмена запишите в молекулярной и ионной формах, а реакции замещения рассмотрите с точки зрения окисления-восстановления.
Чтобы осуществить эти превращения надо знать химические свойства веществ.
Что соли получаются соли:
- при взаимодействии металла с неметаллом;
- оксида металла с кислотой,;
- основания с кислотой;
- соли с кислотой;
- основания с солью ;
- соли с металлом).
Проделайте соответствующие заданию реакции. Каждый способ получения должен проходить в одну стадию. При необходимости воспользуйтесь нагреванием. Твердые вещества берите в небольших количествах.

Взаимодействие серной кислоты с железом

Взаимодействие сульфата меди с железом

Получение гидроксида железа II и изучение его свойств

1 . В пробирку с железными опилками приливается разбавленный раствор H 2 SО 4
Наблюдается растворение железа, окрашивание раствора и выделение водорода.
2 . В пробирку с раствором медного купороса добавляется железо.
Fe° + H 2 +1 S0 4 =Fe +2 S0 4 + H 2 °↑
3 . В пробирку с гидроксидом железа добавляется H 2 SО 4 .
Наблюдается изменение окраски, из голубого раствор становится светло-зеленым. Порошок становится красным.
Fe 0 - 2е = Fe +2 2 1 восстановитель
Происходит изменение окраски раствора – становится слегка зеленоватым.
- Cu +2 SO 4 + Fe 0 = Fe +2 SO 4 + Cu 0
- Fe 0 - 2е = Fe +2 восстановитель
- Cu +2 +2е = Cu 0 окислитель
- В результате реакции образуется сульфат железа и медь.
2Н +1 +2е = Н 2 0 2 1 окислитель
- Fe(ОН) 2 + H 2 SО 4 = FeSО 4 + H 2 О
- В результате реакции образуется сульфат железа.
- Возможен вариант получения сульфата железа(II) действием на карбонат железа(II) серной кислоты.
Описание опыта:

Учебник химии Габиелян О.С. 9 класс.Просвещение Дрофа.
Литература и интернет ресурсы:

-82%
Читайте также:
