Как устроена кристаллическая решетка металлов
Обновлено: 21.09.2024

У каждого вещества есть набор физических свойств. Например, соли легко растворяются в воде и проводят электрический ток, а металлы имеют характерный блеск и ковкость. Такие характеристики зависят от строения вещества — от его кристаллической решетки. В этом материале мы расскажем о видах кристаллических решеток и о том, какие свойства придает веществу каждая из них.
· Обновлено 3 июня 2022
Ждём вас 8 октября в 13:00. Вместе с педагогами, психологами и другими экспертами в образовании и воспитании ответим на главные вопросы мам и пап.
Что такое кристаллическая решетка
Как известно, все вещества состоят из частиц — атомов, которые могут располагаться хаотично или в определенном порядке. У аморфных веществ частицы расположены беспорядочно, а у кристаллических они образуют определенную структуру. Эта структура называется кристаллической решеткой. Она определяет такие характеристики вещества, как твердость, хрупкость, температура кипения и/или плавления, пластичность, растворимость, электропроводность и т. д.
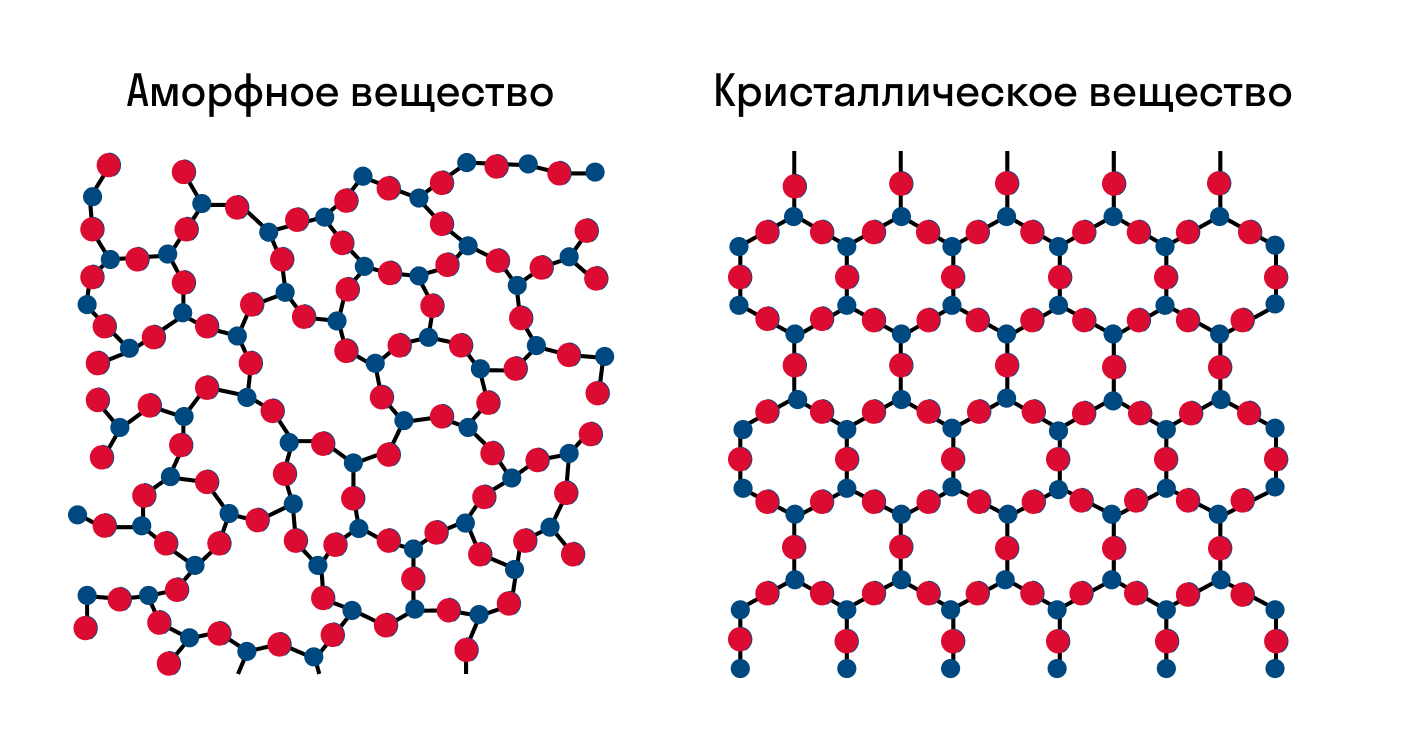
Кристаллическая решетка — это внутренняя структура кристалла, порядок взаимного расположения атомов, ионов или молекул. Точки, в которых находятся эти частицы, называются узлами решетки.
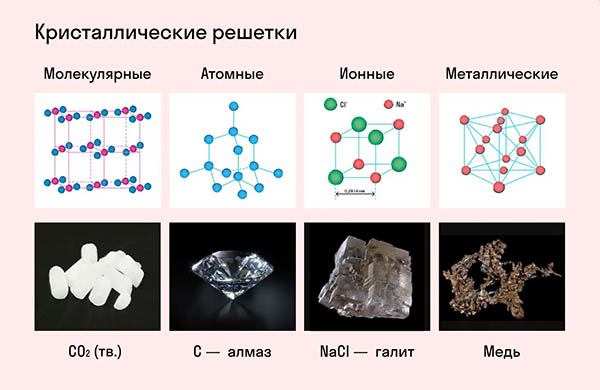
Частицы удерживаются на своих местах благодаря химическим связям между ними. В зависимости от того, какой вид связи удерживает атомы или ионы данного вещества, в химии выделяют основные типы кристаллических решеток:
атомная (ковалентные связи),
молекулярная (ковалентные связи и притяжение между молекулами),
металлическая (металлические связи),
ионная (ионные связи).
Не путайте эти два понятия — кристаллическая решетка и химическая связь. Тип решетки говорит о том, как расположены атомы/ионы в молекуле вещества, а тип связи — по какому принципу они между собой взаимодействуют.
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков

Атомная кристаллическая решетка
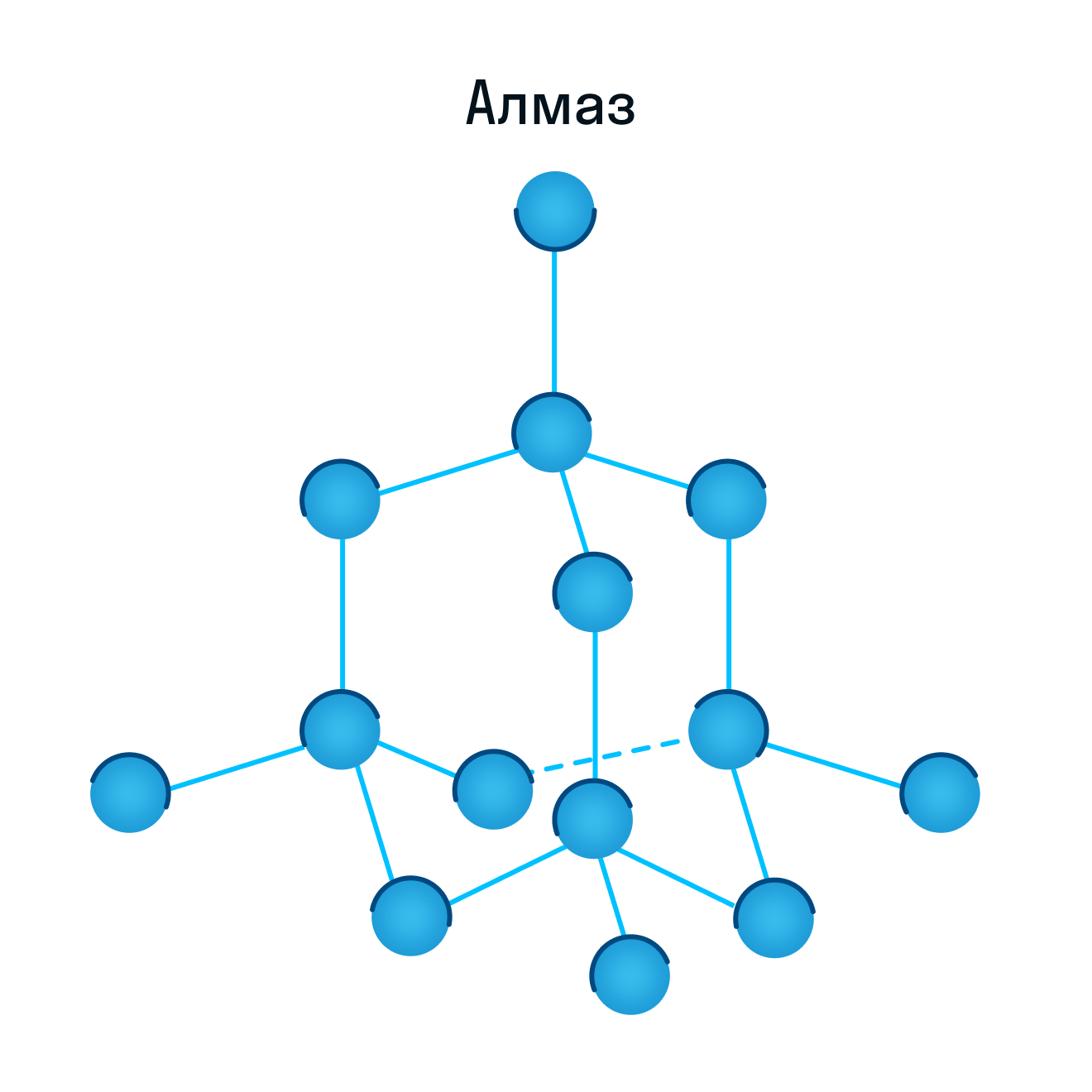
Согласно своему названию, атомная кристаллическая решетка — это структура, в узлах которой расположены атомы. Они взаимодействуют с помощью ковалентных связей, то есть один атом отдает другому свободный электрон или же электроны из разных атомов образуют общую пару. В кристаллах с атомной решеткой частицы прочно связаны, что обуславливает ряд физических характеристик.
Свойства веществ с атомной решеткой:
неспособность к растворению в воде,
высокая температура кипения и плавления.
К примеру, атомную кристаллическую решетку имеет алмаз — самый твердый минерал в мире.
Другие примеры: германий Ge, кремний Si, нитрид бора BN, карборунд SiC.
Если нужно рассказать о свойствах веществ с атомной кристаллической решеткой, достаточно вспомнить песок и перечислить его характеристики.
Молекулярная кристаллическая решетка
Как и в предыдущей группе, в этой находятся вещества с ковалентными связями между атомами. Но физические характеристики этих веществ совершенно иные — они легко плавятся, превращаются в жидкость, растворяются в воде. Почему так происходит? Все дело в том, что здесь кристаллы строятся не из атомов, а из молекул.
Молекулярная кристаллическая решетка — это структура, в узлах которой находятся не атомы, а молекулы.
Внутри молекул атомы имеют прочные ковалентные связи, но сами молекулы связаны между собой слабо. Поэтому кристаллы таких веществ непрочные и легко распадаются.
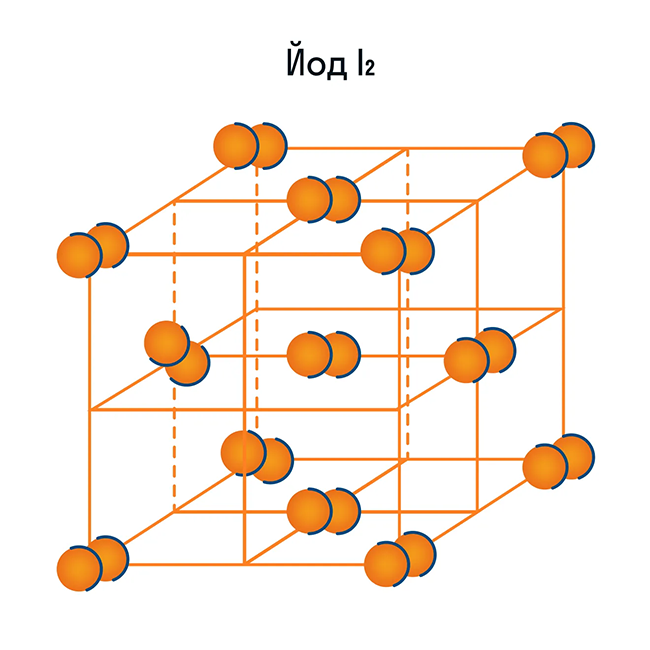
Молекулярная кристаллическая решетка характерна для воды. При комнатной температуре это жидкость, но стоит нагреть ее до температуры кипения (которая сравнительно низка), как она тут же начинает превращаться в пар, т. е. переходит в газообразное состояние.
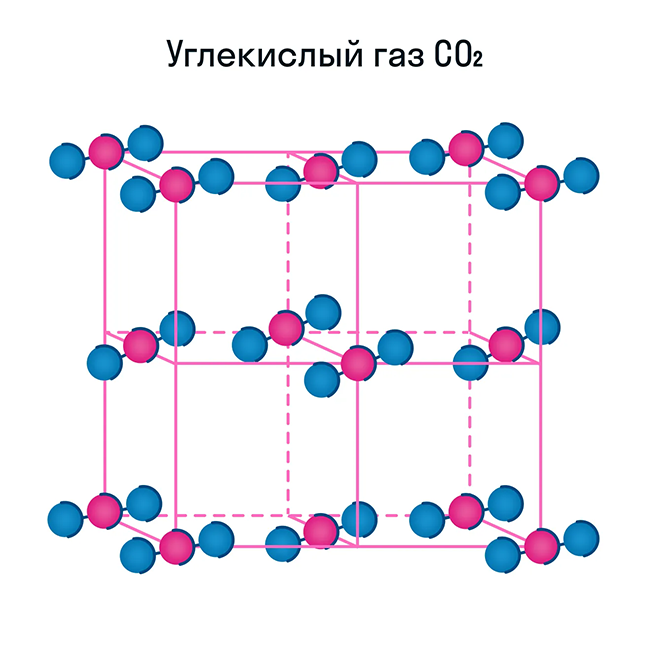
Некоторые молекулярные вещества — например, сухой лед CO2, способны преобразоваться в газ сразу из твердого состояния, минуя жидкое (данный процесс называется возгонкой).
Свойства молекулярных веществ:
у некоторых — наличие запаха.
Помимо воды к веществам с молекулярной кристаллической решеткой относятся аммиак NH3, гелий He, радон Rn, йод I, азот N2 и другие. Все благородные газы — молекулярные вещества. Также к этой группе принадлежит и большинство органических соединений (например, сахар).
Пошаговый гайд от Екатерины Мурашовой о том, как перестать делать уроки за ребёнка и выстроить здоровые отношения с учёбой.

Ионная кристаллическая решетка
Как известно, при ионной химической связи один атом отдает другому ионы и приобретает положительный заряд, в то время как принимающий атом заряжается отрицательно. В итоге появляются разноименно заряженные ионы, из которых и состоит структура кристалла.
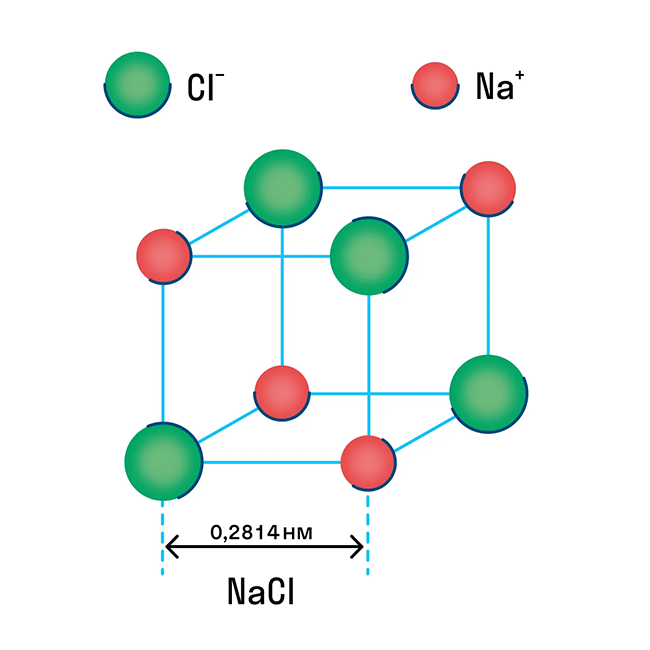
Ионная решетка — это кристаллическая структура, в узловых точках которой находятся ионы, связанные взаимным притяжением.
Ионную кристаллическую решетку имеют практически все соли, типичным представителем можно считать поваренную соль NaCl. О ней стоит вспомнить, если нужно перечислить физические характеристики этой группы. Также ионную решетку имеют щелочи и оксиды активных металлов.
Свойства веществ с ионной структурой:
способность растворяться в воде.
Примеры веществ с ионной кристаллической решеткой: оксид кальция CaO, оксид магния MgO, хлорид аммония NH4Cl, хлорид магния MgCl2, оксид лития Li2O и другие.
Металлическая кристаллическая решетка
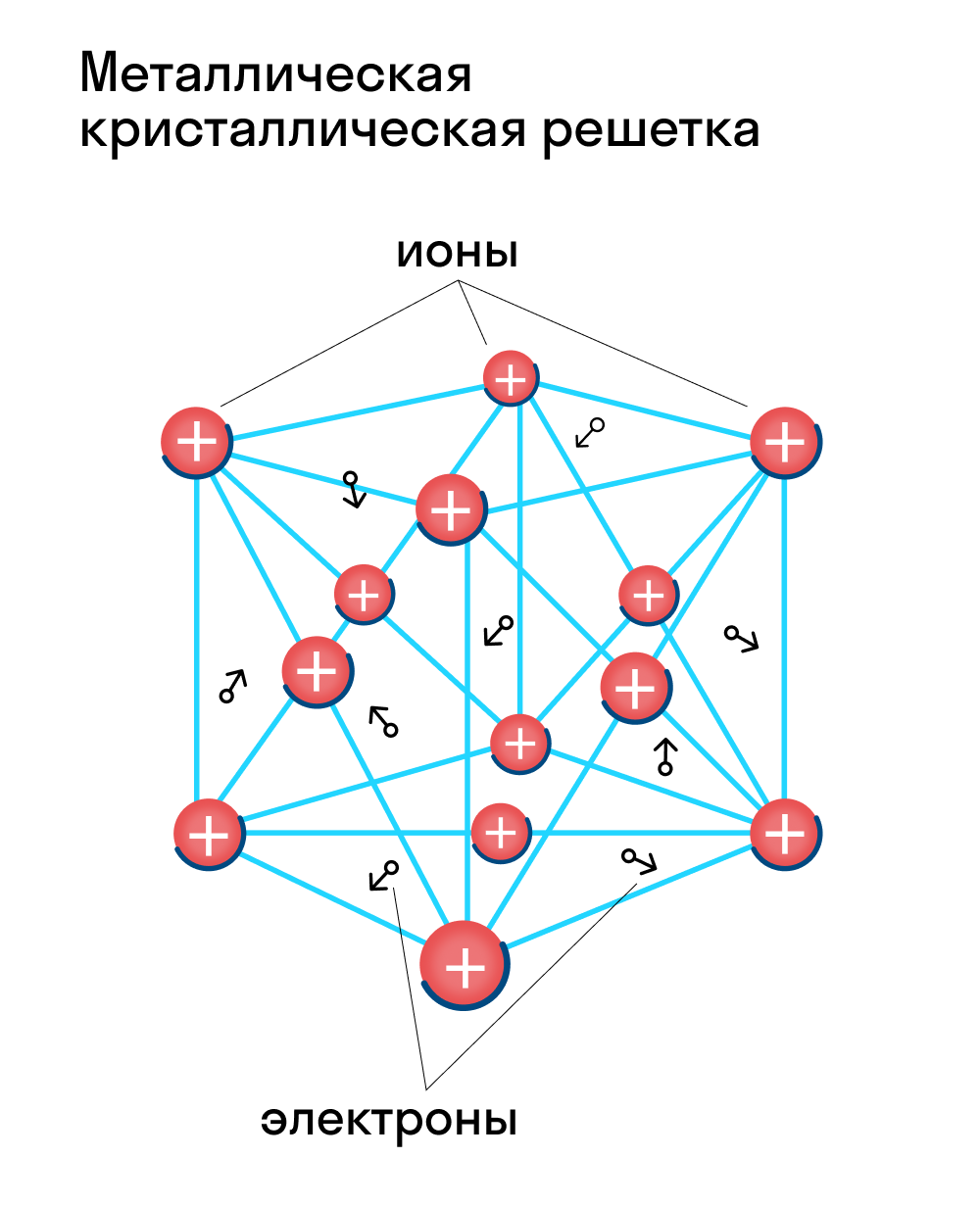
Для начала вспомним, как проходит металлическая химическая связь. В молекуле металла свободные отрицательно заряженные электроны перемещаются от одного иона к другому и соединяются с некоторыми из них, а после отрываются и мигрируют дальше. В результате получается кристалл, в котором ионы превращаются в атомы и наоборот.
Металлическая кристаллическая решетка — это структура, которая состоит из ионов и атомов металла, а между ними свободно передвигаются электроны. Как несложно догадаться, она характерна лишь для металлов и сплавов.
Свободные электроны, мигрирующие между узлами решетки, образуют электронное облако, которое под воздействием электротока приходит в направленное движение. Это объясняет такое свойство металлов, как электрическая проводимость.
В химии типичным примером вещества, которое имеет металлическую кристаллическую решетку, считается медь. Она очень ковкая, пластичная, имеет высокую тепло- и электропроводность. Впрочем, все металлы ярко демонстрируют эти характеристики, поэтому назвать физические свойства данной группы несложно.
Свойства веществ с металлической кристаллической решеткой:
При этом температура плавления веществ может существенно различаться. Например, у ртути это −38,9°С, а у бериллия целых +1287°С.
Подведем итог: о характеристиках разных типов кристаллических решеток расскажет таблица.
Кристаллическое строение металлов

Металлы – особая группа элементов в периодической таблице Менделеева. В отличие от неметаллов элементы этой группы являются исключительно восстановителями с положительной степенью окисления, а также обладают пластичностью, твёрдостью, упругостью, что обусловлено кристаллическим строением металлов.
Общее строение
Металлы – твёрдые вещества, имеющие кристаллическое строение. Исключение составляет ртуть – жидкий металл. Кристаллические решётки представляют собой упорядоченные определённым образом атомы металла. Каждый атом состоит из положительно заряженного ядра и нескольких отрицательно заряженных электронов. В атомах металлов недостаточно электронов, поэтому они являются ионами.
Единица кристаллической решётки – элементарная кристаллическая ячейка, в условных узлах и на гранях которой находятся положительно заряженные ионы. Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Отрицательно заряженные электроны держат на равном расстоянии положительно заряженные электроны, предавая кристаллической решётке правильную геометрическую форму.
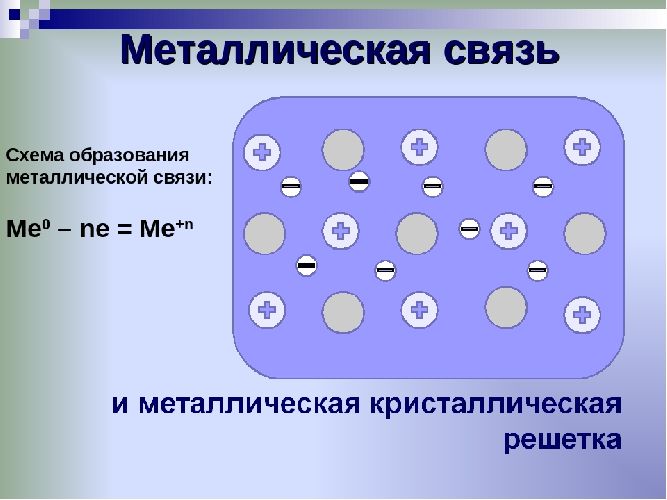
Рис. 1. Схема металлической связи.
Свободное движение электронов обусловливает электро- и теплопроводность металлов.
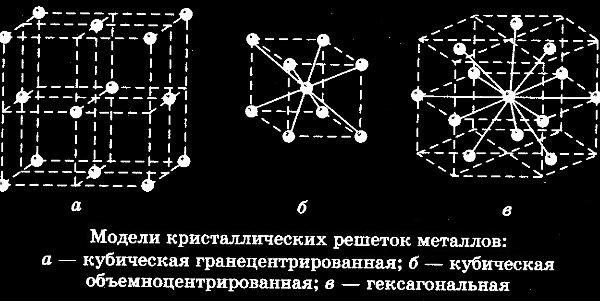
Виды решёток
Элементарные кристаллические ячейки могут иметь различную конфигурацию. В связи с этим выделяют три типа кристаллических решёток:
- объемно-центрированная (ОЦК) кубическая – состоит из 9 ионов;
- гранецентрированная (ГЦК) кубическая – включает 14 ионов;
- гексагональная плотноупакованная (ГПУ) – состоит из 17 ионов.
ОЦК представляет собой куб, в узлах которого находится по атому. В центре куба, на пересечении диагоналей располагается девятый ион. Этот тип характерен для железа, молибдена, хрома, вольфрама, ванадия.
Элементарной кристаллической ячейкой типа ГЦК является куб с ионами в узлах и в середине каждой грани – на пересечении диагоналей. Такое строение имеют медь, серебро, алюминий, свинец, никель.
Третий тип имеет вид гексагональной призмы, в узлах которой находится по шесть ионов с каждой стороны. Посередине между шестью узлами располагается по одному иону. В середине призмы между шестиугольными гранями находится равносторонний треугольник, который составляют три иона.
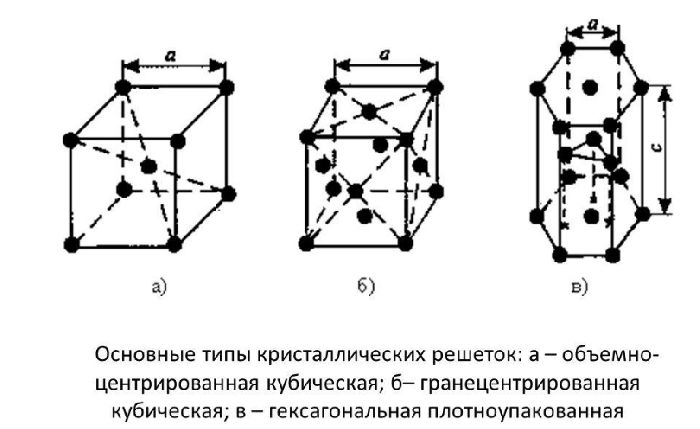
Рис. 2. Типы решёток.
Металл может содержать большое количество дефектов атомного строения. Дефекты влияют на свойства металла.
Характеристика решётки
Кристаллические решётки характеризуются компактностью или степенью наполненности. Компактность определяют показатели:
- параметр решётки – расстояние между атомами;
- число атомов;
- координационное число – количество соседних ячеек;
- плотность упаковки – отношение объёма, занимаемого атомами, к полному объёму решётки.
При подсчёте количества атомов следует помнить, что атомы в узлах и на гранях входят в состав соседних ячеек.
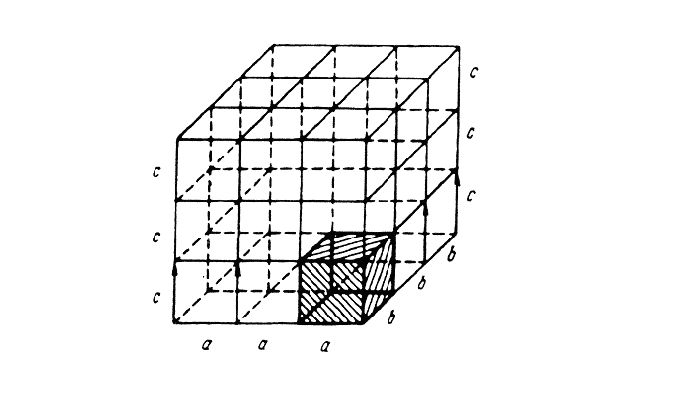
Рис. 3. Кристаллические ячейки составляют решётку.
Что мы узнали?
Узнали кратко об атомно-кристаллическом строении металлов. Металлы – твёрдые кристаллические вещества. Единицей решётки является элементарная кристаллическая ячейка. Благодаря металлическим связям ионы в узлах ячеек удерживаются на одинаковом расстоянии. Различают три типа кристаллических решёток – ОЦК, ГЦК и ГПУ, отличающихся количеством атомов и геометрической формой.
Как устроена кристаллическая решетка металлов
Твердое, жидкое, газообразное тело: что в них общего? Конечно, частицы, из которых они состоят. Таким образом, все химические вещества образуются из мельчайших частиц, которые соединяются между собой связями: более или менее сильными, в зависимости от агрегатного состояния. Частицы образуют решетки. Кристаллическая решетка металлов — это одна из типов решеток, представленных в природе.
Состав кристаллической решетки
Итак, еще из школьного курса химии и физики нам известно, что абсолютно все вещества состоят из мелких частиц, которые связаны между собой. И вот именно от силы связей зависит то, в каком агрегатном состоянии находится тело: твердое, жидкое или газообразное. Когда частицы имеют строгую ориентацию в пространстве, то они формируют твердое тело. Все твердые тела имеют четкие контуры из-за четкой структуры их мелких частей. Что же касается мелких частиц, то, несмотря на свое строгое место в пространстве, они все равно продолжают двигаться. Скорость и амплитуда такого движения напрямую зависит от температуры: если она ниже нуля, то скорость падает и образуется твердое тело, что касается высоких температур, то в таком случае будут образовываться газообразные и жидкие тела, а частицы будут просто быстро двигаться и перемещаться.
Остановимся все же на организации твердых тел. Когда частицы (атомы, молекулы или ионы) точно определены с местом в пространстве, то таким образом обязуется кристаллическая решетка. Частицы могут располагаться как между узлами в пространстве, так и непосредственно в узлах. Молекулярная, атомная, металлическая и ионная – эти четыре типа решеток существуют в природе. Разница между решетками сводится до частиц, которые находятся в узлах и связях, протекающих между ними.
Молекулярные решетки
Молекулярная кристаллическая решетка представляет собой молекулы, которые располагаются в узлах. Связаны такие частицы довольно слабыми связями – межмолекулярными, которые еще называются Ван-дер-Ваальсовыми. Тем не менее, сами молекулы состоят из атомов. Между атомами существует связь намного прочнее и крепче, которая называется ковалентной. Такой тип кристаллической решетки имеется в хлоре, двуокиси углерода, твердом водороде и других веществах, которые являются газообразными при обычной температуре. Именно такая структура зачастую встречается в природе. При этом даже неорганические вещества могут обладать такой структурой: твердые галогеноводороды, лед, сера и некоторые другие. Из-за низкой температуры плавления тела с такой структурой строения очень быстро воспламеняются и плавятся.
Что же касается структуры, которую представляет металлическая кристаллическая решетка, то такие типы частиц свободно движутся лишь в теле кристалла, расположенном в четко определенном узле. Но все же такие частицы имеют возможность свободно передвигаться по кристаллической решетке. Благодаря тому, что частицы, из которых состоит кристаллическая решетка металлов, заряжены по-разному, то они притягиваются друг к другу и образовывают структуру металла.
Благодаря электронном газу, который состоит из свободных движущихся электронов, металл может иметь свойства высокой электро- и теплопроводности. Как только в поле решетки появляется электрическое поле, то электроны тут же направляются в сторону положительных частиц. За счет таких движений образуется ток. Такой тип решетки зачастую составляет элементарные металлы и приспособлен для соединения разных металлов.
Но несмотря на это нельзя точно утверждать, что свойства всех металлов одинаковы, они, наоборот, кардинально отличаются друг от друга. Ведь взаимодействие между электронами и ионами создают тип металла. Также кристаллическая решетка формируется за счет свободных электродов, которые летают в области решетки. За счет решетки металлы имеют высокую температуру плавления (выше, чем органические вещества).
Читайте также:
