Получение металлов на основе электролиза
Обновлено: 02.07.2024
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну .
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды .
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы . Положительно заряженный электрод ( анод ) притягивает отрицательно заряженные частицы ( анионы ). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.

Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины , или графита .
Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений :

Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал , тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H + .
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный ( до Al 3+ включительно в ряду напряжений ), то вместо металла на катоде восстанавливается (разряжается) водород , т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH — , среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH —
Например , при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al 3+ и Н + ) , то на катоде восстанавливается (разряжается) и металл , и водород , так как потенциал таких металлов сравним с потенциалом водорода:
Me n+ + nē → Me 0
2 H + 2O +2ē → H2 0 + 2OH —
Например , при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Fe 2+ + 2ē → Fe 0
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов) , то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu 2+ + 2ē → Cu 0
4. Если на катод попадают катионы водорода H + , то они и восстанавливаются до молекулярного водорода:
2H + + 2ē → H2 0
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H 2 O -2 ).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток , то он окисляется до свободного состояния (до степени окисления 0):
неМе n- – nē = неМе 0
Например : при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl — – 2ē = Cl2 0
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение . Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы :
2H2 O -2 – 4ē → O2 0 + 4H +
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион , то окислению подвергается вода с выделением молекулярно-го кислорода:
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4 O -2 H – – 4ē → O2 0 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например , при электролизе растворов ацетатов выделяется углекислый газ и этан:
2 CH3 C +3 OO – –2ē → 2 C +4 O2+ CH3-CH3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например , электролиз раствора сульфата меди. На катоде восстанавливаются ионы меди:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются молекулы воды:
Анод (+): 2H2 O -2 – 4ē → O2 + 4H +
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
2 Cu 2+ SO4 + 2H2 O -2 → 2 Cu 0 + 2H2SO4 + O2 0
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются хлорид-ионы:
Анод (+): 2 Cl – – 2ē → Cl2 0
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия :
2 H + 2O +2Na Cl – → H2 0 + 2NaOH + Cl2 0
Следующий пример : электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
На аноде окисляются молекулы воды до молекулярного кислорода:
Анод (+): 2H2 O -2 – 4ē → O2 0 + 4H +
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2 H2 + O -2 → 2 H2 0 + O2 0
Еще один пример : электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
На аноде окисляются хлорид-ионы до молекулярного хлора:
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu 2+ Cl2 – → Cu 0 + Cl2 0
Еще несколько примеров: электролиз раствора гидроксида натрия.
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Анод (+): 4 O -2 H – – 4ē → O2 0 + 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются анионы хлора:
Суммарное уравнение электролиза расплава хлорида натрия:
2 Na + Cl – → 2 Na 0 + Cl2 0

Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
На аноде окисляются гидроксид-ионы:
Анод (+): 4 OH – – 4ē → O2 0 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4 Na + OH – → 4 Na 0 + O2 0 + 2H2O
Многие металлы получают в промышленности электролизом расплавов.
Например , алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100 о С), чем оксид алюминия (2050 о С). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
На катоде восстанавливаются катионы алюминия:
Катод (–): Al 3+ + 3ē → Al 0
На аноде окисляются алюминат-ионы:
Анод (+): 4Al O 3 3 – – 12ē → 2Al2O3 + 3 O2 0
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2 Al 2 О 3 = 4 Al 0 + 3 О 2 0

В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C 0 + О2 0 = C +4 O2 -2
Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присутствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например , рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
На аноде окисляются частицы меди из электрода :
Анод (+): Cu 0 – 2ē → Cu 2+
Электролиз
Понятие о металлургии: общие способы получения металлов
Металлургия — это наука о промышленных способах получения металлов. Различают черную и цветную металлургию.
Черная металлургия — это производство железа и его сплавов (сталь, чугун и др.).
Цветная металлургия — производство остальных металлов и их сплавов.
Широкое применение находят сплавы металлов. Наиболее распространенные сплавы железа — чугун и сталь.
Чугун — это сплав железа, в котором содержится 2-4 масс. % углерода, а также кремний, марганец и небольшие количества серы и фосфора.
Сталь — это сплав железа, в котором содержится 0,3-2 масс. % углерода и небольшие примеси других элементов.
Легированные стали — это сплавы железа с хромом, никелем, марганцем, кобальтом, ванадием, титаном и другими металлами. Добавление металлов придает стали дополнительные свойства. Так, добавление хрома придает сплаву прочность, а добавление никеля придает стали пластичность.
Основные стадии металлургических процессов:
- Обогащение природной руды (очистка, удаление примесей)
- Получение металла или его сплава.
- Механическая обработка металла
1. Нахождение металлов в природе
Большинство металлов встречаются в природе в виде соединений. Наиболее распространенный металл в земной коре — алюминий. Затем железо, кальций, натрий и другие металлы.
2. Получение активных металлов
Активные металлы (щелочные и щелочноземельные) классическими «химическими» методами получить из соединений нельзя. Такие металлы в виде ионов — очень слабые окислители, а в простом виде — очень сильные восстановители, поэтому их очень сложно восстановить из катионов в простые вещества. Чем активнее металл, тем сложнее его получить в чистом виде — ведь он стремится прореагировать с другими веществами.
Получить такие металлы можно, как правило, электролизом расплавов солей, либо вытеснением из солей другими металлами в жестких условиях.
Натрий в промышленности получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl = 2Na + Cl2
Калий получают пропусканием паров натрия через расплав хлорида калия при 800°С:
KCl + Na = K↑ + NaCl
Литий можно получить электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl = 2Cs + CaCl2
Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:
Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
Барий получают из оксида восстановлением алюминием в вакууме при 1200 °C:
4BaO+ 2Al = 3Ba + Ba(AlO2)2
Алюминий получают электролизом раствора оксида алюминия Al2O3 в криолите Na3AlF6:
3. Получение малоактивных и неактивных металлов
Металлы малоактивные и неактивные восстанавливают из оксидов углем, оксидом углерода (II) СО или более активным металлом. Сульфиды металлов сначала обжигают.
3.1. Обжиг сульфидов
При обжиге сульфидов металлов образуются оксиды:
2ZnS + 3O2 → 2ZnO + 2SO2
Металлы получают дальнейшим восстановлением оксидов.
3.2. Восстановление металлов углем
Чистые металлы можно получить восстановлением из оксидов углем. При этом до металлов восстанавливаются только оксиды металлов, расположенных в ряду электрохимической активности после алюминия.
Например , железо получают восстановлением из оксида углем:
2Fe2O3 + 6C → 2Fe + 6CO
ZnO + C → Zn + CO
Оксиды металлов, расположенных в ряду электрохимической активности до алюминия, реагируют с углем с образованием карбидов металлов:
CaO + 3C → CaC2 + CO
3.3. Восстановление металлов угарным газом
Оксид углерода (II) реагирует с оксидами металлов, расположенных в ряду электрохимической активности после алюминия.
Например , железо можно получить восстановлением из оксида с помощью угарного газа:
3.4. Восстановление металлов более активными металлами
Более активные металлы вытесняют из оксидов менее активные. Активность металлов можно примерно оценить по электрохимическому ряду металлов:
Восстановление металлов из оксидов другими металлами — распространенный способ получения металлов. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Алюмотермия – это восстановление металлов из оксидов алюминием.
Например : алюминий восстанавливает оксид меди (II) из оксида:
3CuO + 2Al = Al2O3 + 3Cu
Магниетермия – это восстановление металлов из оксидов магнием.
CuO + Mg = Cu + MgO
Железо можно вытеснить из оксида с помощью алюминия:
При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
Активные металлы вытесняют менее активные из растворов их солей.
Например , при добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
Медь покроется белыми кристаллами серебра.
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
3.5. Восстановление металлов из оксидов водородом
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Как правило, взаимодействие оксидов металлов с водородом протекает в жестких условиях – под давлением или при нагревании.
CuO + H2 = Cu + H2O
4. Производство чугуна
Чугун получают из железной руды в доменных печах.
Печь последовательно загружают сверху шихтой, флюсами, коксом, затем снова рудой, коксом и т.д.

1- загрузочное устройство, 2 — колошник, 3 — шахта, 4 — распар, 5 — горн, 6 — регенератор
Доменная печь имеет форму двух усеченных конусов, соединенных основаниями. Верхняя часть доменной печи — колошник, средняя — шахта, а нижняя часть — распар.
В нижней части печи находится горн. Внизу горна скапливается чугун и шлак и отверстия, через которые чугун и шлак покидают горн: чугун через нижнее, а шлак через верхнее.
Наверху печи расположено автоматическое загрузочное устройство. Оно состоит из двух воронок, соединенных друг с другом. Руда и кокс сначала поступают в верхнюю воронку, а затем в нижнюю.
Из нижней воронки руда и кокс поступают в печь. во время загрузки руды и кокса печь остается закрытой, поэтому газы не попадают в атмосферу, а попадают в регенераторы. В регенераторах печной газ сгорает.
Шихта — это железная руда, смешанная с флюсами.
Снизу в печь вдувают нагретый воздух, обогащенный кислородом, кокс сгорает:
Образующийся углекислый газ поднимается вверх и окисляет кокс до оксида углерода (II):
CO2 + С = 2CO
Оксид углерода (II) (угарный газ) — это основной восстановитель железа из оксидов в данных процессах. Последовательность восстановления железа из оксида железа (III):
Последовательность восстановления оксида железа (III):
FeO + CO → Fe + CO2
Суммарное уравнение протекающих процессов:
При этом протекает также частичное восстановление примесей оксидов других элементов (кремния, марганца и др.). Эти вещества растворяются в жидком железе.
Чтобы удалить из железной руды тугоплавкие примеси (оксид кремния (IV) и др.). Для их удаления используют флюсы и плавни (как правило, известняк CaCO3 или доломит CaCO3·MgCO3). Флюсы разлагаются при нагревании:
и образуют с тугоплавкими примесями легкоплавкие вещества (шлаки), которые легко можно удалить из реакционной смеси:
§ 45.1. Получение металлов электролизом водных растворов солей
В § 45 вы познакомились с электрохимическим методом промышленного получения металлов, который основан на электролизе, — электрометаллургией.
У этого метода есть две разновидности. Первая — это проведение электролиза расплава соединений металлов. Особенности этого способа вы рассмотрели на примере электролиза расплава хлорида магния.
Вторая разновидность электрохимического метода, называемая гидроэлектрометаллургией, основана на электролизе водных растворов солей металлов. Преимущество этого метода, по сравнению с электролизом расплавов, заключается в том, что он не требует энергетических затрат на расплавление вещества. Ограничение электролитического метода извлечения металлов из водных растворов состоит в том, что он пригоден лишь для металлов, стоящих в ряду активности металлов правее алюминия.
Особенность проведения электролиза водных растворов солей заключается в том, что наряду с процессами восстановления ионов металла на катоде и окисления анионов соли на аноде протекает конкурирующий процесс электролиза молекул воды. В результате на катоде может выделяться водород, а на аноде — кислород.
Процессы на катоде:
2Н + + 2е – = Н2↑ при рН < 7;
Процессы на аноде:
2Н2О – 4е – = О2↑ + 4Н + при рН ≤ 7;
4ОН – – 4е – = О2↑ + 2Н2О при рН > 7.
Процессы на катоде
Способность металлов восстанавливаться на катоде при электролизе водного раствора солей определяется положением металла в ряду активности.
Катионы металлов в левой части ряда активности, заканчивая алюминием (Li + , Na + , K + , . Аl 3+ ), при электролизе не восстанавливаются. Вместо них восстанавливается водород из молекул воды:
Катионы металлов, расположенных в ряду активности правее водорода (Cu 2+ , Ag + , Hg 2+ , Pt 2+ , Au 3+ ), при электролизе восстанавливаются на катоде до металла:
Cu 2+ + 2е – = Cu 0 ;
Au 3+ + 3е – = Au 0 .
Этот процесс доминирует, но если электролит имеет сильно кислую среду, то одновременно с ионами металла могут восстанавливаться ионы водорода:
Катионы металлов, расположенных в ряду активности между алюминием и водородом (Mn 2+ , Zn 2+ , Сr 3+ , Fe 2+ , . Pb), при электролизе восстанавливаются на катоде одновременно с водородом из воды:
Ni 2+ + 2e – = Ni 0 ;
При электролизе водных растворов солей металлов следует учитывать возможность протекания процессов гидролиза, который ускоряется в результате образования гидроксид-ионов в электролите вблизи катода. В результате на поверхности катода могут образовываться нерастворимые основные соли и основания:
Электропроводность электрода уменьшается, и процесс электролиза замедляется или прекращается. Один из способов борьбы с таким явлением — подкисление электролитов.
Процессы на аноде
На аноде протекают процессы окисления компонентов электролита. В процессе окисления может участвовать и материал самого анода. Различают процессы электролиза в растворах с активным и инертным анодами.
Инертные аноды не окисляются под действием электрического тока и не реагируют с веществами раствора. При электролизе они служат лишь передатчиками электронов. Инертными являются электроды из графита, платины, платинированного титана.
К активным относятся аноды, изготовленные из Сu, Ag, Fe, Ni, Sn, Zn. Металл активных анодов в процессе электролиза разрушается и переходит в раствор в виде ионов. Активные аноды обычно применяют в промышленности при получении покрытий путём электрохимического восстановления металлов из растворов, поскольку растворение металлического анода в процессе электролиза восполняет убыль ионов восстанавливаемого металла из электролита. При этом они обеспечивают постоянство состава раствора, скорости процесса электролиза, состава и свойств получаемых металлических покрытий.
Рассмотрим подробнее процессы, протекающие при электролизе растворов на инертных анодах. Можно выделить следующие закономерности (табл. 31.1):
• в растворах бескислородных кислот и их солей (кроме HF и фторидов) на аноде окисляются анионы, например:
• в растворах кислородсодержащих кислот и их солей в случае максимальной степени окисления атомов неметалла в анионе ( , ) окисляются атомы кислорода в молекулах воды с выделением газообразного кислорода:
• в растворах кислородсодержащих кислот и их солей, в анионах которых содержатся атомы неметалла в промежуточной степени окисления ( , ), окисляются именно эти атомы в составе анионов, например:
Таблица 31.1. Способность к окислению на аноде анионов при электролизе водных растворов солей
В водном растворе не окисляются; окислению подвергаются молекулы воды с выделением кислорода:
В водном растворе легко окисляются, например:
В специально созданных условиях в водных растворах может идти процесс окисления и кислородсодержащих анионов с максимальной степенью окисления неметалла. Например, электролизом концентрированного раствора гидросульфата калия получают сильный окислитель — пероксодисульфат калия:
Примеры использования электролиза водных растворов солей металлов в промышленности и в лаборатории
При разработке условий электролиза следует учитывать, что продукты электролиза могут вступать в химические реакции с электродами и водными растворами или между собой.
Промышленный электролиз водного раствора NaCl. Процесс используют для получения водорода, хлора и каустической соды (NaOH). При этом на катоде выделяется водород:
а в растворе накапливается каустическая сода:
Если не разделить продукты электролиза, то между образовавшимися газами произойдёт химическая реакция.
В растворе также возможно взаимодействие хлора со щёлочью:
Cl2 + 2NaOH = NaClO + NaCl + H2O.
Для того чтобы между продуктами электролиза не происходило взаимодействие, катодное и анодное пространство разделяют мембраной (рис. 108.2).
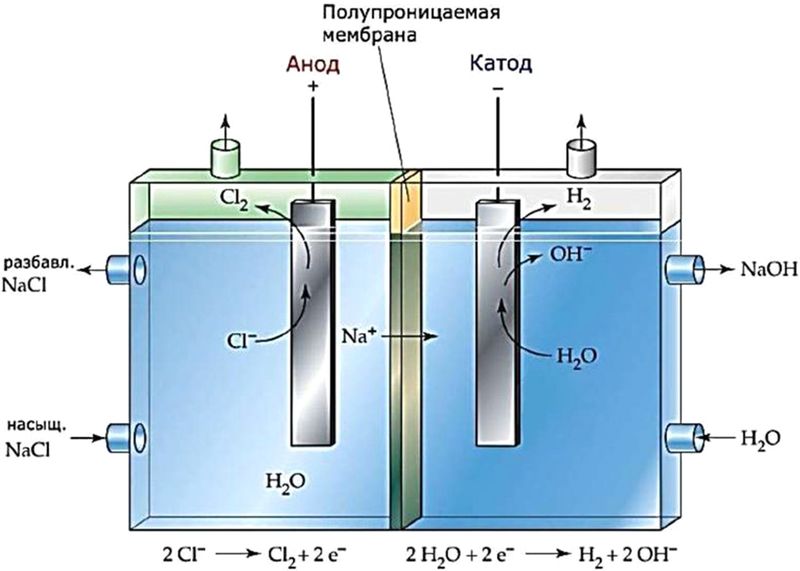
Рис. 108.2. Схема электролизёра с ионообменной мембраной для электролиза раствора хлорида натрия. Мембрана пропускает ионы Na + , но не пропускает ионы Cl – и OH –
С 2015 года в ОАО «Беларуськалий» функционирует цех мембранного электролиза. Продукцией цеха являются: водный раствор гидроксида калия (с массовой долей KOH 46−54 % ); твёрдый гидроксид калия (с массовой долей KOH 9 0−95 % ); соляная кислота (с массовой долей HCl 28−35 % ); гипохлорит натрия NaClO.
Электролиз растворов солей в лаборатории.
Для наглядности при рассмотрении особенностей электролиза водных растворов солей обратимся к химическому эксперименту.
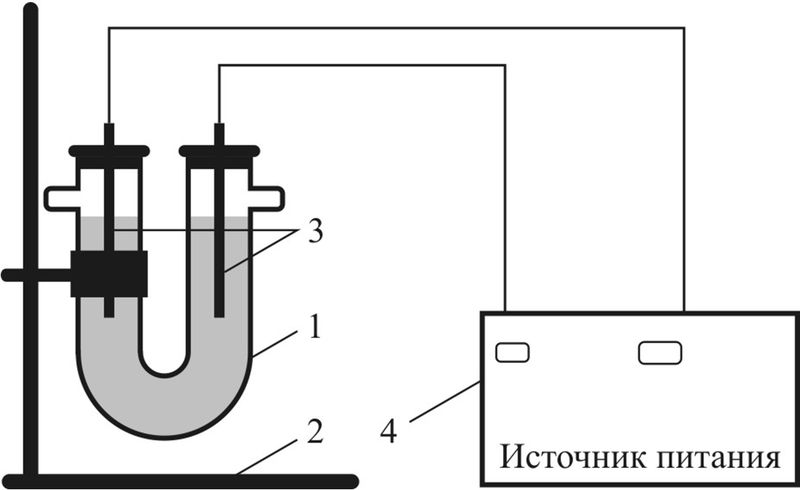
Рис. 108.3. Схема прибора для электролиза:
1 — U-образная трубка (электролизёр);
2 — штатив;
3 — электроды (графитовые стержни);
4 — источник питания постоянного тока
Опыт 1. Проведём электролиз водного раствора CuSO4. Для этого соберём прибор по схеме, представленной на рис. 108.3. В U-образную трубку нальём раствор сульфата меди(II) и опустим два графитовых стержня, закреплённых в резиновых пробках. Стержни с помощью проводов присоединим к источнику тока, на котором поддерживается напряжение постоянного тока до 12 В.
Рис. 108.4. Осаждённая медь на графитовом электроде после проведения электролиза раствора сульфата меди(II)
При пропускании электрического тока через раствор CuSO4 на стержне, присоединённом к положительному полюсу источника тока (анод), можно наблюдать выделение пузырьков газа (это кислород), а на стержне, присоединённом к отрицательному полюсу (катод), — появление красного налёта (это восстановленная медь) (рис. 108.4).
Объяснить наблюдаемое явление можно следующими процессами.
В растворе сульфата меди происходит диссоциация:
При подключении электродов к источнику тока в растворе электролита происходит направленное движение ионов к электродам, имеющим противоположные заряды.
На катоде происходит восстановление меди, которая образует красный налёт на электроде:
Сu 2+ + 2e – = Сu 0
На аноде (положительно заряженном электроде) происходит окисление молекул воды с выделением кислорода:
Суммарное уравнение процессов на электродах в молекулярной форме:
Опыт 2. Проведите электролиз водного раствора йодида калия.
Для проведения электролиза раствора KI воспользуемся установкой из примера 1 (рис. 108.3).
В U-образную трубку нальём раствор KI и пропустим через него электрический ток. Через 3–5 минут, отключив ток и достав электроды, в катодное пространство добавим 2−3 капли фенолфталеина, а в анодное пространство прильём крахмальный клейстер.

Рис. 108.5. Электролизёр после проведения электролиза раствора йодида калия и добавления раствора фенолфталеина (катодное пространство) и крахмального клейстера (анодное пространство)
Раствор в катодном пространстве окрашивается в малиновый цвет, что свидетельствует о щелочной среде. В анодном пространстве наблюдается выделение жёлто-бурого вещества, при добавлении к которому 2–3 капель крахмального клейстера происходит посинение раствора, что указывает на присутствие в растворе йода (рис. 108.5).
Таким образом, продуктами электролиза водного раствора йодида калия являются I2 и щёлочь.
Наблюдаемые явления свидетельствуют о протекании на электродах следующих реакций:
2Н2О + 2e – = Н2↑ + 2ОН – на катоде;
2I – – 2e – = I2 на аноде.
Суммарное уравнение процесса электролиза в молекулярной форме:
Электролиз с активными анодами в промышленности. Помимо электрохимического осаждения металлических покрытий и получения порошков металлов, этот метод применяют для извлечения металлов из растворов, а также для очистки (рафинирования) металлов от содержащихся в них примесей. Так получают чистое золото, медь и многие другие металлы.
Например, при очистке (рафинировании) меди исходный металл, содержащий нежелательные примеси, служит анодом. Анод погружают в раствор сульфата меди(II). При пропускании тока медь на аноде окисляется, её ионы переходят в раствор, перемещаются к катоду и на нём восстанавливаются. Примеси в этом процессе не участвуют из-за их малой концентрации, и поэтому на катоде образуется слой чистой меди.
Процессы электролиза с активными анодами используют для получения покрытий из оксидов металлов. Так, при проведении электролиза с анодом из алюминия его поверхность окисляется, покрываясь слоем оксида. Такой процесс специального наращивания оксида на поверхности металла называют электрохимическим оксидированием (или анодированием). Анодирование применяют для защиты металла от коррозии, придания его поверхности декоративного внешнего вида, повышенной твёрдости.
Методом электролиза растворов солей на поверхность различных изделий наносят покрытия из металлов и их сплавов, композитов с неметаллами, что придаёт изделиям нужные свойства (повышенная коррозионная стойкость, декоративная отделка, электропроводность и др.). К распространённым промышленным процессам относятся цинкование, никелирование, меднение, хромирование, оловянирование, золочение и серебрение.
В НИИ физико-химических проблем Белорусского государственного университета разработаны и внедрены в промышленность процессы электрохимического осаждения покрытий из сплавов металлов и композиционных покрытий металл — оксид металла, например: Ni—B , Ni—P , Ni—Sn , Au—Co , Сu—CuO—Cu2O , Ni — алмаз (алмаз в виде тонко измельчённого порошка). Такие покрытия более твёрдые, износо- и коррозионностойкие, чем покрытия из индивидуальных металлов, обладают декоративным внешним видом (рис. 108.6).
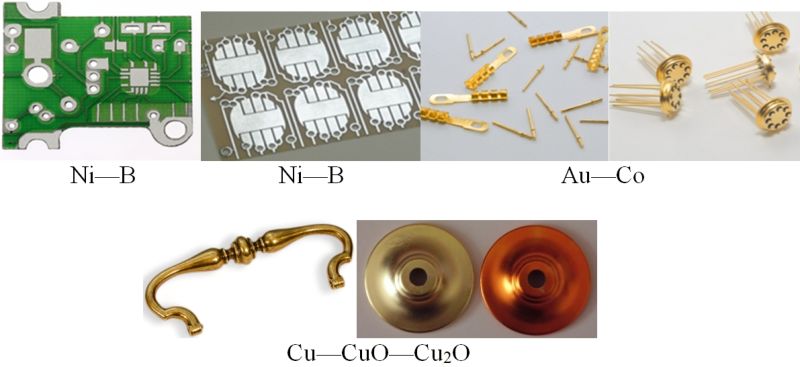
Рис. 108.6. Покрытия на часовых платах, платах кредитных карточек, корпусах транзисторов, фурнитурных изделиях
Электролиз водных растворов используется также в синтезе различных неорганических веществ, в обработке поверхностей металлов (азотирование, борирование, электрополировка, очистка), в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации). Электролизом получают кислород и водород.
При электролизе водных растворов солей на катоде восстанавливаются катионы металлов, расположенных в ряду активности после водорода.
На катоде не восстанавливаются катионы металлов IA- и IIA-групп , расположенных в начале ряда активности, а также алюминий, вместо них восстанавливается водород из молекул воды.
На катоде одновременно с водородом из воды восстанавливаются катионы металлов, расположенных в ряду активности между алюминием и водородом.
На аноде в растворах солей бескислородных кислот окисляются анионы (кроме фторид-ионов).
На аноде в растворах солей кислородсодержащих кислот с максимальной степенью окисления неметалла ( , ) окисляются молекулы воды с выделением кислорода.
Вопросы, задания, задачи
1. Какие из веществ — каменная соль, сахар, медный купорос, глицерин, серная кислота — могут подвергнуться электролизу в водном растворе?
2. Объясните, почему алюминий нельзя получить электролизом водного раствора его хлорида.
3. Приведите уравнения реакций на электродах при электролизе водного раствора сульфата никеля(II).
4. Сравните продукты электролиза расплава и водного раствора хлоридов натрия, никеля(II) и меди(II). Приведите соответствующие уравнения химических реакций.
5. При электролизе водного раствора хлорида натрия без разделения электродных пространств можно получить гипохлорит натрия. Приведите возможные уравнения электродных процессов и химических реакций в растворе.
6. Продукцией цеха мембранного электролиза ОАО «Беларуськалий» являются водный раствор гидроксида калия и соляная кислота. Приведите уравнения реакций, которые лежат в основе получения этих веществ.
7. Как изменится концентрация катионов и анионов в водных растворах CuCl2, Na2SO4, KI, NaOH, HCl при электролизе? Приведите соответствующие уравнения реакций.
8. В качестве лабораторного способа дезинфекции воды используется электролиз водного раствора хлорида натрия в портативных электролизёрах. Объясните процессы, на которых основан этот способ дезинфекции воды.
9. Сырьём для получения цинка является руда, содержащая цинковую обманку (ZnS). Продукт её обжига растворяют в серной кислоте и после нескольких стадий очистки от примесей (Cu 2+ , Fe 2+ , Fe 3+ и др.) подвергают электролизу. Приведите уравнения химических реакций, иллюстрирующих все основные стадии получения цинка.
10. Оксид марганца(IV) получают электролизом раствора сульфата марганца(II) в присутствии серной кислоты. Предположите, какие процессы протекают на электродах и приведите уравнения соответствующих реакций.
Самоконтроль
1. При электролизе водных растворов солей восстанавливаются ионы:
- а) Li + ;
- б) Mg 2+ ;
- в) Ni 2+ ;
- г) Au 3+ .
2. При электролизе водных растворов солей не восстанавливаются ионы:
- а) K + ;
- б) Са 2+ ;
- в) Cu 2+ ;
- г) Ag + .
3. Продуктами электролиза водного раствора калийной соли являются:
4. На катоде могут протекать процессы:
- а) 2Н2О + 2e – = Н2↑ + 2ОН – ;
- б) 2Н2О – 4e – = О2↑ + 4Н + ;
- в) 2Н + + 2e – = Н2↑;
- г) Ni 2+ + 2e – = Ni 0 .
5. При электролизе водного раствора хлорида натрия выделился водород объёмом 2,24 дм 3 (н. у.). Число электронов, отданных при этом ионами хлора, равно:
Проект по введению в инженерную деятельность На тему: «Получение сплавов металлов методом электролиза» Выполнили студенты группы 0442 Иваненко А.Н. Сатекова. - презентация
Презентация на тему: " Проект по введению в инженерную деятельность На тему: «Получение сплавов металлов методом электролиза» Выполнили студенты группы 0442 Иваненко А.Н. Сатекова." — Транскрипт:
1 Проект по введению в инженерную деятельность На тему: «Получение сплавов металлов методом электролиза» Выполнили студенты группы 0442 Иваненко А.Н. Сатекова Ж.А Шашкина Е.И.
2 Цель проекта: Ознакомиться с основными методами получения сплавов металлов посредством электролиза. Задачи: 1. Усвоить основные понятия по теме. 2. Изучить историю возникновения электрометаллургии 3. Рассмотреть данный метод на примере амальгам. 4. Сделать вывод о его преимуществах и недостатках.
3 Металлы группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами. Основные понятия Электролиз – это совокупность процессов, протекающих в растворе или расплаве электролита, при пропускании через него электрического тока. Электрометаллургия методы получения металлов, основанные на электролизе, т. е. выделении металлов из растворов или расплавов их соединений при пропускании через них постоянного электрического тока.
4 История электрометаллургии Из ранее сказанного нам стало известно, что Электрометаллургия это методы получения металлов, основанные на электролизе, следует, мы можем рассмотреть историю ее возникновения и ее дальнейшее развитие. Любое развитие современной техники и промышленности базируется главным образом на применении металлов. Лишь имея металл, обладающий определенными механическими и физическими свойствами, можно сооружать мощные гидроэлектростанции, атомные реакторы и строительные конструкции и производить аппараты химического производства, ракеты и электронные машины.
5 История электрометаллургии Возможность электроплавки металлов впервые была установлена русским физиком В. В. Петровым. В 1802 г. он создал крупнейшую в то время гальваническую батарею, состоящую из 2100 медно-цинковых элементов. Петров первый указал на возможности ее практического применения для освещения, электроплавки и электросварки металлов.
6 История электрометаллургии Первый способ выплавки металла в электрических печах был запатентован еще в 1853 г. ц Пишоном (Франция), который разработал конструкцию дуговой печи косвенного действия, т. е. с дугами, горящими между электродами над металлической ванной.
7 История электрометаллургии В начале XX в. профессор Киевского политехнического института В. П. Ижевский предложил ряд конструкций электропечей лабораторного типа для плавки металлов. Первая такая печь, построенная в 1901 г., позволяла получать однородный металл и была более компактной. С самого начала использования электропечей в промышленности их преимущества ни у кого не вызывали сомнений. В электропечах достигалась более высокая температура можно было производить специальные высококачественные сплавы металлов при минимальном количестве вредных примесей. В наши дни электрометаллургия все так же первостепенное значение для развития промышленности, в особенности сталеплавильное производство.
8 Например, электролизом можно получать амальгамы, которые являются соединениями ртути с другими металлами. Получение сплавов металла методом электролиза Многие металлы легко выделяются на ртутном катоде, поэтому именно электролитический способ получения амальгам нашел широкое применение.
9 Электролиз с применением ртутного катода может проводиться в кислых, нейтральных и щелочных электролитах, а также в неводных растворах различных солей.
10 Электролитический метод получения амальгам основан на электролизе растворов, содержащих ионы ртути и другого металла. Этим способом готовят амальгамы висмута и меди.
11 Электролиз водных растворов хлоридов редкоземельных металлов на ртутном катоде приводит к образованию амальгам, но одновременно получается значительное количество трудноотделимого осадка основной соли. Спиртовые растворы хлоридов отличаются высоким сопротивлением, и амальгамы из них получаются без особенных трудностей.
12 Актуальность метода Многие вещества получают только этим методом Например: никель, натрий С помощью этого метода получают чистые металлы Массовая доля элемента стремится к 100%
13 Факторы влияющие на производство Сила тока и его плотность Температура электролиза Материал электродов КПД источника тока
14 Электролиз и его преимущества Металлические изделия покрывают слоем другого металла электролитическим способом с целью защиты его от коррозии.
15 Данный метод отличается простотой и дешевизной Универсальный метод
16 Электролиз и его недостатки Большая энергоемкость Низкая производительность Необходимость утилизации большого количества отходов
17 Выводы: Ознакомились с основным методом получения сплавов металлов посредством электролиза. Усвоили основные понятия о электролизе, металле и электрометаллургии. Изучили историю возникновения электрометаллургии. Рассмотрели метод получения сплава металла на примере амальгам. Сделали выводы о преимуществах и недостатках электролиза.
Читайте также:
