Превращения в металлах и сплавах при нагреве и охлаждении
Обновлено: 19.05.2024
Уральский государственный лесотехнический университет
Кафедра технологии металлов
Блюм Э.Э., Потехин Б.А., Резников В.Г.
Основы термической обработки сталей
(конспект лекций)
для самостоятельной работы студентов очного и заочного факультетов
1. Превращения при нагреве и охлаждении стали
1.1. Кристаллическое строение металлов
Металлы и сплавы тела кристаллические - атомы в них расположены в определенном порядке в пространстве. Порядок в расположении атомов в пространстве называют кристаллической решеткой .
В чистых металлах, т.е. при наличии атомов одного элемента, возможно 14 вариантов расположения атомов. Это обусловлено тем, что в кристалле каждый атом должен иметь одинаковое количество атомов-соседей, расположенных от него на одинаковом расстоянии.
В химических соединениях, т.е. при наличии атомов различных элементов, число возможных комбинаций в расположении атомов (типов решеток) становится бесконечно большим. Подавляющее большинство металлов и сплавов имеют сравнительно простые кристаллические решетки (см. рис. 1)
Наибольший интерес представляет строение железа и его сплавов (стали и чугуны)
Железо ниже температуры 911 0 С имеет кубическую объемно-центрированную кристаллическую решетку (ОЦК) и называется a Fe . Такое же строение могут иметь некоторые другие металлы ( Ti , V , W , Mo , Cr , Mn ).
При температурах 911-1390 0 С железо имеет кубическую гранецентрированную кристаллическую решетку (ГЦК) и называется g Fe . Такая же решетка имеется у некоторых других металлов ( Cu , Al , Pb ).
Кратчайшее расстояние между центрами атомов в кристаллической решетке называется параметром решетки (а). Параметры измеряют в ангетремах (А) или килоиксах (КХ)
Параметры решетки соизмеримы с радиусом атомов. Например, у a Fe а=2,8608А, R ат =1,26А,у g Fe а=3,649А, R ат =1,29А
1.2. Аллотропия металлов
Аллотропия - способность некоторых металлов изменять тип кристаллической решетки при изменении внешних условий (температуры и давления). Обычно каждый тип решетки устойчив в определенном интервале температур, но в некоторых случаях, например при быстром охлаждении может одновременно существовать несколько типов решеток. Различные модификации (типы решеток) одного и того же металла обозначают греческими буквами: a , b , g , d и т.д. Буквой обозначается самая низкотемпературная модификация.
Например, при нагреве железа происходят следующие превращения:
a Fe ® b Fe ® g Fe ® d Fe ® Ж
магнитно не магнитны
Признаки аллотропического превращения следующие:
1. Изменяется тип кристаллической решетки;
2. Наблюдается тепловой эффект;
3. Свойства изменяются скачком
Таким образом в железе наблюдается два аллотропических превращения (при температурах 911 и 1390 0 ).
С изменением типа кристаллической решетки железа резко изменяется растворимость в нем углерода. Так максимальная растворимость углерода в a Fe 0,02% (при t =723 0 ), а в g Fe 2,14% (при t =1130 0 ). Это черезвычайно важно для понимания процессов происходящих при термической обработке стали.
Аллотропия наблюдается в ряде металлов ( Sn , Ti , Ni , Mn , Cr и др.).
1.3. Строение металлических сплавов
Химические элементы из которых состоит сплав называют компонентами. При взаимодействии компонентов в сплавах образуются фазы. Фаза - однородная часть сплава отделенная от других поверхностью раздела. При изучении процессов, происходящих при нагреве и охлаждении сплавов, используются диаграммы состояния, которые строят опытным путем. Диаграммой состояния называют график, который показывает фазовое состояние сплава в зависимости от температуры и химического состава. Следует иметь в виду, что диаграммы состояния построены для условий медленного нагрева или охлаждения.
В сплавах могут быть следующие типы твердых фаз: кристаллы чистых компонентов, кристаллы твердых растворов, кристаллы химических соединений.
Кристаллы чистых компонентов состоят из одинаковых атомов, расположенных в виде кристаллической решетки.
Кристаллы твердых растворов состоят из разноименных атомов, образующих общую кристаллическую решетку, тип которой такой же, как у одного из входящих компонентов. При рассмотрении в микроскоп твердые растворы выглядят, как чистые металлы, т.е. являются однофазными. В отличие от химических соединений твердые растворы существуют не при определенном соотношении компонентов, а в интервале концентраций. Поэтому они на диаграммах состояния всегда занимают определенные области. Твердые растворы, как правило, имеют невысокую твердость.
В промышленных сплавах наиболее часто встречаются два типа твердых растворов: замещения и внедрения.
В твердых растворах замещения атомы растворимого элемента занимают в кристаллической решетке места атомов растворителя. Такие твердые растворы могут быть ограниченной и неограниченной растворимости. При неограниченной растворимости любое количество атомов одного компонента может быть заменено атомами другого компонента. Это возможно при выполнении следующих условий: у обоих компонентов одинаковый тип кристаллической решетки, сходное строение валентной электронной оболочки атомов, малое различие в размерах атомов.
Если у двух металлов с одинаковым типом кристаллической решетки диаметры атомов различаются значительно, то растворение второго компонента приводит к сильным искажениям кристаллической решетки. Когда эти искажения достигают определенной величины, решетка становится неустойчивой, что приводит к пределу растворимости.
Твердые растворы замещения всегда образуются между металлами, например, железо с Cr , Mn , Ni , W , Co .
В твердых растворах внедрения атомы растворимого элемента размещаются в междуузельных пространствах кристаллической решетки элемента растворителя. Такие твердые растворы образуются в том случае, когда диаметр атомов растворимого элемента много меньше, чем диаметр атомов элемента растворителя. Поэтому такие твердые растворы образуются между металлами и неметаллами (С,Н,О,N), имеющими малые размеры атомов. Образование таких твердых растворов приводит к некоторому искажению кристаллической решетки и к увеличению параметра решетки. Примером таких твердых растворов в стали служит феррит (твердый раствор внедрения углерода в a Fe ) и аустенит (твердый раствор внедрения углерода в g Fe ).Схемы твердых растворов замещения и внедрения показаны на рис. 2.
Следует, однако, иметь в виду, что в промышленных сплавах, например в сталях, нет в чистом виде твердых растворов замещения и внедрения. Даже простые углеродистые стали представляют собой сложные многокомпонентные сплавы, в которых образуются твердые растворы внедрения на базе твердых растворов замещения.
Химические соединения - такие фазы, которым можно приписать простые стехиометрические формулы. Они имеют обычно сложную кристаллическую решетку с упорядоченным расположением атомов, тип которой отличается от решеток входящих в них компонентов. Состав химических соединений, в отличие от тверды растворов, постоянный и не изменяется с изменением температуры. Поэтому на диаграммах состояния химические соединения показывают вертикальной прямой линией.
Свойства химических соединений всегда сильно отличаются от свойств входящих в них компонентов.
В сталях наибольший интерес представляет химическое соединение Fe 3 C, обладающее высокой твердостью и хрупкостью.
При рассмотрении сплавов в микроскоп видны структурные составляющие . Структурными составляющими называют участки сплава, которые выглядят одинаково (светлыми, темными, пестрыми). Структурные составляющие выявляют путем травления полированных образцов-шлифов кислотами или другими реактивами. Структурные составляющие могут состоять из одной или нескольких фаз.
Все сплавы в твердом состоянии могут состоять из следующих структурных составляющих:
1. Кристаллов твердых растворов,
2. Кристаллов химических соединений,
3. Механической смеси кристаллов различных типов (кристаллов чистых компонентов, твердых растворов и химических соединений).
При образовании механических смесей особо выделяют однородные механические смеси, которые являются самостоятельными структурными составляющими и при рассмотрении в микроскоп выглядят однородными участками.
Если однородная механическая смесь образовалась при кристаллизации из жидкого состояния, то она называется эвтектикой. Например, при кристаллизации белого чугуна содержащего 4,3%С образуется эвтектика (однородная механическая смесь состоящая из аустенита и цементита), которая имеет специальное название ледебурит .
Если однородная механическая смесь кристаллов образовалась в твердом состоянии, то она называется эвтектоидом . Например, в углеродистой стали содержащей 0,83%С при охлаждении ниже 723 0 аустенит распадается на феррит и цементит. Такая однородная механическая смесь в сталях имеет специальное название - перлит .
1.4. Превращения в стали при нагреве
Термическая обработка стали состоит в нагреве до определенной температуры, выдержке и охлаждении с определенной скоростью.
При кажущейся простоте этих операций в процессе их выполнения в стали протекают сложные процессы, которые и определяют свойства после термической обработки.
На рис. 3. Показан фрагмент диаграммы Fe-C, где находятся углеродистые стали. Линии на диаграмме имеют специальные обозначения. Линия А 1 (723 0 ) показывает начало образования аустенита при нагреве, линия А 3 - конец образования аустенита, линия А ст - конец растворения цементита в аустените.
После медленного охлаждения, а диаграмма и построена при медленном охлаждении, структуры стали в зависимости от содержания углерода будут различными.
Превращения, происходящие в железе и стали при нагреве и охлаждении
Внимательно всмотревшись в излом металла, ясно можно увидеть, что он представляет собой нагромождение (совокупность) отдельных кристаллов (зерен), крепко сцепленных между собой. Мельчайшей частицей металла, как и всякого другого вещества, является атом. В элементарных ячейках, из которых состоят кристаллы железа, атомы расположены в определенном порядке. Это расположение изменяется в зависимости от температуры нагрева. При любой температуре ниже 910° атомы в ячейках кристаллов располагаются в виде куба, образуя так называемую кристаллическую решетку альфа-железа. В этом кубе восемь атомов расположены в углах решетки и один в центре.
При нагреве свыше 910° происходит перегруппировка атомов и кристаллическая решетка представляет собою форму куба с четырнадцатью атомами; условно ее называют решеткой гамма-железа. При температуре 1390° решетка гамма-железа перестраивается в решетку с девятью атомами, носящую название дельта-железо. Эта решетка отличается от решетки альфа-железа несколько большим расстоянием между центрами атомов и сохраняется до момента расплавления железа, т. е. до 1535° (Рис. 1).
Перестройка кристаллической решетки при медленном охлаждении происходит в обратном порядке: дельта-железо при 1390° превращается в гамма-железо, а гамма-железо при 898° превращается в альфа-железо.
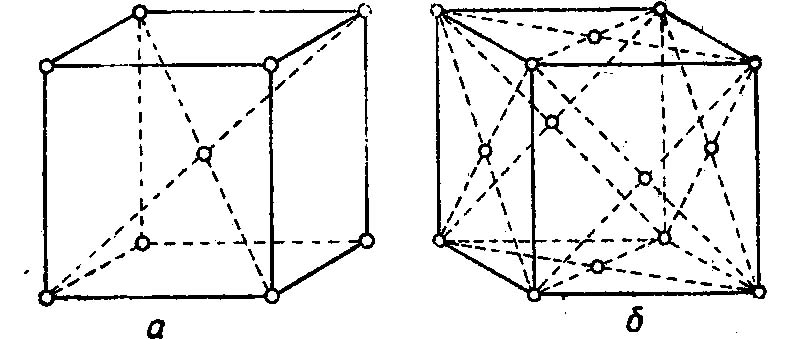
Рис. 1. Строение кристаллической решетки: а — альфа и дельта железа; б — гамма железа.
Критические точки превращения
На рис.2 показаны кривые охлаждения и нагревания чистого железа. Как видно из этих кривых, в процессе перестройки одной решетки в другую, а также при расплавлении и затвердевании железа происходят температурные остановки, являющиеся результатом выделения дополнительного количества тепла при охлаждении и поглощении дополнительного количества тепла при нагревании.
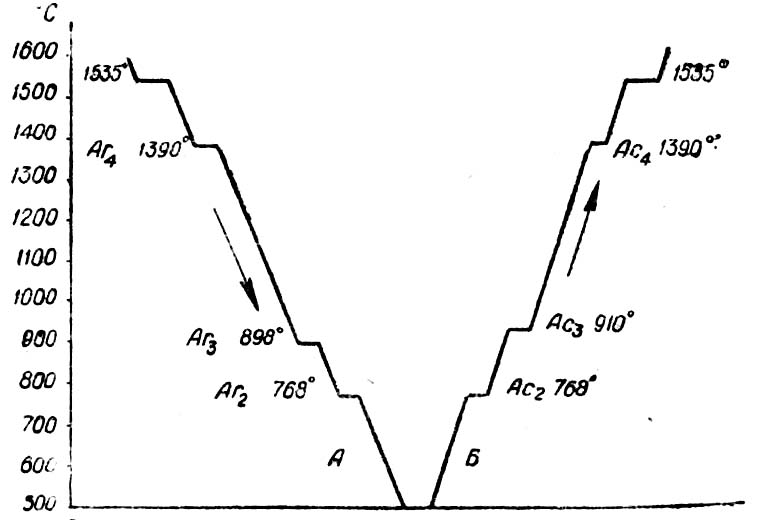
Рис. 2. Кривые охлаждения и нагрева чистого железа.
Температурные остановки, при которых происходят перестройки решеток, называются критическими температурами или критическими точками и обозначаются Аrпри охлаждении и Ас при нагревании. В точках Аr2и Ас2,не происходит перестройка атомной решетки, а изменяются магнитные свойства железа. При температуре выше 768° железо теряет способность притягиваться магнитом. При очень малой скорости нагревания и охлаждения критические точки А с3и Аr3не совпадают друг с другом на 12°. При увеличении скорости охлаждения несовпадение критических точек увеличивается, так как температура значительно снижается и железо переохлаждается. Это явление, носит название гистерезис.
При нагревании и охлаждении стали происходит также перестройка атомной решетки, но температуры критических точек не постоянны. Они зависят от содержания углерода и легирующих примесей в стали, а также от скорости нагревания и охлаждения.
На рис. 3 представлена диаграмма состояния углеродистой стали при медленном охлаждении и нагревании.
Рис.3. Диаграмма состояния углеродистых сталей.
Структура стали
Структурой стали называется внутреннее ее строение. Углерод в стали находится в виде химического соединения с железом, и это соединение называется — цементит. Кроме цементита, в стали имеется феррит, представляющий собой почти чистое железо. В зависимости от содержания углерода большая или меньшая часть феррита находится в механической смеси с цементитом, образуя новую структуру — перлит. Если небольшой кусок металла прошлифовать, отполировать и протравить в специальном реактиве, то под микроскопом можно различить структуры. Ниже приводится описание структур железоуглеродистых сплавов.
Аустенит представляет собою твердый раствор углерода и других элементов в гамма-железе. Наибольшее содержание углерода, которое может раствориться в ау-стените — это 2%. Аустенит образуется при затвердевании жидкой стали и при нагреве твердой стали выше критических температур.
В обычных сталях аустенит устойчив только лишь при температуре выше критических точек. При охлаждении, даже самом быстром, с этих температур аустенит превращается в другие структуры. При комнатной температуре аустенит полностью сохраняется в ряде марок нержавеющих сталей, в высокомарганцовистой стали и в незначительном количестве остается при закалке некоторых марок инструментальной и конструкционной сталей.
Аустенит мягок, пластичен, тягуч, мало упруг. Твердость его по Бринелю находится в пределах 170—220.
Аустенит немагнитен, обладает невысокой электропроводностью.
Феррит представляет собой твердый раствор углерода и других элементов в альфа-железе. Наибольшее содержание углерода, которое может раствориться в феррите, это 0,04%. Феррит устойчив при температурах ниже критической точки AC1. Он выделяется из аустенита при медленном охлаждении последнего ниже A6i. Феррит мягок, сильно тягуч. Твердость HB= 60—100. Феррит магнитен до 768°. Свыше этой температуры он теряет магнитные свойства.
Цементит представляет собой химическое соединение железа с углеродом Fe3C—карбид железа. Цементит содержит углерода 6,67%. Выделяется из жидкого и твердого раствора при медленном охлаждении. Цементит весьма тверд и хрупок. Твердость его НB= 800—820. Он магнитен до 210°. Выше этой температуры цементит теряет магнитные свойства.
Перлит представляет собой механическую смесь феррита и цементита. Он образуется из аустенита при медленном его охлаждении. Температура превращения аустенита в перлит 723°С. При весьма медленном переходе через эту температуру цементит образуется в виде зерен (глобулей), и тогда перлит называется зернистым. При более быстром охлаждении цементит приобретает форму пластинок, и такой перлит называется пластинчатым. При весьма быстром охлаждении в результате значительного переохлаждения аустенита вместо перлита получаются другие структуры, о которых речь будет ниже.
Перлит магнитен, прочен и пластичен. Твердость его находится в пределах от 160 до 230 кг/мм 2 по Бринелю. При обработке резанием наиболее чистую поверхность дает структура зернистого перлита.
Мартенсит образуется в результате весьма быстрого охлаждения (закалки) аустенита. При быстром охлаждении успевает произойти перестройка кристаллической решетки гамма-железа в решетку альфа-железа, выделение же углерода в карбид железа не успевает произойти, и он весь остается растворенным в решетке альфа-железа. Так как нормально альфа-железо может растворить в себе не более 0,04% углерода, то такой раствор называют пересыщенным. Он отличается весьма большой твердостью (свыше Rc= 60) и хрупкостью. Следует указать, что решетка альфа-железа, получающаяся в результате закалки, имеет искаженную форму. Так, размеры ее граней не одинаковы — в одном направлении они удлинены за счет других (см. рис. 4). Такая решетка называется тетрагональной. Чем больше в стали углерода, тем больше тетрагональность решетки и тем более велики внутренние напряжения. При нагревании до температур 100—200° тетрагональность мартенсита уменьшается, форма кристаллической его решетки приближается к форме правильного куба, и вместе с этим уменьшаются внутренние напряжения. Мартенсит магнитен.
Рис. 4. Строение кристаллической решетки стали, закаленной на мартенсит.
Троостит представляет собой высокодисперсную (мелкораздробленную) смесь феррита и карбидов. Он образуется при охлаждении аустенита с замедленной против закалки скоростью или в результате нагрева (отпуска) мартенсита в пределах 250—400°.
При нагреве закаленной стали происходит постепенное выделение углерода из кристаллической решетки с образованием карбидов. Троостит менее прочен, более пластичен, чем мартенсит. Твердость его НB330—400. При охлаждении аустенита в горячих средах в интервале 250—400° (изотермическое превращение аустенита) происходит образование игольчатого троостита, несколько более прочного, чем обычный троостит.
Сорбит представляет собой дисперсную смесь феррита и карбидов. Он образуется при охлаждении аустенита с небольшой скоростью или при нагреве (отпуске) мартенсита до 400—650°. Карбиды сорбита более крупные, чем троостита. Сорбит пластичен, вязок и магнитен. Твердость НВ 270—320.
Ледебурит представляет собой эвтектическую смесь аустенита и цементита. Он содержит углерода 4 3% Образуется ледебурит при затвердевании жидкого сплава с содержанием углерода свыше 2%. Ледебурит хрупок.
На рис. 5. представлены фотоснимки структур стали с различным содержанием углерода.
Структура стали с содержанием углерода 0,83% состоит из сплошного перлита и называется эвтектоидной; при меньшем содержании углерода структура стали состоит из перлита и феррита и носит название доэвтектоидной, а при большем содержании углерода — из перлита и цементита и называется заэвтектоидной. Температура 723°, при которой перлит переходит в аустенит, также называется критической и обозначается Ас.
Для того чтобы доэвтектоидную и эвтектоидную сталь полностью отжечь, нормализовать или закалить, их нужно нагреть до такой температуры, при которой они перешли бы в аустенитное состояние.
Рис. 5. Микроструктура отожженной углеродистой стали:
а - с содержанием углерода -0,1%
б - с содержанием углерода -0,85%
в - с содержанием углерода -1,1%
Превращения, происходящие в стали при нагревании
По диаграмме на рис. 3 можно проследить за изменениями структуры трех разных марок стали при нагревании:
- Сталь с содержанием углерода 0,83%. Структура стали представляет собой перлит. При температуре 723° в точке Aс1 перлит переходит в аустенит.
- Сталь с содержанием углерода 0,4%. Структура стали представляет собой перлит и феррит. При температуре 723° в точке К1 перлит переходит в аустенит, и по мере повышения температуры происходит растворение свободного феррита в аустените. При пересечении линии GS в точке К2 закончится растворение феррита и структура будет полностью состоять из аустенита. Для этой стали точка К1на диаграмме будет нижней критической точкой Ас1,а К2— верхней критической точкой Ас1,.
- Сталь с содержанием углерода 1,2%. Структура стали представляет собой перлит и цементит. При температуре 723° в точке Pi перлит переходит в аустенит, и при дальнейшем повышении температуры происходит постепенное растворение цементита в аустените. При пересечении линии SEв точке Р2 это растворение закончится. Для этой стали точка Р1 явится нижней критической точкой Ас1, а точка Ρ2 — верхней критической точкой, которая для заэвтектоидных сталей обозначается Асm.
Линия на диаграмме, обозначенная буквами GS, соответствует окончанию растворения феррита в аустените в доэвтектоидных сталях, а линия SE соответствует окончанию растворения цементита в аустените в заэвтектоидных сталях.
Следует указать, что заэвтектоидные стали при операциях термической обработки не нагревают выше линии Аcт(такая высокая температура нагрева приведет к перегреву и ухудшению свойств стали), а ограничиваются нагревом выше первой критической точки ACl, что полностью обеспечивает получение необходимых свойств.
Превращения, происходящие в стали при медленном охлаждении
В сталях, нагретых до аустенитного состояния, при весьма медленном охлаждении произойдут обратные превращения, а именно:
а) в стали с содержанием углерода 0,83% аустенит превратится в перлит;
б) в стали с содержанием углерода 0,4% сначала из аустенита начнет выделяться феррит, а затем в районе температуры 700° оставшийся аустенит превратится в перлит и
в) в стали с содержанием углерода 1,2% сначала из аустенита выделится цементит, а затем в районе температуры 700° оставшийся аустенит превратится в перлит.
Даже при весьма медленном охлаждении температура распада аустенита не совпадает с теми температурами, при которых аустенит образовался при нагревании. Чем скорость охлаждения больше, тем больше становится гистерезис, т. е. разница между критическими температурами (точками) при нагревании и охлаждении.
Превращения, происходящие в стали при быстром охлаждении
Как указывалось выше, при быстром охлаждении не успевает произойти превращение аустенита в перлит с выделением избыточного феррита или цементита, а в зависимости от скорости охлаждения аустенит превращается в новые структуры - мартенсит, троостит или сорбит. Сталь с этими структурами отличается от сталей со структурами перлита и феррита повышенной твердостью, прочностью и уменьшенной пластичностью. Если углеродистую сталь, нагретую выше критических температур, охладить очень быстро, то аустенит превратится в мартенсит и это превращение начнется лишь при температуре около 200°. При несколько меньшей скорости охлаждения образуется структура троостит, а при еще меньшей — сорбит.
В производственных условиях при охлаждении углеродистой инструментальной стали в воде образуется мартенсит, при охлаждении в масле — троостит и при охлаждении в струе воздуха -сорбит. На рис. 6 показаны микроструктуры закаленной стали.
Рис. 6. Микроструктура закаленной стали:
а — игольчатый мартенсит;
В легированных сталях, благодаря присутствию специальных элементов, для образования мартенсита не требуется столь большой скорости охлаждения, как для углеродистых сталей, и мартенсит образуется при охлаждении в масле, а для быстрорежущих сталей — и при охлаждении на воздухе.
Троостит и сорбит можно получить не только в результате ускоренного охлаждения, нои путем нагрева закаленной стали, имеющей структуру мартенсита, до температуры ниже Aс1, т. е. путем отпуска стали. В этом случае троостит получается при нагреве стали до 400°, а сорбит—при нагреве до 650°. При нагреве до промежуточных температур получаются смешанные структуры: при нагреве от 250—400° — мартенсит и троостит и при нагреве от 400—650° — троостит и сорбит. В производственных условиях троостит и сорбит получают путем отпуска закаленной стали.
Превращения, происходящие в стали при охлаждении в среде, имеющей температуру выше 200° (изотермическое превращение)
Если деталь, нагретую выше критической точки, поместить в среду, имеющую температуру от 700 до примерно 200°, и выдержать в ней до выравнивания температуры по всему сечению, то аустенит превратится в ту структуру, которая соответствует превращению при данной температуре.
О поведении стали при изотермической обработке, выборе температуры и времени выдержки судят по кривым изотермического превращения, построенным для разных марок стали.
Рис. 7. Диаграмма изотермического превращения аустенита углеродистой стали.
На рис. 7 дан вид диаграммы изотермического превращения в стали. На горизонтальной оси отложено время начала и конца превращения, а на вертикальной— температура, при которой оно происходит. Линия А с соответствует переходу аустенита в перлит, а линия Мн — образованию мартенсита из аустенита. На кривой I начинаются, а на кривой II заканчиваются структурные превращения.
Если углеродистую инструментальную сталь, нагретую до 800°, поместить в масло, расплавленную соль или щелочь при температуре 250°, в ней образуется игольчатый троостит с высокой твердостью Rc=45—55. Если эту же сталь охладить в среде, имеющей температуру свыше 600°, в ней образуется перлит и такая сталь легко обрабатывается на станках. При охлаждении стали в среде с промежуточными температурами образуются структуры троостита и сорбита с соответствующей твердостью.
Изотермический отжиг нашел большое применение при термической обработке инструментальных сталей как процесс, резко уменьшающий время по сравнению с другими видами отжига.
Изотермическая закалка в инструментальном деле применяется редко из-за недостаточной для инструмента твердости, достигаемой при этом процессе.
Источник:
Остапенко Н.Н.,Крапивницкий Н.Н. Технология металлов. М. Высшая школа,1970г.
Каменичный И.С. Практика термической обработки инструмента. Киев, 1959 г.
Превращения в металлах и сплавах в твердом состоянии
Превращения в металлах и сплавах в твердом состоянии по своей физической сущности во многом напоминают кристаллизацию жидких металлов. Эти превращения называют фазовой перекристаллизацией, а при их исследованиях используют те же подходы в отношении механизмов и кинетики формирования новой фазы, включая образование зародышей и последующий их рост.
В чистых металлах основными превращениями в твердом состоянии являются аллотропические (полиморфные), а также магнитные превращения. В сплавах превращения в твердом состоянии дополняются целым рядом превращений, таких как эвтектоидное, перитектоидное, растворение и выделение избыточных фаз и др. Их изучение потребует знания диаграмм фазового равновесия и будет кратко рассмотрено позже.
Аллотропическим (полиморфным) превращением называют изменение пространственной решетки кристаллического тела. В качестве примеров аллотропических превращений можно привести превращение низкотемпературной аллотропической формы a - Fe с объемно-центрированной кубической решеткой в высокотемпературную форму g - Fe с гранецентрированной кубической решеткой, при температуре 911 °С и последующее превращение при температуре 1392 °С g - Fe в d - Fe с объемно-центрированной кубической решеткой, аналогичной a - Fe. Аналогичные превращения можно наблюдать в титане, цирконии и т.д. В титане и цирконии низкотемпературной аллотропической формой являются a - Ti, a - Zr с гексагональной плотноупакованной решеткой. При температуре выше 882° С для титана и 862° С для циркония образуются b - Ti и b - Zr, обладающие объемно-центрированной решеткой.
Аллотропическое превращение заключается в том, что атомное строение кристаллического тела изменяется при нагреве и охлаждении при переходе через критическую точку. Сам процесс перестройки кристаллической решетки происходит изотермически при постоянной температуре, кривая охлаждения сплава претерпевающая аллотропические превращения, аналогична кривой, наблюдаемой при затвердевании жидкого металла (рисунок 2. 11). Температура перехода называется критической точкой превращения. При температуре (Т0) наблюдается фазовое равновесие двух аллотропических разновидностей.
| Рисунок 2.11. Термическая кривая для случая аллотропического при охлаждении | Рисунок 2.12. Изменение свободной энергии системы при аллотропическом превращении |
Аналогично процессу кристаллизации аллотропическое превращение идет с поглощением тепла при нагреве и выделением его при охлаждении. Аллотропическое превращение (также по аналогии с процессом кристаллизации) происходит путем образования зародышей и их последующего роста, в связи с чем оно протекает всегда с наличием переохлаждения (при охлаждении) и перенагрева при нагреве.
Аллотропическое превращение происходит так же как и процесс кристаллизации, в связи со стремлением системы к уменьшению свободной энергии, и поскольку линии, характеризующие изменения свободной энергии в зависимости от температуры, пересекаются при температуре Т0 (рисунок 2.12). При температурах выше Т0 стабильной является b - фаза, при более низкой температуре стабильной оказывается a - фаза, имеющая меньший запас свободной энергии.
В процессах кристаллизации основным препятствием образования твердых кристаллов являются затраты энергии на образование границы раздела фаз. Это вызывает необходимость переохлаждения для начала процесса кристаллизации.
При аллотропическом превращении кроме энергии, затрачиваемой на образование границы раздела фаз, необходимы дополнительные затраты энергии на преодоление упругого сопротивления твердой фазы, связанные с тем, что полиморфные превращения всегда приводят к изменением объема. Поскольку затраты энергии для образования зародышей при аллотропическом превращении больше, чем при кристаллизации из жидкого состояния, то переохлаждение при превращениях в твердом состоянии должны быть гораздо больше, чем при кристаллизации.
Аллотропические превращения могут протекать по двум механизмам:
1. диффузионным (нормальным) путем,
2. бездиффузионным (мартенситным) путем.
В отдельных металлах эти превращения могут протекать как по одному, так и по другому механизму, что будет зависеть от скорости охлаждения.
Диффузионный механизм аллотропического превращения заключается в том, что атомы, располагающиеся в решетке высокотемпературной модификации путем диффузионного перемещения, занимают новые места, характерные для новой аллотропической формы: низкотемпературной модификации.
Следовательно, развитие диффузионного механизма аллотропического превращения наиболее благоприятно при высоких температурах, обеспечивающих большую скорость диффузионного перемещения атомов. Кроме того, если температура превращения настолько высока, что обеспечивает высокую пластичность, то затраты энергии на преодоление упругого сопротивления тела образованию и росту новой фазы, отличающейся от новой фазы удельным объемом становятся меньше, в связи с чем аллотропическое превращение протекает при минимальном переохлаждении. Зародыши новой фазы появляются на границах зерен старой фазы и на других дефектах кристаллов. В дальнейшем происходит рост этих зародышей за счет перехода атомов из старой фазы в новую. Наряду с этим наблюдается продолжение зарождения новых зародышей образующейся фазы.
При переходе металла из одного кристаллографического состояния в другое происходит не только изменение кристаллической структуры, но и имеет место полный процесс фазовой перекристаллизации, при которой на месте старых зерен образуются совершенно новые зерна с новым расположением границ. Причем на месте старого одного зерна могут возникнуть несколько новых или на месте нескольких старых - одно новое зерно.
Этот процесс зависит, главным образом, от скорости охлаждения и степени переохлаждения, которые в основном определяют количество образующихся в единицу времени центров кристаллизации и скорость роста новой фазы. Чем выше скорость охлаждения и выше степени переохлаждения, тем больше количество центов кристаллизации, тем более дисперсными являются зерна новой фазы.
Поскольку аллотропические превращения происходят в твердой среде, наиболее интенсивно процесс фазовой перекристаллизации будет происходить в том случае, если длина диффузных путей будет минимальной. А это означает, что при образовании зародышей должен соблюдаться принцип структурного и размерного соответствия. Он сформулирован С.Т. Конобеевским и заключается в том, что: "форма и ориентировка зародышей новой фазы при кристаллизации должны соответствовать минимуму поверхностной энергии при данном объеме, а минимум поверхностной энергии обеспечивается при максимальном сходстве в расположении атомов на соприкасающихся гранях старой и новой фаз".
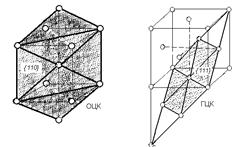 | Рисунок 2.13. Близкие по строению плоскости в решетке ОЦК и в ГЦК решетке |
Поэтому зарождение новой фазы начинается на плоскостях, которые являются наиболее сходными у обеих кристаллических решеток. Например, при переходе g - Fe в a - Fe наибольшее сходство имеют плоскости в g - Fe и в a - Fe (рисунок 2.13).
Преобразованием плоскостей g в a и направлений [110] g в [111] a во всем объеме металла протекает рассматриваемое аллотропическое превращение. При этом происходит лишь небольшой поворот кристаллографических направлений, при котором обеспечиваются углы 70°30¢ и 54°45¢ соответствующие расположению атомов в объемно-центрированном кубе.
Форма выделений новой фазы в основном определяется упругой энергией, возникающей при выделении. Если при аллотропическом превращении наблюдается большая степень размерного и структурного соответствия кристаллов старой и новой фаз, упругая энергия системы минимальна, а кристаллы новой фазы имеют форму дисков (пластин). Кроме того, на форму выделяющихся кристаллов оказывает влияние степень анизотропии упругих свойств обеих фаз. Если модули упругости возникающей фазы для всех направлений меньше, чем модули переходной фазы, в этом случае форма выделений - диски или пластины. Если модуль новой фазы только для одного из направлений меньше, чем модуль исходной фазы, то может появиться игольчатая форма выделений.
Появление новой фазы с новым удельным объемом может способствовать развитию сопутствующих процессов, таких как наклеп (фазовый) и рекристаллизации. Кроме того, на развитие аллотропии может оказывать влияние наличие примесей, которые могут играть роль дополнительных зародышевых центров. Все эти дополнительные параметры могут оказать влияние на окончательную структуру и свойства металла, претерпевшего аллотропическое превращение. В результате собирательной рекристаллизации, сопутствующей аллотропическому превращению, происходит укрупнение зерна, причем тем больше, чем выше температура нагрева. В случае же нагрева до температур, лежащих выше критической точки, когда происходит образование зерен новой фазы, но не успевает начаться укрупнение зерна, обычно получается очень маленькое зерно.
Бездиффузионный или мартенситный механизм аллотропического превращения осуществляется при низких температурах, при которых диффузия или самодиффузия почти не осуществляется. Это превращение происходит или в металлах с низкой температурой аллотропического перехода или при сильном переохлаждении высокотемпературной аллотропической формы в металлах с высокой температурой превращения. Так у кобальта, у которого Т0 = 420 °С, аллотропическое превращение идет только бездиффузионным путем. В железе, титане, цирконии и других металлах с высокой температурой Т0 при большом переохлаждении превращение идет бездиффузионным путем, а при малом переохлаждении - диффузионным путем. При мартенситном аллотропическом превращении новая фаза образуется путем кооперативного и закономерного перемещения атомов таким образом, что они сохраняют своих соседей и смещаются по отношению один к другому на расстояния, не превышающие междуатомные. Основное предположение мартенситного превращения заключается в том, что в процессе перехода старой фазы в новую сохраняется сопряженность (когерентность) их пространственных решеток. При наличии когерентности двух фаз поверхностная энергия границы очень мала, что способствует интенсивному росту образовавшихся кристаллов.
Упругая энергия сравнительно велика, она все время возрастает в процессе роста кристалла. Это происходит до тех пор, пока не будет превзойден предел упругости в переходной зоне. При этом в ней происходит пластический сдвиг, нарушающий когерентность кристаллических решеток старой и новой фаз. Возникновение некогерентной границы приостанавливает рост данного кристалла мартенситной фазы. Дальнейшее увеличение количества образующейся фазы происходит путем образования новых зародышей и мгновенного их роста. Скорость роста кристаллов при мартенситном превращении очень велика и достигает скорости звука. Скорость образования центров кристаллизации подчиняется общим закономерностям фазовых превращений. При развитии мартенситного механизма аллотропического превращения участки новой фазы располагаются вдоль определенных кристаллографических плоскостей старой фазы и выглядят под микроскопом в виде иголок или пластин. Это является результатом структурного и размерного соответствия, устанавливающегося между решетками старой и новой фаз.
Важной особенностью мартенситного превращения является то, что в изотермических условиях превращения только часть старой фазы переходит в новую. Дальнейшее превращение может протекать только при понижении температуры. Мартенситное превращение происходит в интервале температур. Различают точки Мн и Мк - начало и конец мартенситного превращения. Во многих случаях превращение не доходит до конца даже при очень низких температурах. Установлено, что мартенситное превращение, как и нормальное - диффузионное обратимо. Образование высокотемпературной формы из низкотемпературной при достаточной степени перенагрева может происходить бездиффузионным путем.
Магнитное превращение, наблюдаемое в ферромагнитных материалах, не является обычным фазовым превращением. Оно не связано с перемещением диффузией атомов, а вызывается только изменением взаимодействия магнитно нескомпенсированных d или f - электронов, обусловливающих возникновение ферромагнетизма. Характер изменения магнитных свойств зависит от физической природы металла. Температура потери магнитных свойств, называемая точкой Кюри, не зависит от скорости нагрева или охлаждения. Эта температура постоянна для каждого металла. Для железа она равна 768° С, никеля - 365- 370° С, кобальта - 1050° С.
Лекция 7. Диаграмма состояния с полиморфным превращением на примере системы железо-углерод, основные фазы.
Основные фазы. Превращения в железоуглеродистых сплавах при нагреве и охлаждении. Углеродистые стали. Критические точки в сталях. Влияние содержания углерода на механические свойства сталей. Влияние примесей на эксплуатационные свойства сталей. Хладноломкость сталей. Чугуны;(6ч)
Лекция 7. Диаграмма состояния с полиморфным превращением на примере системы железо-углерод, основные фазы.
Железоуглеродистые сплавы (стали и чугуны) важнейшие металлические сплавы современной техники.
Представление о строении сплавов железоуглеродистых сплавов дает диаграмма системы Fe – C, начало изучения, которой было положено работами Д.К. Чернова в 1868 году.
Железо в твердом состоянии может находиться в двух полиморфных модификациях: Feα
с ОЦК решеткой (к.ч.=8; к.к.=0,68) и Feγ с ГЦК решеткой (к.ч.=12; к.к.= 0, . Диаграмма 74).
Ниже 910 ºC и выше 1392 ºC устойчиво α-железо с ОЦК решеткой. В интервале температур 910-1392 ºC устойчиво γ-железо с кристаллической решеткой ГЦК (рис.7.1).

Рис.7.1. Кривая нагрева – охлаждения железа
Железо при 768ºC испытывает магнитное превращение. Выше 768ºC железо становится немагнитным.
Углерод образует с железом твердые растворы внедрения. Растворимость углерода в железе зависит от кристаллической модификации железа.
Диаметр поры кристаллической решетки ОЦК (свободное место в середине ребер) равен 0,062нм, что значительно меньше, чем диаметр поры решетки ГЦК, равной 0,102нм, а диаметр атома ( иона) углерода-0,154нм. Поэтому α-железо способно растворять углерод в очень малом количестве, а растворимость углерода в γ-железе существенно больше.
Железо не только растворяет углерод, но и образует с ним химическое соединение цементит (Fe3C).
В системе железо-углерод возможно присутствие следующих фаз: жидкой фазы, твердых растворов на базе Feα (феррита) и на базе Feγ (аустенита), химического соединения Fe3C (цементита).
Феррит (Ф)- твердый раствор внедрения углерода в Feα.. При 727 ºC наблюдается максимальная растворимость углерода в феррите, составляющая 0,02%; при 20 ºC в феррите растворяется около 0,006% С. Высокотемпературная модификация Feα.( называется Feδ) с предельной растворимостью углерода 0,1 % при температуре 1499 o С (точка J). Свойства феррита близки к свойствам чистого железа. Область феррита на диаграмме состояния железо-углерод расположена левее линии GPQ и AHN.
Аустенит (А) – твердый раствор внедрения углерода в Feγ. Растворимость углерода в аустените зависит от температуры. При 1147 ºC аустенит может растворять до 2,14 %С, при 727 ºC – 0,8%С. Область аустенита на диаграмме – NJESGN.
Цементит (Ц) – карбид железа Fe3C, в котором содержится 6,67 %С. Температура плавления цементита 1252 ºC. Обладает высокой твердостью ( 8000 МПа НВ ), легко царапает стекло. Цементит очень хрупок, имеет практически нулевую пластичность, сложную орторомбическую решетку с плотной упаковкой атомов.
Диаграмма состояния железо-углерод приведена на рис.3.2.

Линия ABCD- линия ликвидус, линия AHJECF – солидус. Точка А соответствует температуре плавления железа (1539 ºC), точка D – температуре плавления цементита (1252ºC). Точки N и G соответствуют температурам полиморфного превращения железа.
Рис. 7.2. Диаграмма состояния системы Fe – C
Три горизонтальные линии на диаграмме Fe – C (рис.2) – HJB, ECF и PSK указывают на протекание нонвариантных реакций.
При 1499ºC (линия HJB) протекает перитектическая реакция:
По линии ECF при 1147 ºC происходит эвтектическое превращение:
Образующая эвтектика называется ледебуритом.
Ледебурит (Л)- механическая смесь аустенита и цементита, содержащая 4,3%С.
По линии PSK при 727 ºC происходит эвтектоидное превращение:
В результате которого из аустенита, содержащего 0,8%С, образуется механическая смесь феррита и цементита. Эвтектоидное превращение происходит аналогично кристаллизации эвтектики, но не из жидкости, а из твердого раствора. Образующийся эвтектоид называется перлитом.
Перлит (П) – механическая смесь феррита и цементита, содержащая 0,8%С. Зерно перлита состоит из параллельных пластинок цементита и феррита, на травленом шлифе напоминает перламутр, отсюда и называется – перлит.
Аустенит, входящий в состав ледебурита, при 727 ºC также испытывает эвтектоидное превращение. Поэтому ниже 727 ºC ледебурит состоит из механической смеси перлита и цементита.
На рис.7.3 приведены кривые охлаждения сплавов: 0,02; 0,5; 0,8; 1,7; 3,5; 4,3; 5,5%С.
Сплав 1, содержащий менее 0,02%С, фактически, представляет собой технически чистое железо. Точка 1 соответствует началу кристаллизации аустенита, точка 2 – окончанию кристаллизации. При охлаждении от точки 2 до точки 3 никаких превращений в образовавшемся аустените не происходит.
В точке 3 начинается, а в точке 4 заканчивается перестройка кристаллической решетки аустенита (ГЦК) в кристаллическую решетку феррита (ОЦК). При охлаждении в интервале температур 3-4 состав аустенита меняется по линии GS, а состав феррита – по линии GP. От точки 4 до точки 5 превращений не происходит, образовавшийся феррит просто охлаждается. Линия PQ соответствует линии переменной растворимости.
Ниже этой линии сплав пересыщен углеродом, происходит выделение избыточного углерода, образующего химическое соединение с железом, т.е. цементит. При охлаждении цементит выделяется непрерывно, и концентрация углерода в феррите уменьшается по линии PQ, составляя при комнатной температуре Ш.

Рис.7.3 Кривые охлаждения сплавов: 0,02; 0,5; 0,8; 1,7; 3,5; 4,3; 5,5%С.
Сплав II содержит 0,5%С. Образование кристаллов аустенита происходит в интервале температур 1-2. Состав аустенита изменяется по линии солидус АЕ, состав жидкой фазы по линии ликвидус АС. В точке 2 кристаллизация аустенита заканчивается, и от точки 2 до точки 3 структурных изменений в нем не происходит, аустенит просто охлаждается. В точке 3 начинается выделение феррита из аустенита. Концентрация углерода в феррите изменяется по линии GP, а концентрация углерода в аустените – по линии GS. При охлаждении сплава до точки 4 состав аустенита будет соответствовать точке S, т.е. эвтектоидному составу. При температуре 727 ºC произойдет эвтектоидное превращение с образованием перлита AS↔ФР+ЦК. При комнатной температуре структура сплава состоит из феррита и перлита.
Количество перлита в структуре увеличивается по мере роста содержания углерода в сплаве вплоть до концентрации 0,8%С.
Сплав Ш, содержащий 0,8%С, по составу соответствует точке S. Аустенит сплава с такой концентрацией углерода не испытывает превращения при охлаждении до 727 ºC, а при этой температуре весь аустенит превращается в перлит. При комнатной температуре структура сплава состоит из одного перлита.
Концентрация углерода в сплаве IV составляет более 0,8%С, но менее 2,14%С. До точки 3 превращения в этом сплаве такие же, как в сплавах П и Ш. При охлаждении в диапазоне температур между точками 3-4 из кристаллической решетки аустенита выделяется избыточный
углерод с образованием вторичного цементита ЦП. При этом содержание углерода в аустените изменяется по линии ES. На линии PSK при температуре 727 ºC происходит эвтектоидное превращение, при котором аустенит превращается в перлит. Поэтому при комнатной температуре структура сплава состоит из перлита и вторичного цементита.
Сплавы V, VI, VII содержат более 2,14%С. При первичной кристаллизации таких сплавов происходит эвтектическое превращение, в процессе которого из жидкости, содержащей 4,3%С, образуется ледебурит – механическая смесь двух твердых фаз: аустенита и цементита.
В сплаве V кристаллизация начинается в точке 1 выделением аустенита из жидкого раствора и заканчивается в точке 2. При охлаждении в интервале между точками 1 и 2 состав аустенита изменяется по линии солидус, а концентрация углерода в жидкой фазе - по линии ликвидус. В точке 2 при 1147 ºC состав жидкости соответствует точке С, т.е. жидкость имеет концентрацию углерода, равную 4,3%С. Количественное соотношение жидкой и твердой фаз в точке 2 определяется соотношением отрезков Е и С. При 1147 ºC происходит эвтектическое превращение Жс↔АЕ + ЦF. При дальнейшем охлаждении в интервале 2-3 из аустенита, как структурно свободного, так и входящего в эвтектику (ледебурит), выделяется вторичный цементит. Состав аустенита изменяется по линии ES, т.е. от 2,14 до 0,8%С. В точке 3 происходит перлитное превращение аустенита, содержащего 0,8%С. Структура сплава V при комнатной температуре состоит из из перлита и ледебурита. Вторичный цементит и цементит ледебурита сливаются и практически не различимы.
В сплаве VI, содержащем 4,3%С, при эвтектической температуре вся жидкость превращается в ледебурит. При понижении температуры содержание углерода в аустените, входящем в ледебурит, понижается по линии ES. При 727 ºC происходит перлитное превращение аустенита.
В сплаве VII кристаллизация начинается с образования кристаллов цементита. Такой цементит называется первичным. Первичный цементит выделяется из жидкости при охлаждении в интервале температур 1-2. Состав жидкости при этом меняется по линии ликвидус и в точке 2 жидкость содержит 4,3%С. Количественное соотношение жидкой и твердой фаз в точке 2 определяется соотношением отрезков Е2 и С2. При 1147 ºC происходит эвтектическое превращение. Аустенит образовавшегося ледебурита при охлаждении испытывает превращения, рассмотренные выше. При комнатной температуре структура сплава VII состоит из ледебурита и первичного цементита.
На свойства сплавов оказывает большое влияние различие в размерах и расположении выделений цементита. Цементит первичный выделяется при высоких температурах непосредственно из жидкой фазы. Его кристаллы – крупные. Цементит вторичный выделяется из аустенита при достаточно высоких температурах и высокой скорости диффузии. Поэтому цементит вторичный образуется в виде сетки по границам зерен. Цементит третичный выделяется из феррита при сравнительно низких температурах обычно внутри зерен в виде дисперсных включений. Эти включения увеличивают прочность феррита.
Температуры, при которых происходят фазовые и структурные превращения в сплавах системы железо - цементит, т.е. критические точки, имеют условные обозначения.
Обозначаются буквой А (от французского arret - остановка):
А1 - линия PSK (7270С) - превращение П А;
A2 - линия MO (7680С, т. Кюри) - магнитные превращения;
A3 - линия GOS (переменная температура, зависящая от содержания углерода в сплаве) - превращение Ф → А;
A4 - линия NJ (переменная температура, зависящая от содержания углерода в сплаве) - превращение;
Acm - линия SE (переменная температура, зависящая от содержания углерода в сплаве) - начало выделения цементита вторичного (иногда обозначается A3).
Так как при нагреве и охлаждении превращения совершаются при различных температурах, чтобы отличить эти процессы вводятся дополнительные обозначения. При нагреве добавляют букву с, т.е , при охлаждении - букву r.
Сплавы системы железо-углерод по структурному признаку делят на две группы: углеродистые стали и белые чугуны.
Углеродистые стали содержат от нескольких сотых % до 2 %С и заканчивают кристаллизацию образованием аустенита.
Белые чугуны содержат более 2,14%С и заканчивают кристаллизацию образованием эвтектики – ледебурита.
Структура и свойства сталей. Влияние содержания углерода на механические свойства сталей. Понятие о хладноломкости.
Превращения в сталях при нагреве и охлаждении
Решетка: ГЦК(0.8)/ОЦК(0.02)/ромбоэдрич.(6.69) соответственно.
Превращение при нагреве П―›А вызывает изменение кристаллической решетки, из 2-х фаз образуется одна, возникает перераспределение углерода – превращение диффузионное.

Превращение при нагреве доэвтектоидной стали пойдет в 2 стадии:
Превращение при нагреве заэвтектоидной стали состава х2 идет также в 2 этапа:
Итог: превращения при нагреве любой стали завершается образованием аустенита, является диффузионным и сопровождается измельчением зерна.
(1) – природнокрупнозернистые стали;
(2) – природномелкозернистые стали (в сталь введены специальные добавки, которые тормозят рост зерна.
2.1. Перлитное превращение
Наблюдается в условиях медленного охлаждения или в условиях изотермической выдержки.
Рассмотрим сталь с содержанием С 0.8%, П[Ф+Ц]―›А. Решетка: ГЦК(0.8)/ОЦК(0.02)/ромбоэдрич.(6.69) соответственно.
При перлитном превращении фаза превращается в две новые, при этом изменяется тип кристаллической решетки и перераспределяется углерод.
1) превращение диффузионное.
| Выдержка при: | Структура |
| 650 ± 20˚С | Перлит |
| 600 ± 20˚С | Сорбит |
| 550 ± 20˚С | Тростит |
Ниже 550˚С перлитное превращение не протекает из-за замедления диффузии углерода.
2) пластинчатая, перлитообразная структура.
| НВ, МПа | Структура |
| Перлит | |
| Сорбит | |
| Тростит |
Твердость зависит от дисперсности смеси.
. 3) перлитное превращение начинается не сразу и протекает постепенно во времени.
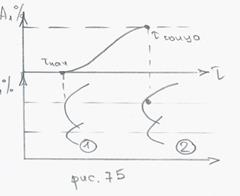
(1) – линия начала превращения;
(2) – линия конца превращения;
С–образная диаграмма превращения аустенита – диаграмма изотермического превращения переохлажденного аустенита.
2.2. Мартенситное превращение
При превращении получается мартенсит. Протекает в условиях быстрого превращения – нет времени на диффузию!
При мартенситном превращении из одной исходной фазы получается одна новая. При этом меняется тип решетки, но не происходит перераспределения углерода – бездиффузионное превращение.
Мартенситное превращение – бездиффузионная перестройка решетки, при которой каждый атом смещается на расстояние многим меньшее межатомного и сохраняет своих соседей.
Кристалл мартенсита растет путем направленного смещения группы атомов плоскости хорошего сопряжения решетки, см. рис. 77.
- 1-й атом смещается на расстояние, меньшее межатомного;
- i-й атом смещается на целое межатомное расстояние и рост данного кристалла прекращается.
Особенности строения мартенсита:
Мартенсит всегда состоит из особо мелких кристаллов
(1) – пластинок (пластинчатый мартенсит);
(2) – иголок (игольчатый)
Мартенсит всегда содержит столько же углерода, сколько было в аустените – он всегда сильно пересыщенный твердый раствор внедрения углерода в железо α.
Углерод находится на параллельных ребрах ячейки:
Мартенсит всегда содержит огромное количество дефектов:
~ 10 12 ГЦК (0.74) ―› ОЦК (0,68)
Дефекты фактически компенсируют разницу плотности укладки этих
1) крайне неравновесная фаза в сталях;
2) самая искаженная кристаллическая решетка;
3) max твердость;
4) min пластичность – чем больше углерода в стали, тем тверже Ме.
Мартенсит имеете самый большой удельный объем, при образовании мартенсита сталь увеличивается в объеме.
Условия получения мартенсита:
- нагреть до аустенитного состояния;
- быстро охладить, чтобы не было диффузионного перлитного превращения, Vкр – критическая скорость охлаждения,
охлаждать нужно со скоростью большей, чем Vкр;
- при непрерывном охлаждении полностью пройти мартенситный интервал температур, Мн – Мк,
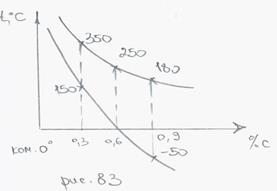
если не достигнута точка Мк, если %С > 0.6, то кроме мартенсита сохраняется остаточный аустенит.
2.3. Промежуточное (бейнитное) превращение
1) аустенит, обедненный углеродом, из него получают малоуглеродистый мартенсит;
2) аустенит, обогащенный углеродом, из него получается цементит.
Ммалоуглер + Ц = Бейнит.
Превращение это промежуточное:
- по температурному интервалу;
- есть элемент диффузии и бездиффузионный элемент превращения;
- по уровню твердости НВ ~ 5000 МПа (М ~ 6000 МПа, Т ~ 4000 МПа)
В зависимости от условий охлаждения возможны три варианта превращений аустенита с получением различных структур.
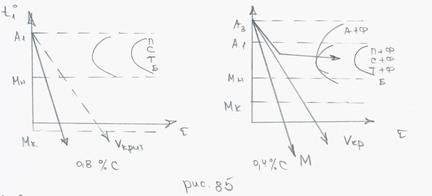
Диаграммы С-образные или изотермических превращений.
Для условия непрерывного охлаждения построены термокинетические диаграммы
Читайте также:
