Презентация металлы и неметаллы 11 класс
Обновлено: 02.07.2024
Металлы и неметаллы, нахождение соединений металлов и неметаллов в природе. Химические свойства металлов. Электрохимический ряд напряжений металлов.
Из 118 элементов, известных
в настоящее время, … являются металлами. Металлы и их соединения играют важную роль в минеральной и органической жизни Земли. Атомы и ионы металлов входят в состав важнейших соединений, участвующих в жизнедеятельности растений, животных и человека.
Металлы – это элементы, проявляющие в своих соединениях только положительные степени окисления, и в простых веществах которые имеют металлические связи
«Металлом называется твердое, непрозрачное и светлое тело, которое в огне плавится и холодное ковать можно». М.В.Ломоносов.
Положение металлов в Периодической системе элементов Д.И. Менделеева
В Периодической системе химических элементов Д.И. Менделеева металлы располагаются ниже диагонали бериллий – астат. Элементы, расположенные вблизи диагонали, например, бериллий, алюминий, титан, германий, сурьма обладают двойственным характером и относятся к металлоидам. Металлы располагаются в начале периодов, к ним относятся s-элементы 1 и 2 групп, р-элементы 13 группы, все, кроме бора, 14 группы: германий, олово, свинец, 15 группы: сурьма, висмут, а также все d- и f- элементы.
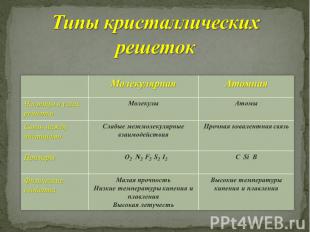
Металлы
Металлическая кристаллическая решетка
Металлическая связь
На внешнем уровне 1-3 электрона
Отдают внешние электроны, поэтому являются восстановителями
В периодах Ме свойства усиливаются
В группах Ме свойства усиливаются
Неметаллы – химические элементы, атомы которых принимают электроны для завершения внешнего энергетического уровня, образуя при этом отрицательно заряженные ионы. Электронная конфигурация валентных электронов неметаллов в общем виде — ns2np1−5 Исключение составляют водород (1s1) и гелий (1s2), которые тоже рассматривают как неметаллы.
Неметаллы обычно обладают большим спектром степеней окисления в своих соединениях. Большее число электронов на внешнем энергетическом уровне по сравнению с металлами определяет их большую способность к присоединению электронов и проявлению высокой окислительной активности.
Положение неметаллов в Периодической системе Д.И. Менделеева
Если в Периодической системе мысленно провести диагональ от бериллия к астату, то в правом верхнем углу таблицы будут находиться элементы-неметаллы. Среди неметаллов есть s-элемент – водород; р-элементы бор; углерод, кремний; азот, фосфор, мышьяк, кислород, сера, селен, теллур, галогены и астат. Элементы VIII группы – инертные (благородные) газы, которые имеют полностью завершенный внешний энергетический уровень и их нельзя отнести ни к металлам, ни к неметаллам.
Руды – природные соединения металлов.
Вследствие высокой активности большинство металлов в природе встречается в соединениях. Только металлы малой химической активности (Cu,Ag,Hg,Au,Pt) встречаются в природе в свободном состоянии, в виде вкраплений в горные породы или в результате разрушения горных пород в россыпях (золотоносный песок). Иногда эти металлы встречаются в значительных россыпях – самородки.
В природе металлы образуют соединения с различными окислителями и по этому признаку классифицируют руды.
Оксидные руды.
Fe2O3 - гематит,
Fe2O3 • H2O - гетит
Al2O3 - боксит
TiO2 – рутил.
Карбонатные – легко переходят в оксидные, разлагаясь при нагревании:
CaCO3- Мрамор, мел, известняк;MgCO3- магнезит,CuCO3•Cu(OH)2малахит.
Силикатные и алюмосиликатные.
Полевой шпат ортоклаз K2O•Al2O3•6SiO2, каолинитAl2O3•2SiO2•2H2O, берилл 3BeO•Al2O3•6SiO2. Очень трудно поддаются переработке. Из них добывают только те металлы, которые не встречаются в других соединениях.
Сульфидные.
FeS2– железный колчедан,Cu2S•FeS2– медный колчедан,PbS– свинцовый блеск,ZnS– цинковая обманка. Обычно сульфидные руды содержат несколько металлов.
Галидные.
NaCl- каменная или поваренная соль,KCl- сильвин,KCl•MgCl2•6H2O– карналлит.
Нахождение неметаллов в природе
Неметаллы находятся в земной коре (в большинстве своем кислород и кремний — 76 % от массы земной коры а также As, Se, I, Te, но в очень незначительных количествах), в воздухе (азот и кислород) , в составе растительной массы (98,5 % — углерод, водород, кислород, сера, фосфор и азот), а также в основе массы человека (97,6 % — — углерод, водород, кислород, сера, фосфор и азот). Водород и гелий – входят в состав космических объектов, включая Солнце. Чаще всего в природе неметаллы встречаются в виде соединений.
Химические свойства
Взаимодействуют с кислородом
Взаимодействуют с неметаллами
Взаимодействуют с галогенами
Взаимодействуют с водородом
Взаимодействуют с кислотами
Взаимодействуют с солями
Взаимодействуют с оксидами
Взаимодействуют с водой
Презентация по химии по теме "Металлы и неметаллы"

Неметаллы, химические элементы, которые образуют простые тела, не обладающие свойствами, характерными для металлов. К неметаллам относятся 22 элемента. Только два неметалла — углерод и сера — были известны в древности. В 13 в. был получен мышьяк, в 17 в. открыты водород и фосфор, в конце 18 в. — кислород, азот, хлор, теллур. В 1789 А. Л. Лавуазье включил эти неметаллы в список простых веществ (кроме хлора, который тогда считали окисленной соляной кислотой). В 1-й половине 19 в. были получены бром, иод, селен, кремний, бор. Изолировать фтор и открыть инертные газы удалось лишь в конце 19 в. Астат получен искусственно в 1940.

Положение неметаллов в ПС
Неметаллы находятся в верхнем правом углу ПС над диагональю В – Аt.
Расположены в главных подгруппах 4 - 8 групп.

Особенности строения атомов неметаллов
на внешнем уровне имеют от 4 до 8 электронов
- небольшой радиус атомов
- стремятся принять электроны
- характерные связи: ионная и ковалентная

Физические свойства
Агрегатное состояние.
Твердые вещества: бор, углерод, кремний, фосфор, сера, мышьяк, селен, теллур, йод, астат;
Жидкости: бром – красно – бурая жидкость с тяжелым неприятным запахом;
Газы: водород, азот, кислород, фтор, хлор и инертные газы.
Особыми являются инертные или благородные газы. Инертные газы не имеют цвета и запаха. И являются одноатомными. Инертные газы считаются благородными. Обладают более высокой электропроводностью (по сравнению с другими) и, при прохождении через них тока, ярко светятся.
Неон - огненно красным светом.
Гелий - ярко-жёлтым светом.
Аргон – синим светом.
Криптон – светло- желтым светом.
Ксенон – фиолетовым светом.

Несмотря на свою инертность, эти газы находят широкое применение:
- гелием заполняют воздушные шары и дирижабли.
- неон применяется для световой рекламы.
- аргон в качестве защитной среды при сварке (дуговой, лазерной, контактной и т. п.) как металлов, так и неметаллов.
Все указанные неметаллы (водород, кислород, азот, фтор и хлор) имеют двухатомные молекулы. Водород, кислород и азот бесцветны, фтор имеет светло – зеленый цвет, хлор – желто – зеленый.
б) Не имеют металлического блеска (исключение – графит, йод)
в) Большинство не проводят электрический ток (кроме кремния и графита)
г) Хрупкие.

Синквейн
Напишите синквейн на тему «Неметаллы». Работаем в группах по 4 человека. Зачитать.
Синквейн – пятистрочие
В первой строчке тема называется одним словом (обычно существительным).
Вторая строчка – это описание темы в двух словах (двумя прилагательными).
Третья строчка – это описание действия в рамках этой темы тремя словами.
Четвертая строчка – это фраза из четырех слов, показывающая отношение к теме.
Последняя строка – это синоним из одного слова, который повторяет суть темы.
Напишите синквейн на тему «Неметаллы».
Синквейн на тему «Неметаллы».
Неметаллы
самородные, связанные
проявляют, присоединяют, образуют
имеют ковалентную природу строения
элементы
Рабочие листы и материалы для учителей и воспитателей
Более 3 000 дидактических материалов для школьного и домашнего обучения
Презентация "Неметаллы"
презентация к уроку по химии (11 класс) на тему
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Подписи к слайдам:
Урок по теме НЕМЕталлы Разработчик: Черникова Татьяна Александровна преподаватель государственного бюджетного профессионального образовательного учреждения Воронежской области «Павловский техникум»
Цели урока Создание условий для 1) формирования у учащихся знаний неметаллах, положении химических элементов неметаллов в ПСХЭ, особенностей строения их атомов, окислительных способностях неметаллов, о внешнем виде простых веществ неметаллов, их физических и химических свойствах, о закономерностях изменений свойств неметаллов с увеличением порядкового номера, о способах их получения; 2) формирования у учащихся умений определять и описывать положение неметаллов в ПСХЭ, отличать металлы и неметаллы по физическим свойствам, классифицировать вещества с точки зрения строения внешних электронных оболочек, сопоставлять научное и реальное; 3) совершенствования навыков анализировать экспериментальные данные, составлять уравнения химических реакций, находить закономерности в изменении свойств веществ, строить речевое высказывание, находить и использовать нужную информацию в учебнике. 4) формирования личностных результатов – химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами.
Задачи урока 1) ознакомить учащихся с понятием о неметаллах; 2) использовать знания о строении атома, чтобы изучить особенности строения атомов неметаллов, их окислительных способностей; 3) проследить закономерности изменения свойств неметаллов в соответствии с положением в ПСХЭ; 4) продолжить формирование навыков составления химических уравнений; 5) ознакомить учащихся с внешним видом веществ неметаллов путем демонстрации образцов; 6) сравнить физические свойства неметаллов и металлов; 7) узнать основные способы получения неметаллов ; 8 ) закрепить полученные знания.
План урока Организационный момент Актуализация знаний Определение темы и целей урока Изучение нового материала Закрепление знаний Домашнее задание
Неметаллы – это химические элементы, атомы которых принимают электроны для завершения внешнего энергетического уровня, образуя при этом отрицательно заряженные ионы Особенности неметаллов: - элементов-неметаллов всего 16 - кислород и кремний составляют 75 % земной коры - С, Н, О, S , Р, N – элементы жизни - гелий и водород – элементы Вселенной - кислород и водород составляют воду
Строение атомов неметаллов Атом водорода Атом углерода Атом серы Атом азота Атом хлора Атом кислорода
Найдите неметаллы и назовите их
Чем правее и выше стоит элемент в псхэ , тем ярче выражены его неметаллические свойства Показатель В периоде: В группе: заряд ядра радиус атома число электронов на внешнем энергетическом уровне электроотрицательность окислительные свойства неметаллические свойства
Степень окисления Степень окисления соответствует числу электронов , которое следует присоединить к положительному иону , чтобы восстановить его до нейтрального атома, или отнять от отрицательного иона , чтобы окислить его до нейтрального атома
Определите степени окисления неметаллов в соединениях Укажите какие из оксидов являются высшими для данных неметаллов, а какие – низшими
Способность присоединять электроны обусловливает окислительные свойства неметаллов Окислительные свойства неметаллов проявляются в первую очередь при их взаимодействии с металлами Неметаллы (кроме фтора) могут проявлять и восстановительные свойства. В образующихся соединениях они имеют положительную степень окисления
1 группа NH 3 H 2 SO 4 Al(NO 3 ) 3 . CH 3 CH 2 OH 2 группа FeCl 3 H 2 CO 3 Fe 2 (SO 4 ) 3 C 6 H 5 Cl Определите степени окисления в веществах 3 группа P 2 S 5 HNO 3 Na 2 SO 4 CH 3 COOH 4 группа H 2 S H 3 PO 4 CH 3 Cl Na 2 CO 3
Химические свойства неметаллов Используя учебник на странице продолжите уравнения, расставьте стехиометрические коэффициенты и степени окисления Окислительные свойства Восстановительные свойства 1. Взаимодействие с металлами-восстановителями Na + S = 2. Взаимодействие с водородом (с образованием летучих соединений): Н 2 + S ↔ 3. Взаимодействие с неметаллом с меньшей электроотрицательностью Р + S = 4. Взаимодействие со сложными веществами: FeCl 2 + Cl 2 → 1. Взаимодействие с фтором (фтор – всегда окислитель) S+F 2 = 2. Взаимодействие с кислородом: S+O 2 → 3. Взаимодействие со сложными веществами-окислителями: Н 2 +С uO →
Большинство неметаллов могут выступать в химических реакциях как в роли восстановителя , так и в роли окислителя (восстановительные свойства неприсущи только фтору)
Получение неметаллов Выпишите в тетрадь из учебника на странице 122 основные способы получения неметаллов
Задание для закрепления материала Перед вами на партах находятся задания для закрепления и проверки усвоения материала по теме «Неметаллы». После выполнения заданий п оменяйтесь тестом с соседом и проверьте тест вместе со мной. Система оценивания проверочной работы по теме «Неметаллы» Верное выполнение заданий блока А с установлением соответствия оценивается 1 баллом за каждое правильно указанное соответствие. Максимальное количество набранных баллов – 10. Верное выполнение каждого задания Блока Б, т.е. заданий с выбором ответа, оценивается одним баллом. Максимальное количество набранных баллов – 10. Оценка работы по пятибалльной шкале определяется на основе суммарного числа баллов, полученных за выполнение заданий: «5» - 17-20 баллов «4» - 12-16 баллов «3» - 7 - 11 баллов «2» - 1 – 6 баллов
Домашнее задание Разработайте 10 тестовых заданий по теме: « Аллотропные модификации углерода, олова и кислорода» Для выполнения задания используйте учебники - Габриелян О.С. Химия: учеб. для студ. проф. учеб. заведений / О.С. Габриелян – М: Просвещение, 2007.- 254 с. - Габриелян О.С. Химия 11 класс. Базовый уровень: учеб. для общеобразоват . учреждений / О.С. Габриелян – М.: Дрофа, 2014. - 224 с. - Рудзитис Г.Е. Химия 11 класс: учебник для общеобразоват . учреждений / Г.Е. Рудзитис, Ф.Г. Фельдман - М.: «Просвещение», 2011. - 159 с.
Презентация на тему: Неметаллы 11 класс

№ слайда 1
Неметаллы Выполнил ученик 11 В класса Хугаев Эрик

№ слайда 2
Неметаллы Неметаллы - химические элементы с типично неметаллическими свойствами

№ слайда 3
Положение неметаллов в таблице Менделеева Неметаллы занимают правый верхний угол Периодической Системы Химических Элементов (ПСХЭ). Также к неметаллам относят водород (Н) и гелий (Не)

№ слайда 4
Особенности атомного строения неметаллов Небольшой атомный радиус На внешнем уровне 4-8 электронов Располагаются только в главных подгруппах Характерно высокое значение ЭО (электроотрицательности)

№ слайда 5
№ слайда 6
Типы кристаллических решеток

№ слайда 7
Химические свойства неметаллов Преобладают окислительные свойства: В соответствии с численными значениями относительной ЭО окислительные способности неметаллов увеличиваются в следующем порядке: Si B H2 P C S I2 N2 Cl2 O2 F2

№ слайда 8
Химические свойства неметаллов Проявляют также восстановительные свойства: Восстановительные свойства постепенно возрастают от кислорода к кремнию: O2 Cl2 N2 I2 S C P H2 B Si

№ слайда 9
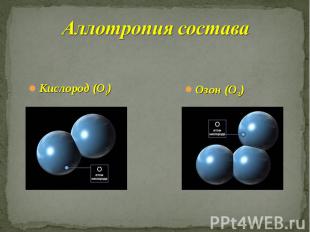
Аллотропия Аллотропия – это способность атомов одного химического элемента образовывать несколько простых веществ

№ слайда 10
Причины аллотропии Различный состав молекул простого вещества (аллотропия состава) Способ размещения атомов или молекул в кристаллической решётке (аллотропия формы)
№ слайда 11

№ слайда 12

№ слайда 13
Презентация по химии "Неметаллы" (11 класс)

В чем горят дрова и газ,
Фосфор, водород, алмаз?
Дышит чем любой из нас
Каждый миг и каждый час?
Без чего мертва природа?
Правильно, без …
КИСЛОРОДА
В воздухе он главный газ,
Окружает всюду нас.
Угасает жизнь растений
Без него, без удобрений.
В наших клеточках живет
Важный элемент …
АЗОТ
Удивить готов он нас -
Он и уголь, и алмаз,
Он в карандашах сидит,
Потому что он — графит.
Грамотный народ поймет
То, что это …
УГЛЕРОД

Абдуллина Миляуша Альбертовна
учитель химии и биологии МБОУ СОШ с.Урмиязы

Цель урока: систематизировать знания об элементах и простых веществах – неметаллах.
Задачи: развивать умения учащихся сравнивать,анализировать,систематизировать знания о неметаллах, воспитывать умения работать в паре.


НЕМЕТАЛЛЫ - это химические элементы, для атомов которых характерна способность принимать электроны до завершения внешнего уровня.
В главной подгруппе:
число электронов на внешнем слое не изменяется
радиус атома увеличивается
электроотрицательность
уменьшается
окислительные свойства
уменьшаются
-НЕМЕТАЛЛИЧЕСКИЕ свойства УМЕНЬШАЮТСЯ
В периоде:
радиусы атомов уменьш.
- число электронов на
внешнем слое уменьш.
- электроотрицательность
увеличивается
окислительные свойства
увеличиваются
- НЕМЕТАЛЛИЧЕСКИЕ
свойства
УВЕЛИЧИВАЮТСЯ


Особенности атомного строения неметаллов
Небольшой атомный радиус
На внешнем уровне 4-8 электронов
Располагаются только в главных подгруппах
Характерно высокое значение ЭО

Установите соответствия между элементами и степенями окисления
4573621


Агрегатное состояние
Газы
Не, N2, Н2,
Cl2, O2, O3
Жидкие
Твердые
Br2
I2, P4, C,
Si, B, S8


Цвет неметаллов
БЕЛЫЙ
ЧЕРНЫЙ
ФОСФОР
ФОСФОР
ГРАФИТ
ЖЕЛТО-ЗЕЛЕНЫЙ
ХЛОР

Температура плавления
3 8000 С – у графита

Типы кристаллических решеток

Аллотропия
Разное типы кристаллических решеток
Р - фосфор
Красный фосфор - атомная
Белый фосфор - молекулярная

Аллотропия
Разная структура кристаллических решеток
С - углерод
Тетраэдр
Слоистая

Аллотропия серы. Кристаллическая, пластическая и моноклинная

Аллотропия
Разный состав молекул
О - кислород
Кислород
Озон

ХИМИЧЕСКИЕ СВОЙСТВА НЕМЕТАЛЛОВ
Окислительные свойства простых веществ:
Реагируют с металлами
2Fe + 3 Cl₂⁰ = 2 FeCl⁻₃
Реагируют с водородом
3N₂⁰ + H₂ = 2N⁻³H₃
Реагируют с неметаллами с более низким значением электроотрицательности
2P⁰ + 5S⁰ = P₂⁺⁵S₅⁻²
4) Реагируют с некоторыми сложными веществами
C⁻⁴H⁺₄ + 2 O⁰₂ = C⁺⁴O₂⁻² + 2 H₂⁺O⁻²

Восстановительные свойства неметаллов
( простых веществ):
Со фтором все восстановители
2) С кислородом
Si⁰ + O₂ = Si⁺⁴O₂
3) Со сложными веществами-окислителями
Например - H₂, C
3C⁰ + 2Fe₂O₃ = 3C⁺⁴O₂ + 4Fe

НЕМЕТАЛЛЫ
реагируют с кислотами окислителями (H2SO4(конц) и HNO3 )
неМе + H2SO4(конц) = к-та(max c.o.) + SO2 + H2O
C + H2SO4(конц) =
P + H2SO4(конц) =
S + H2SO4(конц) =
HNO3 окисляет неМе до соответствующих кислот
у HNO3 (конц) азот восстанавливается до NO2
у HNO3 (разб) азот восстанавливается до NO
С Si реагирует только HNO3 (разб)

галогены (кроме фтора) и сера при взаимодействии со щелочами
S + KOH =
Cl2 + NaOH(на холоду) =
Cl2 + NaOH(при нагревании) =
хлор и бром при взаимодействии с водой образуют смесь кислот
Cl2 + H2O = HClO + HCl

Закрепление материала
1.Задана следующая схема превращений веществ:
x y
N2→ Mg3N2→ NH3
Определите, какие из указанных веществ являются веществами X и Y.
1) Mg(OH)2
2) Mg
3) MgO
4) HCl
5) H2O
(25)

2. Установите соответствие между простыми веществами и формулами реагентов, с которыми они могут взаимодействовать:
А) Ca1) Fe, H2SO4, Cl2
Б)S2) Na, Cl2, CuO
В) O23) HCl, H3PO4, Cu
Г) H24) H2O, HCl, Br2
5) Fe, P, CH4
(4152)
3. Из предложенного перечня выберите два вещества, которые реагируют с серой и азотом.
1) H2O
2) Mg
3) H2SO4 (конц.)
4) Li
5) KOH раствор
(24)

4.Установите соответствие между названием простого вещества и реагентами, с каждым из которых оно может взаимодействовать:
ПРОСОЕ ВЕЩЕСТВО РЕАГЕНТ
А) Br2 1) CuSO4, HCl, Cl2
Б) H2 2) NaOH, HI, Al
В) Fe 3) Mg, P, CuS
Г)O2 4) SO2, CO2, CaO
5) N2, Cl2, CuO
(2513)
5.Из предложенного перечня веществ выберите два вещества, с каждым из которых может реагировать углерод.
1) йодид калия (р-р)
2) уксусная кислота
3) углекислый газ
4) концентрированная соляная кислота
5) оксид олова (IV)
(35)

6. Кремний сожгли в атмосфере хлора. Полученный хлорид обработали водой. Выделившийся при этом осадок прокалили. Затем сплавили с фосфатом кальция и углём. Составьте уравнения четырёх описанных реакций.
7.Задана следующая схема превращений веществ:
x y
S→ H2SO4→ SO2
Определите, какие из указанных веществ являются веществами X и Y.
1) O2
2) Na2SO3
3) HNO3
4) Cu(OH)2
5) H2O

СПАСИБО ЗА ВНИМАНИЕ!
Домашнее задание: §19 , выполнить задания ЕГЭ (8,9,10).
Читайте также:
