Презентация простые вещества металлы 8 класс габриелян
Обновлено: 28.09.2024
Данная презентация может быть полезна при изучении темы "Простые вещества металлы" в 8 , а также при повторении в 9 классе.
| Вложение | Размер |
|---|---|
| prostye_veshchestva_me.pptx | 1 МБ |
Подтяните оценки и знания с репетитором Учи.ру
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Подписи к слайдам:
Простые вещества Металлы Работу выполнила Круглова И.А. учитель химии МОУ « Глажевская СОШ » Киришского р-на Ленинградской обл.
Цели урока: Повторить особенности строения атомов металлов и металлическую химическую связь Познакомить с общими физическими свойствами металлов Дать понятие об аллотропии
содержание Положение металлов в Периодической системе Д.И.Менделеева особенности строения атомов металлов металлическая химическая связь общие физические свойства металлов понятие аллотропии на примере олова проверим знания
Положение в Периодической системе Д.И.Менделеева Из 110 элементов – 88 металлы Li B Ниже диагонали B –At и элементы побочных подгрупп Fr At
Особенности строения атомов металлов 1-3 е на внешнем уровне большой R a Ме 0 – n е Ме + n
Химическая связь Металлическая в металлах и сплавах Ионная между ионами металла и неметалла
Общие физические свойства металлов Твердость Электропроводность Теплопроводность Металлический блеск Ковкость и пластичность Звон Цвет
Общие физические свойства металлов 1. Твердость ( кроме Hg ) Ртуть- жидкий металл Самый твердый - хром Cr ( царапает стекло) Мягкие – щелочные металлы Li , Na , K , Rb , Cs
2.Электропроводность и теплопроводность Ag Cu Au Al Mg Zn Fe Pb Hg Электропроводность уменьшается Хорошие проводники Ag Cu Au Al Плохие - Pb Hg
3.Металлический блеск Самый блестящий- Hg Венецианские зеркала Менее блестящий- А g Современные зеркала
4.Ковкость и пластичность Наиболее пластичные металлы- Au Ag Cu Sn Pb Zn Подсвечники из золота Очень хрупкие- Cr Mn Хром
5.Звон Самые звонкие- Ag Cu Au Царь-колокол
6.Цвет Черные – Fe и сплавы Чугунная решетка Цветные среди них драгоценные Au Ag Pt Золотые яйца работы К.Фаберже
Аллотропия олова Белое олово b- Sn (металл) Серое олово a- Sn (неметалл)
Отгадайте фамилию русского ученого, который сказал: «Металлом называется светлое тело, которое ковать можно». Ломоносов
Проверим знания: Вариант 1 1. Какие свойства подчеркивал М. В. Ломоносов, характеризуя металлы как "светлые тела, которые ковать можно"? Выберите правильный ответ: а) теплопроводность, б) обычно серый цвет с металлическим блеском, в) электрическую проводимость, г) пластичность. 2. Выберите самый пластичный драгоценный металл: а) золото, б) серебро, в) платина. 3. Причина электрической проводимости металлов заключается в характерном для них строении: а) наличие в узлах кристаллической решетки ионов, б) наличие в узлах кристаллической решетки атомов, в) присутствие подвижных обобществленных электронов. Вариант 2 1. Как на практике используют пластичность металлов? Выберите правильный ответ: а) делают зеркала, б) используют в качестве проводника электрического тока, в) выковывают изделия разной формы, . г) прокатывают в листы, д ) производят легкие сплавы для конструирования самолетов, ракет, е) вытягивают в проволоку. 2. Выберите самые электропроводные металлы: а) золото, б) серебро, в) натрий, г) железо, д ) медь е) марганец ж) алюминий з ) магний Буквы ответа расположите в порядке убывания электропроводности металлов. 3. Причина пластичности металлов заключается в их строении: а) присутствие подвижных обобществленных электронов, б) наличие в узлах кристаллической решетки ионов, в) наличие в узлах кристаллической решетки атомов.
Открытый урок по химии "Простые вещества - металлы" конспект + презентация
презентация к уроку по химии (8 класс) на тему
Материал содержит конспект и презентацию открытого урока по химии в 8 классе по программе Габриелян О.С.
| Вложение | Размер |
|---|---|
| konspekt_otkrytogo_uroka_po_himii.doc | 92.5 КБ |
| prostye_veshchestva_-_metally.ppt | 744 КБ |
Предварительный просмотр:
МКОУ «Нестеровская ООШ»
Открытый урок по химии в 8 классе по теме:
«Простые вещества – металлы»
Разработала учитель биологии, химии и географии
Белова Римма Евгеньевна
- повторение особенностей строения атомов элементов-металлов и образования металлической связи
- усвоение знаний о физических свойствах металлов и их применении в хозяйстве.
- образовательные: систематизировать сведения о строении атомов элементов-металлов, изменении металлических свойств в периодах и главных подгруппах таблицы Д. И. Менделеева, структуре кристаллической решетки; изучить физические свойства простых веществ – металлов и их значение;
- воспитательные: создать условия для повышения познавательной активности учащихся, развивать коммуникативные навыки, воспитывать позитивное отношение к химии, критическое отношение к оценке знаний;
- развивающие: создать условия для развития универсальных учебных действий: а) познавательных : постановка и решение проблемы, действия со знаково-символическими средствами, умение работать с информацией, анализ, установление причинно-следственных связей, доказательство суждений;
б) личностных : соотношение цели действия и его результата, ориентация в межличностных отношениях; в) коммуникативных: умение грамотно выражать свои мысли, постановка вопросов, сотрудничество в паре, ведение диалога; г) регулятивных: целеполагание, планирование, определение последовательности действий, контроль, коррекция, оценка, саморегуляция.
Тип урока – урок «открытия» новых знаний.
Оборудование: коллекция металлов, изделия из металлов, лоток для лабораторных опытов, карточки с заданиями, инструктивная карта лабораторной работы, учебник «О. С. Габриелян, Химия, 8 класс», презентация «Простые вещества – металлы», интерактивная доска, цифровые ресурсы ФЦИОР.
- Организационный момент.
- Ознакомление с темой и целью урока.
- Планирование урока.
- Актуализация знаний.
- Изучение физических свойств металлов и установление взаимосвязи между ними и применением металлов.
- Закрепление.
I. Учитель: Здравствуйте! Сегодня мы начинаем путешествие по увлекательному миру веществ. Но для начала нам необходимо определить первый пункт назначения и маршрут. ( На электронной доске – слайд №2 )
А для этого попробуйте отгадать загадку Слайд 3
Пахать и строить – все он может
Если огонь ему поможет
Отгадка лежит у меня на столе. (Демонстрация изделий из металлов: гвоздя, ложки, кольца, проволоки).
Учитель. Совершенно верно, сегодня мы будем говорить о металлах. Слайд 4
Напомните, пожалуйста, к какой группе веществ относятся металлы?
Учащиеся: Металлы относятся к простым веществам.
Учитель: Какие вещества называют простыми?
У чащиеся: Простыми называют вещества, состоящие из атомов одного химического элемента.
Учитель: Давайте сформулирует тему нашего урока: «Простые вещества – металлы» Слайд 4
Итак, мы определили станцию, но как же до нее добраться? Нам необходимо составить план изучения данной темы.
У вас на партах лежат карточки с заданиями ( Приложение 1 ). Ознакомьтесь с ними, пожалуйста, но не заполняйте.
Учащиеся предлагают этапы освоения нового материала. Слайд 5
- 1. Повторить особенности строения металлов и металлической связи.
- 2. Познакомиться с общими физическими свойствами металлов.
Учитель: Итак, повторим особенности строения атомов металлов и связи, которая для них характерна, а на основании знаний о связи познакомимся с физическими свойствами металлов. Слайд 6
- В главных подгруппах правее и выше линии «B – At» – неметаллы; левее и ниже – металлы. Элементы, оказавшиеся вблизи этой линии, проявляют переходные свойства.
- В побочных подгруппах находятся только металлы.
Учитель вызывает трех учеников к доске с заданием записать электронные и графические формулы для атомов натрия, магния и алюминия.
Задание для всего класса – проверить правильность выполнения задания.
На основе схем, записанных на доске, ученики формулируют вывод
Слайд 6 продолжение
- Для металлов характерно небольшое число электронов на внешнем энергетическом уровне (1-3).
- При образовании химических связей атомы металлов отдают внешние электроны, а атомы неметаллов их захватывают.
Учитель: Вспомните, ребята, как изменяются свойства атомов химических элементов в периоде? в группе?
Ответы учащихся. Слайд 7
Учитель : Какая связь образуется между атомами элементов-металлов? В чем ее особенность? Слайд 8
Учащиеся: Между атомами элементов-металлов образуется металлическая связь. Её особенность заключается в том, что она образована атом-ионами посредством обобществленных электронов.
- Учитель : Эта важнейшая особенность образования металлической связи является основной причиной особенных физических свойств металлов. Слайд 9
Видеосюжет Интернет-ресурса ФЦИОР «Физические свойства металлов».
Учитель : Какие физические свойства обуславливает наличие свободных электронов.
Учитель: А теперь давайте познакомимся с физическими свойствами металлов на практике. Для этого проведём лабораторную работу. Работаем по инструктивной карте. ( Приложение 2 ).Время – 5 минут.
Запись свойств в тетрадь: Слайд 10
- Металлический блеск.
- Непрозрачность.
- Цвет у большинства металлов светло-серый, исключения: медь – красновато-оранжевого, золото – желтого, цезий – светло-желтого цвета.
- Твердость (исключение: ртуть – жидкий металл).
- Пластичность.
- Теплопроводность.
- Электропроводность.
- Плотность и температура плавления различны.
Учащиеся проводят анализ рис.45 в учебнике (с.83).
Учитель: На основании всего вышесказанного можно сделать вывод: Металлы – это ковкие, пластичные вещества, которые имеют металлический блеск, тепло- и электропроводны.
А как вы думаете, зачем нам нужны знания о металлах?
Учащиеся предлагают варианты ответа.
Учитель: Вышеперечисленные физические свойства явились причиной широкой области применения металлов. Слайд 11
VI. Учитель : Вернёмся к тестам – карточкам. Выполните задания согласно инструкции. (Работа с тестами) Передайте для проверки соседу по парте. Оцените работы, подпишите и сдайте мне.
Я предлагаю вам послушать химическую сказку.
В одном Менделеевском царстве, периодическом государстве в семиэтажном дворце поселились коренные жители. Называли их в зависимости от местожительства в занимаемых комнатах.
Впрочем, догадайтесь сами. Одни жители в этом дворце были бедны, но беспечны. Хотя в карманах у большинства из них было мало монет, никто не горевал по этому поводу. Если же заводилась хоть одна лишняя монета, то характер их портился, они становились агрессивными и даже опасными, поэтому скорее хотели от неё избавиться, чтобы стать опять добрыми и веселыми.
Другие жители - «знать» этой страны отличалась от простых граждан своей скупостью. Свои монеты они неохотно одалживали и при малейшей возможности стремились забрать еще. Не смотря на разное материальное благополучие – бедные жители и знать были уверенны в себе и жили под девизом «мой дом - моя крепость».
Кем были жители этого Менделеевского царства?
Ответы учащихся: Металлы и неметаллы .
VII. Учитель : Наш урок подходит к концу.
На заключительном этапе предлагаю дать оценку уроку. Продолжите, пожалуйста, фразу: Слайд 12
Сегодня на уроке я узнал……
Было интересно, потому что…..
На уроке мне не понравилось…
VIII. Запись домашнего задания.
Учитель: Всем спасибо за работу. Д. И. Менделеев сказал: «Жить- это значит узнавать!» ( слайд № 15 ). Стремитесь к новым знаниям, открытиям и победам. Всего хорошего, до свидания!
1. У металлов на внешнем энергетическом уровне …………..электрона.
2. У всех металлов имеется ………………………….блеск.
3. Все металлы по агрегатному состоянию…………………………………. за исключением……………..
4. Все металлы……………………………цвета, за исключением металлов …………….
5. Все металлы проводят……………………………….
6. Общность физических свойств металлов объясняется наличием у них………………связи.
7. Определите тип химической связи:
Инструктивная карта по выполнению лабораторной работы
"Физические свойства металлов"
Лабораторная работа «Физические свойства металлов»
Цель: Познакомиться с физическими свойствами металлов.
Оборудование: Лоток с набором образцов металлов, алюминиевая проволока, медная проволока.
- Рассмотрите образцы металлов и определите есть ли у них блеск. Зафиксируйте результат.
- Определите являются ли образцы металлов прозрачными. Результат занесите в таблицу.
- Внимательно рассмотрите все образцы и установите: твердыми или жидкими являются металлы. Зафиксируйте результат.
- Рассмотрите образцы металлов и определите цвет каждого из них. Зафиксируйте результат.
- Несколько раз перегните образцы алюминия и меди и установите, пластичны ли они? Зафиксируйте результат.
- Определите из жизненного опыта тепло и электропроводность алюминия и меди Результат занесите в таблицу.
Презентация к уроку по химии в 8 классе Подготовила учитель химии МКОУ «Нестеровская ООШ» Белова Римма Евгеньевна Простые вещества - металлы
Загадка: Пахать и строить, всё он может, если огонь ему поможет.
Тема урока: Простые вещества – металлы
План изучения темы. 1. Повторить особенности строения металлов и металлической связи. 2. Познакомиться с общими физическими свойствами металлов. Выяснить значение металлов.
В главных подгруппах правее и выше линии « B – At » – неметаллы; левее и ниже – металлы. Элементы, оказавшиеся вблизи этой линии проявляют переходные свойства. В побочных подгруппах находятся только металлы. Для металлов характерно небольшое число электронов на внешнем энергетическом уровне (1-3) и электроотрицательность ниже 2. При образовании химических связей атомы металлов отдают внешние электроны, а атомы неметаллов их захватывают.
Группы элементов Увеличение Числа электронов на последнем уровне Радиуса атома Неметаллических свойств Способности принимать электроны (окислительные свойства) У в е л и ч е н и е Числа уровней Радиуса атома Металлических свойств Способности отдавать е
Физические свойства металлов.
Металлический блеск Непрозрачность Цвет у большинства металлов светло-серый, исключения: медь – красновато-оранжевого, золото – желтого, цезий – светло-желтого цвета Твердость (исключение: ртуть – жидкий металл) Пластичность Теплопроводность Электропроводность Плотность и температура плавления различны
ВЫВОД: Металлы – это ковкие, пластичные вещества, которые имеют металлический блеск, тепло- и электропроводны.
Применение металлов Изготовление проводников Получение сплавов Ядерная энергетика Производство ювелирных украшений Машино-строение Изготовление посуды, инструментов Изготовление строймате-риалов Электро-ника
Продолжите фразу : Сегодня на уроке я узнал…… Было интересно, потому что….. На уроке мне не понравилось…
Домашнее задание: § 14 Сборник задач: №№357, 358, 362-364. Составить кроссворд на тему «Простые вещества – металлы»
Презентация по химии на тему "Простые вещества - металлы" (8 класс)

«Оловянная чума»
Роберт Скотт
(англ.),
полярный исследователь
Весной 1912 года погибла экспедиция Р.Скотта к Южному полюсу. Причина гибели – «оловянная чума». Экспедиция осталась без горючего из-за того, что топливо просочилось из запаянных оловом баков, поражённых «оловянной чумой»
При t=-33°С белое олово максимально быстро переходит в серое

«Оловянная чума»
Наполеон Бонапарт
Возможно «Оловянная чума» как на одна из причин поражения армии Наполеона в России в 1812 г. — рассыпались оловянные пуговицы на мундирах.
При t=-33°С белое олово максимально быстро переходит в серое

«Оловянная чума»
Музей
А.В. Суворова
г. С-Петербург
«Оловянная чума» погубила ценнейшие коллекции оловянных солдатиков. В петербургском музее А.Суворова, в подвале, где они хранились, лопнули зимой батареи отопления.
При t=-33°С белое олово максимально быстро переходит в серое

Агрегатное состояние – твердые в-ва
искл.:
От сереблисто-белого до темно-серого, искл. Au (желтый) и Cu (красно-коричневый).
Цвет
Электро- и теплопроводность
Причина – относительно
свободные е
_
Hg – жидкий металл

Как правило пластичные (Au, Ag, Cu, Al и др.), искл. Sn (серое),
Твердые (Cr, Fe) и мягкие (Au, Na, K).
Изменяется в широком интервале
Самая высокая:
Tпл.(W)= +3380°С
Самая низкая?
Tпл.(Hg)= − 38,8°С
Пластичность/хрупкость
Твердость/мягкость
Температура плавления

Искл.:
золото и медь
От серебристо-белого до серого
бериллий
германий
литий
Металлический блеск



Температура плавления
Легкоплавкие tТугоплавкие t >1000ºC

Плотность металлов
Легкие (pТяжелые(p>0,5г/мл)

Домашнее задание
Спасибо за внимание!
Белый учебник 8Г, 8К
§ 14, с.85 №1,4
Синий учебник 8А,8Б
§ 13, с. №

Фотографии металлов и неметаллов, изображения кристаллических решеток взяты из ресурсов ИНТЕРНЕТ:
Краткое описание документа:
Данную презентацию учащиеся могут использовать для самостоятельного изучения нового материала, если пропустили урок по какой-либо причине (болезнь, соревнования и т.п.). Возможно использование презентации для повторения материала, например при подготовке к контрольной работе.
Элементы данной презентации можно использовать при введении в тему "Металлы в 9 классе.
Презентация содержит информацию об отличительных физических свойствах металлов, о их возможном применении, а также об аллотропных модификациях на прмере олова.
Рабочие листы и материалы для учителей и воспитателей
Более 3 000 дидактических материалов для школьного и домашнего обучения
Презентация по химии для 8 класса по теме "Простые вещества - металлы"

Презентация по химии для 8 класса по теме "Простые вещества - металлы" соответствует программе О.С. Габриеляна.
Просмотр содержимого документа
«Презентация по химии для 8 класса по теме "Простые вещества - металлы"»

Простые вещества-

Цели урока:
- Повторить особенности строения атомов металлов и металлическую химическую связь
- Познакомиться с общими физическими свойствами металлов
Положение в Периодической системе Д.И.Менделеева
Ниже диагонали
B –At и элементы побочных подгрупп

Особенности строения атомов металлов
Химическая связь
в металлах и

Общие физические свойства металлов

Как раньше люди использовали свои знания о металлах?

Отгадайте фамилию русского ученого, который сказал: «Металлом называется светлое тело, которое ковать можно».
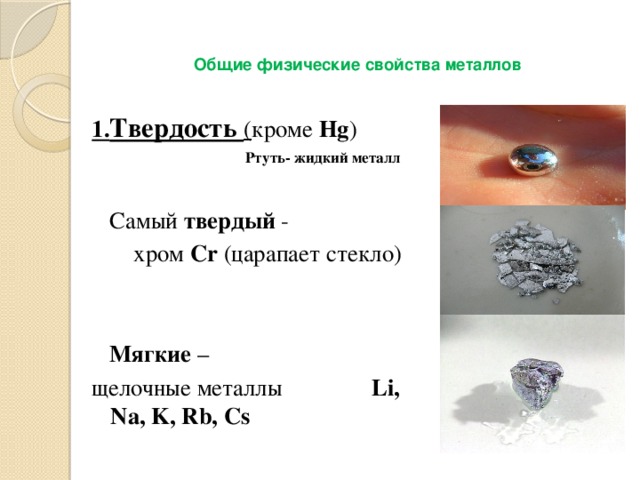
1. Твердость ( кроме Hg )
Ртуть- жидкий металл
Самый твердый -
хром Cr (царапает стекло)
щелочные металлы Li, Na, K, Rb, Cs

2.Электропроводность и теплопроводность Ag Cu Au Al Mg Zn Fe Pb Hg Электропроводность уменьшается
Ag Cu Au Al
3.Металлический блеск
4.Ковкость и пластичность
- Очень хрупкие-
- Наиболее пластичные металлы- Au Ag Cu Sn Pb Zn
Подсвечники из золота

Пластичность - важнейшее свойство металлов изменять свою форму при ударе, прокатываться в тонкие листы и вытягиваться в проволоку.

Царь-колокол

Fe и сплавы
Чугунная решетка
Золотые яйца работы К.Фаберже
Вариант 2
1. Как на практике используют пластичность металлов?
Выберите правильный ответ:
а) делают зеркала,
б) используют в качестве проводника электрического тока,
в) выковывают изделия разной формы, .
г) прокатывают в листы,
д) производят легкие сплавы для конструирования самолетов, ракет,
е) вытягивают в проволоку.
2. Выберите самые электропроводные металлы:
а) золото, б) серебро, в) натрий, г) железо,
д) медь е) марганец ж) алюминий з) магний
Буквы ответа расположите в порядке убывания электропроводности металлов.
3. Причина пластичности металлов заключается в их строении:
а) присутствие подвижных обобществленных электронов,
б) наличие в узлах кристаллической решетки ионов,
в) наличие в узлах кристаллической решетки атомов.
Вариант 1
1. Какие свойства подчеркивал М. В. Ломоносов, характеризуя металлы как "светлые тела, которые ковать можно"? Выберите правильный ответ:
а) теплопроводность,
б) обычно серый цвет с металлическим блеском,
в) электрическую проводимость,
г) пластичность.
2. Выберите самый пластичный драгоценный металл:
а) золото, б) серебро, в) платина.
3. Причина электрической проводимости металлов заключается в характерном для них строении:
а) наличие в узлах кристаллической решетки ионов,
б) наличие в узлах кристаллической решетки атомов,
в) присутствие подвижных обобществленных электронов.
Читайте также:
