При электролизе раствора соли одновалентного металла
Обновлено: 01.05.2024
2. Правила для определения результатов электролиза:
а) процессы на катоде;
б) процессы на аноде.
3. Закон Фарадея.
4. Области использования электролиза.
Движение ионов в растворе или расплаве электролита является хаотическим, беспорядочным. Но если в раствор или расплав электролита опустить электроды и пропустить постоянный электрический ток, то ионы будут двигаться упорядоченно к электродам: катионы – к катоду, анионы – к аноду. На катоде идет процесс восстановления, катионы принимают электроны. На аноде идет процесс окисления, анионы отдают электроны. Это явление называется электролизом.
Электролиз – это окислительно-восстановительный процесс, протекающий на электродах в растворах или расплавах электролитов при пропускании электрического тока. Сущность электролиза заключается в том, что за счет электрической энергии осуществляется химическая реакция, которая не может протекать самопроизвольно.
Для определения результатов электролиза существует ряд правил.
П р о ц е с с ы н а к а т о д е (восстановление).
• В расплавах катионы металла восстанавливаются до свободного металла:
М n+ + nе = М 0 .
• В растворах процесс на катоде н е з а в и с и т от материала катода, а зависит от активности восстанавливаемого металла.
а) Если металл расположен в ряду напряжений от Li до Al включительно, то на катоде идет процесс восстановления воды:
б) Если металл расположен в ряду напряжений между Al и H2, то на катоде идут одновременно процессы восстановления воды и катионов металла:
М n+ + nе М 0 .
в) Если металл расположен в ряду напряжений после Н2, то на катоде идет процесс восстановления катионов металла:
При электролизе растворов кислот идет процесс восстановления ионов водорода:
2Н + + 2е = H2 0 .
П р о ц е с с ы н а а н о д е (окисление).
• В расплавах анионы бескислородных кислот (кроме фторидов) окисляются до соответствующего простого вещества, например:
2Cl – – 2е = Cl2 0 .
Кислородсодержащие анионы выделяют кислород и превращаются в один из оксидов:
• В растворах процесс на аноде зависит от материала анода и от природы аниона. Аноды могут быть двух видов – растворимые (железо, медь, цинк, серебро и все металлы, которые окисляются в процессе электролиза) и нерастворимые, или инертные (уголь, графит, платина, золото).
а) Если анод растворимый, то независимо от природы аниона всегда идет окисление металла анода, например:
Cu 0 – 2e = Cu 2+ .
б) Если анод инертный, то в случае бескислородных анионов (кроме фторидов) идет окисление анионов:
В случае кислородсодержащих анионов и фторидов идет процесс окисления воды, анион при этом не окисляется и остается в растворе:
При электролизе растворов щелочей идет окисление гидроксид-ионов:
Количественная характеристика процессов электролиза определяется з а к о н о м Ф а р а д е я: масса электролита, подвергшегося превращению при электролизе, а также массы образующихся на электродах веществ прямо пропорциональны количеству электричества, прошедшего через раствор или расплав электролита, и эквивалентным массам соответствующих веществ.
Закон электролиза в математической форме:
m =где Э – эквивалент вещества (г/моль), I – сила тока (А), t – продолжительность процесса электролиза (с), F – постоянная Фарадея (F = 96 500 Кл/моль).
Электролиз широко используют в промышленности для выделения и очистки металлов, получения щелочей, хлора, водорода. Алюминий, магний, натрий, кадмий получают только электролизом. Важной областью применения электролиза является защита металлов от коррозии. При этом на поверхности металлических изделий электрохимическим методом наносят тонкий слой другого металла, устойчивого к коррозии.
Тест по теме "Электролиз"
При электролизе раствора сульфата цинка с инертными электродами на аноде выделяется:
а) цинк; б) кислород;
в) водород; г) сера.
2. Объем кислорода (в л, н.у.), выделившегося на инертном аноде при пропускании электрического тока силой 20 А в течение 2,5 ч через раствор сульфата калия, равен:
а) 10,4; б) 11,2; в) 6,8; г) 20,6.
3. При электролизе 240 г 15%-го раствора гидроксида натрия на аноде выделилось 89,6 л (н.у.) кислорода. Массовая доля вещества в растворе после окончания электролиза равна (в %):
а) 28,1; б) 32,1; в) 37,5; г) 40,5.
4. При электролизе раствора хлорида натрия образуются:
а) натрий и хлор;
б) гидроксид натрия, хлор и водород;
в) кислород и хлор;
г) натрий, хлор и соляная кислота.
5. При электролизе расплава гидроксида натрия на аноде выделяется:
а) натрий; б) водород; в) кислород; г) вода.
6. При электролизе раствора хлорида кальция на катоде выделилось 5,6 г водорода. Какова масса (в г) вещества, выделившегося на аноде?
а) 198,8; б) 99,4; в) 89,6; г) 44,8.
7. Медный купорос массой 100 г растворили в воде и провели электролиз до обесцвечивания раствора. Объем (в л, н.у.) собранного газа равен:
а) 2,24; б) 4,48; в) 11,2; г) 22,4.
8. Платиновый электрод:
в) расходуется в процессе электролиза;
г) не расходуется в процессе электролиза.
9. Процесс на катоде при электролизе растворов солей зависит от:
а) природы катода;
б) активности металла;
в) состава аниона;
г) не зависит от перечисленных факторов.
10. При электролизе раствора нитрата меди(II) с медными электродами на аноде будет происходить:
а) выделение диоксида азота;
б) выделение монооксида азота;
в) растворение анода;
г) выделение кислорода.
Ключ к тесту
Задачи на электролиз
1. При электролизе раствора хлорида меди(II) на аноде выделилось 560 мл газа (н.у.). Найти массу меди, выделившейся на катоде.
Ответ. 1,6 г.
2. При электролизе расплава хлорида натрия массой 70,2 г получен хлор, занимающий при н.у. объем 10,08 л. Найти долю выхода хлора.
3. При электролизе 149 г 20%-го раствора хлорида калия получен гидроксид калия массой 20,16 г. Найти долю выхода продукта реакции.
4. При электролизе водного раствора хлорида калия выделилось 7,2 л водорода (н.у.). Найти массу и количество вещества гидроксида калия, образовавшегося в результате электролиза.
Ответ. 36 г и 0,64 моль.
5. Какие вещества и в каких количествах образуются при электролизе 234 г расплава хлорида натрия? Какая масса железа может вступить в реакцию с веществом, выделившимся на аноде?
Ответ. 4 моль Na и 2 моль Cl2; 74,7 г Fe.
6. Ток одной и той же силы пропущен в течение одинакового времени через растворы нитрата серебра и сульфата меди. В результате выделилось 0,64 г меди. Найти массу выделившегося серебра.
Ответ. 2,16 г.
7. При электролизе раствора, содержащего 2,22 г соли двухвалентного металла, на аноде выделилось 0,448 л хлора (н.у.). Определить, какая соль была подвергнута электролизу. Написать уравнение реакции электролиза.
Ответ. Хлорид кальция.
8. Ток силой 6 А пропустили через водный раствор серной кислоты в течение 1,5 ч. Вычислить массу разложившейся воды и объем выделившихся газов (н.у.).
Ответ. 3,02 г Н2О; 3,76 л Н2 и 1,88 л О2.
9. Сколько времени потребуется для разложения 2 моль воды током силой 2 А?
Ответ. 53,6 ч.
10. Найти объем кислорода (н.у.), который выделится при пропускании тока силой 6 А в течение 30 мин через водный раствор гидроксида калия.
Ответ. 627 мл.
11. При электролизе водного раствора сульфата хрома(III) током силой 2 А масса катода увеличилась на 8 г. В течение какого времени проводили электролиз?
Ответ. 6,18 ч.
12. Через расплав оксида алюминия пропускали постоянный ток силой 16 А в течение 3 ч. Вычислить массу алюминия, выделившегося на катоде.
Ответ. 16,1 г.
1. При пропускании тока силой 2,5 А через раствор электролита за 30 мин выделилось 2,77 г металла. Определить металл.
Ответ. Олово.
2. При пропускании через раствор соли некоторого металла тока силой 1,5 А в течение 30 мин на катоде выделилось 1,071 г металла. Определить металл.
Ответ. Индий.
3. Через 300 г 10%-го раствора хлорида натрия пропустили ток. Спустя некоторое время ток выключили. Объем газа, выделившегося на аноде, при давлении 1 атм и температуре 27 °С равен
1 л. Найти массовые доли веществ, находящихся в растворе после выключения тока, если доля выхода продуктов электролиза составляет 91% от теоретически возможного.
Ответ. 8,36% NaCl и 1,2% NaOH.
4. Газ, выделившийся на аноде при электролизе 200 г 20%-го раствора хлорида натрия, пропустили через 400 г 30%-го раствора бромида калия. К полученному раствору добавили избыток раствора нитрата серебра. Определить количественный состав выпавшего осадка.
Ответ. 59,4 г AgBr и 98,15 г AgCl.
5. Через 800 г 10%-го водного раствора хлорида натрия пропустили ток. После окончания процесса электролиза соли весь выделившийся на аноде газ поглотили горячим раствором, получившимся в результате электролиза. Найти массовые доли веществ, содержащихся в растворе после поглощения газа.
Ответ. 8,35% NaCl и 3,03% NaClO3.
6. Через 50 г 10%-го раствора сульфата натрия некоторое время пропускали ток. Когда процесс прервали, объем выделившегося на аноде газа составил 10 л (давление 1 атм, температура 20 °С). Найти массовую долю сульфата натрия в растворе после прекращения электролиза.
Ответ. 14,28%.
7. Некоторое количество нитрида натрия обработали избытком воды и получили газ А. Оставшееся в растворе вещество выделили и при электролизе в расплаве получили газ В на аноде. Смесь А и В пропустили над нагретой платиной, и газы вступили в реакцию без остатка. Найти долю выхода вещества А, если выход газа В можно считать количественным.
Ответ. 3) = 60%.
8. При электролизе расплава 8 г соединения одновалентного металла на аноде выделилось
11,2 л водорода (н.у.). Определить соединение. Можно ли подвергнуть электролизу его водный раствор?
Водород на аноде может выделяться только при электролизе расплавов гидридов металлов МН:
M(MH) = m(MH)/(MH) = 8/1 = 8 г/моль.
Искомый гидрид – LiH.
Подвергнуть электролизу водный раствор LiH невозможно, т.к. он разлагается водой:
9. Водный раствор каустической соды подвергали электролизу током 10 А в течение 268 ч. После окончания электролиза осталось 100 г 24%-го раствора гидроксида натрия. Найти первоначальную концентрацию раствора.
10. При пропускании постоянного тока силой 6,4 А в течение 30 мин через расплав хлорида неизвестного металла на катоде выделилось 1,07 г металла. Определить состав соли, подвергшейся электролизу.
При электролизе раствора содержащего нитрат одновалентного металла образовалось 54 г металла и 4 г газа?
При электролизе раствора содержащего нитрат одновалентного металла образовалось 54 г металла и 4 г газа.

При электролизе NO3 выделяется О2.
Раз при электролизе выделился металл, значит в нитрате не щелочной металл.
В электрохимическом ряду металлов от алюминия до водорода нет одновалентных металлов, следовательно водород не выделяется в ходе реакции.
Тогда запишем уравнение.
Металл запишем в общем виде, как Me.
4MeNO3 = 4Me + O2 + 4HNO3
Количество вещества металла относится к количеству выделившегося кислорода, как 4 : 1.
Найдем количество кислорода.
N = m / M = 4 / 32 = 0, 125 моль.
Тогда количество металла : n1 = 4 * 0, 125 = 0, 5 моль.
Найдем молярную массу металла : M = m / n1 = 54 / 0, 5 = 108 г / моль.
Следовательно, это серебро.

Одновалентные металлы?

Химия, срочно?
))) При электролизе хлорида калия массой 500 грамм содержащего 3% примесей, получили металл и газ.
Вычислите массу получившегося металла и объем выделившегося газа!
В результате реакции одновалентного металла с водой образовалось хорошо растворимое в воде твердое вещество и газ, причем масса получившегося в растворе вещества, выраженная в граммах, в 5 раз больше,?
В результате реакции одновалентного металла с водой образовалось хорошо растворимое в воде твердое вещество и газ, причем масса получившегося в растворе вещества, выраженная в граммах, в 5 раз больше, чем объем веделившегося газа в литрах (н.
Определите расчетным путем, какай металл прореагировал.

При электролизе какого раствора соли на катоде не будет выделяться металл?
При электролизе какого раствора соли на катоде не будет выделяться металл.
Какой последовательности будут выделяться металлы при электролизе раствора содержащего одинаковой концентрации нитратов хрома нитрат серебра нитрат цинка напишите уравнение реакции?
Какой последовательности будут выделяться металлы при электролизе раствора содержащего одинаковой концентрации нитратов хрома нитрат серебра нитрат цинка напишите уравнение реакции.

Оксид металла содержащий 70 % металла, полностью восстановили водородом до металла ?
Оксид металла содержащий 70 % металла, полностью восстановили водородом до металла .
При расстворении 11, 2 г полученного металла в азотной кислоте образовался нитрат трехвалентного металла и выделилрсь 13, 44 л оксида азота 4.
Определите массу исходного оксида металла.

Химия ПРИ ЭЛЕКТРОЛИЗЕ ХЛОРИДА КАЛИЯ , массой 500 грамм, содержащего 3% примесей получили металл и газ?
Химия ПРИ ЭЛЕКТРОЛИЗЕ ХЛОРИДА КАЛИЯ , массой 500 грамм, содержащего 3% примесей получили металл и газ.
Оксид одновалентного металла содержит 93, 1% металла?
Оксид одновалентного металла содержит 93, 1% металла.
Вычислите молярную массу эквивалентного металла.
Назовите этот металл.
При взаимодействии 12, 4 г оксида одновалентного металла с водой образовалось 16 г его гидроксида?
При взаимодействии 12, 4 г оксида одновалентного металла с водой образовалось 16 г его гидроксида.
При сгорании 0, 7г одновалентного металла в кислороде образовалось 1, 5г его оксида?
При сгорании 0, 7г одновалентного металла в кислороде образовалось 1, 5г его оксида.
Определить этот металл.
Я про алюминийАлюминий – легкий, прочный и пластичный металл. Это один из самых востребованных металлов, и по темпам роста потребления он давно и с большим отрывом оставил позади сталь, никель, медь и цинк. Алюминий без преувеличений можно назвать ..

Тому що рН показує ступінь концентрації катіонів гідрогену у воді, що є дуже важливим для косметики.
1. дано N(NH3) = 4. 816 * 10 ^ 23 - - - - - - - - - - - - - - - - - - - - - - - - - - - - - V(NH3) - ? N(NH3) / N(A) = V(NH3) / Vm V(NH3) = N(NH3) * Vm / N(A) = 4. 816 * 10 ^ 23 * 22. 4 / 6. 02 * 10 ^ 23 = 15. 58 L ответ 15. 58 л 2) дано m(O2)..

Соотвественно правильным ответом будет являться : 4) KCl ; 5) AgCl ; 6) NH4Cl.
Дано W(O) = 47 % - - - - - - - - - - - - - - - - E - ? Е - это неизвестный элемент W(O) = Ar(O) * n / M(X2O3) * 100% 47% = 16 * 3 / 2x + 48 * 100% 94x + 2256 = 4800 X = 27 - это алюминий Al2O3 ответ алюминий.

Напиши нормально не понятно или сфоткай.
В SO3 32 / (32 + 3 * 16) = 0, 4 или 40 %.
Реакции есть на фотографии.

4HCl + MnO2 = MnCl2 + Cl2 + 2H2O соляная кислота отдаёт в свободном виде половину имеющегося хлора. M(Cl общ. ) = 1000 * 0, 365 * 0, 9726 = 355 г масса выделившегося хлора = 355 / 2 = 177, 5 г.
Типы химической реакции соединение, разложение замещение.
© 2000-2022. При полном или частичном использовании материалов ссылка обязательна. 16+
Сайт защищён технологией reCAPTCHA, к которой применяются Политика конфиденциальности и Условия использования от Google.
Интерактивный урок по теме "Электролиз"

Электролизэто совокупность окислительновосстановительных процессов,протекающих при прохождении постоянного электрического тока через раствор или расплав электролита с погруженными в него электродами
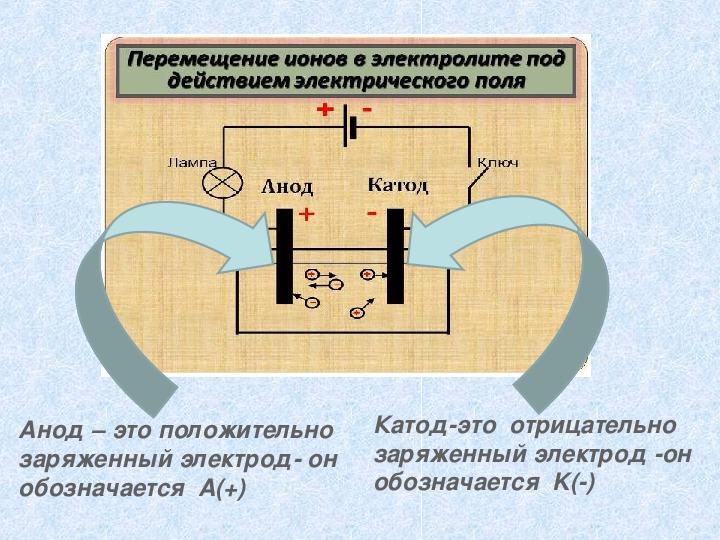
Анод – это положительно заряженный электрод он обозначается A(+) Катодэто отрицательно заряженный электрод он обозначается K()
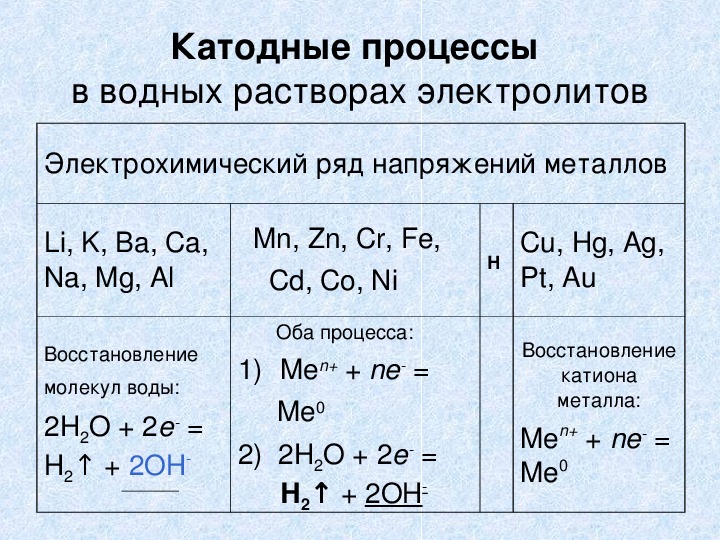
Катодные процессы в водных растворах электролитов Электрохимический ряд напряжений металлов Li, K, Ba, Ca, Na, Mg, Al Mn, Zn, Cr, Fe, Cd, Co, Ni Н Cu, Hg, Ag, Pt, Au Восстановление молекул воды: 2H2O + 2e = + ↑ 2ОН Н2 Оба процесса: 1) Men+ + ne = Me0 2) 2H2O + 2e = Н2↑ + 2ОН Восстановление катиона металла: Men+ + ne = Me0

Анодные процессы в водных растворах электролитов Анион кислотного остатка Аm Бескислородный (Cl, Br, I, S2 и др., кроме F) Окисление аниона (кроме фторида) Аm me = А0 , 2, NO3 2 и др.) и F Кислородсодержащий ( ОН, SO4 CO3 В кислой и нейтральной среде – окисление молекул воды: 2H2O – 4e = O2↑ + 4H+ в щелочной среде: 4OH 4e = O2↑ + 2H2O
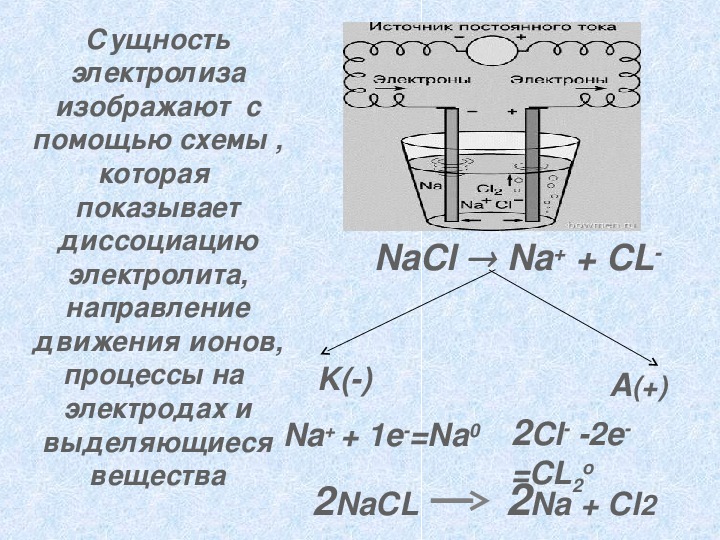
Сущность электролиза изображают с помощью схемы , которая показывает диссоциацию электролита, направление NaCl Na+ + CL движения ионов, процессы на электродах и выделяющиеся вещества K() A(+) Na+ + 1e=Na0 2Cl 2e 2NaCL 2Na + Cl2 =CL2 o
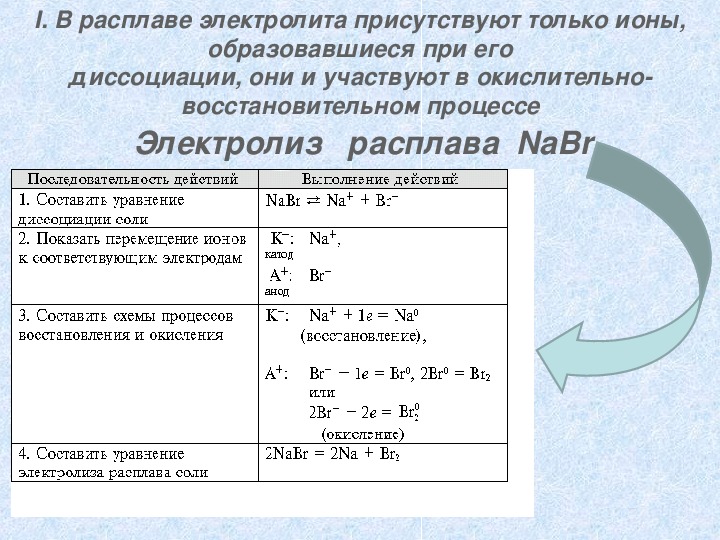
образовавшиеся при его диссоциации, они и участвуют в окислительно I. В расплаве электролита присутствуют только ионы, восстановительном процессе Электролиз расплава NaBr
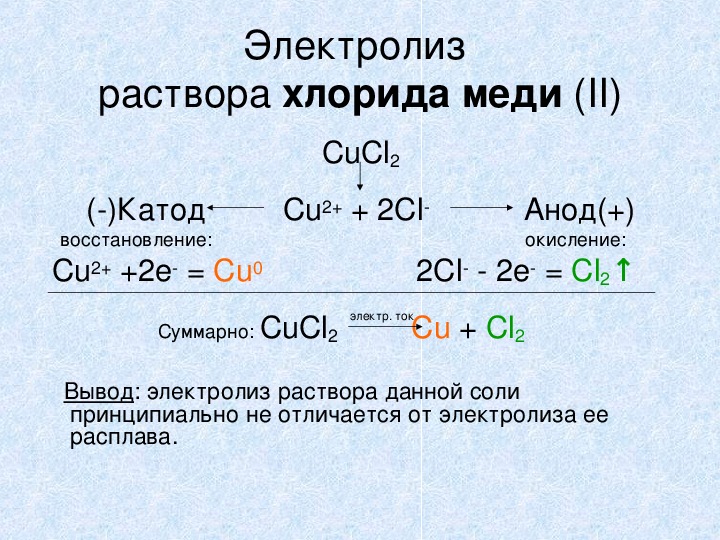
Электролиз раствора хлорида меди (II) CuCl2 ()Катод Cu2+ + 2Cl Анод(+) восстановление: окисление: Cu2+ +2е = Сu0 2Cl 2е = Cl2↑ Суммарно: CuCl2 Сu + Cl2 электр. ток Вывод: электролиз раствора данной соли принципиально не отличается от электролиза ее расплава.

Схема электролиза раствора сульфата меди (II) CuSO4 ()Катод Cu2+ + SO4 2 Анод(+) восстановление окисление ионов меди: H2SO4 молекул воды: Cu2+ + 2е = Сu0 2H2O – 4e = O2↑ + 4H+ Для подбора коэффициентов используем метод электронноионного баланса: К() Cu2+ + 2е = Сu0 2 А(+) 2H2O – 4e = O2↑ + 4H+ 1 Суммарно: 2CuSO4 + 2H2O 2Cu + O2 электр. ток + ↑ 2H2SO4

Изменение восстановительной активности анионов Анионы по их способности окисляться располагаются в следующем порядке: , F I, Br, S2, Cl, OH, SO4 2, NO3 Восстановительная активность уменьшается

Электролиз раствора иодида калия KI ()Катод K+ + I Анод(+) Восстановление KOH окисление анионов молекул воды: иода: 2H2O + 2e = Н2↑ + 2ОН I e = I0 ; 2I = I2 Для подбора коэффициентов используем метод электронноионного баланса: К() 2H2O + 2e = Н2 А(+) 2I 2e = I2 Суммарно: 2KI + 2H2O Н2↑ + I2 + 2KOH электр. ток ↑ + 2ОН 1 0 ; 1

Электролиз раствора сульфата натрия Na2SO4 ()Катод 2Na+ + SO4 2 Анод(+) восстановление окисление молекул воды молекул воды 2H2O + 2e = Н2↑ + 2ОН 2H2O – 4e = O2↑ + 4H+ щелочная среда кислая среда электр. ток Суммарно: 2H2O 2H2↑ + O2↑ Вывод: электролиз данной соли сводится к разложению воды; соль необходима для увеличения электропроводности, так как чистая вода является очень слабым электролитом.

Проверь себя При электролизе водного раствора хлорида лития (LiCL) на аноде в результате электролиза образуется: 1) хлор 2) литий 3) кислород 4) водород

Проверь себя При электролизе водного раствора сульфата меди (II) ( CuSO4) на катоде выделится: А) кислород Б) водород В) медь Г) сера

Проверь себя Установите соответствие между формулой соли и продуктом,образующимся на инертном аноде при электролизе ее водного раствора Формула соли А) NiSO4 Б) NaCLO4 В) LiCL Г) RbBr Продукт на аноде 1) S 2) SO2 3) CL2 4) O2 5) H2 6)Br2

Проверь себя Установите соответствие между формулой вещества и продуктом, образующимся на катоде при электролизе его водного раствора Формула вещества Продукт реакции А) Ca(OH)2 Б) AgNO3 В) AL(NO3)3 Г) HNO3 1) Ag, H2 2) Ca 3) O2 4) Ag 5) AL 6)H2

Проверь себя Установите соответствие между названием вещества и способом его получения Название вещества А) Никель Б) Натрий В) Алюминий Г) Бром Получение электролизом 1) Расплава NaOH 2) Раствора KBr 3) Раствора AL(NO3)3 4) Раствора Na2SO4 5) Раствора NiSO4 6) AL2O3 в расплавленном криолите

Электролиз солей • Задание В3: установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе её водного раствора ФОРМУЛА СОЛИ ПРОДУКТ НА КАТОДЕ А Б В Г Na2SO4 Ca(NO3)2 ZnSO4 CuCl2 1 Ca 2 Na 3 H2 4 5 Cu 6 Cu(OH)2 Zn;H2

Задание • Только электролизом расплава можно получить группу металлов • A)K, Ca,Mg • B)Fe, Ca, Hg • C) Li, Ag, Sn • D) Cs, Al, Cu • E) Na,Cu, Ag

Задание • На катоде при электролизе происходит процесс • А) восстановления • В)замещения • С)диссоциации • Д)окисления • Е) разложения

Задание • Кислород выделяется при электролизе раствора соли • А) Ca(NO3)2 • B) CuF2 • C) ZnI2 • D) KCl • E) NaCL

ЗАДАЧА 1 • Сумма объемов всех газов (н.у.) , полученных при электролизе раствора, содержащего 8,5г хлорида лития + 2ОН ↑ • А) 2,24л К() 2H2O + 2e = Н2 • В) 4,48л А(+) 2Cl 2e = Cl2 0 • С) 8,96л 2LiCl + 2H2O = Н2↑ + CL2 + 2KOH • Д) 3,36л 1* M(LiCl)=42,5 • Е) 1,12л


Задача 2 • Сумма всех коэффициентов в суммарном уравнении электролиза раствора йодида натрия • А) 6 • В) 4 К() 2H2O + 2e = Н2 • С) 10 А(+) 2I 2e = I2 • Д) 12 2KI + 2H2O = Н2↑ + I2 + 2KOH • Е) 8 Ответ: Е + 2ОН ↑ 0

Задача 3 • Сумма масс (в г) всех продуктов электролиза раствора, содержащего 0,5 моль сульфида калия • А) 114 • В)90 • С)73 • Д)146 • Е) 88

Задача 4 • При электролизе раствора соли одновалентного металла образовалось 20г щелочи и 5,6л газа на аноде. Электролизу подверглась соль • А) хлорид рубидия • В) хлорид калия • С)нитрат серебра • Д) хлорид натрия • Е) хлорид лития
11 класс
§ 10. Электрический ток в растворах и расплавах электролитов. Законы электролиза
Электропроводность электролитов.
К электролитам относят растворы солей, кислот и щелочей, а также расплавленные соли. Как возникает электропроводность у этих веществ?
Соединим последовательно источник тока, электрическую лампочку и два электрода (две пластинки). Электроды разъединены (цепь не замкнута), поэтому лампочка не горит. Опустим теперь электроды в сосуд с дистиллированной водой. Лампочка также не горит. Следовательно, дистиллированная вода не является проводником электрического тока. Вынем электроды из воды и поставим их на лист бумаги, на который насыпана поваренная соль NaCl. Лампочка и теперь не горит. Следовательно, и сухая соль не является проводником электрического тока.
Ещё раз опустим в дистиллированную воду электроды с прилипшей к ним солью (рис. 2.4). Мы увидим, что лампочка загорелась, что свидетельствует о появлении электрического тока в цепи.
Таким образом, хотя в отдельности дистиллированная вода и соль не являются проводниками, раствор соли в воде является хорошим проводником электрического тока. То же самое можно сказать (и на опыте в этом убедиться) о водных растворах кислот и щелочей.
Электролитическая диссоциация.
Заряженные частицы, обеспечивающие электрический ток в растворах электролитов, образуются в результате электролитической диссоциации. Рассмотрим этот процесс на примере бромида калия КВr. Взаимодействие атомов брома и калия в молекуле бромида калия упрощённо можно представить как взаимодействие двух ионов: положительно заряженного иона K + и отрицательно заряженного иона Br - . Объясняется это тем, что единственный валентный электрон у калия слабо связан с атомом. При образовании молекулы KBr этот электрон переходит к атому брома, превращая его в отрицательный ион Br - .
В соответствии с этим молекулу KBr можно схематически изобразить в виде диполя (рис. 2.5). В электрическом поле, создаваемом молекулой KBr, молекулы воды ориентируются так, как показано на рисунке 2.6. При этом они растягивают молекулу KBr. В результате часть молекул KBr распадается — диссоциирует на ионы K + и Br - .
Степень диссоциации (доля молекул растворённого вещества, которые распадаются на ионы) зависит от температуры, концентрации раствора и диэлектрической проницаемости растворителя. C увеличением температуры степень диссоциации возрастает и, следовательно, увеличивается концентрация положительно и отрицательно заряженных ионов.
Наряду с процессом диссоциации в растворах электролитов происходит и обратный процесс. Ионы разных знаков при встрече могут снова объединиться в нейтральные молекулы — рекомбинировать (воссоединиться). При неизменных условиях в растворе устанавливается динамическое равновесие, при котором число молекул, распадающихся за секунду на ионы, равно числу пар ионов, которые за то же время вновь воссоединяются в нейтральные молекулы. При наступлении динамического равновесия концентрация ионов в растворе электролита сохраняется постоянной (при неизменной температуре).
При отсутствии внешнего электрического поля ионы вместе с нераспавшимися молекулами находятся в хаотическом тепловом движении. Если сосуд с раствором электролита включить в электрическую цепь, то между электродами образуется электрическое поле и ионы в растворе придут в упорядоченное движение (рис. 2.7).
Положительно заряженные ионы станут двигаться по направлению напряжённости поля, т. е. к катоду (электроду, соединённому с отрицательным полюсом источника тока), а отрицательно заряженные ионы — в противоположном направлении, т. е. к аноду (электроду, соединённому с положительным полюсом источника тока). Отрицательные ионы, пришедшие к аноду и называемые анионами, отдают свои лишние электроны аноду, а посредством его и соединительных проводников — положительному полюсу источника, возмещая на нём недостаток электронов. Положительные ионы, пришедшие к катоду и называемые катионами, получают недостающие им электроны из избытка их на катоде. Тем самым во внешней цепи устанавливается перемещение электронов от отрицательного полюса источника тока к положительному. При этом через раствор электролита заряд переносится вместе с частицами вещества — ионами. Такую проводимость называют ионной.
Электролиз.
При прохождении электрического тока через раствор электролита анионы отдают свои лишние электроны на аноде (в химии это называется окислительной реакцией), а катионы на катоде получают недостающие электроны (восстановительная реакция). Таким образом, на электродах при прохождении через раствор электрического тока происходит выделение веществ, входящих в состав электролитов.
Процесс выделения на электродах веществ, связанный с окислительно-восстановительными реакциями, называют электролизом.
При постоянной температуре графиком зависимости силы тока от напряжения для растворов электролитов является, как и для металлического проводника, прямая. Однако она не проходит через начало координат, а сдвинута вправо (рис. 2.8).
Это объясняется тем, что при электролизе происходит поляризация электродов 1 , погружённых в раствор электролита. При этом возникающая ЭДС поляризации имеет знак, противоположный знаку напряжения U на электродах. На рисунке 2.8 отрезок OA соответствует ЭДС поляризации.
1 Это явление связано с тем, что на электродах выделяются вещества, которые по химическому составу отличаются от материала электродов.
Закон электролиза Фарадея.
Выясним, от чего зависит масса вещества, выделяющегося за определённое время при электролизе.
Масса m выделившегося вещества равна произведению массы одного иона mi на число ионов Ni осевших на электроде за время Δt:
Масса иона равна
где M — молярная (или атомная) масса вещества; NA — постоянная Авогадро.
Число ионов, осевших на электроде, равно
где Δq = IΔt — заряд, прошедший через раствор электролита за время Δt; qi — заряд иона, который равен произведению элементарного заряда (заряда электрона) е на валентность n атома (или группы атомов), из которого образовался ион: qi = еn.
При диссоциации молекул, состоящих из одновалентных атомов (n = 1), возникают однозарядные ионы. Например, при диссоциации молекулы бромида калия KBr возникают ионы K + и Br - ,а при диссоциации молекулы медного купороса CuSO4 получаются два двухзарядных иона Cu 2+ и SO 2- 4 , так как атом меди и кислотный остаток в данном соединении двухвалентны (n = 2).
Подставляя в формулу (1) выражения (2) и (3) и учитывая выражения для Δq и qi получим
Обозначим через k коэффициент пропорциональности между массой вещества m и зарядом q = IΔt в формуле (4):
Тогда формула (4) примет вид
Macca вещества, выделившегося на каждом из электродов, прямо пропорциональна силе тока и времени прохождения тока через раствор электролита.
Это утверждение было экспериментально установлено в 1833 г. М. Фарадеем и носит название закона электролиза Фарадея.
Коэффициент k в формуле (6) называют электрохимическим эквивалентом вещества и выражают в килограммах на кулон (кг/Кл). Он зависит от рода вещества. Из формулы (6) видно, что электрохимический эквивалент k численно равен массе вещества, выделившегося на электроде, при переносе ионами через раствор электролита заряда, равного 1 Кл.
Произведение элементарного заряда е на постоянную Авогадро NA носит название постоянной Фарадея:
Введя постоянную Фарадея в формулу (4) для массы вещества, выделившегося при электролизе на электроде, получим
Согласно формуле (7) постоянная Фарадея F численно равна заряду, который нужно пропустить через раствор электролита, чтобы выделить на электроде 1 моль одновалентного вещества. Постоянная Фарадея, найденная из опыта, равна F = 9,65 ∙ 10 4 Кл/моль.
Зная постоянную Авогадро NA и постоянную Фарадея F, можно найти заряд одновалентного иона, т. е. заряд электрона: е = F /NA ≈ 1,6 ∙ 10 -19 Кл. Любой двухвалентный ион переносит заряд в два раза больший, трёхвалентный — в три раза больший и т. д. Никогда не бывает, чтобы ион переносил заряд, содержащий дробную часть заряда одновалентного иона. Отсюда следует вывод, что заряд одновалентного иона (е = 1,6 ∙ 10 -19 Кл) представляет собой наименьший (элементарный) заряд, существующий в природе. Любой электрический заряд состоит из целого числа элементарных зарядов.
Технические применения электролиза.
Рассмотрим некоторые примеры использования электролиза в технике.
Гальваностегия — покрытие металлических изделий тонким слоем другого металла (никелирование, хромирование, серебрение, золочение и т. д.) с целью их предохранения от окисления и придания им привлекательного внешних) вида. Предмет, подлежащий покрытию, тщательно очищают, хорошо обезжиривают и помещают в качестве катода в электролитическую ванну, содержащую раствор соли того металла, которым должен быть покрыт данный предмет. Анодом является пластинка из того же металла. Для более равномерного покрытия обычно применяют две пластинки в качестве анода, помещая предмет между ними (рис. 2.9).
Гальванопластика — электролитическое изготовление копий с рельефных предметов (медалей, гравюр, барельефов и т. д.). C рельефного предмета делают восковой или иной слепок. Затем поверхность слепка покрывают тонким слоем графита, чтобы она стала проводящей. В таком виде слепок используется в качестве катода, который опускают в электролитическую ванну с раствором медного купороса. Анодом является медная пластинка. Когда на слепке нарастёт достаточно толстый слой меди, электролиз прекращают и воск осторожно удаляют. Так получают точную медную копию оригинала.
Процесс получения отслаиваемых покрытий был разработан русским учёным Борисом Семёновичем Якоби (1801—1874), который в 1836 г. применил этот способ для изготовления фигур для Исаакиевского собора в Санкт-Петербурге.
Вопросы:
1. При каком условии в электрической цепи горит электрическая лампочка (см. рис. 2.4)?
2. В чём заключается явление электролитической диссоциации?
3. Какие заряженные частицы обеспечивают электрический ток в растворах и расплавах электролитов?
4. Что такое электролиз? Приведите примеры практического использования электролиза.
5. Запишите и сформулируйте закон Фарадея для электролиза.
6. Какой физический смысл имеет постоянная Фарадея? Чему она равна?
Вопросы для обсуждения:
Электрическую лампу включили в сеть последовательно с электролитической ванной, наполненной слабым раствором поваренной соли (NaCl). Изменится ли накал нити лампы, если добавить в раствор ещё некоторое количество соли?
Пример решения задачи
Электролитическая ванна с раствором CuSO4 включена в цепь, сила тока в которой изменяется с течением времени так, как показано на рисунке 2.10.
Сколько меди выделится на катоде спустя 8 мин после начала электролиза в каждом случае? Электрохимический эквивалент меди равен 0,33 ∙ 10 -6 кг/Кл.
где k — электрохимический эквивалент вещества.
По графику зависимости силы тока от времени (рис. 2.10, а) определим модуль заряда, прошедшего через раствор электролита за 8 мин. Для этого рассчитаем площадь фигуры под графиком. Учитывая данные и выражая время в единицах СИ, найдём:
q1 = (3 ∙ 4 ∙ 60 ∙ 1/2 + 3 ∙ 4 ∙ 60) Кл = 1080 Кл.
Для графика зависимости силы тока от времени (рис. 2.10,б)
q2 = 1/2 ∙ 3 ∙8 ∙ 60 Кл = 720Кл.
Подставляя числовые данные в формулу закона электролиза, получим
m1 = 0,33 ∙ 10 -6 ∙ 1080 кг = 0,000356 кг ≈ 0,36 г;
m2 = 0,33 ∙ 10 -6 ∙ 720 кг = 0,000238 кг ≈ 0,24 г.
Упражнения:
1. При электролизе водного раствора соли некоторого металла на катоде выделился 1 моль металла. Через раствор прошёл заряд, модуль которого равен 1,93 ∙ 10 5 Кл. Найдите валентность ионов металла.
2. При силе тока 2,5 А за 20 мин в электролитической ванне выделилось 1017 мг двухвалентного металла. Чему равна его атомная масса?
3. При какой силе тока, который пропускают через раствор сернокислого цинка (ZnSO4) в течение 1,8 ∙ 10 4 с, на катоде выделится 3,06 ∙ 10 -2 кг цинка?
4. Изделие покрывают при электролизе слоем серебра толщиной 2 ∙ 10 -5 м. Сколько времени длится электролиз, если сила тока в ванне 0,525 А? Площадь поверхности изделия составляет 1,82 ∙ 10 -2 м 2 .
5. Золочение металлических изделий длилось 1,93 ∙ 10 3 с при силе тока 1 А в цепи. Определите толщину нанесённого слоя золота, если общая площадь поверхности изделий равна 0,0034 м 2 .
Читайте также:
