При контакте с каким из металлов будет корродировать железо
Обновлено: 17.05.2024
Одним из основных способов является нанесение защитных покрытий на изделия. Защитные покрытия - слои, искусственно создаваемые на поверхности металлических изделий для предохранения их от коррозии. Защитные покрытия делятся на неметаллические неорганические (оксидные, фосфатные, хроматные), неметаллические органические (лакокрасочные и полимерные) и металлические покрытия. Покрытия неметаллические неорганические и органические механически защищают металлы от коррозии, изолируя их от контакта с внешней средой.
Металлические покрытия по характеру защитного действия делятся на анодные и катодные.
а) анодным называется покрытие, стандартный потенциал которого меньше, чем у защищаемого металла. При нарушении слоя анодного покрытия возникают коррозионные Г.Э., в которых металл покрытия играет роль анода и корродирует, а на защищаемом металле - катоде - восстанавливается окислитель. Например, для железа j 0 (Fe 2+ /Fe) = -0,44B анодными будут покрытия – цинк, j 0 (Zn 2+ /Zn) =-0,76В, хром (j 0 (Cr 3+ /Cr) = -0,71В)
б) катодным называется покрытие, стандартный потенциал которого больше, чем у защищаемого металла. При нарушении катодного покрытия образуется ГЭ, в котором металлическое покрытие будет катодом, а защищаемый металл – анодом.
Например, катодные покрытия для меди (j 0 (Сu 2+ /Сu) = +0,337В) - серебро (j 0 (Ag + /Ag) = 0,799B, золото (j 0 (Au + /Au) = 1,68B).
Протекторная защита - к изделию присоединяют металл или сплав, потенциал которого значительно меньше потенциала изделия. Такие металлы или сплавы называются протекторами, чаще всего это Al, Mg, Zn. В коррозионной среде металл протектора растворяется, а на защищаемом металле протекают катодные процессы.
Пример 10 Подберите протектор для защиты изделия из сплава Sn-Pb от коррозии в водном растворе с рН = 1; Составьте уравнения процессов коррозии.
Анодный: А(Mn) : Mn – 2e® Mn 2+ х3
Катодный К(Sn-Pb): 2H + + 2e ®H2 - водородная деполяризация
O2 + 4H + +4e ® H2O - кислородная деполяризация
Суммарный процесс: 3Mn + 6H + + O2 ® 3Mn 2+ =H2 + H2O
61. Медный кабель находится в свинцовой оболочке. Среда – влажный воздух с рН = 7. Что будет корродировать, при нарушении оболочки? Напишите уравнения электродных процессов и суммарной реакции коррозии. Составьте схему коррозионного Г.Э.
62. Определите, какой из металлов: никель, кадмий или марганец является протектором для конструкции из железа. Опишите электродные и суммарный процессы коррозии во влажной среде с рН = 8.
63 Определите, какой металл будет растворяться при коррозии сплава никель-кобальт в растворе щелочи с рН =12. Напишите уравнения электродных процессов и суммарной реакции.
64. Деталь из латуни ( сплав медь-цинк ) помещена в раствор с рН = 11. С какой деполяризацией будет протекать коррозия? Напишите уравнения электродных и суммарного процессов коррозии. Будут ли при коррозии протекать побочные процессы?
65. Подберите анодное покрытие для серебра. Определите, с какой деполяризацией будет протекать коррозия при нарушении покрытия во влажной среде с рН = 5. Напишите уравнения электродных процессов и суммарной реакции коррозии.
66. Деталь из сплава хром-никель находится в щелочном растворе с рН = 10, кислород отсутствует. Какой из компонентов сплава будет растворяться при коррозии. Составьте уравнения электродных процессов, нарисуйте схему коррозионного Г.Э.
67. Составьте уравнения электродных процессов и суммарной реакции, происходящих при атмосферной коррозии (рН = 7) луженого железа и луженой меди в случае нарушения целостности покрытия.
68. Будет ли корродировать деталь из сплава кадмий-олово в 0,001М растворе серной кислоты в отсутствии кислорода? Опишите уравнения электродных процессов, если коррозия возможна.
69. Можно ли хранить в контакте магний и алюминий во влажной среде с рН = 7? Ответ мотивируйте.
70. Алюминиевые детали изделия склепаны медными заклепками. Какие процессы происходят в местах контакта алюминия и меди в морской воде с рН = 6,5?
71. Подберите катодное и анодное покрытия для кобальта. Опишите процессы коррозии в кислой среде с рН = 2 в присутствии кислорода при нарушении целостности катодного и анодного покрытий.
72. В контакте с каким из металлов: цинком, кобальтом, медью кадмий будет корродировать? Напишите уравнения электрохимической коррозии в кислой среде с рН = 5.
73. Возможна ли коррозия серебра в средах : а) с рН = 2, б) с рН =12. Опишите процессы коррозии, нарисуйте схему коррозионного Г.Э.
74. Какой из металлов: медь или никель – будет корродировать в растворе соляной кислоты с концентрацией С = 0,001М в отсутствии кислорода. Напишите электродные реакции и суммарный процесс коррозии. Нарисуйте схему коррозионного Г.Э.
75. Напишите электродные реакции и суммарные процессы коррозии железа во влажной среде с рН = 5
а) в присутствии кислорода, б) без кислорода.
76. Магний корродирует в растворе хлорида натрия при контакте раствора с воздухом. Напишите электродные реакции и суммарный процесс коррозии, если рН = 7.
77. Для какого из металлов: цинка, марганца или олова кадмий может служить протектором при защите от коррозии в водном растворе с рН = 10.Напишите уравнения электродных процессов и суммарной реакции коррозии. Составьте схему коррозионного Г.Э.
78. Каким покрытием является хром – катодным или анодным – по отношению к алюминию. Какой из металлов будет корродировать в случае нарушения поверхностного слоя покрытия в атмосфере влажного воздуха с рН = 6,5. Составьте схему коррозионного Г.Э.. Напишите уравнения электродных процессов при коррозии.
79. Изделие из хрома, спаянного со свинцом, находится в водном растворе с рН = 10. Опишите электродные процессы и суммарную реакцию процесса коррозии изделия. Подберите к изделию протектор.
80. Какой из перечисленных металлов: золото, медь, серебро, - будет разрушаться в атмосфере влажного воздуха при рН = 7. Напишите уравнения электродных процессов и суммарной реакции для коррозии этого металла. Составьте схему коррозионного Г.Э. Подберите для этого металла анодное покрытие.
81. Какие из приведенных металлов:Fe, Pb, Sn, Cu , будут корродировать в водных средах в отсутствии кислорода:а) рН = 2; б) рН =7. Напишите уравнения электродных процессов и суммарной реакции металла в кислой среде.
82 Приведена схема коррозионного гальванического элемента в растворе серной кислоты при нарушении целостности хромового покрытия на железе.
Определите, с какой деполяризацией будет протекать процесс. Напишите уравнения процессов коррозии и укажите деполяризаторы процесса.
83. Подберите анодное покрытие для сплава олово-никель. Напишите электродные процессы и суммарную реакцию коррозии во влажном воздухе при рН = 6 в случае нарушения целостности покрытия. Составьте схему образующегося коррозионного гальванического элемента.
84. В контакте находятся серебро и свинец. Какой из металлов будет корродировать и с какой деполяризацией в растворе с рН = 12. Напишите уравнения коррозионного процесса. Составьте схему коррозионного Г.Э.
85. Каким является цинковое покрытие на меди – катодным или анодным. Опишите процессы коррозии в щелочном растворе с рН = 8 при нарушении покрытия. Составьте схему коррозионного Г.Э.
86. Никель покрыт золотом и находится в растворе соляной кислоты. Коррозия никеля происходит при нарушении целостности покрытия в результате работы гальванического коррозионного элемента: опишите процессы коррозии и составьте схему коррозионного Г.Э.
87. Подберите к олову катодное и анодное покрытия. Напишите уравнения электродных процессов и суммарной реакции во влажном воздухе с рН = 4,5: а) при нарушении целостности катодного покрытия; б) при нарушении целостности анодного покрытия.
88. Какой из металлов(никель, железо, алюминий) может быть протектором от коррозии кадмия в растворе с рН = 10. Напишите уравнения протекающего процесса коррозии с выбранным протектором. Составьте схему коррозионного Г.Э.
89. Какие металлы (железо, олово, медь, серебро, цинк) будут разрушаться в воде (рН = 7), из которой удален кислород? Для одного из корродирующих металлов напишите уравнения электродных процессов и суммарной реакции коррозии. Составьте схему коррозионного Г.Э.
90. Напишите уравнения электродных реакций и суммарного процесса коррозии кобальта в водном растворе с рН =3: а) в присутствии кислорода, б) в отсутствии кислорода. Составьте схемы коррозионных Г.Э.
Электрохимическая коррозия металлов
Коррозия - это самопроизвольно протекающий процесс разрушения металлов в результате химического или электрохимического взаимодействия их с окружающей средой.
Электрохимическая коррозия - наиболее распространенный вид коррозии металлов, это разрушение металла в среде электролита с возникновением внутри системы электрического тока. Примером коррозионных процессов электрохимического характера является разрушение деталей машин и различных металлических конструкций в почвенных, грунтовых, речных и морских водах, во влажной атмосфере, в технических растворах, под действием смазочно-охлаждающих жидкостей, применяемых при механической обработке металлов и т.д.
Причиной электрохимической коррозии является образование на поверхности металла большого количества микрогальванических пар, которые возникают по следующим причинам:
1. Наличие примесей металлов или других веществ, отличающихся по активности от основного металла.
2. Структурная неоднородность поверхности металла, что определяет наличие участков с разной активностью.
3. Неравномерность распределения деформаций в металле после термической и механической обработки и др.
При электрохимической коррозии на поверхности металла одновременно протекают два процесса:
- анодный - окисление металла: Ме - n? = Me n+
- катодный - восстановление ионов водорода в кислой среде:
2H + + 2e = H2 или молекул кислорода, растворенного в воде, в случае атмосферной коррозии:
Ионы или молекулы, которые восстанавливаются на катоде, называются деполяризаторами. При атмосферной коррозии - коррозии во влажном воздухе при комнатной температуре - деполяризатором является кислород.
Пример 20. Как происходит коррозия цинка, находящегося в контакте с кадмием в нейтральном и кислом растворах? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Решение. При таком контакте возникает коррозионный гальванический микроэлемент. Цинк имеет более отрицательный потенциал (-0,763 В), чем кадмий (-0,403) (табл. 12.1), поэтому он является анодом, а кадмий - катодом.
Анодный процесс: Zn - 2? = Zn 2+ .
Катодный процесс: в кислой среде: 2H + + 2? = H2 ;
в нейтральной среде: 2H2O + O2 + 4? = 4OH - .
Так как ионы Zn 2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом коррозии в нейтральной среде будет Zn(OH)2.
Скорость коррозии тем больше, чем сильнее различаются электродные потенциалы металлов, т.е. чем дальше они расположены друг от друга в ряду напряжений. Кроме того, скорость коррозии повышается при увеличении концентрации электролита и повышении температуры.
Защита от коррозии.
Все методы защиты условно делятся на следующие группы:
1. Легирование металлов. Это эффективный, хотя и дорогой метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивность металла вследствие образования на их поверхностях прочных оксидных пленок. В качестве таких компонентов применяют хром, никель, вольфрам и др.);
2. Защитные покрытия (металлические, неметаллические). Металлические покрытия подразделяются на анодные и катодные. При анодном покрытии металл покрывается более активным металлом, расположенным в ряду напряжения левее, например железо – цинком, и вэтом случае при коррозии идет окисление цинка. При катодном покрытии металл покрывается менее активным металлом, например железо - оловом, и в этом случае при коррозии тдет окисление железа;
3. Электрохимическая защита (этот метод основан на торможении анодных или катодных реакций коррозионного процесса. Защита осуществляется присоединением к защищаемой конструкции металла с более отрицательным значением электродного потенциала - протектора, а также катодной или анодной поляризацией за счет тока от внешнего источника);
4. Изменение свойств коррозионной среды. Для снижения агрессивности среды уменьшают концентрацию компонентов, опасных в коррозионном отношении, например снижают концентрацию Н + - ионов – подщелачивание, удаляют кислород и др.
Пример 21. Какие процессы протекают при коррозии оцинкованного и луженого железа?
а) в кислой среде;
Решение. 1. Оцинкованное железо получают, покрывая железо тонким слоем цинка. При таком контакте возникает гальванический элемент. Цинк имеет более отрицательный потенциал (-0,763 В), чем железо (-0,44 В) (табл. 7.1), поэтому он является анодом, а железо - катодом. а) Схема ГЭ записывается в кислой среде:
Анодный процесс: Zn - 2? = Zn 2+ ;
катодный процесс: 2H + + 2? = H2 .
Следовательно, цинк в этом случае корродирует вместо железа. Подобная защита металла, при которой он играет роль катода в процессе электрохимической коррозии, называется катодной защитой, а цинк в этом случае является анодным покрытием.
б) Для коррозии на воздухе схема ГЭ: (-) Zn ½ H2O, O2 ½ Fe (+).
катодный процесс: 2H2O + O2 + 4? = 4OH - .
Цинк защищает железо от коррозии даже после нарушения целостности покрытия.
2. Так называемую «белую жесть» получают, покрывая тонким слоем олова листовое железо. Сравнение электродных потенциалов железа (-0,44 В) и олова (-0,13 В) показывает, что железо окисляется легче олова, поэтому железо в этой паре играет анода.
a) В кислой среде: (-) Fe ½ HCl ½ Sn (+).
Анодный процесс: Fe - 2?= Fe 2+ ;
б) Во влажной атмосфере: (-) Fe ½ H2O, O2 ½ Sn (+).
Суммарный процесс: 2Fe + 2H2O + O2 = 2Fe 2+ + 4OH - .
Олово защищает железо лишь до тех пор, пока защитный слой остается неповрежденным. Стоит только его повредить, как на железо начинают воздействовать воздух и влага. Олово даже ускоряет коррозию железа, потому что служит катодом в электрохимическом процессе коррозии. Подобная защита металла, при которой он играет роль анода в процессе электрохимической коррозии, называется анодной защитой, а олово в этом случае является катодным покрытием.
Пример 22. Как будет протекать процесс коррозии в том случае, если железную водосточную трубу прибить к дому алюминиевыми гвоздями?
Решение. Сравнение электродных потенциалов железа (-0,44 В) и алюминия (-1,7 В) показывает, что алюминий этой паре является анодом, а железо - катодом. Схема ГЭ:
Таким образом, вблизи алюминиевого гвоздя труба будет защищена от коррозии. Однако алюминиевый гвоздь должен в этих условиях быстро корродировать, и в конце концов труба упадет. Продуктом коррозии будет белый порошок гидроксида алюминия.
Анодный процесс: Al - 3? = Al 3+ , х4
катодный процесс: 2H2O + O2 + 4? = 4OH - . х3
Суммарный процесс: 4Al + 6H2O + 3O2 = 4Fe 2+ + 12OH - .
Коррозия железа
Процесс коррозии железа чаще всего сводится к его окислению кислородом воздуха или кислотами, содержащимися в растворах, и превращению его в оксиды. Коррозия металлов (ржавление) вызывается окислительно-восстановительными реакциями, протекающими на границе металла и окружающей среды. В зависимости от механизма возникновения, различают такие виды коррозии железа, как: химическая, электрохимическая и электрическая.
Процесс химической коррозии железа
Окислительно-восстановительные реакции в данном случае проходят через переход электронов на окислитель. В процессе коррозии такого типа кислород воздуха взаимодействует с поверхностью железа. При этом образуется оксидная пленка, которая называется ржавчиной:
В отличие от плотно прилегающих оксидных пленок, которые образуются в процессе коррозии на щелочных металлах, алюминии, цинке, рыхлая оксидная пленка на железе свободно пропускает к поверхности металла кислород воздуха, а также другие газы и пары воды. Это способствует дальнейшей коррозии железа.
Процесс электрохимической коррозии
Этот вид коррозии проходит в среде, которая проводит электрический ток. Металл в грунте подвергается, преимущественно, электрохимической коррозии. Процесс коррозии такого типа – это результат химических реакций с участием компонентов окружающей среды. Также электрохимическая коррозия возникает в случае контакта металлов, находящихся в ряду напряжений на некотором расстоянии друг от друга, в результате чего возникает гальваническая пара катод-анод.
Атмосферный и грунтовый процесс коррозии выражается схемой:
В результате образуется ржавчина различной расцветки, что обусловлено тем, что образуются различные окислы железа. Какое именно вещество образуется в процессе коррозии железа, зависит от давления кислорода, влажности воздуха, температуры, длительности процесса, состава железного сплава, состояния поверхности изделия и т. д. Скорость разрушения разных металлов различна.
Процесс коррозии металла в растворах электролитов – это результат работы большого количества микроскопических гальванических элементов, у которых в качестве катода выступают примеси в металле, а в качестве анода – сам металл. В результате чего возникают микроскопические гальванические элементы.
Также атомы железа на разных участках имеют различную способность отдавать электроны (окисляться). Участки металла, на котором протекает этот процесс, выступают в роли анода. Остальные участки – катодные, на которых происходят процессы восстановления воды и кислорода:
Результат – из ионов железа (II) и гидроксид-ионов образуется гидроксид железа (II). Далее идет его окисление до гидроксида железа (III) – основного компонента ржавчины:
Для того чтобы гальванический элемент работал, необходимо наличие двух металлов различной химической активности и среды, которая проводит электрический ток, – электролита. При контакте железа и другого металла (например, цинка) коррозия железа замедляется, а более активного металла (цинка) – ускоряется. Это обусловлено тем, что поток электронов идет от более активного металла (анода) к менее активному металлу (катоду). Так, при контакте железа с менее активным металлом, коррозия железа ускоряется.
Процесс электрической коррозии
Такой вид разрушения металлических подземных конструкций, кабелей и сооружений могут вызывать блуждающие токи, исходящие от трамваев, метро, электрических железных дорог и различных электроустановок с постоянным током.
Ток с металлических конструкций выходит в грунт в виде положительных ионов металла – происходит электролиз металла. Участок выхода токов – это анодные зоны. Именно в них и протекают активные процессы электрической коррозии железа. Блуждающие токи могут достигать 300 А и действовать в радиусе нескольких десятков километров.
Блуждающими токами, исходящими от источников переменного тока, вызывается слабая коррозия подземных стальных конструкций, и сильная – конструкций из цветных металлов. Защита металлических конструкций от коррозии является очень важной задачей, так как она причиняет огромные убытки.
Коррозия при непосредственном контакте различных металлов
Рассмотрим коррозию железа, находящегося в контакте с медью в кислой среде, например водном растворе НС1(рис.11). В образующемся гальваническом элементе анодом является железо (Е° Fe/Fe2+ = -0,44 В), а като-
Рисунок 11- Коррозии железа при контакте с медью в кислой среде (рН <7)
Следовательно, железо на поверхности окисляется, образующиеся при этом свободные электроны перемещаются от железа к меди (на катод), где участвуют в процессе восстановления ионов водорода (Н + ), находящихся в электролите (рН < 7):
Анод: Fe│ Fe° - 2 е → Fe 2+
Катод: Сu | 2Н + +2 ё → Н2
Если в электролите не содержится кислоты (рН > 7), то анодный процесс не изменится, но на катоде будет восстанавливаться растворённый в воде кислород:
При контакте железа с металлом, имеющим меньший потенциал, например с цинком (E°Zn/Zn2+ = - 0,76 В), в возникающем гальваническомэлементе анодом будет являться цинк, а катодом - железо. Коррозии в данном случае будет подвергаться цинк, а железо разрушаться не будет, так как катодные реакции не затрагивают металл катода:
Анод: Zn│Zn° - 2 ё → Zn 2+
Катод: Fe │2Н + + 2 ё → Н2 (в кислой среде),
Анод:Zn│Zn° - 2 ё → Zn│2
Катод: Fe │О2+2Н2О + 4ё →4(ОН) - │1(в отсутствие кислоты)
Таким образом, контакт с цинком предотвращает коррозию железа, что часто используется для защиты стальных изделий от коррозии. Соединения металлов в сплавах также обладают электропроводностью, а следовательно, могут участвовать в работе гальванических элементов.
Рассмотрим атмосферную коррозию стали (рис. 12).
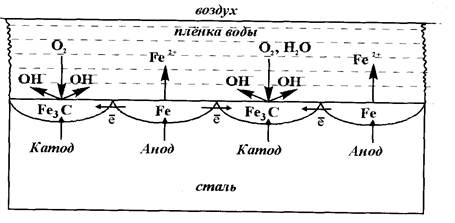
Рисунок 12 - Атмосферная коррозия стали
В составе стали всегда имеются кристаллиты феррита (железо) и цементита (карбид железа - Fe3C). Так как Е°Fе< Е°Fе3С , то при наличии влаги (электролита) на поверхности стали между кристаллами Fe и Fe3C возникает множество микрогальванических элементов, в которых анодом будут частицы железа (феррита), а катодом - кристаллиты цементита:
Анод:Fe │Fe° - 2 ё → Fe 2+ │2
Образующиеся на аноде и катоде ионы соединяются в нерастворимый гидроксид:
который быстро окисляется кислородом воздуха:
Получающийся таким образом Fe(OH)3 составляет основу ржавчины.При высыхании он может частично или полностью терять воду, превращаясь в метагидроксид FeO(OH), или Fe2О3. Ржавчина представляет собой бурый, рыхлый налет, не защищающий металл от дальнейшего разрушения.
2) Коррозия при неравномерной аэрации разных участков поверхности одного металла
Неравномерная аэрация означает неодинаковое содержание кислорода воздуха в электролите (воде) у разных участков поверхности металла. Известно, что с ростом концентрации растворённого в электролите (воде) кислорода, возрастает и значение электродного потенциала металла.
Если на гладкую железную пластинку нанести каплю водного раствора соли (например, NaCl), то по краям капли (там, где кислорода больше) образуются катодные участки, а анод будет находиться там, где содержание кислорода меньше всего - в центре капли. Там же (на аноде) будет происходить окисление, то есть коррозия железа. По краям капли на поверхности железной пластинки происходит восстановление кислорода с образованием ионов ОН - . Эти ионы образуют с ионами железа нерастворимые гидроксиды (ржавчина) в виде колец между центром и краями капли, как показано на рис.13.
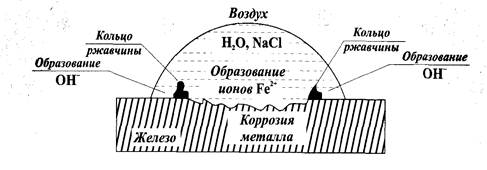
Рисунок 13 - Коррозия железа в условиях неравномерной аэрации
Запишем анодный и катодный процессы:
Анод: Fe - центр капли│Fe° - 2 ё → Fe 2+ │2
Катод: Fe - край капли│О2+2Н2О + 4ё →4(ОН) - │1
Аналогичные процессы будут происходить и в других случаях неравномерной аэрации: коррозии в первую очередь подвергается тот участок поверхности металла, доступ кислорода воздуха к которому затруднён.
3) Коррозия под действием блуждающих токов
Источником подземных блуждающих токов могут быть различные устройства, работающие на постоянном токе. Это электропоезда, метро, трамваи, троллейбусы, установки для электросварки, электролизёры и т.д. Коррозию под действием внешнего источника электрического тока называют электрокоррозией.
Рассмотрим коррозию подземного стального трубопровода во влажной почве под действием блуждающих токов (рис.14).
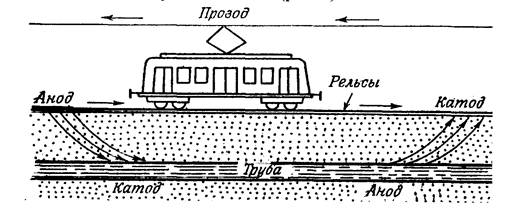
Рисунок 14 - Коррозия подземных коммуникаций под действием блуждающих токов
В месте входа тока в трубопровод возникает катодный участок, и на этом участке будет протекать реакция восстановления молекулярного кислорода, находящегося во влажной почве. Участок металла трубопровода, где происходит выход тока, становится анодом и разрушается.
Анод: Fe│Fe° - 2 ё → Fe 2+ │2
Коррозия под действием блуждающих токов обычно приводит к быстрому разрушению подземных металлических конструкций.
Совместимость металлов или как избежать гальванической коррозии?

Контактная коррозия происходит при непосредственном контакте двух разнородных металлов. Нельзя, к примеру, соединять алюминиевые листы медной заклепкой, так как при определенных условиях они образуют сильную гальваническую пару.
Разные металлы имеют разные электродные потенциалы. В присутствии электролита один из них играет роль катода, а другой анода. В результате химической реакции, протекающей между ними, начнется коррозионный процесс, в котором медь (катод) будет беспощадно разрушать алюминий (анод).
Почти все пары разнородных металлов, находящиеся в контакте между собой, подвержены коррозии, так как даже влага из воздуха может выступить в роли электролита и активировать их электродный потенциал. Но одни пары уязвимы в большей степени, а другие – в меньшей.
Например, алюминий отлично контактирует с оцинкованной сталью, хромом и цинком, а латунь совершенно не «дружит» со сталью, алюминием и цинком. Чтобы узнать, какие металлы совместимы, а какие нет, обратимся к основам химии.
В ряду электрохимической активности металлы стоят в следующей последовательности:

Электрохимический ряд напряжения металлов
Для примера рассмотрим пару алюминий – медь. Алюминий стоит в ряду слева от водорода и имеет электроотрицательный потенциал равный -1.7В, а медь находится справа и имеет положительный потенциал +0.4В. Большая разница потенциалов приводит к разрушению более активного алюминия. Медь сильнее всех, впереди стоящих элементов, поэтому в паре с любым из них она выйдет победителем. Чем дальше друг от друга в ряду стоят элементы, тем выше их несовместимость и вероятность протекания гальванической коррозии.
Данные о совместимости некоторых металлов представлены в таблице:
| Алюминий | Латунь | Бронза | Медь | Оцинкованная сталь | Железо | Свинец | Нержавеющая сталь | Цинк | |
| Алюминий | Д | Н | Н | Н | Д | О | О | Д | Д |
| Медь | Н | О | О | Д | О | Н | О | Н | Н |
| Оцинкованная сталь | Д | О | О | О | Д | О | Д | О | Д |
| Свинец | О | О | О | О | Д | Д | Д | О | Д |
| Нержавеющая сталь | Д | Н | Н | Н | О | О | О | Д | Н |
| Цинк | Д | Н | Н | Н | Д | Н | Д | Н | Д |
Д – абсолютно допустимые контакты (низкий риск ГК);
О – ограничено допустимые контакты (средний риск ГК);
Н – недопустимые контакты (высокий риск ГК).
Приведенная таблица может служить кратким справочником для определения совместимости некоторых конструкционных металлов. Допустимость и недопустимость контактов разнородных в электрохимическом отношении металлов устанавливает ГОСТ 9.005-72.
Пример недопустимых гальванических пар:

Гальваническое действие может возникнуть, если строительную конструкцию из нержавеющей стали скреплять оцинкованными болтами. В этой нежелательной паре пострадает высоко анодный крепеж, поскольку его электроны будут перемещаться в направлении катодной нержавеющей стали. Поэтому, крепежные детали должны быть изготовлены из менее гальванически активного металла, чем материал металлоконструкции.

На скорость течения гальванокоррозии оказывает влияние площадь поверхности анода и катода. Если большой по размеру анод соединить с маленьким катодом, то анод будет ржаветь медленно, а если сделать наоборот, то быстро. Например, используйте болты из нержавеющей стали для крепления алюминия, но не наоборот.
Степень интенсивности протекания контактной коррозии зависит и от условий эксплуатации соединения. В обычных атмосферных условиях процесс будет протекать менее быстро и возрастает в агрессивной электропроводной среде, например, растворах кислот и щелочей. Присутствие в воде других веществ увеличивает проводимость электролита и скорость коррозии. Поэтому при проектировании конструкций важна оценка окружающей среды.
Как защитить конструкцию или узел от контактной коррозии?
Если по конструктивным соображениям невозможно избежать нежелательного контакта разнородных металлов, то можно попытаться уменьшить гальваническую коррозию с помощью следующих методов:
- окраска поверхностей в районе их стыка;
- нанесение совместимых металлических покрытий;
- изоляция соединения от внешней среды;
- электрическая изоляция;
- установка неметаллических прокладок, вставок, шайб в болтовых соединениях.
Практика показывает, что в тех случаях, когда пренебрегают требованиями к допустимости контактов разных металлов, приходится дорого за это расплачиваться. Неправильная компоновка контактных пар выводит из строя узлы крепления, металлоконструкции и может стоять человеческой жизни.
Нержавеющая сталь, это сплав с хромом и никелем в основном, кстати которых в приведенном ряду нет. Хром стоит между цинком и железом (ближе к цинку), никель - после железа. Собственно поэтому непросто говорить про поведение нержавеющих сталей, многое зависит от соотношения содержания этих элементов. Хрома существенно больше, но не знаю, как это влияет на электрохимическую активность (возможно зависимость совсем не линейна, да и разница потенциалов там разная, не симметрично эти металлы относительно железа стоят). Всё ещё пишут про зависимость от количества углерода. Высокоуглеродистые стали и чугуны менее коррозионностойкие.
Алюминий и нержавейка на яхте вместе не живут. Может из за влаги и соли в воздухе, может еще по какой причине но это факт.
Дмитрий, нержавейка-алюминий нежелательный контакт - это ваши догадки?
Нержавейка-алюминий нежелательный контакт, а в таблице стоит ДА .
Очень нужная статья. Только бы побольше вариантов крепления с алюминием в трущейся паре
Болты из алюминия - свежо!
Нержавеющая сталь - это в основном железо. Оно рядом с цинком. Кто там пару создаёт?
В целом очень поверхностная заметка.
Читайте также:
