При образовании ионной связи электроны переходят от атомов металлов к атомам неметаллов
Обновлено: 18.05.2024
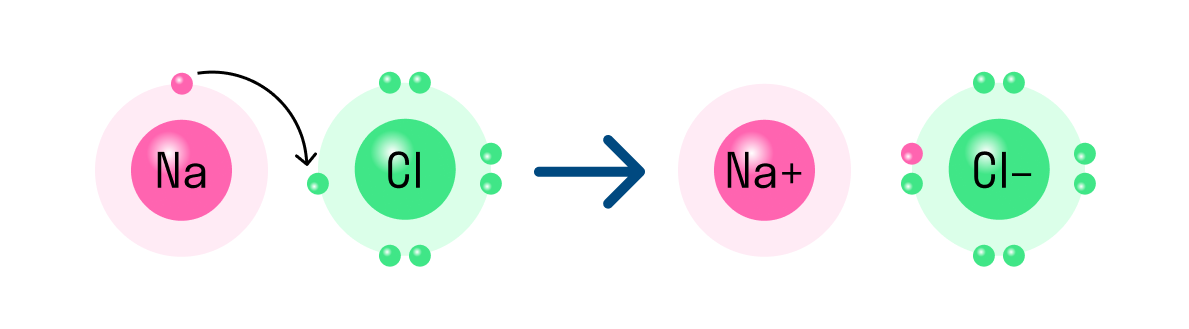
Для атома существует две основные возможности подчиниться правилу октета . Первая из них — образование ионной связи. (Вторая — образование ковалентной связи , о ней речь пойдет ниже). При образовании ионной связи атом металла теряет электроны, а атом неметалла приобретает. Для примера рассмотрим электронное строение атомов натрия и хлора:
Na 1s 2 2s 2 2 p 6 3 s 1 — один электрон на внешнем уровне
Cl 1s 2 2s 2 2 p 6 3 s 2 3 p 5 — семь электронов на внешнем уровне
Если атом натрия передаст свой единственный Зs-электрон атому хлора, правило октета будет выполнено для обоих атомов. У атома хлора окажется восемь электронов на внешнем третьем слое, а у атома натрия — тоже восемь электронов на втором слое, который теперь стал внешним:
Na + 1s 2 2s 2 2 p 6 — восемь электронов на внешнем уровне
Cl — 1s 2 2s 2 2 p 6 3 s 2 3 p 6 — восемь электронов на внешнем уровне
При этом ядро атома натрия по-прежнему содержит 11 протонов, но общее число электронов уменьшилось до 10. Это означает, что число положительно заряженных частиц на одну превышает число отрицательно заряженных, поэтому общий заряд „атома” натрия равен +1.
„Атом” хлора теперь содержит 17 протонов и 18 электронов и его заряд равен -1.
Заряженные атомы, образовавшиеся в результате потери или приобретения одно или нескольких электронов, называются ионами . Положительно заряженные ионы получили название катионов , а отрицательно заряженные называются анионами .
Катионы и анионы, имея противоположные заряды, притягиваются друг к другу электростатическими силами. Это притяжение противоположно заряженных ионов и называется ионной связью . Она возникает в соединениях, образованных металлом и одним или более неметаллами. Нижеперечисленные соединения удовлетворяют этому критерию и имеют ионную природу: MgCl 2 , Fel 2, CuF, Na 2 0, Na 2 S0 4 , Zn(C 2 H 3 0 2 ) 2.
Есть и другой способ изображения ионных соединений:

Образование ионной связи
В этих формулах точками показывают только электроны, находящиеся на внешних оболочках ( валентные электроны ). Такие формулы называют формулами Льюиса в честь американского химика Г. Н. Льюиса, одного из основоположников (наряду с Л. Полингом) теории химической связи.
Перенос электронов от атома металла к атому неметалла и образование ионов возможны благодаря тому, что неметаллы имеют высокую электроотрицательность, а металлы — низкую.
Из-за сильного притяжения ионов друг к другу ионные соединения в большинстве своем твердые и имеют довольно высокую температуру плавления.
Ионная связь образуется при переносе электронов от атома металла к атому неметалла. Образовавшиеся при этом ионы притягиваются друг к другу электростатическими силами.
Ионная связь
В этом материале речь пойдет о том, что такое ионная связь и чем она отличается от других видов, которые изучают на уроках химии в 8 классе.
О чем эта статья:
Общие сведения о химических связях
Давайте вспомним, как образуются химические связи. Для этого представим атом: он состоит из ядра с положительным зарядом и набора отрицательно заряженных электронов, которые располагаются на нескольких уровнях. Внешний уровень называется валентным, на нем располагаются валентные электроны. Они могут образовывать пары или быть свободными, т. е. неспаренными.
Во взаимодействии двух атомов участвуют свободные электроны внешней оболочки. Сколько таких электронов имеется у атома — столько химических связей он может образовать.
При этом каждый атом стремится приобрести устойчивую конфигурацию — двух- или восьмиэлектронную внешнюю оболочку, подобную той, что есть у инертного газа. Атом может достичь ее, отдавая или принимая часть электронов, а также образуя общую электронную пару с другим атомом. Если в результате получается два разноименно заряженных иона, говорят об ионном типе связи. Он характерен для взаимодействия атомов металла и неметалла.
Определение ионной связи
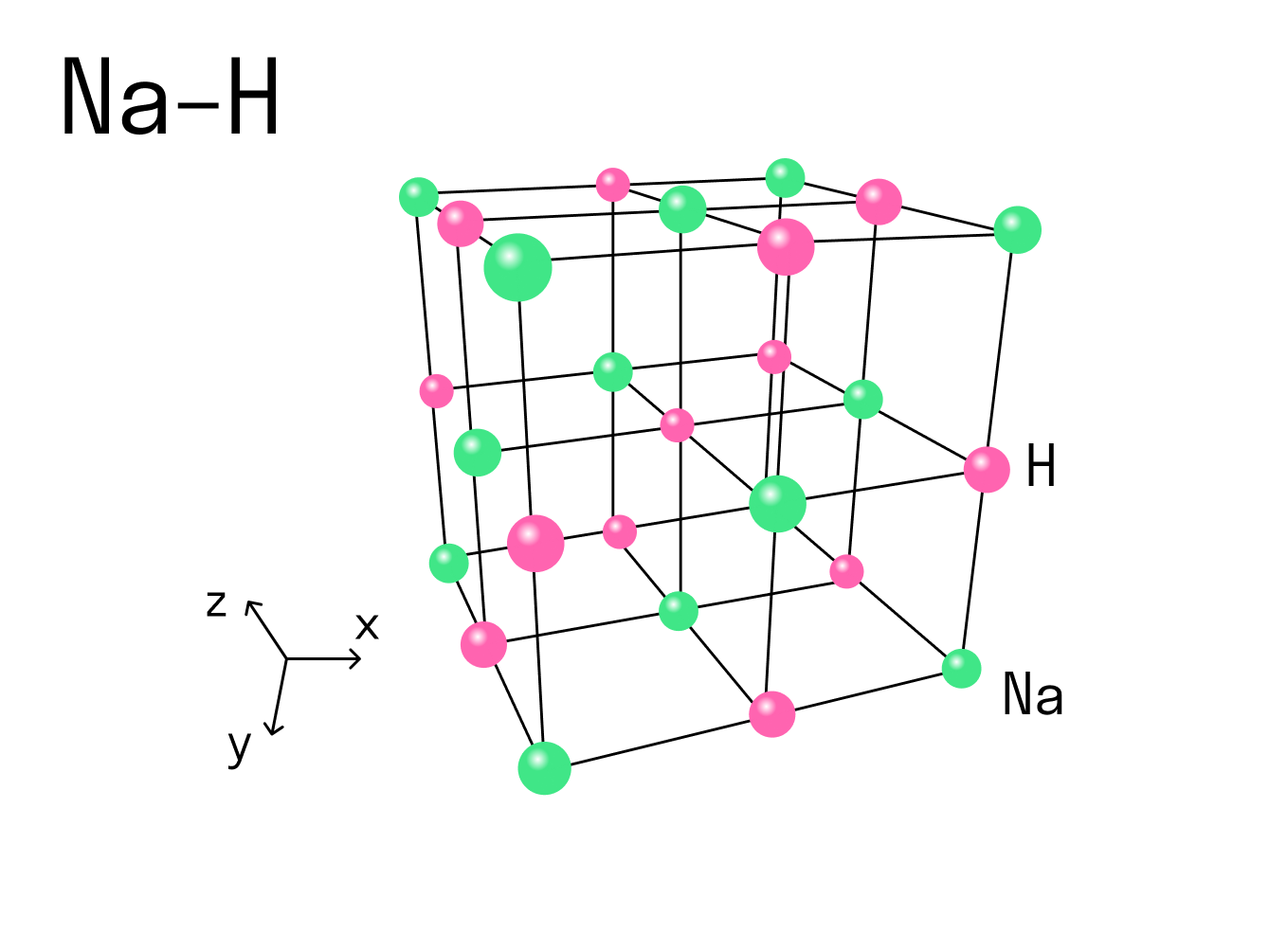
Рассмотрим этот тип связи на примере реакции натрия и водорода, в результате которой получается гидрид натрия. У атома натрия Na есть один свободный электрон на внешнем уровне, в то время как атому водорода H не хватает одного электрона, чтобы завершить внешнюю оболочку и принять стабильную форму. Поскольку натрий имеет более низкую электроотрицательность, чем водород, он отдает свой валентный электрон и получает отрицательный заряд. Водород принимает этот электрон и получает положительный заряд. В итоге образуется два иона — катион Na + и анион H - .
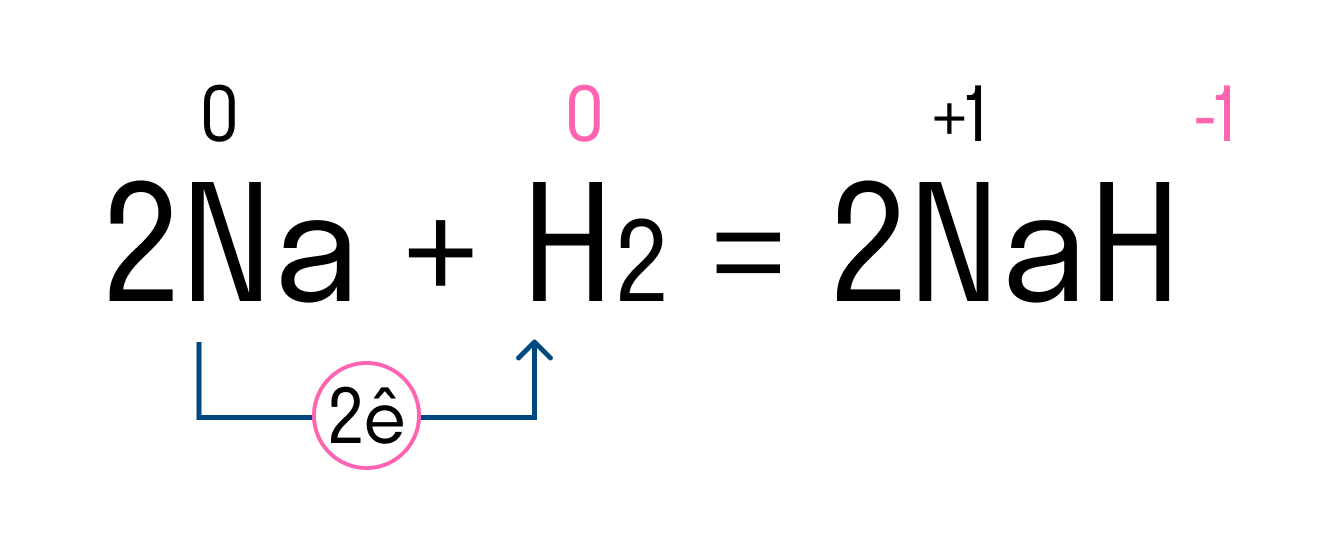
Между положительным ионом Na + и отрицательным H - возникает электростатическое притяжение, которое и удерживает их вместе. Так образуется ионная связь в гидриде натрия.
Ионная связь — это тип химической связи, характерный для разноименно заряженных ионов, которые образовались в результате отдачи и присоединения электронов атомами. В нее вступают элементы с большой разностью электроотрицательности. Обычно так взаимодействуют атомы металла и неметалла.
Чаще всего именно так связаны в соединениях щелочные и щелочноземельные металлы с галогенами. Поскольку у щелочных металлов электроотрицательность ниже, их атомы становятся катионами, а атомы галогенов — анионами.
Механизм образования ионной связи похож на донорно-акцепторный механизм ковалентной связи. Первую даже называют крайним выражением второй.
Соли аммония NH4NO3, NH4Cl, (NH4)2SO4 хоть и не являются соединениями металла и неметалла, но также образованы с помощью ионной связи.
Координационное число
Вернемся к нашему примеру с гидридом натрия и посмотрим на кристаллическую решетку, которую имеет это ионное соединение. Каждый ион Na + контактирует с шестью ионами H - . Это максимально возможное для данного иона число химических связей, оно называется координационным.
Координационное число — это количество ближайших соседей иона в ионной кристаллической решетке. По сути это количество связей, которые образует каждый ион в составе сложного вещества.
При рассмотрении ковалентной химической связи говорят о валентности — она характеризует, сколько связей есть у конкретного атома с другими атомами. Но к ионным соединениям это понятие не применяют, потому что все ионы в кристаллической решетке взаимодействуют друг с другом. Вместо этого есть координационное число, и оно отражает количество таких взаимодействий.
Примеры веществ с ионной связью
Таким же образом, как в гидриде натрия, ионы образуются и в других подобных ему соединениях. Например, в хлориде натрия NaCl атом натрия имеет один свободный электрон и отдает его атому хлора. В итоге оба завершают свой внешний уровень. Образуется ион натрия с положительным зарядом и отрицательно заряженный ион хлора.
Другой пример ионной химической связи — сульфид натрия Na2S. В данном случае у нас также есть натрий с одним свободным электроном и сера, у которой на внешнем уровне есть 2 свободных электрона из 6. Таким образом, чтобы завершить уровень и обрести стабильную форму, сере нужно 2 электрона. Поэтому в формуле сульфида серы присутствует два атома натрия.
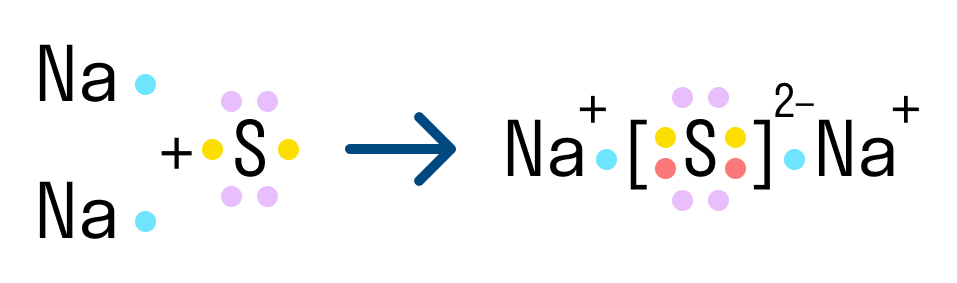
Характеристики ионной связи
Мы узнали, как образуется ионная связь, а теперь поговорим о ее характеристиках. Она существенно отличается от других типов связи между атомами.
не имеет кратности.
Разберемся в каждом пункте и начнем с направленности. Ковалентная полярная связь направлена, потому что она подразумевает смещение общей электронной пары к тому атому, который имеет большую электроотрицательность. В случае с ионами все иначе. Согласно закону Кулона притяжение между отрицательным и положительным ионом идет по прямой, соединяющей эти заряженные частицы. В кристаллической решетке все разноименно заряженные ионы взаимодействуют друг с другом и притяжение распределяется равномерно, поэтому говорят, что ионная связь не направлена.
А как насчет насыщаемости? Эта характеристика указывает на то, что атом может вступить в ограниченное количество химических связей, поскольку имеет ограниченное число неспаренных электронов. Но ионная связь — это не процесс соединения свободных электронов в пары, а взаимное притяжение ионов. Каждый ион может притягивать к себе неограниченное число ближайших соседей, поэтому нет смысла говорить о насыщаемости.
Из вышесказанного понятно, что ионная связь не имеет и кратности. Эта характеристика означает число общих электронных пар у атома, но в данном случае мы рассматриваем притяжение между ионами.

Физические свойства ионной связи
Между ионами в молекуле всегда образуется достаточно сильное притяжение, поэтому вещества с ионной связью в обычных условиях твердые и нелетучие. Такие соединения сложно разрушить при помощи тепловой энергии, что обуславливает высокую температуру кипения и плавления. При этом ионы имеют небольшой радиус взаимодействия — это придает веществам хрупкость.
Свойства ионных соединений:
растворимость в воде,
Типичным веществом с ионными связями можно считать хлорид натрия NaCl или поваренную соль. Ее кристаллы в точности соответствуют всем характеристикам.
Как определить ионную связь
Чтобы быстро понять, является ли нужное нам соединение ионным, выполните следующие действия:
Посмотрите, какие элементы входят в состав соединения. Формула вещества с ионной связью должна включать металл и неметалл. Если это щелочной металл (I группа таблицы Менделеева) и галоген (VII группа), то связь между ними точно ионная.
По шкале Полинга определите электроотрицательности обоих элементов соединения. Если разница между ними больше 1,7 — связь ионная. Это объясняется тем, что такой тип связи характерен для веществ, у которых сильно отличаются показатели электроотрицательности.
Дополнительным способом убедиться в правильности результата может стать оценка физических свойств вещества. Если оно имеет высокую температуру кипения или плавления и проводит электроток — связь скорее всего ионная.
Вопросы для самопроверки:
Опишите, как образуется ионная связь. Какие условия для этого необходимы?
Что такое координационное число элемента в ионном соединении?
Каковы основные физические свойства ионных соединений?
В чем разница между характеристиками ионной и ковалентной связей?
Как можно определить ионную связь, зная электроотрицательность элементов в соединении?
Химическая связь

Какая сила удерживает вместе атомы в молекуле вещества и почему они не разбегаются в разные стороны? Эта сила называется химической связью, школьники узнают о ней в 8 классе. Еще Ньютон предположил, что она имеет электростатическую природу, но подробнее в этом разобрались лишь в начале ХХ века. Сейчас расскажем, что такое химическая связь и какой она бывает.
Химическая связь и строение вещества
| Химическая связь — это взаимодействие между атомами в молекуле вещества, в ходе которого два электрона (по одному от каждого атома) образуют общую электронную пару либо электрон переходит от одного атома к другому. |
Как понятно из определения химической связи, при взаимодействии двух атомов один из них может притянуть к себе внешние электроны другого. Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Существует несколько систем измерения ЭО, но пользоваться для расчетов можно любой из них. Для образования химической связи важно не конкретное значение ЭО, а разница между этими показателями у двух атомов.
Механизм образования химической ковалентной связи
Существует два механизма взаимодействия атомов:
обменный — предполагает выделение по одному внешнему электрону от каждого атома и соединение их в общую пару;
донорно-акцепторный — происходит, когда один атом (донор) выделяет два электрона, а второй атом (акцептор) принимает их на свою свободную орбиталь.
Независимо от механизма химическая связь между атомами сопровождается выделением энергии. Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
| Энергией связи называют ту энергию, которая выделяется при взаимодействии атомов. Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва. |
Также на прочность влияют следующие показатели:
Длина связи — расстояние между ядрами атомов. С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
Кратность связи — количество электронных пар, появившихся при взаимодействии атомов. Чем больше это число, тем выше энергия и, соответственно, прочность связи.
На примере химической связи в молекуле водорода посмотрим, как меняется энергия системы при сокращении расстояния между ядрами атомов. По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь. Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии. Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.
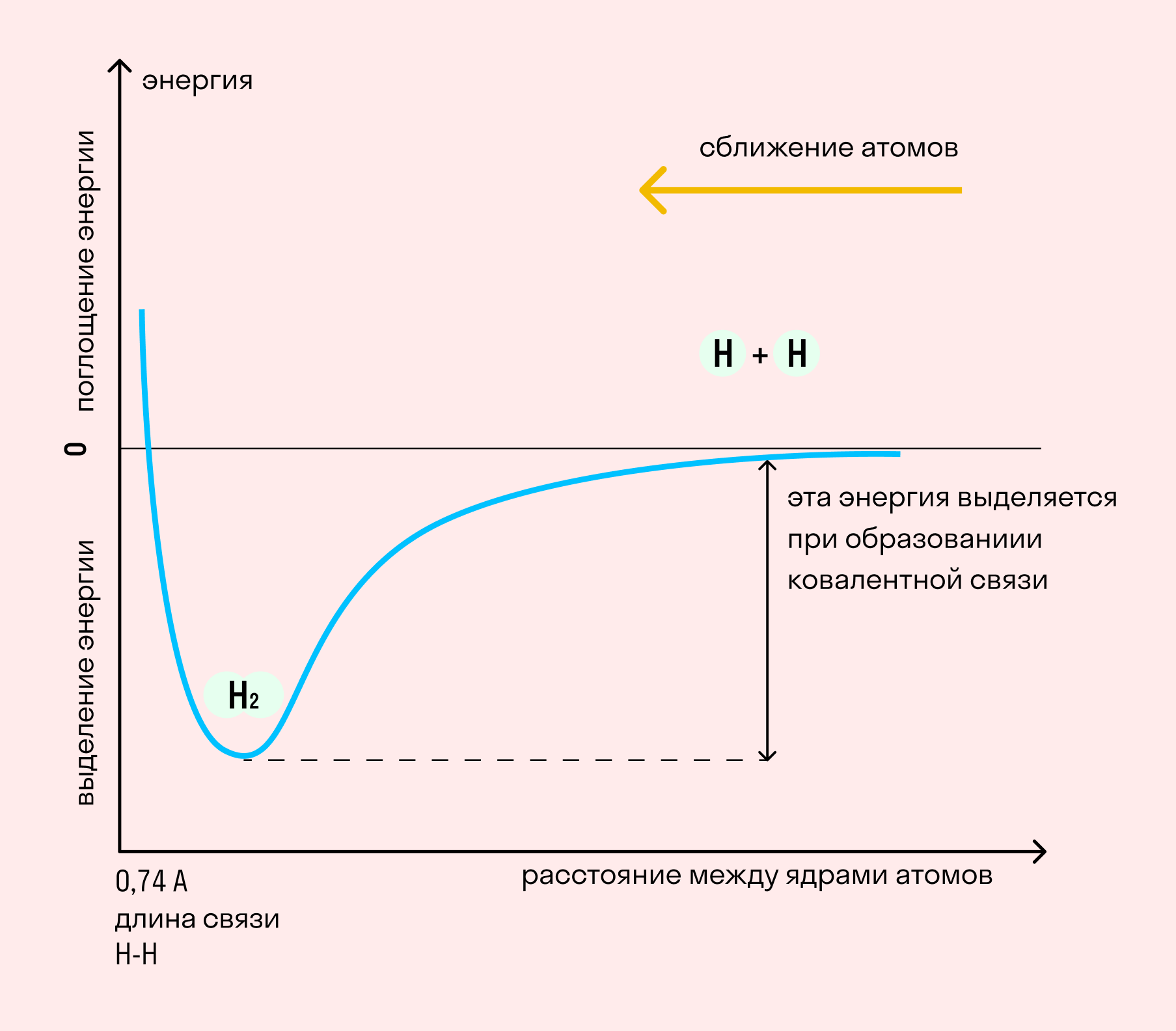
Основные типы химических связей
Различают четыре вида связей в химии: ковалентную, ионную, металлическую и водородную. Но в чистом виде они встречаются редко, обычно имеет место наложение нескольких типов химических связей. Например, в молекуле фосфата аммония (NH4)3PO4присутствует одновременно ионная связь между ионами и ковалентная связь внутри ионов.
Также отметим, что при образовании кристалла от типа связи между частицами зависит, какой будет кристаллическая решетка. Влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Основные характеристики химической связи:
насыщенность — ограничение по количеству образуемых связей из-за конечного числа неспаренных электронов;
полярность — неравномерная электронная плотность между атомами и смещение общей пары электронов к одному из них;
направленность — ориентация связи в пространстве, расположение орбиталей атомов под определенным углом друг к другу.
Ковалентная связь
Как уже говорилось выше, этот тип связи имеет два механизма образования: обменный и донорно-акцепторный. При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
| Ковалентная связь — это процесс взаимодействия между атомами с одинаковыми или близкими радиусами, при котором возникает общая электронная пара. Если эта пара принадлежит в равной мере обоим взаимодействующим атомам — это неполярная связь, а если она смещается к одному из них — это полярная связь. |
Как вы помните, сила притяжения электронов определяется электроотрицательностью атома. Если у двух атомов она одинакова, между ними будет неполярная связь, а если один из атомов имеет большую ЭО — к нему сместится общая электронная пара и получится полярная химическая связь.
В зависимости от того, сколько получилось электронных пар, химические связи могут быть одинарными, двойными или тройными.
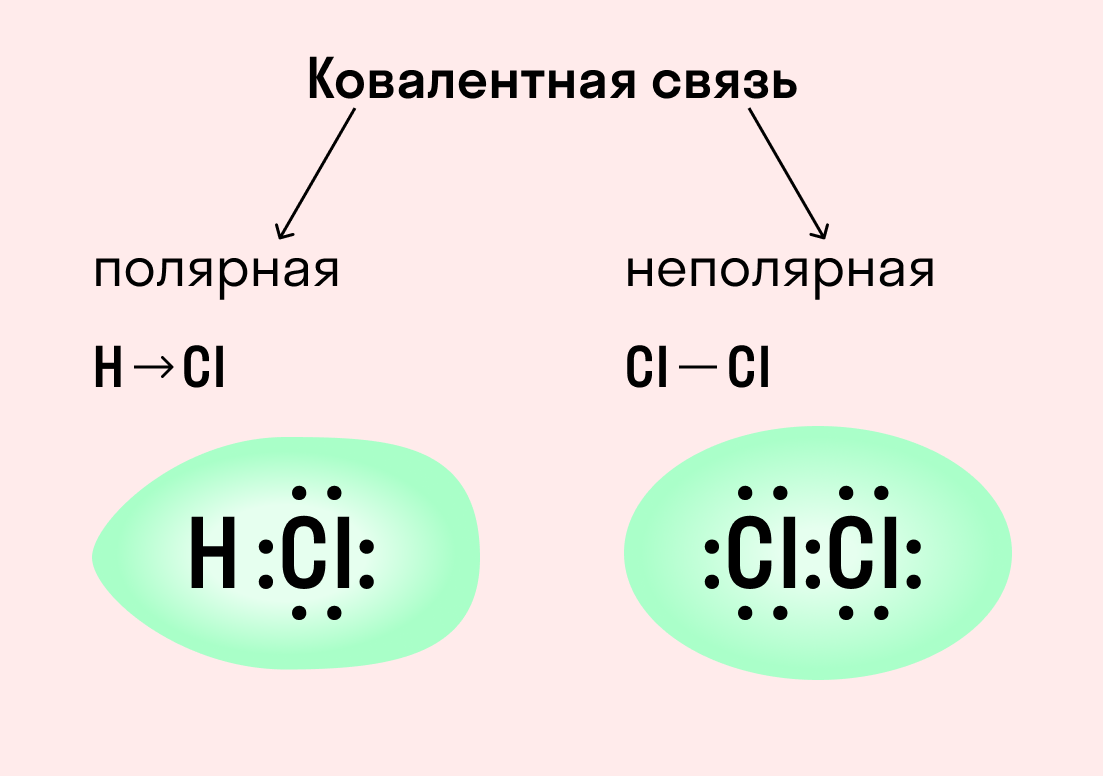
Ковалентная неполярная связь образуется в молекулах простых веществ, неметаллов с одинаковой ЭО: Cl2, O2, N2, F2 и других.
Посмотрим на схему образования этой химической связи. У атомов водорода есть по одному внешнему электрону, которые и образуют общую пару.
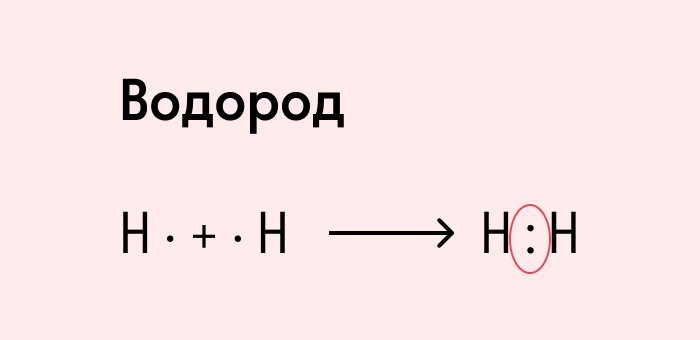
Ковалентная полярная связь характерна для неметаллов с разным уровнем ЭО: HCl, NH3,HBr, H2O, H2S и других.
Посмотрим схему такой связи в молекуле хлороводорода. У водорода имеется один свободный электрон, а у хлора — семь. Таким образом, всего есть два неспаренных электрона, которые соединяются в общую пару. Поскольку в данном случае ЭО выше у хлора, эта пара смещается к нему.
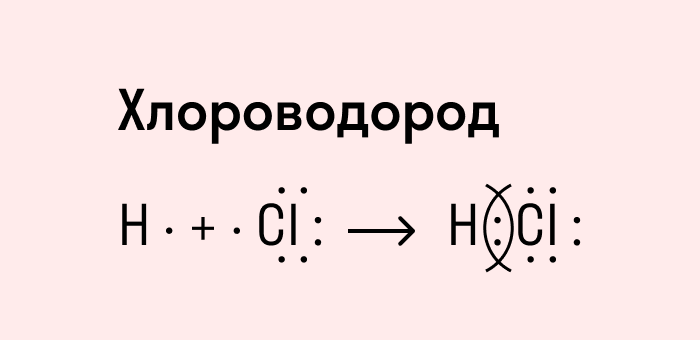
Другой пример — молекула сероводорода H2S. В данном случае мы видим, что каждый атом водорода имеет по одной химической связи, в то время как атом серы — две. Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.
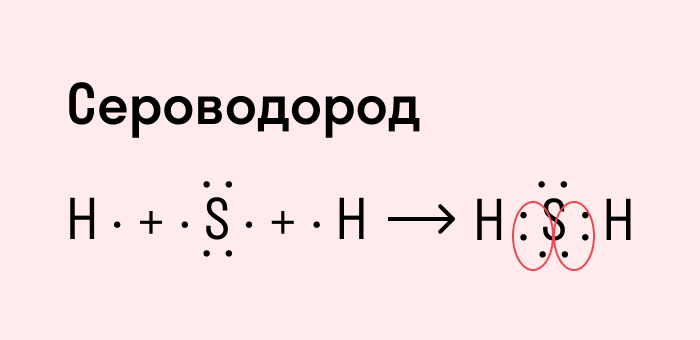
Число связей, которые могут быть у атома в молекуле вещества, называется валентностью.
Характеристики ковалентной связи:
Ионная связь
Как понятно из названия, данный тип связи основан на взаимном притяжении ионов с противоположными зарядами. Он возможен между веществами с большой разницей ЭО — металлом и неметаллом. Механизм таков: один из атомов отдает свои электроны другому атому и заряжается положительно. Второй атом принимает электроны на свободную орбиталь и получает отрицательный заряд. В результате этого процесса образуются ионы.
| Ионная связь — это такое взаимодействие между атомами в молекуле вещества, итогом которого становится образование и взаимное притяжение ионов. |
Разноименно заряженные ионы стремятся друг к другу за счет кулоновского притяжения, которое одинаково направлено во все стороны. Благодаря этому притяжению образуются ионные кристаллы, в решетке которых заряды ионов чередуются. У каждого иона есть определенное количество ближайших соседей — оно называется координационным числом.
Обычно ионная связь появляется между атомами металла и неметалла в таких соединениях, как NaF, CaCl2, BaO, NaCl, MgF2, RbI и других. Ниже схема ионной связи в молекуле хлорида натрия.

Все соли образованы с помощью ионных связей, поэтому в задачах, где нужно определить тип химической связи в веществах, в качестве подсказки можно использовать таблицу растворимости.
Характеристики ионной связи:
не имеет направленности.

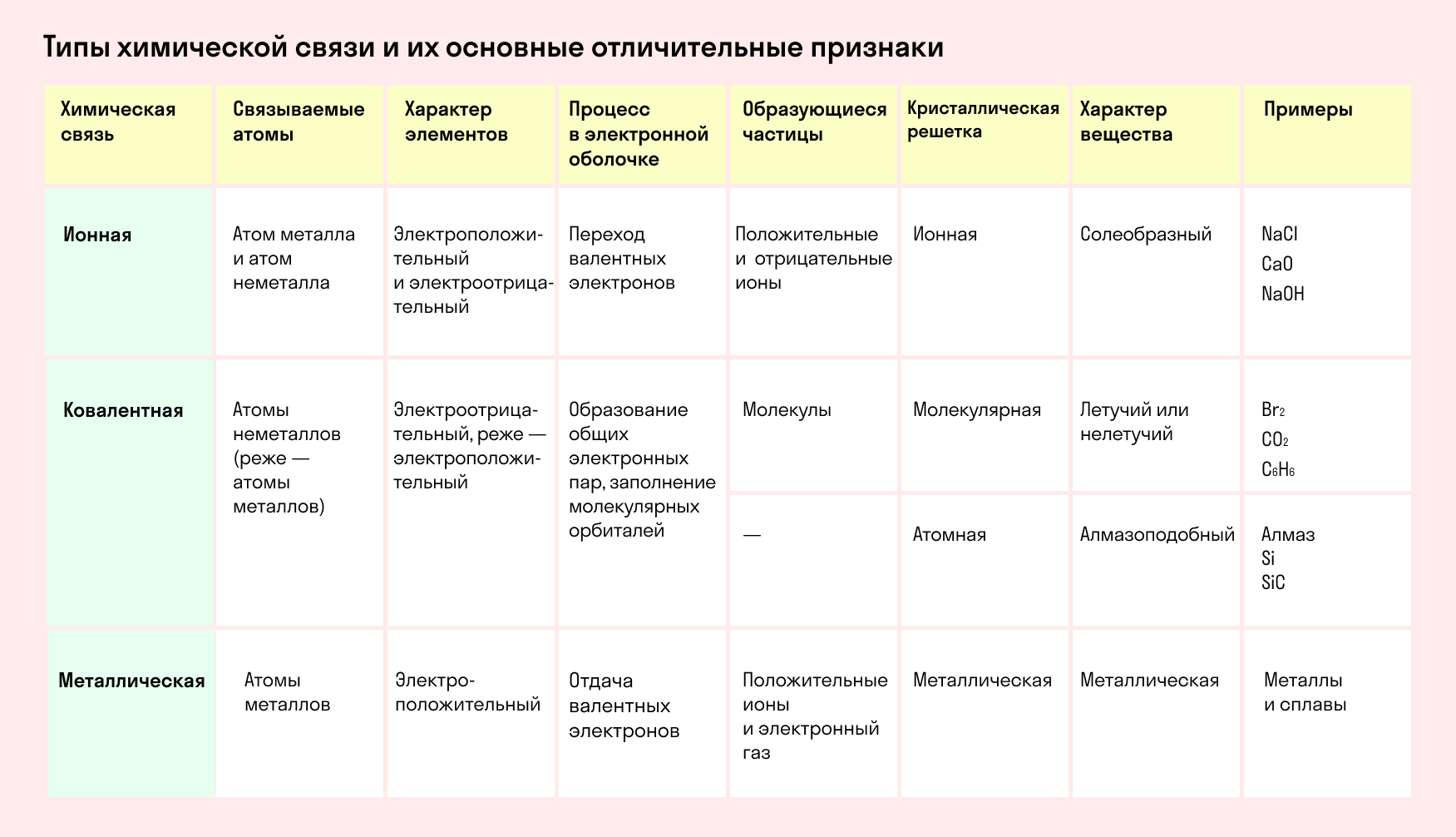
Ковалентная и ионная связь в целом похожи, и одну из них можно рассматривать, как крайнее выражение другой. Но все же между ними есть существенная разница. Сравним эти виды химических связей в таблице.
Характеризуется появлением электронных пар, принадлежащих обоим атомам.
Характеризуется появлением и взаимным притяжением ионов.
Общая пара электронов испытывает притяжение со стороны обоих ядер атомов.
Ионы с противоположными зарядами подвержены кулоновскому притяжению.
Имеет направленность и насыщенность.
Ненасыщенна и не имеет направленности.
Количество связей, образуемых атомом, называется валентностью.
Количество ближайших соседей атома называется координационным числом.
Образуется между неметаллами с одинаковой или не сильно отличающейся ЭО.
Образуется между металлами и неметаллами — веществами со значимо разной ЭО.
Металлическая связь
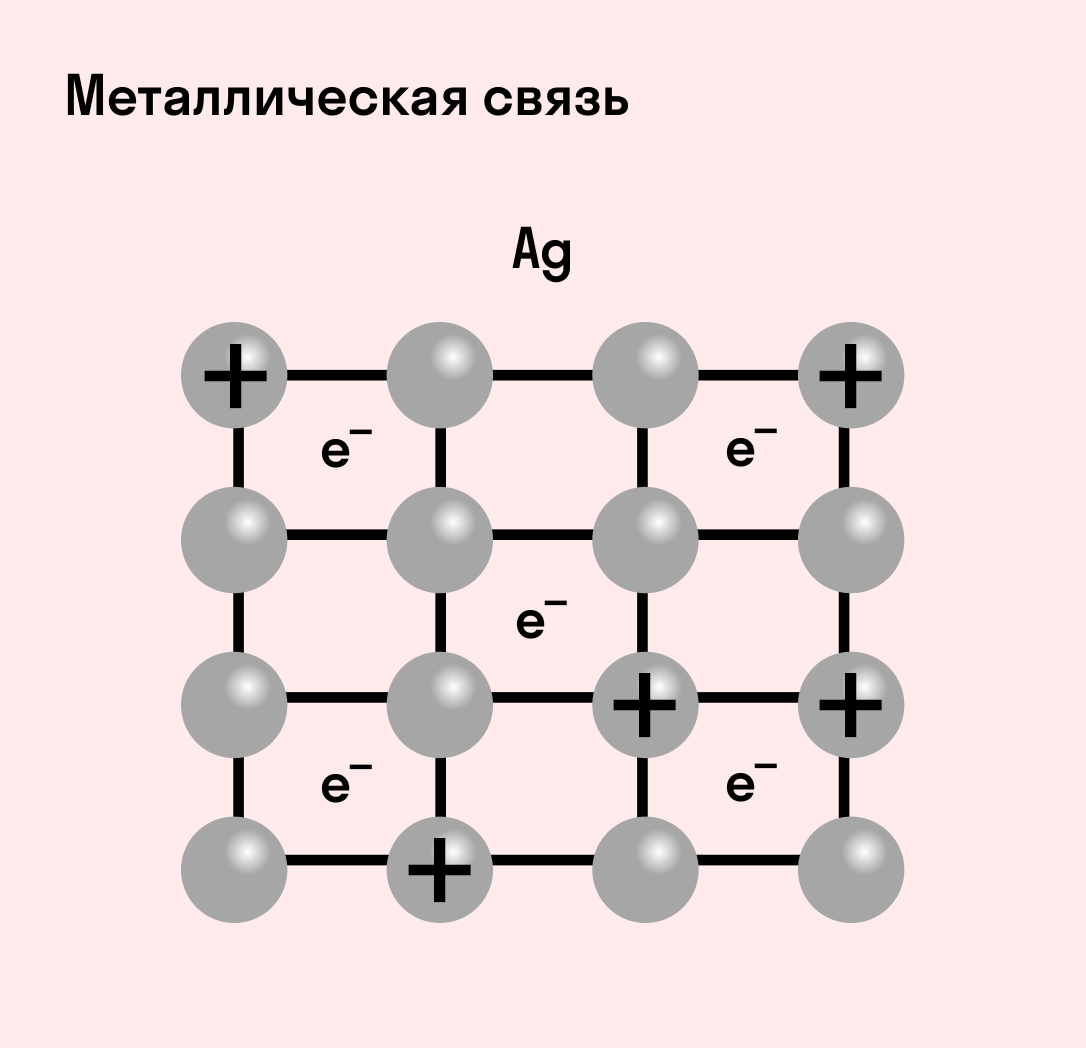
Отличительная особенность металлов в том, что их атомы имеют достаточно большие радиусы и легко отдают свои внешние электроны, превращаясь в положительно заряженные ионы (катионы). В итоге получается кристаллическая решетка, в узлах которой находятся ионы, а вокруг беспорядочно перемещаются электроны проводимости, образуя «электронное облако» или «электронный газ».
Свободные электроны мигрируют от одного иона к другому, временно соединяясь с ними и снова отрываясь в свободное плавание. Этот механизм по своей природе имеет сходство с ковалентной связью, но взаимодействие происходит не между отдельными атомами, а в веществе.
| Металлическая связь — это взаимодействие положительных ионов металлов и отрицательно заряженных электронов, которые являются частью «электронного облака», рассеянного по всему объему вещества. |
Наличие такого «электронного облака», которое может прийти в направленное движение, обусловливает электропроводность металлов. Другие их качества — пластичность и ковкость, объясняются тем, что ионы в кристаллической решетке легко смещаются. Поэтому металл при ударном воздействии способен растягиваться, но не разрушаться.
Характеристики металлической связи:
Металлическая связь присуща как простым веществам — таким как Na, Ba, Ag, Cu, так и сложным сплавам — например, AlCr2, CuAl11Fe4, Ca2Cu и другим.
Схема металлической связи:
M — металл,
n — число свободных внешних электронов.
К примеру, у железа в чистом виде на внешнем уровне есть два электрона, поэтому его схема металлической связи выглядит так:
Обобщим все полученные знания. Таблица ниже описывает кратко химические связи и строение вещества.
Водородная связь
Данный тип связи в химии стоит отдельно, поскольку он может быть как внутри молекулы, так и между молекулами. Как правило, у неорганических веществ эта связь происходит между молекулами.
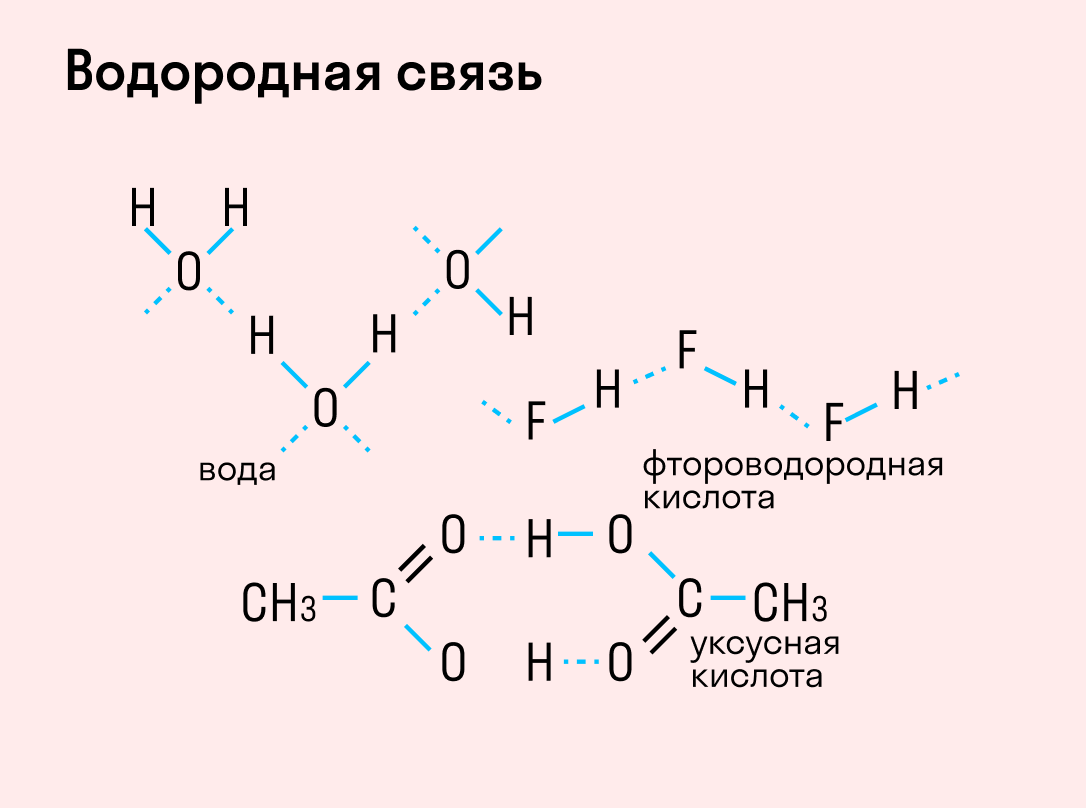
| Водородная связь образуется между молекулами, содержащими водород. Точнее, между атомами водорода в этих молекулах и атомами с большей ЭО в других молекулах вещества. |
Объясним подробнее механизм этого вида химической связи. Есть молекулы А и В, содержащие водород. При этом в молекуле А есть электроотрицательные атомы, а в молекуле В водород имеет ковалентную полярную связь с другими электроотрицательными атомами. В этом случае между атомом водорода в молекуле В и электроотрицательным атомом в молекуле А образуется водородная связь.
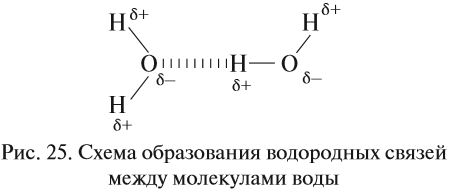
Графически водородная связь обозначается тремя точками. Ниже приведена схема такого взаимодействия на примере молекул воды.
В отдельных случаях водородная связь может образоваться внутри молекулы. Это характерно для органических веществ: многоатомных спиртов, углеводов, белковых соединений и т. д.
Характеристики водородной связи:
Кратко о химических связях
Итак, самое главное. Химической связью называют взаимодействие атомов, причиной которого является стремление системы приобрести устойчивое состояние. Во время взаимодействия свободные внешние электроны атомов объединяются в пары либо внешний электрон одного атома переходит к другому.
Образование химической связи сопровождается выделением энергии. Эта энергия растет с увеличением количества образованных электронных пар и с сокращением расстояния между ядрами атомов.
Основные виды химических связей: ковалентная (полярная и неполярная), ионная, металлическая и водородная. В отличие от всех остальных водородная ближе к молекулярным связям, поскольку может быть как внутри молекулы, так и между разными молекулами.
Как определить тип химической связи:
Ковалентная полярная связь образуется в молекулах неметаллов между атомами со сходной ЭО.
Ковалентная неполярная связь имеет место между атомами с разной ЭО.
Ионная связь ведет к образованию и взаимному притяжению ионов. Она происходит между атомами металла и неметалла.
Металлическая связь бывает только между атомами металлов. Это взаимодействие положительных ионов в кристаллической решетке и свободных отрицательных электронов. Масса рассеянных по всему объему свободных электронов представляет собой «электронное облако».
Водородная связь появляется при условии, что есть атом с высокой ЭО и атом водорода, связанный с другой электроотрицательной частицей ковалентной связью.
Химическая связь и строение молекулы: типом химической связи определяется кристаллическая решетка вещества: ионная, металлическая, атомная или молекулярная.
Металлическая связь
Теорию ионной связи предложил в 1916г. немецкий ученый В. Коссель. Эта теория объясняет образование связей между атомами типичных металлов и атомамитипичных неметаллов:CsF, CsCl, NaCl, KF, KCl, Na2O и др.
Согласно этой теории, при образовании ионной связи атомы типичных металлов отдают электроны, а атомы типичных неметаллов принимают электроны.
В результате этих процессов атомы металлов превращаются в положительно заряженные частицы, которые называются положительными ионами или катионами; а атомы неметаллов превращаются в отрицательные ионы — анионы. Заряд катиона равен числу отданных электронов.
Атомы металлов отдают электроны внешнего слоя, а образующиеся ионы имеют завершенные электронные структуры (предвнешнего электронного слоя).
Величина отрицательного заряда аниона равна числу принятых электронов.
Атомы неметаллов принимают такое количество электронов, какое им необходимо для завершения электронного октета (внешнего электронного слоя).
Например: общая схема образования молекулы NaCl из атомов Na и С1: Na°-le = Na +1 Образование ионов
Na +1 + Сl - = Nа + Сl -
Na°+ Сl°= Nа + Сl - Соединение ионов
· Связь между ионами называется ионной связью.
Соединения, которые состоят из ионов, называются ионными соединениями.
Алгебраическая сумма зарядов всех ионов в молекуле ионного соединения должна быть равна нулю,потому что любая молекула является электронейтральной частицей.
Резкой границы между ионной и ковалентнои связями не существует. Ионную связь можно рассматривать как крайний случай полярной ковалентнои связи, при образовании которой общая электронная пара полностьюсмещается к атому с большей электроотрицательностью.
Атомы большинства типичных металлов на внешнем электронном слое имеют небольшое число электронов (как правило, от 1 до 3); эти электроны называются валентными. В атомах металлов прочность связи валентных электронов с ядром невысокая, то есть атомы обладают низкой энергией ионизации. Это обусловливает легкость потери валентных электронов ч превращения атомов металла в положительно заряженные ионы (катионы):
В кристаллической структуре металла валентные электроны обладают способностью легко перемещаться от одного атома к другому, что приводит к обобществлению электронов всеми соседними атомами. Упрощенно строение кристалла металла представляется следующим образом: в узлах кристаллической решетки находятся ионы Ме п+ и атомы Ме°, а между ними относительно свободно перемещаются валентные электроны, осуществляя связь между всеми атомами и ионами металла (рис. 3). Это особый тип химической связи, называемой металлической.
· Металлическая связь — связь между атомами и ионами металлов в кристаллической решетке, осуществляемая обобществленными валентными электронами.
Благодаря этому типу химической связи металлы обладают определенным комплексом физических и химических свойств, отличающим их от неметаллов.
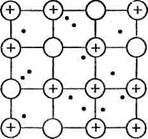
Рис. 3. Схема кристаллической решетки металлов.
Прочность металлической связи обеспечивает устойчивость кристаллической решетки и пластичность металлов (способность подвергаться разнообразной обработке без разрушения). Свободное передвижение валентных электронов позволяет металлам хорошо проводить электрический ток и тепло. Способность отражать световые волны (т.е. металлический блеск) также объясняется строением кристаллической решетки металла.
Таким образом, наиболее характерными физическими свойствами металлов в зависимости от наличия металлической связи являются:
■металлический блеск и непрозрачность;
■пластичность, ковкость, плавкость;
■высокие электро- и теплопроводность; и склонность к образованию сплавов.
Урок 4. Понятие о химической связи

В предыдущих уроках данного курса есть много рассуждений о том, что вещество состоит из молекул, что молекулы состоят из атомов. А не возникал ли у вас вопрос: почему атомы, составляющие молекулу, не разлетаются в разные стороны? Что удерживает атомы в молекуле?
Их удерживает химическая связь.
Химическая связь — совокупность сил, которые удерживают атомы в молекуле или кристалле.
Для того чтобы понять природу химической связи, достаточно вспомнить простой физический опыт. Два шарика, висящие рядом на ниточках, никак не «реагируют» друг на друга. Но если придать одному шарику положительный заряд, а другому — отрицательный, они притянутся друг к другу. Не эта ли сила притягивает атомы друг к другу? Действительно, исследования показали, что химическая связь имеет электрическую природу.
Откуда же возникают заряды в нейтральных атомах?
Ионная связь
При описании строения атомов было показано, что все атомы, за исключением атомов благородных газов, стремятся присоединить или отдать электроны. Причина — образование устойчивого восьмиэлектронного внешнего уровня (как у благородных газов). При приёме или отдаче электронов возникают электрические заряды и, как следствие, электростатическое взаимодействие частиц. Так возникает ионная связь.
Ионная связь — это связь между ионами.
Ионы — это устойчивые заряженные частицы, которые образуются в результате приема или отдачи электронов.
Например, в реакции участвует атом активного металла и активного неметалла:
В этом процессе атом металла (натрия) отдаёт электроны (рис. 14).

Таким образом, в этом процессе образовалась устойчивая частица (8 электронов на внешнем уровне), которая имеет заряд, так как у ядра атома натрия заряд по-прежнему +11, а оставшиеся электроны имеют суммарный заряд –10. Поэтому заряд иона натрия +1. Кратко запись этого процесса выглядит так:
Что происходит с атомом серы? Этот атом принимает электроны до завершения внешнего уровня (рис. 15).
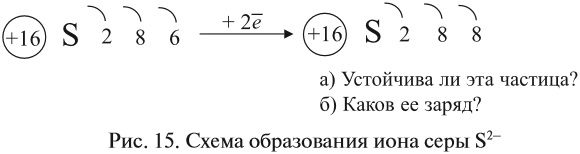
Простой подсчёт показывает, что эта частица имеет заряд:
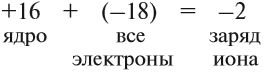
Разноименно заряженные ионы притягиваются, в результате чего возникает ионная связь и «ионная молекула»:
Существуют и другие способы образования ионов (см. урок 6).
Формально сульфиду натрия приписывают именно такой состав молекулы, хотя вещество, состоящее из ионов, имеет приблизительно такое строение (рис. 16).
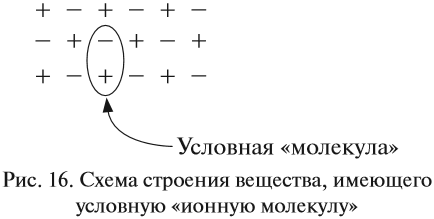
Таким образом, можно сказать определённо, что вещества, состоящие из ионов, не содержат отдельных молекул! В этом случае можно говорить лишь об условной «ионной молекуле».
Задание 4.1. Покажите, как происходит переход электронов при возникновении ионной связи между атомами:
Помните! Атом металла отдаёт внешние электроны; атом неметалла принимает недостающие электроны.
Вывод. Ионная связь по описанному выше механизму образуется между атомами активных металлов и активных неметаллов.

Ковалентная связь
Исследования, однако, показывают, что полный переход электронов от одного атома к другому происходит далеко не всегда. Очень часто химическая связь образуется не при отдаче-приёме электронов, а в результате образования общих электронных пар*. Такая связь называется ковалентной.
* Эти электронные пары возникают в месте пересечения электронных облаков.
Ковалентная связь образуется в месте перекрывания электронных облаков* обоих атомов.
* Электронное облако — область пространства, где нахождение электрона наиболее вероятно.
Такая связь образуется, например, между атомами неметаллов. Возникает вопрос: каким образом область пересечения электронных облаков может связывать атомы? Рассмотрим динамическую модель этого явления, т. е. процесс возникновения ковалентной связи. Предположим, два атома сблизились на достаточно близкое расстояние.
Вопрос. Какие силы возникли между атомами?
Поскольку вокруг ядер атомов расположены отрицательно заряженные электроны, между атомами возникают силы отталкивания. Но если атомы обладают достаточной энергией, их электронные облака перекрываются (см. рис. 17.).
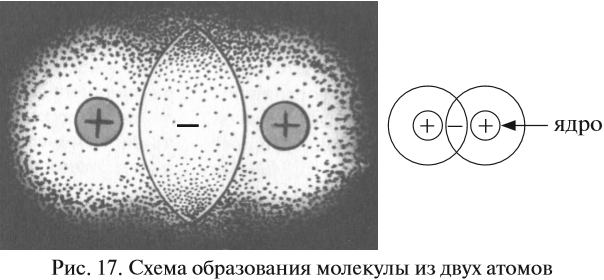
В этой области пространства возникает избыточный отрицательный заряд. А ядра атомов, как известно, имеют положительный заряд. Таким образом, ядра обоих атомов притягиваются к общему отрицательному заряду, который возник благодаря пересечению электронных облаков. Поэтому:
- во-первых, область перекрывания электронных облаков является, фактически, химической связью;
- во-вторых, чем больше область перекрывания электронных облаков, тем прочнее (при прочих равных условиях) данная связь.
В месте перекрывания электронных облаков образуются общие электронные пары. Рассмотрим, как возникает ковалентная связь в молекуле азота N2. Для этого рассмотрим строение атома азота:
Или: N … 2s 2 2р 3
Вопрос. Сколько электронов не хватает до завершения внешнего уровня?
Не хватает трёх электронов. Поэтому, обозначив каждый электрон внешнего уровня точкой, получим:
Вопрос. Почему три электрона обозначены одиночными точками?
Дело в том, что мы хотим показать образование общих пар электронов. А пара — это два электрона. Такая пара возникает, в частности, если каждый атом предоставит по одному электрону для образования каждой пары (1 + 1 = 2). Атому азота не хватает трёх электронов до завершения внешнего уровня. Значит, он должен «приготовить» три одиночных электрона для образования будущих пар.
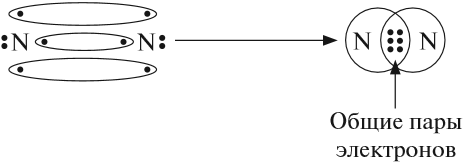
Получена электронная формула молекулы азота, при помощи которой показано, что:
- у каждого атома азота имеется теперь восемь электронов (шесть из них обведены кружочком плюс 2 электрона «собственной», неподелённой пары электронов);
- между атомами возникли 3 общие пары электронов (место пересечения кружков).
Каждая общая пара электронов соответствует одной ковалентной связи. Сколько ковалентных связей возникло? Три. Каждую связь (каждую общую пару электронов) покажем при помощи чёрточки (валентный штрих):
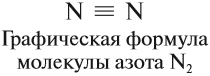
Эта графическая формула показывает, что атом азота в молекуле N2 — трёхвалентен, так как валентность — это способность атома образовывать определённое число ковалентных химических связей.
Может ли возникнуть такая связь между разными атомами? Может. Пусть атом азота взаимодействует с атомами водорода:
Строение атома водорода показывает, что этот атом имеет один электрон. Сколько таких атомов нужно взять, чтобы атом азота «получил» «желаемое» — три электрона? Очевидно, три атома водорода (рис. 19).
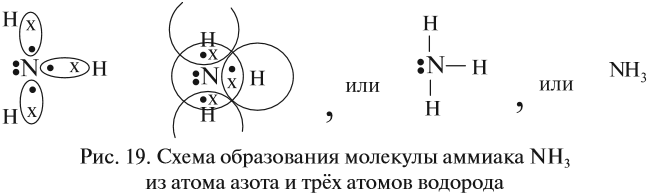
Крестиком (х) обозначены электроны атома водорода. Электронная формула молекулы аммиака показывает, что у атома азота стало восемь электронов, а у каждого атома водорода получилось по два электрона (а больше на первом энергетическом уровне и быть не может).
Графическая формула показывает, что атом азота имеет валентность три (три чёрточки, или три валентных штриха), а каждый атом водорода — валентность один (по одной чёрточке).
Значит, атом азота в этих молекулах (N2 и NН3) трёхвалентен. Поскольку пара электронов может образовываться из неспаренных электронов обоих атомов, то валентность атома часто соответствует числу неспаренных электронов. Например, в атоме азота 3 неспаренных электрона, поэтому валентность атома азота (в молекуле азота) равна III.
Казалось бы, атом азота не может иметь бОльшую валентность, так как в образовании химической связи задействованы все неспаренные электроны. Но у атома азота осталась «лишняя» неподелённая пара электронов, которая не участвовала в образовании ковалентных связей.
Если ковалентная связь образуется с участием атома, который имеет «собственную» пару электронов (2), то второй атом должен иметь свободную орбиталь (0):
В этом случае атом, имеющий пару электронов (донор), передаёт её на свободную орбиталь второго атома (акцептора). Рассмотрим механизм образования ковалентной связи по донорно-акцепторному механизму:
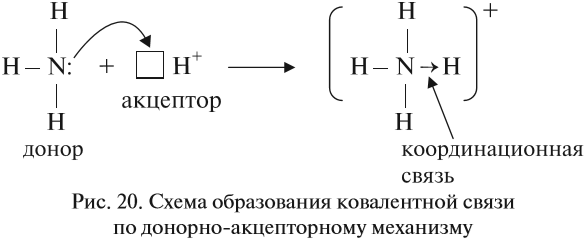
В полученном катионе аммония валентность атома азота равна IV.
Отметим, что валентность IV для атома азота — максимально возможная. Дело в том, что ковалентные связи образуются за счёт пересечения электронных облаков. А сколько таких электронных облаков в атоме азота? Четыре (одно s— и три р-облака). Поэтому и образуются 4 ковалентные связи. И не больше!
Ковалентная связь может быть полярной и неполярной. Полярность ковалентной связи определяется электроотрицательностью атомов её образующих. Электроотрицательность — способность атома смещать к себе общую пару электронов. Максимальную электроотрицательность (ЭО) имеет фтор 4,1. Далее значение ЭО уменьшается в ряду:
Хотя в состав обеих молекул N2 и NН3 входит один и тот же атом азота, химические связи между атомами отличаются друг от друга. В молекуле азота N2 химические связи образуют одинаковые атомы, поэтому общие пары электронов находятся посередине между атомами. Атомы сохраняют нейтральный характер. Такая химическая связь называется неполярной.
В молекуле аммиака NH3 химическую связь образуют разные атомы. Поэтому один из атомов (в данном случае — атом азота) сильнее притягивает общую пару электронов, так как имеет бОльшую ЭО. Общие пары электронов смещаются в сторону атома азота, и на нём возникает небольшой отрицательный заряд, а на атоме водорода — положительный (рис. 21).

Задание 4.2. Определите, какая химическая связь осуществляется между атомами в веществах:
Задание 4.3. Составьте электронные и графические формулы для тех веществ из упражнения 4.2, в которых вы определили наличие в них ковалентной связи. Для ионной связи составьте схемы перехода электронов.

Химическая связь и агрегатные состояния вещества. Кристаллические решётки
Тип химической связи влияет на свойства вещества, на его поведение в растворах. Так, чем больше, значительнее притяжение между частицами, тем труднее их оторвать друг от друга, тем труднее перевести твёрдое вещество в газообразное или жидкое состояния. Попробуйте определить, между какими частицами больше силы взаимодействия.
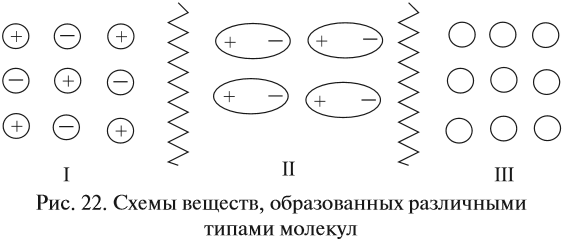
Если силы притяжения частиц значительны (притяжение разноимённо заряженных ионов), то частицы колеблются вблизи положения равновесия, а перемещаться не могут, что обусловливает сохранение формы и объёма. Максимальное взаимодействие между частицами осуществляется в случае I (ионная связь). Такие вещества находятся в твёрдом состоянии. Все вещества, построенные по ионному типу, — твёрдые. Среди веществ с ионной структурой ни жидких, не газообразных веществ нет! Для таких веществ характерно особое внутреннее строение — кристаллическая решётка:
От типа кристаллической решётки, которая формируется в твёрдом состоянии, зависят многие физические свойства вещества. В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решёток: ионные, атомные, молекулярные и металлические.
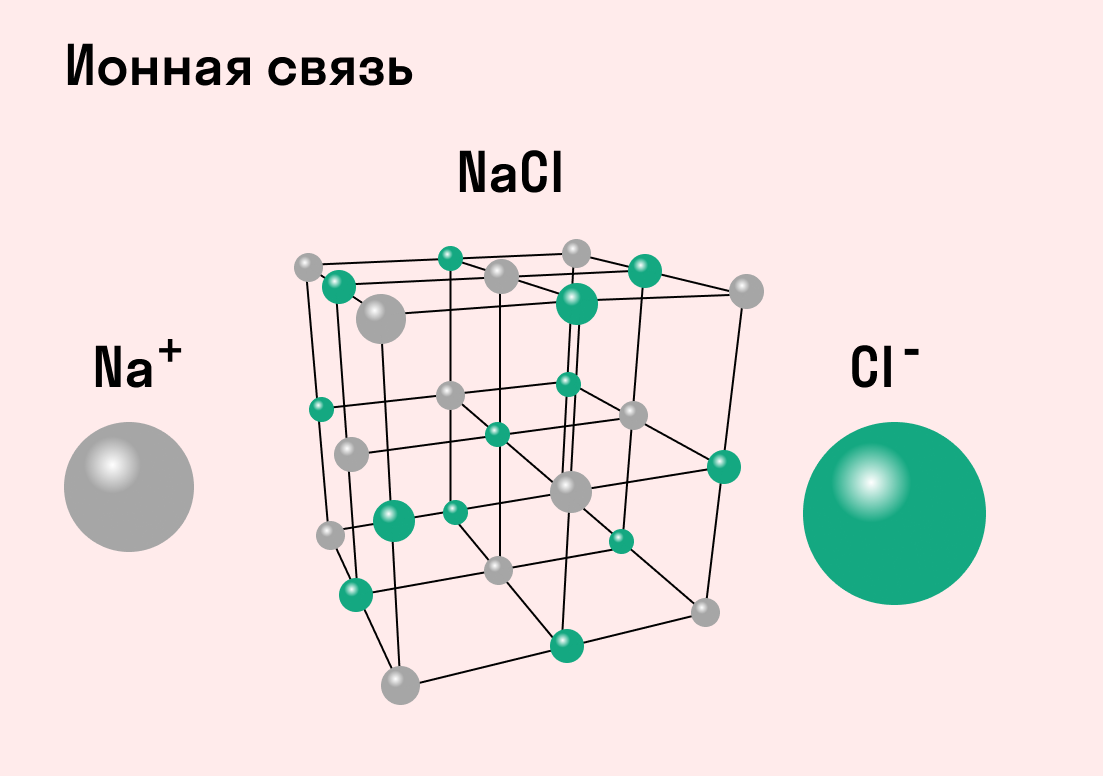
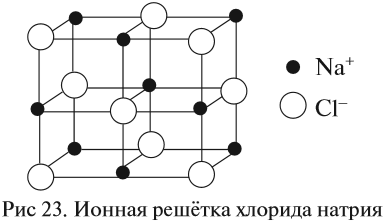
Кристаллические решётки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Примером может служить кристалл поваренной соли (хлорида натрия), в котором каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион — шестью ионами натрия. Очень часто кристаллические решётки изображают, как показано на рис. 23, где указывается только взаимное расположение частиц, но не их размеры.
Такие вещества обладают твёрдостью, тугоплавкостью, их расплавы проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде, хотя бывают и исключения.
Большинство веществ, построенных при помощи ковалентной связи, состоят из отдельных молекул (рис. 24).
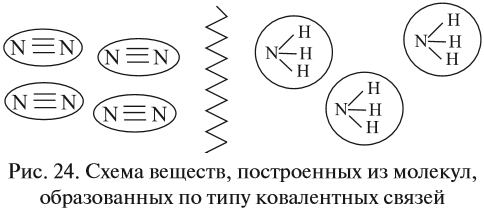
К таким веществам относятся спирты, сахара и большинство органических соединений. Поэтому, если такое вещество станет твёрдым, то эти молекулы образуют молекулярную кристаллическую решётку, т. е. в узлах её находятся молекулы.
Кристаллические решётки, состоящие из молекул (полярных и неполярных), называются молекулярными. Молекулы в таких решётках соединены между собой сравнительно слабыми межмолекулярными силами. Поэтому вещества с молекулярной решёткой имеют малую твёрдость и низкие температуры плавления, их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной решёткой невелико: вода, кислоты.
Кристаллические решётки, в узлах которых находятся отдельные атомы, называются атомными. Атомы в таких решётках соединены между собой прочными ковалентными связями. Примером может служить алмаз — одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами:
Весь кристалл алмаза следует рассматривать как гигантскую молекулу. Атомная кристаллическая решетка характерна для твёрдого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием, а также кварца — чистого оксида кремния. Такие вещества очень прочные и тугоплавкие. Они нерастворимы в воде и прочих растворителях.
Металлы образуют металлическую кристаллическую решётку. Свойства таких веществ рассмотрены в уроке 8 данного Самоучителя.
- молекулярное строение имеют вещества, построенные при помощи ковалентной связи, которые, связывая атомы, образуют молекулы;
- немолекулярное строение имеют вещества, построенные при помощи
- ковалентной связи, которые связывают отдельные атомы;
- металлической связи;
- ионной связи.
Задание ЕГЭ. К числу веществ молекулярного строения относятся: 1) древесный уголь; 2) кварц; 3) лёд; 4) известняк. Укажите тип кристаллической решётки в остальных веществах.
Наименьшее взаимодействие между незаряженными частицами (рис. 22, случай III), поэтому между молекулами вещества с неполярной ковалентной связью силы притяжения ничтожны. В этом случае молекулы свободно двигаются во всех направлениях, вещество находится в газообразном состоянии *.
Подробнее о газах рассказано в уроке 30.1 данного Самоучителя. Там же рассматриваются способы решения задач по теме «Газы».
Следовательно, вещества, состоящие из неполярных молекул или молекул с неполярными связями, являются газами или летучими жидкостями. Среди веществ такого типа только йод является твёрдым (при нормальных условиях) из-за высокой массы молекул, но он легко возгоняется, переходя из твёрдого состояния сразу в газообразное состояние.
У полярных молекул (диполей) межмолекулярные взаимодействия многократно сильнее, поэтому частицы могут перемещаться «на один шаг», соблюдая ближний порядок, что обусловливает текучесть жидкости. Впрочем, молекулы с полярными связями могут быть и газообразными, и твёрдыми.
Агрегатное состояние в этом случае (при прочих равных условиях) обычно зависит:
- от молярной массы вещества (чем она больше, тем выше температура плавления или кипения);
- от степени полярности связей (чем она больше, тем выше температура плавления или кипения);
- от наличия водородных связей.
Водородные связи возникают за счёт сильно полярных связей, содержащих атом водорода: N–H, O–H, F–H.
В таких случаях на атомах возникают довольно значительные заряды (δ+) и (δ–) (но всё же меньше единицы!), и атомы (а, значит, и молекулы в целом) притягиваются друг к другу. Атом водорода имеет очень маленький радиус и может частично «внедряться» в электронное облако соединённого атома:
![]()
Поэтому все молекулы воды оказываются связанными бесчисленными водородными связями. В результате на разрыв всех этих связей требуется затратить очень много энергии (например, при испарении воды). Поэтому вода имеет аномально высокую температуру кипения:
![]()
Если рассуждать логически, опираясь на положение кислорода в периодической системе, экстраполировать параметры в системе Н2О — H2S — H2Se — H2Тe, то у воды как самого лёгкого водородного соединения шестой группы должна быть температура кипения около –80 °C! А на самом деле? А на самом деле она намного выше: +100 °C.
Выводы. Таким образом, агрегатное состояние веществ (температуры кипения и плавления) зависит:
Читайте также: