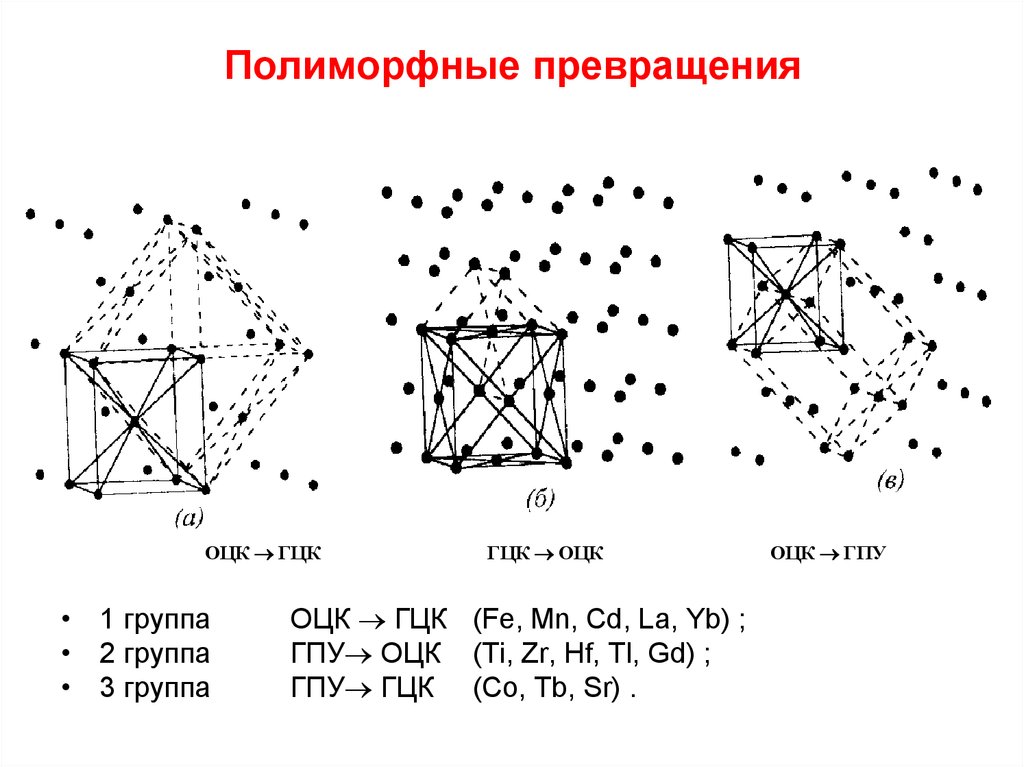
При полиморфном превращении металла сохраняется его
Обновлено: 02.07.2024
Некоторые элементы могут изменять свое кристаллическое строение, т.е. тип кристаллической решетки, в зависимости от внешних условий — температуры и давления.
Существование одного элемента в нескольких кристаллических формах (кристаллических модификациях) называется полиморфизмом или аллотропией.
Каждая полиморфная модификация имеет свою область температур, при которых она устойчива. Превращение одной кристаллической формы в другую происходит при постоянной температуре с выделением значительного количества тепла при охлаждении, что связано с затратой определенной энергии на перестройку кристаллической решетки и поглощением тепла при нагреве.
Перестройка кристаллической решетки в твердом состоянии называется вторичной кристаллизацией.
Как и при первичной кристаллизации для полиморфных превращений необходимы переохлаждение или перегрев относительно равновесной температуры. По своему механизму это кристаллизационный процесс, осуществляемый путем образования зародышей (как правило, на границах зерен) и последующего их роста. В результате образуются новые кристаллические зерна, имеющие другой размер и форму. Скачкообразно изменяются все свойства: удельный объем, теплоемкость, теплопроводность, механические и химические свойства.
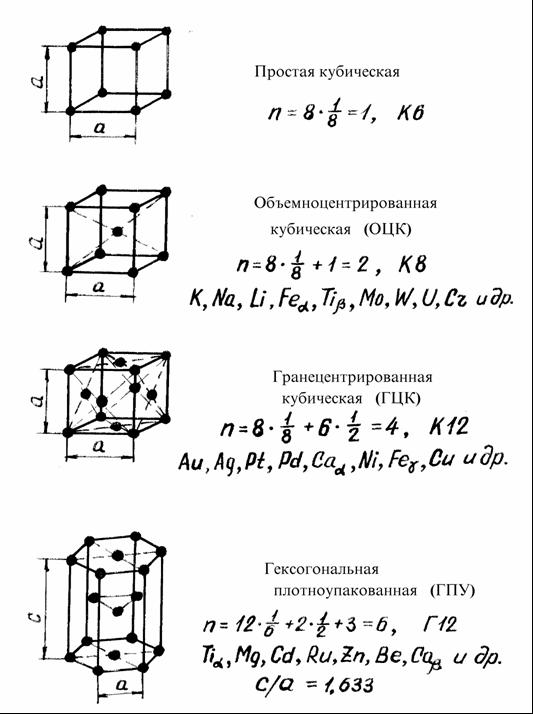
Рисунок 2 – Виды элементарных кристаллических ячеек
Полиморфные модификации обозначают буквами греческого алфавита , , , и т.д. Модификацию, устойчивую при более низких температурах, обозначают , при более высоких — , затем и т.д. Температурным полиморфизмом обладают около тридцати металлов, например: марганец (-Мn, -Мn, -Мn, -Мn), титан (-Тi, -Тi), кобальт (-Сo, -Сo), олово (-Sn, -Sn) и др. Часть металлов не имеют полиморфных превращений, например: Ni (ГЦК), Аu (ГЦК), Ag (ГЦК), Pt (ГЦК), Cu (ГЦК), Zn (ГПУ).
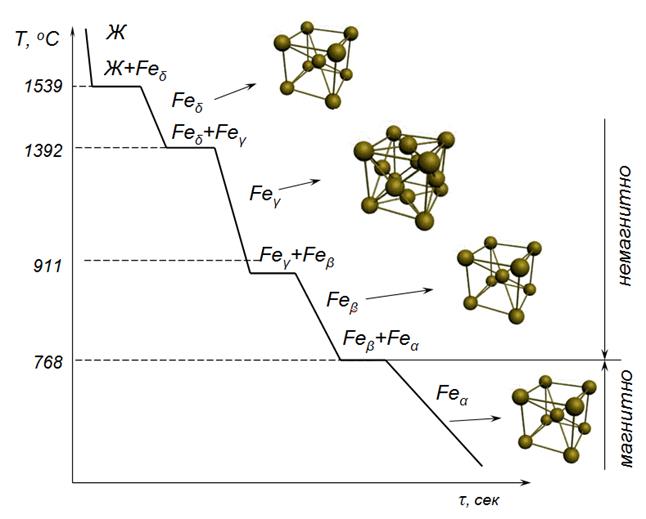
Железо является основным компонентом сталей, чугунов и обладает полиморфизмом. На рисунке 3 приведена кривая охлаждения железа с температурами полиморфных превращений.
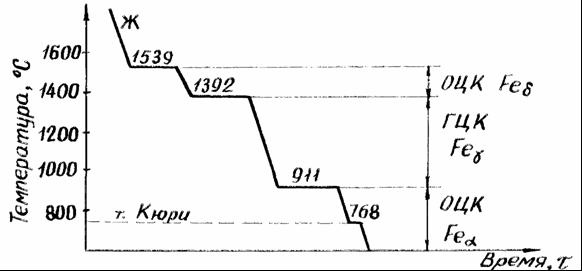
Рисунок 3 — Кривая охлаждения железа
Железо имеет две температуры полиморфного превращения 911 0 С и 1392 0 С. Ниже 911 0С железо имеет кубическую объемноцентрированную ячейку (ОЦК) и модификацию -Fe (Fe). При 911 0 С решетка перестраивается в кубическую гранецентрированную (ГЦК) и модификацию -Fe (Fe). При 1392 0 С решетка вновь перестраивается в ОЦК и модификацию -Fe (Fe). При 768 0 С (точка Кюри) на кривой охлаждения имеется площадка, связанная не с перестройкой решетки, а с изменением магнитных свойств железа. Ниже 768 0 С железо магнитно, выше — немагнитно.
Точка Кюри — это температура, соответствующая переходу из ферромагнитного состояния в парамагнитное.
Примером полиморфного превращения, обусловленного изменением температуры и давления, является изменение кристаллического строения углерода. В обычных условиях он находится в виде модификации графита, а при нагреве до 2000 0 С и давлении порядка 10 10 Па образуется модификация алмаза.
В середине восьмидесятых годов прошлого века открыта третья форма углерода в виде замкнутых сферических или сфероидальных молекул, состоящих из пяти- и шестиугольников — фуллерены. В зависимости от количества объединенных атомов углерода существуют фуллерены С28…С960. Наиболее стабильными являются молекулы С60 и С70. Полиморфные модификации углерода приведены на рисунке 4.
Полиморфные превращения в металлах.
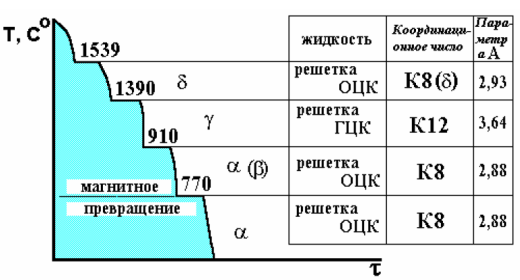
Металлы и сплавы в зависимости от температуры могут сосуществовать в разных кристаллических формах, или в разных модификациях. При полиморфном превращении одна кристаллическая решетка сменяет другую. Полиморфное превращение происходит в том случае, если при данной температуре может существовать металл с иной кристаллической решеткой и меньшим уровнем свободной энергии. На рис. 12 показана кривая охлаждения чистого железа и полиморфные u1087 превращения в металле.
Рис. 12. Кривая охлаждения чистого металла (железа).
Полиморфное превращение - кристаллизационный процесс и осуществляется путем образования зародышей и последующего их роста. Образование зародышей идет с соблюдением принципа структурного и размерного соответствия. Рост зерен новой фазы происходит путем неупорядоченных, взаимно не связанных переходов отдельных атомов (группы атомов) через мажфазную границу. В результате граница новых зерен передвигается в сторону исходных, поглощая их. Зародыши новой фазы возникают по границам старых зерен или в зонах с повышенным уровнем свободной энергии.
Вновь образующиеся кристаллы закономерно ориентированы по отношению к кристаллам исходной модификации. В результате полиморфного превращения образуются новые зерна, имеющие другой размер и форму. Происходит скачкообразное изменение свойств материала.
Полиморфное превращение также называют перекристаллизацией. Если нагрев металла проведен до температуры, немного превышающей температуру полиморфного превращения (критической точки), получается очень мелкое зерно. Это явление используется в практике термической обработки металлов.
8Диаграммы состояния систем с ограниченной растворимостью компонентов в твердом состоянии с эвтектическими и перетектическими превращениями.
На рис. 20. точка d характеризует предельную растворимость компонента β в компоненте α , а точка с компонента α в компонента β. Сплав, соответствующий точке 3, затвердевает при постоянной температуре Т4. При температуре несколько ниже жидкий сплав оказывается насыщенным по отношению к обеим фазам (α и β - твердым растворам), так как точка 3 принадлежит сразу двум ветвям ликвидуса. Поэтому из жидкости состава 3 при температуре Т4 одновременно выделяются предельно насыщенные кристаллы твердого раствора α d и β c, образующие механическую смесь.
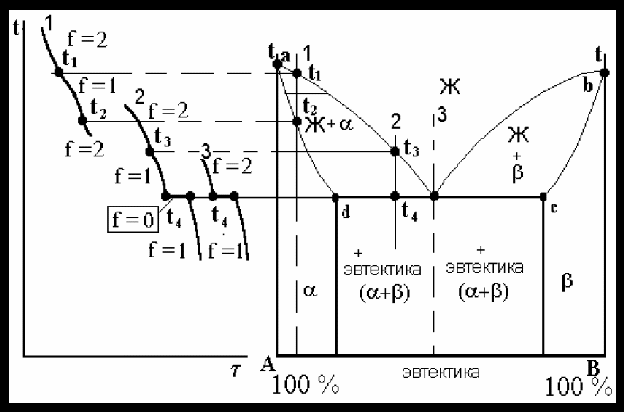
Рис. 20. Диаграмма состояния сплавов, образующих ограниченные твердые растворы и эвтектику.
Сплавы, в которых происходит одновременная кристаллизация α и β фаз при постоянной и самой низкой для данной системы сплавов температуре, называют эвтектическими. Структура, состоящая из механической смеси двух (или более) твердых фаз, одновременно кристаллизовавшихся из жидкого сплава, называется эвтектикой. В переводе с греческого - “легкоплавящаяся”. Сплавы, располагающиеся влево от эвтектического состава и имеющие концентрацию в пределах точек d b 3, называются доэвтектическими, а справа в пределах концентрации точек 3 и с - заэвтектическими.
При кристаллизации эвтектик сначала зарождаются и растут кристаллы α − твердого раствора, богатого компонентом А. Жидкость, окружающая этот кристалл, обогащается вторым компонентом В, и в результате этого происходит выделение кристалликов α и β – твердого раствора. Жидкость, прилегающая к образовавшимся кристалликам β − фазы, в свою очередь, обогащается металлом А, и поэтому вновь выделяются кристаллики α - фазы, богатые компонентом А. В результате переменного пересыщения жидкости по отношению к α и β - фазам образуется эвтектическая колония.
Процесс кристаллизации эвтектики протекает при постоянной температуре, так как согласно правилу фаз при одновременном существовании трех фаз постоянного состава система безвариантна. На кривой охлаждения образуется площадка. Одновременно кристаллизуются две фазы. После затвердевания сплав состоит из кристаллов эвтектики.
Диаграмма состояния сплавов с перетектикой приведена на рис. 21. Линия acb на диаграмме соответствует линии ликвидус, а линия adeb - линии солидус.
Точка d характеризует максимальную растворимость компонента В в компоненте А, а точка е - предельную растворимость компонента А в компоненте В. Линия cde – линия перетектического превращения. Это превращение, как и эвтектическое, протекает в условиях существования трех фаз - жидкой и двух твердых α и β.
Перетектическое превращение отличается от эвтектического. При перетектическом превращении кристаллизуется только одна фаза, образующаяся в результате взаимодействия ранее выделившейся твердой фазы и жидкой части сплава определенного состава (точки с).
Процесс перетектического превращения происходит при постоянной температуре (f=0).
Процесс кристаллизации перетектического превращения не заканчивается при температуре t3, а продолжается и заканчивается , например для сплава 2 в точке, соответствующей температуре t4. Для сплава 1 при достижении температуры t3 на лини cde выделяются кристаллы как α.
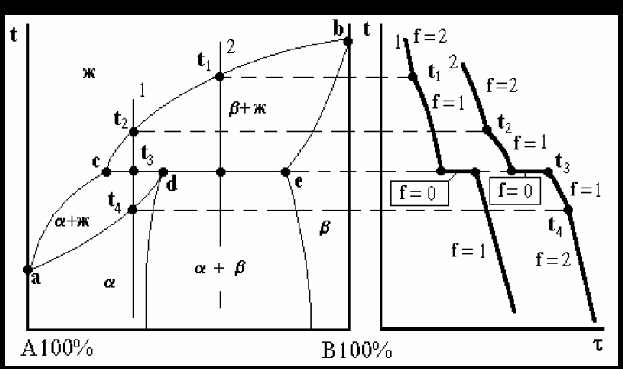
Рис. 21. Диаграмма состояния сплавов, образующих ограниченные твердые растворы и перетектику.
Процесс кристаллизации перетектического превращения не заканчивается при температуре t3, а продолжается и заканчивается , например для сплава 2 в точке, соответствующей температуре t4. Для сплава 1 при достижении температуры t3 на лини cde выделяются кристаллы как α – так и β - фазы. В процессе перетектического превращения α - фаза зарождается на поверхности β -кристаллов, обволакивает их и растет. В результате перетектической реакции могут образовываться не только твердые растворы, но и неустойчивые химические соединения, которые плавятся инконгруэнтно, т.е. при плавлении состав жидкого расплава не совпадает с составом соединения.
Эвтектика, англ. eutectic, eutecticum (от греческого слова "éutektos" - легко плавящийся) - смесь компонентов, которые плавятся при определённой, минимальной температуре.
Диаграмма с эвтектикой или диаграмма с эвтектическим превращением относится к диаграммам состояния сплавов с ограниченной растворимостью компонентов в твёрдом состоянии (III рода). В таких сплавах оба компонента неограниченно растворимы в жидком состоянии, ограниченно растворимы в твёрдом состоянии и не образуют химических соединений.
9Основные механические испытания - это определение прочностных характеристик, т.е. способности выдерживать внешние механические нагрузки без недопустимых изменений первоначальных размеров и формы. По характеру приложения нагрузки испытания делятся на статические, с плавным ростом нагрузки с требуемой скоростью и динамические, когда нагрузка воздействует в виде рывка, удара.
При статических испытаниях определяют разрушающее напряжение при растяжении, сжатии или изгибе, предел текучести, относительное удлинение при разрыве и относительную деформацию при сжатии, модуль упругости и др. При динамических испытаниях - ударную вязкость и стойкость к вибрации. Определяются твердость, гибкость, пластичность.
Следующие типы испытаний:на растяжение пластмасс, керамики, цемента (двусторонние лопатки), пластмасс и слоистых пластиков на сжатие (призмы, цилиндры), пластмасс на раскалывание, пленок на разрыв, пластмасс на статический изгиб (брусок лежит на двух опорах и нагружен в середине).
Ударная вязкость пластмасс по Шарпи и т.д. определяется с помощью маятниковых копров. Производят с помощью тяжелого маятника с бойком. После разлома образца маятник поднимается до какой-то точки. По разности первоначального положения и конечного находят энергию удара, затраченную на разрушение. Ударная вязкость - отношение энергии удара к площади поперечного сечения образца.
Твердость определяется несколькими способами:
Метод Бринелля - вдавливается шарик при определенной нагрузке. Чем больше диаметр отпечатка - тем меньше твердость. По значению измеренного диаметра отпечатка с использованием выражения определяется значение твердости по Бринелю.
Несколько другой способ реализован в методе Роквелла. Здесь производится вдавливание конусной иглы (индентора) при определенной нагрузке и по значению смещения индентора (это характеризует глубину), определяется твердость по Роквеллу.
Еще один популярный способ основан на царапанье более твердого материала менее твердым. Тем самым определяется относительная твердость материалов. Сравнение с рядом эталонных материалов, которым присвоены номера твердости по Моосу, (алмаз -10, корунд - 9, кварцит - 7, известняк - 3 и т.д.) позволяет получить и количественную характеристику.
Твердость пленок определяют маятниковым методом - на пленку ставится маятник, чем тверже материал, тем дольше маятник качается.
10 Диаграммы состояния системы, образующей химическое соединение.
Диаграмма состояния системы с наличием устойчивого химического соединения показана на рис. 23.
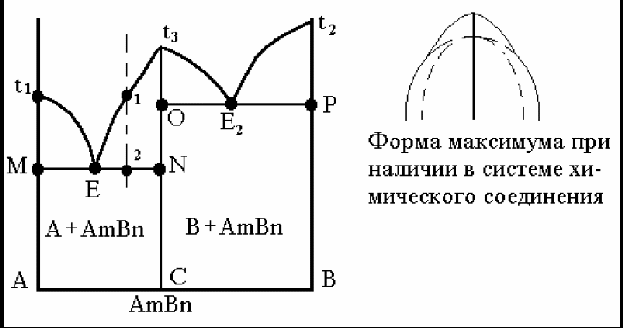
Рис.23. Диаграмма состояния системы, образующей устойчивое химическое соединение.
В связи с особыми свойствами химического соединения на диаграмме появляется ордината этого соединения, соответствующая его составу. На этой ординате откладывается температура плавления этого химического соединения t3. Ордината делит диаграмму состояния на две части, каждая из которых представляет простейший эвтектический тип диаграмм состояния.
Химическое соединение не является компонентом, так как образуется путем взаимодействия компонентов А и В. Выше точки 1 присутствует жидкость, несколько ниже точки 1 происходит образование и рост кристаллов AmBn. В точке 2 жидкий раствор состава Е2 будет кристаллизоваться с образованием эвтектики, состоящей из кристаллов компонента А и химического соединения АmBn. В итоге кристаллизации расплав состава 1 будет состоять из кристаллов компонента АmBn и эвтектики, состоящей из кристаллов химического соединения АmBn и кристаллов компонента А. Если химическое соединение неустойчиво, образуется диаграмма со скрытым максимумом. Сначала будут кристаллизоваться чистые компоненты, затем выпадут кристаллы химического соединения. Взаимодействием двух фаз будет образована третья: произойдет перетектическое превращение.
Механизм полиморфных превращений в металлах
В металловедении под полиморфизмом понимают любые изменения в кристаллографической форме решётки материала. Поэтому аллотропическое или полиморфное превращение играет важную роль в свойствах и использовании металлов, склонных к подобным изменениям.
Суть явления
Полиморфные превращения происходят в ответ на изменения внешних факторов – температуры, давления, либо того и другого вместе.
Так, например, происходит с углеродом, который встречается в двух различных полиморфных формах- графита с гексагональной структурой и алмаза - с изометрической. Вещество FeS2 чаще всего встречается в виде пирита с изометрической структурой, но оно также может иметь ромбическое внутреннее расположение, и тогда его называют марказитом. Существуют и другие примеры.
Свойства вещества определяются не только его химическим составом, но и геометрией составляющих атомов и ионов, а также природой связывающих их электрических сил.
Большинство минералов представляют собой соединения, состоящие из двух или более элементов; их формулы получены на основе количественного химического анализа и указывают относительные пропорции составляющих элементов. Поэтому наблюдаются значительные вариации в ионах, которые занимают определенные атомные позиции в их структуре. Например, содержание железа в родохрозите (MnCO3) может варьироваться в широких пределах, поскольку двухвалентное железо (Fe 2+ ) замещает катионы марганца (Mn 2+ ) в структуре родохрозита.
Поэтому формула данного минерала может быть дана в более общих терминах, а именно (Mn, Fe) CO3. Она показывает, что, хотя количество марганца и железа меняется, но отношение катиона к отрицательно заряженной анионной группе остается фиксированным: один атом Mn 2+ или Fe 2+ к одной группе CO3. Такое изменение является результатом замены одного иона или ионной группы другим в конкретной структуре. Это явление называется ионным замещением или твердым раствором. Возможны три типа твердого раствора:
- замещающий;
- промежуточный;
- упущенный.
Замещающий твердый раствор является наиболее распространенной разновидностью: пример с родохрозитом это подтверждает. Однако на степень замещения могут влиять и другие факторы, наиболее важным из которых является размер иона. Ионы двух разных элементов могут свободно заменять друг друга, только если их ионные радиусы различаются примерно на 15 процентов или меньше.
На аллотропические превращения влияет также температура, соответствующая началу роста кристаллов. Чем выше температура, чем более обширен термический беспорядок в кристаллической структуре и тем менее требовательны требования к пространству. В результате ионное замещение, которое не могло произойти в кристаллах, выращенных при низких температурах, может присутствовать в кристаллах, выращенных при более высоких температурах. Так, высокотемпературная форма KAlSi3O8 (санидин) может содержать больше натрия вместо калия, чем низкотемпературные аналоги данного минерала.
Дополнительным фактором, влияющим на ионное замещение, является поддержание баланса между положительными и отрицательными зарядами в структуре. Замена одновалентного иона (например, Na + ) двухвалентным ионом (например, Ca 2+ ) требует дополнительных замен, чтобы структура оставалась электрически нейтральной.
Условия для полиморфного превращения
Стабильность химических связей атомов и ионов металлов определяют электрические силы. Физические и химические свойства минералов по большей части объясняются типами этих связывающих сил, среди которых:
- твёрдость:
- температура начала плавления;
- электропроводность;
- теплопроводность;
- коэффициент теплового расширения.
Твёрдость и температура плавления кристалла увеличиваются (а коэффициент теплового расширения уменьшается) пропорционально прочности такой связи. Чем сильнее электрические связи, тем большее количество тепла потребуется для их разделения.
Электрические силы, называемые химическими связями, можно разделить на пять типов:
- ионные;
- ковалентные;
- металлические;
- ван-дер-ваальсовы;
- водородные.
Такая классификация в значительной степени обусловлена целесообразностью, поскольку химические связи в данном металле могут фактически обладать характеристиками более чем одного типа связи.
Ионные связи проявляются в тенденции атомов металлов приобретать или терять электроны, пока их внешние орбитали не станут стабильными; Обычно это достигается за счет заполнения этих орбиталей максимально допустимым числом валентных электронов.
Кристаллы с ионной связью обычно обладают умеренной твёрдостью и удельным весом, довольно высокими температурами плавления и плохой теплопроводностью и электропроводностью.
Ковалентные связи образуются только между резко полярными веществами, которых среди металлов практически не встречается. В отличие от солей, металлы обладают высокой пластичностью, прочностью, пластичностью и проводимостью. Многие из них характеризуются более низкой твёрдостью и более высокими температурами плавления и кипения, чем, например, материалы с ковалентной связью. Все эти свойства являются результатом металлического механизма связи, который можно представить как набор положительно заряженных ионов, погруженных в облако валентных электронов. Притяжение между катионами и электронами удерживает кристалл вместе.
Электроны не связаны с каким-либо конкретным катионом и, таким образом, могут свободно перемещаться по структуре. У некоторых металлов (натрий, цезий, рубидий и калий) лучистая энергия света может вызвать полное удаление электронов с их поверхностей Этот результат известен как фотоэлектрический эффект. Подвижность электронов отвечает за способность металлов проводить тепло и электричество.
Самородные металлы - единственные минералы, демонстрирующие чистую металлическую связь.
Связи Ван-дер-Ваальса и водородные связи характерны для газов, органических жидкостей и некоторых твёрдых тел, поэтому здесь не рассматриваются.
Механизм превращения
Наибольшей интенсивностью полиморфных превращений обладают самородные металлы, которые объединяются в три группы:
- Группа золота, состоящая из золота, серебра, меди и свинца;
- Платиновая группа, состоящая из платины, палладия, иридия и осмия;
- Группа железа, содержащая железо и никель.
Гораздо слабее полиморфизм выявляется у ртути, тантала, олова и цинка.
Золото, серебро и медь являются членами одной группы (столбца) периодической таблицы элементов и, следовательно, имеют схожие химические свойства. В некомбинированном состоянии их атомы соединены довольно слабой металлической связью. поэтому атомы расположены в простом кубическом расположении с плотной упаковкой. И золото, и серебро имеют атомный радиус 1,44 × 10 –7 мм, что позволяет твёрдому раствору полностью образовываться между ними. Радиус меди значительно меньше (1,28 Å), и поэтому медь только в ограниченной степени заменяет золото и серебро. Из-за схожей кристаллической структуры металлы группы золота обладают схожими физическими свойствами, поэтому хорошо кристаллизуются в изометрической системе и имеют высокую плотность упаковки.
Аналогичен механизм аллотропного превращения у металлов платиновой группы..
Металлы группы железа изометричны и имеют простую кубическую упакованную структуру, чем объясняется лёгкость происходящих полиморфных превращений.
Почему полиморфное превращение также называют перекристаллизацией?
Полиморфизм - это способность вещества кристаллизоваться в различные кристаллические формы, которые называются кристаллическими модификациями. Полиморфы имеют одинаковое жидкое или газообразное состояние, но в твёрдом состоянии ведут себя по-разному.
Для всех металлов, испытывающих аллотропические превращения, кристаллические структуры подвижны и могут видоизменяться в нескольких разных пропорциях.
Некоторые полиморфные формы могут быть стабильными только в том случае, когда при кристаллизации присутствует небольшое количество растворителя.
Таким образом, перекристаллизация – процесс перестройки одной кристаллической решётки в другую – обязательно сопровождается и определёнными полиморфными превращениями.
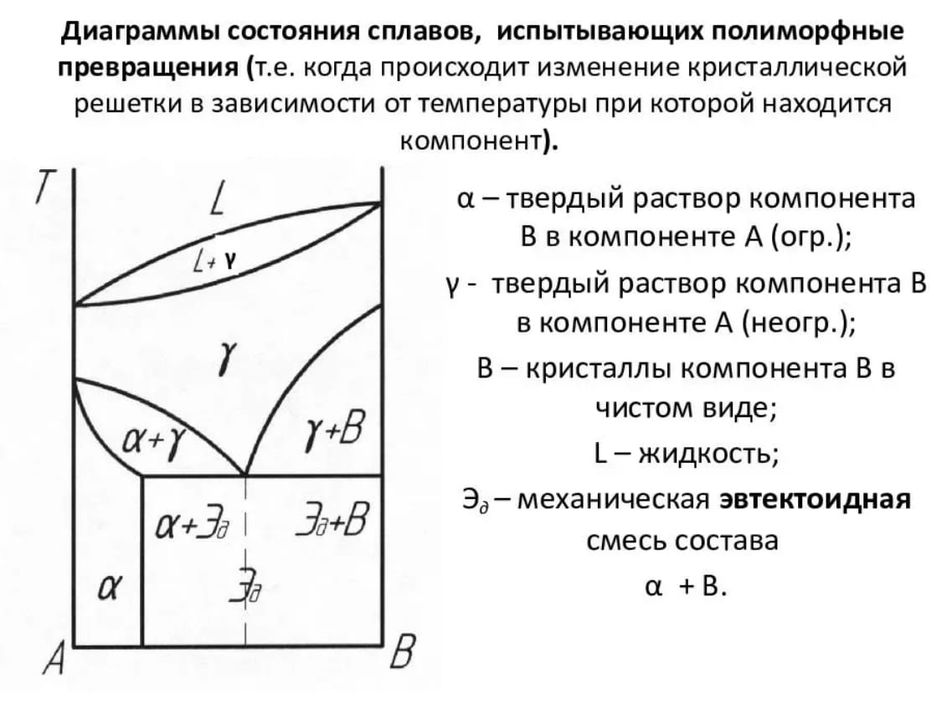
5. Полиморфные превращения металлов
В периодической системе (рис. 1) для многих элементов обозначены два и даже три типа кристаллических решеток. Это объясняется тем, что у этих элементов происходит перекристаллизация в твердом состоянии, которая часто называется вторичной кристаллизацией. Наличие разного кристаллического строения веществ при различных температурах называется полиморфизмом. Различные кристаллические модификации обозначаются малыми буквами греческого алфавита a, , , и т. д., которые в виде индекса добавляют к символу, обозначающему элемент (например Fe, Fe, Ti, Ti и др.).
Перекристаллизация в твердом состоянии объясняется тем„ что начиная с определенной температуры (температура перекристаллизации) изобарный потенциал GH нового типа кристаллической решетки становится меньше такового для старой решетки (Gc), т. е. (GHcGc). Кривые изменения изобарных потенциалов G различных кристаллических модификаций GH и Gc в зависимости от температуры аналогичны кривым GM и Gж на рис. 12 при кристаллизации жидкости.
На скорость перекристаллизации сплавов большое влияние оказывает диффузия разнородных атомов, образующих сплав. Обычно зародыши новой фазы образуются на границах зерен старой фазы. При росте новых кристаллов известное время сохраняется связь между старой и новой решеткой по плоскости, где атомы в обоих решетках являются общими. Такая, связь называется когерентной.

Если в разных модификациях сохраняется характер связи, то полиморфное превращение сопровождается изменением атомных радиусов, что в значительной степени компенсирует объемные изменения, связанные с изменением координационного числа решетки при превращении. В случае изменения типа связи, при превращении имеет место значительное изменение объема. Например, при превращении происходит изменение объема на 25%, вследствие чего материал при превращении от больших внутренних напряжений разрушается («оловянная чума»).
Процесс перекристаллизации при полиморфном превращении определяется теми же закономерностями, что и кристаллизация жидкой фазы. Это значит, что в старой кристаллической фазе возникают центры ч.ц., новой фазы, которые растут с определенной скоростью с.р.
Значения ч.ц. и с.р. также зависят от степени переохлаждения, как и в случае кристаллизации жидкости (см. рис. 16). Существенной особенностью перекристаллизации металлов является то, что этот процесс протекает как при малых, так и больших переохлаждениях, т. е. кривые, характеризующие зависимость ч.ц.=f(n) и с.p.=f(n) могут быть представлены в полном виде (рис. 16). Поэтому и кинетические кривые перекристаллизации для металлов соответствуют рис. 19,А,б и 19,Б,б.
Замедление процесса перекристаллизации при высоких степенях переохлаждения обусловлено низкой скоростью процессов самодиффузии атомов, что необходимо для роста кристаллов поной фазы. Поэтому иногда можно создать такие условия, что перекристаллизация не может протекать и при низкой температуре будет зафиксировано термодинамически неустойчивое высокотемпературное или промежуточное состояние.
Явление полиморфизма в металлах имеет большое практическое значение. Достаточно отметить, что только благодаря полиморфизму железа имеется возможность широкого изменения свойств сплавов на основе железа (сталей) посредством термической обработки (закалки, отжига).
№ 40. Титан имеет полиморфное превращение TiTi, при 882,5 °С. Считая, что кривые ч.ц. и ср. на рис. 16 соответствуют охлаждению титана от 882,5 °С и ниже, подумайте, какая структура титана образуется при степенях переохлаждения n1, n2, n3? Ответ (см. на с. 32): при 1) n1 — крупнозернистый Ti, n2 — мелкозернистый Tia, n3 — очень мелкозернистый Ti; 2) n1 и n2— крупнозернистый Ti, n3 — мелкозернистый Ti; 3) n1 — крупнозернистый Ti, n2 — мелкозернистый Ti, n3 — переохлажденный Ti.
6.Полиморфные превращения в металлах.
Металлы и сплавы в зависимости от температуры могут сосуществовать в разных кристаллических формах, или в разных модификациях. При полиморфном превращении одна кристаллическая решетка сменяет другую. Полиморфное превращение происходит в том случае, если при данной температуре может существовать металл с иной кристаллической решеткой и меньшим уровнем свободной энергии. Показана кривая охлаждения чистого железа и полиморфные превращения в металле.

Вновь образующиеся кристаллы закономерно ориентированы по отношению к кристаллам исходной модификации. В результате полиморфного превращения образуются новые зерна, имеющие другой размер и форму. Происходит скачкообразное изменение свойств материала. Полиморфное превращение также называют перекристаллизацией. Если нагрев металла проведен до температуры, немного превышающей температуру полиморфного превращения (критической точки), получается очень мелкое зерно. Это явление используется в практике термической обработки металлов.
7. Строение типовых двухкомпонентных сплавов.
Строение и свойства типовых двухкомпонентных сплавов определяются типом твердого раствора. При образовании твердых растворов электрическое сопротивление, твердость возрастают, а теплопроводность, пластичность - обычно падают. Рассмотрим наиболее важные из них.
Твердый раствор внедрения. (рис.13) Чем больше поры и меньше атом внедрения, тем легче само внедрение.
При определенных условиях - медленном охлаждении, способствующем диффузии, атомы занимают определенные места в решетке растворителя. Процесс называют упорядочением. Рис. 15.1. и 15.2.
Механическая смесь. Если два компонента не способны к взаимному растворению в твердом состоянии и не образуют химического соединения, создается механическая смесь. Сплав будет состоять из кристаллов каждого компонента.
Промежуточные фазы.
Возникает новая кристаллическая решетка, отличающаяся от решеток исходных компонентов.
Твердые растворы на базе химического соединения. Рис.17. Здесь сохраняется решетка соединения, при этом часть атомов решетки растворителя заменяется атомами растворяющегося элемента или возникают не занятые узлы (растворы вычитания).
Химическое соединение. При образовании химического соединения возникает новая фаза с экстремальными свойствами.
Упорядоченные твердые растворы. В обычных твердых растворах атомы растворенного элемента располагаются в решетке растворителя беспорядочно.
Интерметалиды. Соединения металлических элементов между собой.
В сплавах существуют электронные соединения - фазы Юм-Розери, Лавеса и внедрения.
Электронные соединения - фазы Юм-Розери образуются между металлами из следующих основных групп: Cu, Ag, Au, Fe, Pd, Pt, c одной стороны , и Be, Zn Cd, Al, Sn, Si - с другой. Характеризуются определенным соотношением валентных электронов к числу атомов(3/2 - ОЦК -фаза; 21/13- сложная кубическая ячейка с 52 атомами на ячейку - фаза и 7/4 - гексагональная решетка - фаза), причем каждому соотношению соответствует определенная кристаллическая решетка. Фазы Лавеса - устойчивые химические соединения с ионным типом связей образуются преимущественно между элементами различной природы и с существенно различными атомными размерами. Если атомные размеры различаются мало, то появляется тенденция к образованию электронных соединений. Эти фазы со стехеометрической формулой АВ2 образуются между элементами, атомные диаметры которых находятся приблизительно в соотношении 1:1.2. Фазы Лавеса встречаются как упрочняющие интерметаллидные фазы в жаропрочных сплавах. Фазы внедрения образуют металлы переходных групп с металлоидами, имеющими малый атомный радиус (водород, азот, углерод), если их обратное отношение радиусов, меньше 0.59. Эти фазы удовлетворяют условиям характеризующим, химическое соединение (М4Х, М2 Х и МХ). Карбиды и нитриды, встречающиеся в стали являются фазами внедрения.
Читайте также:
