Происходит вытеснение водорода металлом из кислоты
Обновлено: 04.07.2024
Вытеснение водорода считается законченным при содержании углекислого газа в газовой смеси, отобранной из водородного коллектора не менее 85 % при вращающемся роторе и не менее 95 % при неподвижном роторе. [1]
Вытеснение водорода применяется для определения мольных масс эквивалентов тех элементов, которые в виде простого вещества ( металла) способны вытеснять водород из растворов кислот и щелочей. [2]
Вытеснение водорода происходит и при адсорбции ионов брома на родиевом электроде. Вероятно, это связано с тем, что размеры иона брома меньше, чем иона иода. При адсорбции ионов брома также снижается энергия связи адсорбированного водорода, что, по-видимому, связано с электростатическим взаимодействием между ионами и диполями водорода. [3]
Вытеснение водорода углекислотой мало отличается от вытеснения воздуха углекислотой. Перед началом вытеснения закрываются вентили и снимаются перемычки между водородным коллектором и линией от электролизной или водородной установки для создания видимого разрыва. [4]
Вытеснение водорода считается законченным при содержании углекислого газа в газовой смеси, отобранной из водородного коллектора, не менее 85 % при вращающемся роторе и не менее 95 % при неподвижном роторе. [5]
Вытеснение водорода из кислот различными металлами происходит по-разному: одни металлы вытесняют водород быстрее, другие - медленнее, а некоторые вовсе не вступают в реакцию замещения с кислотами. [6]
Вытеснение водорода углекислотой мало отличается от вытеснения воздуха углекислотой. [7]
Вытеснение водорода считается законченным при содержании углекислого газа в газовой смеси, отобранной из водородного коллектора не менее 85 % при вращающемся роторе и не менее 95 % при неподвижном роторе. [8]
Вытеснение водорода двуокисью углерода мало отличается от вытеснения воздуха углекислотой. Вытеснение водорода считается законченным при содержании окиси углерода в газовой смеси, отобранной из водородного коллектора, не менее 85 % при вращающемся роторе и не менее 95 % при неподвижном роторе. [9]
Практически вытеснение водорода металлом, стоящим в этом ряду до него, из кислот и воды не происходит, если на его поверхности образуется нерастворимая защитная пленка из соли, окиси или гидроокиси. Например, цинк не вытесняет водород из воды и вытесняет его из соляной и серной кислот. Цинк вытесняет никель и медь из водных растворов их солей, но сам он из солей не вытесняется магнием, хотя последний и стоит в ряду напряжений до него. Водород вытесняет из водных растворов солей металлы, стоящие в ряду напряжений после него. Бекетов ( 1868 г.) показал, что вытеснять металлы водород может при условии высокой концентрации его в растворе. [11]
На вытеснение водорода при Неподвижном роторе углекислого газа требуется 1 7 - 2 2 объема статора, а при вращающемся роторе - 2 5 - 3 объема. [12]
Реакции вытеснения водорода металлами из кислот также являются окислительно-восстановительными процессами. [13]
При вытеснении водорода углекислотой вентили 3, 4 л 5 закрыты, а вентили /, 2 и 6 открыты. Попасть в этом случае в водородный коллектор, креме как через генератор, она не может. [14]
При вытеснении водорода углекислым газом продувка производится до содержания углекислого газа в верхней зоне ресиверов не менее 95 %, так как такая смесь с запасом обеспечивает невзрывоопасность газа при его смешении с воздухом в любой пропорции. [15]
Урок 24. Выделение водорода в реакциях кислот с металлами
В уроке 24 «Выделение водорода в реакциях кислот с металлами» из курса «Химия для чайников» познакомимся с рядом активности металлов, а также больше узнаем о кислотах в химических реакциях.

Характерное химическое свойство кислот — выделение из них водорода в реакциях с некоторыми металлами. Атомы металлов замещают атомы водорода в молекулах кислот, в результате чего водород выделяется в виде газа. В пробирку с хлороводородной кислотой опустим кусочек цинка. На поверхности металла образуются, а затем выделяются из раствора пузырьки газа. Соберем этот газ в пробирку и поднесем ее к пламени спиртовки (рис. 100). Мы услышим хлопок. Это свидетельствует о наличии в пробирке водорода.
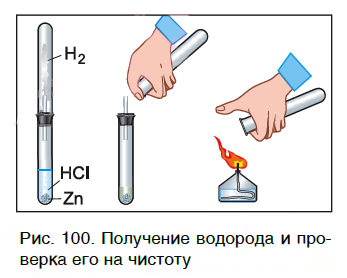
Каплю образовавшегося раствора поместим на стеклянную пластинку и подогреем ее в пламени спиртовки. После испарения воды на пластинке остается вещество белого цвета. Опытным путем можно установить, что состав этого вещества выражается формулой ZnCl2.
Теперь мы можем записать уравнение реакции цинка с кислотой:
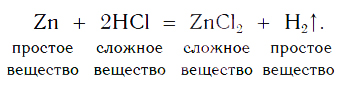
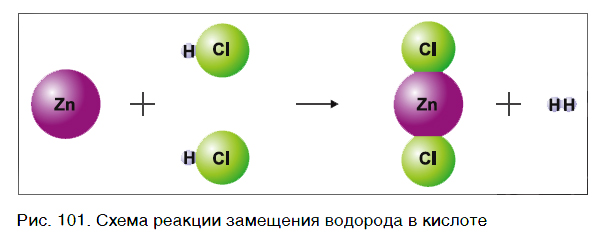
На рисунке 101 дана схема этой реакции. Из уравнения и поясняющей его схемы видим, что атомы цинка замещают атомы водорода в кислоте. В результате из простого вещества цинка и сложного вещества хлороводородной кислоты образуются два новых: сложное вещество ZnCl2 и простое вещество водород Н2.
Так же протекают реакции алюминия, железа, других металлов и с раствором серной кислоты:
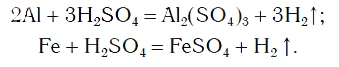
Эти химические реакции подтверждают, что кислоты являются сложными веществами, состоящими из атомов водорода,
способных замещаться на атомы металла, и кислотных остатков.
Вытеснительный ряд металлов
При проведении опыта вы убедились, что алюминий энергично вытесняет водород из раствора хлороводородной кислоты. С железом реакция вытеснения водорода протекает менее энергично, а с медью вовсе не идет.
По интенсивности вытеснения водорода из кислот металлы можно разместить в ряд:
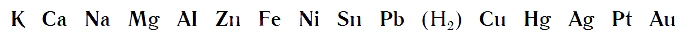
Его называют рядом активности или вытеснительным рядом металлов.
Чем левее расположен металл в вытеснительном ряду до водорода (Н2), тем активнее он вытесняет водород из кислот. Металлы, стоящие в ряду правее водорода, из кислот водород не вытесняют.
Зная расположение металлов в вытеснительном ряду, заранее можно предсказать:
- Будут ли реагировать металлы с кислотами с выделением водорода;
- Насколько активно будут протекать эти реакции.
Для получения водорода из кислот в лаборатории или школьном кабинете химии необходимо брать металлы, которые в вытеснительном ряду стоят до водорода. Но не каждый металл подходит для этих целей. Активные металлы натрий и калий реагируют с кислотами со взрывом, а реакции кислот с оловом и свинцом протекают медленно. Наиболее подходящими металлами для практического получения водорода являются цинк и алюминий. Как вы убедились, при проведении реакций этих металлов с раствором хлороводородной кислоты они протекают спокойно и достаточно быстро.
Краткие выводы урока:
- Кислоты — сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков.
- Металлы, стоящие в вытеснительном ряду до водорода, вытесняют его из кислот.
- В лаборатории водород получают в реакции металлов с кислотами.
Надеюсь урок 24 «Выделение водорода в реакциях кислот с металлами» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Урок 22. Химические свойства водорода
В уроке 22 «Химические свойства водорода» из курса «Химия для чайников» узнаем с какими веществами реагирует водород; выясним, какими химическими свойствами обладает водород.

Водород вступает в химические реакции с простыми и сложными веществами. Однако при обычных условиях водород малоактивен. Для его взаимодействия с другими веществами необходимо создать условия: повысить температуру, применить катализатор и др.
Реакции водорода с простыми веществами
При нагревании водород вступает в реакции соединения с простыми веществами — кислородом, хлором, азотом, серой.
Если поджечь на воздухе чистый водород, выходящий из газоотводной трубки, он горит ровным, еле заметным пламенем. Теперь поместим трубку с горящим водородом в банку с кислородом (рис. 95).
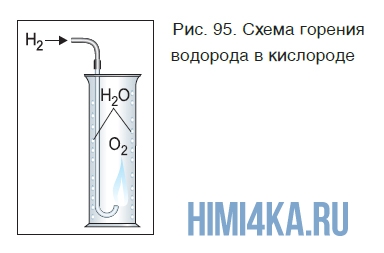
Горение водорода продолжается, при этом на стенках банки видны капли воды, образующейся в результате реакции:
При горении водорода выделяется много теплоты. Температура кислородно-водородного пламени достигает больше 2000 °С.
Химическая реакция водорода с кислородом относится к реакциям соединения. В результате реакции образуется оксид водорода (вода). Это значит, что произошло окисление водорода кислородом, т. е. эту реакцию мы можем назвать и реакцией окисления.
Если же в пробирку, опрокинутую вверх дном, собрать немного водорода методом вытеснения воздуха, а затем поднести к ее отверстию горящую спичку, то раздастся громкий «лающий» звук небольшого взрыва смеси водорода с воздухом. Такую смесь называют «гремучей».
На заметку: Способность водорода в смеси с воздухом образовывать «гремучий газ» часто являлась причиной катастроф на воздушных шарах, заполненных водородом. Нарушение герметичности оболочки шара приводило к пожару и даже взрыву. В наше время воздушные шары заполняют гелием или постоянно нагнетаемым горячим воздухом.
В атмосфере хлора водород сгорает с образованием сложного вещества — хлороводорода. При этом протекает реакция:
Реакция водорода с азотом происходит при повышенной температуре и давлении в присутствии катализатора. В результате реакции образуется аммиак NH3:
На заметку: Водород способен не только растворяться в некоторых металлах, но и реагировать с ними. При этом образуются химические соединения, называемые гидридами (NaH — гидрид натрия). Гидриды некоторых металлов используют как горючее в ракетных двигателях на твердом топливе, а также при получении термоядерной энергии.
Реакции водорода со сложными веществами
Водород реагирует при повышенной температуре не только с простыми, но и со сложными веществами. Рассмотрим в качестве примера его реакцию с оксидом меди(II) CuO (рис. 96).
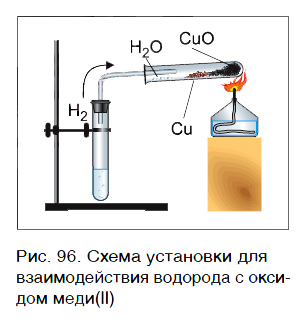
Пропустим водород над нагретым порошком оксида меди(II) CuO. По мере протекания реакции цвет порошка изменяется с черного на коричнево красный. Это цвет простого вещества меди Cu. В ходе реакции на холодных частях пробирки появляются капельки жидкости. Это еще один продукт реакции — вода H2O. Отметим, что в отличие от простого вещества меди вода — сложное вещество.
Уравнение реакции оксида меди(II) с водородом:
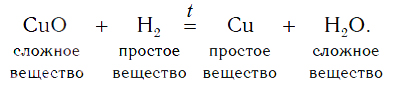
Водород в реакции с оксидом меди(II) проявляет способность отнимать у оксида металла кислород, тем самым восстанавливать металл из этого оксида. В результате происходит восстановление меди из сложного вещества CuO до металлической меди (Cu).
Реакции восстановления — это реакции, в ходе которых сложные вещества отдают атомы кислорода другим веществам.
Вещество, отнимающее атомы кислорода, называют восстановителем. В реакции с оксидом меди(II) восстановитель — водород. Так же реагирует водород и с оксидами некоторых других металлов, например PbO, HgO, MoO3, WO3 и др. Окисление и восстановление всегда взаимосвязаны между собой. Если одно вещество (Н2) окисляется, то другое (CuO) — восстанавливается, и наоборот.
- При нагревании водород реагирует с кислородом, хлором, азотом, серой.
- Восстановление — это отдача атомов кислорода сложными веществами другим веществам.
- Процессы окисления и восстановления взаимосвязаны между собой.
Надеюсь урок 22 «Химические свойства водорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Урок 26. Получение водорода и его применение
В уроке 26 «Получение водорода и его применение» из курса «Химия для чайников» узнаем о получении водорода в лабораториях и в промышленности, а также выясним в каких отраслях промышленности его применяют.

Водород находит широкое применение в технике и лабораторных исследованиях. Мировое промышленное производство водорода из меряется десятками миллионов тонн в год.
Выбор промышленного способа получения простых веществ зависит от того, в какой форме соответствующий элемент находится в природе. Водород находится в природе преимущественно в соединениях с атомами других элементов. Поэтому для его получения необходимо использовать химические методы. Эти же методы применяют для получения водорода и в лабораторной практике.
Получение водорода в лаборатории
В лабораториях водород получают уже известным вам способом, действуя кислотами на металлы: железо, цинк и др. Поместим на дно пробирки три гранулы цинка и прильем небольшой объем соляной кислоты. Там, где кислота соприкасается с цинком (на поверхности гранул), появляются пузырьки бесцветного газа, которые быстро поднимаются к поверхности раствора:
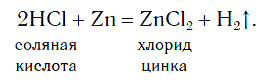
Атомы цинка замещают атомы водорода в молекулах кислоты, в результате чего образуется простое вещество водород Н2, пузырьки которого выделяются из раствора. Для получения водорода таким способом можно использовать не только хлороводородную кислоту и цинк, но и некоторые другие кислоты и металлы.
Соберем водород методом вытеснения воздуха, располагая пробирку вверх дном (объясните почему), или методом вытеснения воды и проверим его на чистоту. Пробирку с собранным водородом наклоняем к пламени спиртовки. Глухой хлопок свидетельствует о том, что водород чистый; «лающий» громкий звук взрыва говорит о загрязненности его примесью воздуха.
В химических лабораториях для получения относительно небольших объемов водорода обычно применяют способ разложения воды с помощью электрического тока:
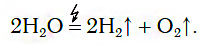
Из уравнения процесса разложения следует, что из 2 моль воды образуются 2 моль водорода и 1 моль кислорода. Следовательно, и соотношение объемов этих газов также равно:
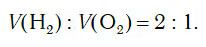
Получение водорода в промышленности
Очевидно, что при огромных объемах промышленного производства сырьем для получения водорода должны быть легкодоступные и дешевые вещества. Такими веществами являются природный газ (метан СН4) и вода. Запасы природного газа очень велики, а воды — практически неограниченны.
Самый дешевый способ получения водорода — разложение метана при нагревании:
Эту реакцию проводят при температуре около 1000 °С.
В промышленности водород также получают, пропуская водяные пары над раскаленным углем:
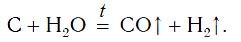
Существуют и другие промышленные способы получения водорода.
Применение водорода
Водород находит широкое практическое применение. Основные области его промышленного использования показаны на рисунке 103.
Значительная часть водорода идет на переработку нефти. Около 25 % производимого водорода расходуется на синтез аммиака NH3. Это один из важнейших продуктов химической промышленности. Производство аммиака и азотных удобрений на его основе осуществляется в нашей стране на ОАО «Гродно Азот». Республика Беларусь поставляет азотные удобрения во многие страны мира.
В большом количестве водород расходуется на получение хлороводородной кислоты. Реакция горения водорода в
кислороде используется в ракетных двигателях, выводящих в космос летательные аппараты. Водород применяют и для получения металлов из оксидов. Таким способом получают тугоплавкие металлы молибден и вольфрам.
В пищевой промышленности водород используют в производстве маргарина из растительных масел. Реакцию горения водорода в кислороде применяют для сварочных работ. Если использовать специальные горелки, то можно повысить температуру пламени до 4000 о С. При такой температуре проводят сварочные работы с самыми тугоплавкими материалами.
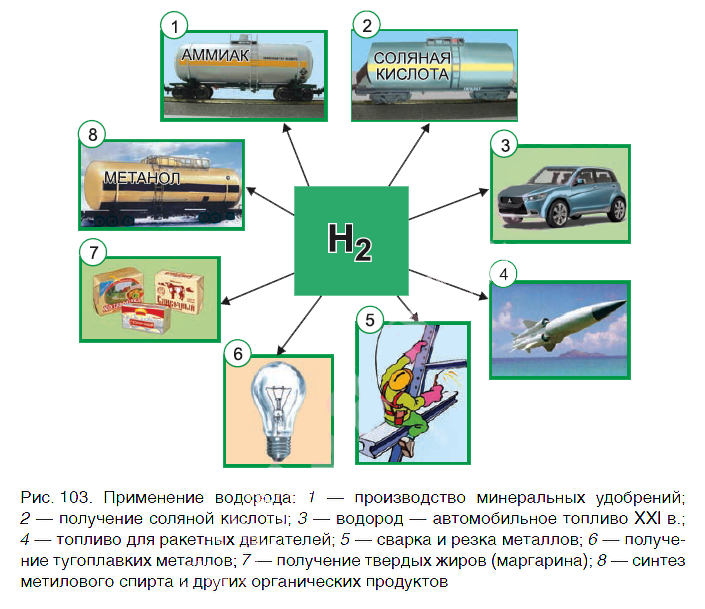
В настоящее время в ряде стран, в том числе и в Беларуси, начаты исследования по замене невозобновляемых источников энергии (нефти, газа, угля) на водород. При сгорании водорода в кислороде образуется экологически чистый продукт — вода. А углекислый газ, вызывающий парниковый эффект (потепление окружающей среды), не выделяется.
Предполагают, что с середины XXI в. должно быть начато серийное производство автомобилей на водороде. Широкое применение найдут домашние топливные элементы, работа которых также основана на окислении водорода кислородом.
- В лаборатории водород получают действием кислот на металлы.
- В промышленности для получения водорода используют доступное и дешевое сырье — природный газ, воду.
- Водород — это перспективный источник энергии XXI в.
Надеюсь урок 26 «Получение водорода и его применение» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Химические свойства металлов

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
Cu, Hg, Ag, Pt, Au
Восстановительная способность металлов в свободном состоянии
Возрастает справа налево
Взаимодействие металлов с кислородом
Быстро окисляются при обычной температуре
Медленно окисляются при обычной температуре или при нагревании
Взаимодействие с водой
Выделяется водород и образуется гидроксид
При нагревании выделяется водород и образуются оксиды
Водород из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с концентрированными азотной и серной кислотами
С кислотами не реагируют, растворяются в царской водке
Взаимодействие с солями
Не могут вытеснять металлы из солей
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей
Взаимодействие с оксидами
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов
Читайте также:
