Что такое аллотропия металлов
Обновлено: 16.05.2024
Три аллотропные модификации серы: ромбическая, моноклинная и пластическая. Й. Берцелиус и введение понятия "Аллотропия" в науку. Сущность гипотезы А. Авогадро. Способность элемента к образованию аллотропных форм и суть аллотропии некоторых веществ.
| Рубрика | Химия |
| Вид | доклад |
| Язык | русский |
| Дата добавления | 14.03.2014 |
| Размер файла | 133,5 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Аллотропия
Аллотропия - существование двух и более простых веществ одного и того же химического элемента, различных по строению и свойствам - так называемых аллотропных модификаций или форм.
Явление аллотропии обусловлено либо различным составом молекул простого вещества (аллотропия состава: например, кислород и озон), либо способом размещения атомов или молекул в кристаллической решётке (аллотропия формы: например, алмаз и графит).
Понятие аллотропии введено в науку Й. Берцелиусом в 1841 году для обозначения разных форм существования элементов; одновременно он предполагал, по-видимому, применить его и к изомерии соединений. После принятия гипотезы А. Авогадро стало понятно, что элементы могут существовать в виде многоатомных молекул, например, О2 -кислород и О3 - озон.
В начале XX века было признано, что различия в кристаллической структуре простых веществ (например, углерода или фосфора) также являются причиной аллотропии. В 1912 году В. Оствальд отметил, что аллотропия элементов является просто частным случаем полиморфизма кристаллов (т. е. способностью веществ существовать в различных кристаллических структурах), и предложил от него отказаться. Однако, по настоящее время они используются параллельно. Аллотропия относится только к простым веществам, независимо от их агрегатного состояния; полиморфизм - только к твёрдому состоянию независимо от того, простое это вещество или сложное. Таким образом, эти термины совпадают для простых твёрдых веществ (кристаллическая сера, фосфор, железо и др.
В настоящее время известно более 400 разновидностей простых веществ. Способность элемента к образованию аллотропных форм обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов.
Аллотропия некоторых веществ
аллотропия берцелиус авогадро
Множество модификаций: алмаз, графит, фуллерен, карбин, графен, углеродные нанотрубки, лонсдейлит и др. Точное число модификаций указать затруднительно вследствие разнообразия форм связывания атомов углерода между собой. Наиболее многочисленны молекулярные структуры фуллеренов и нанотрубок.
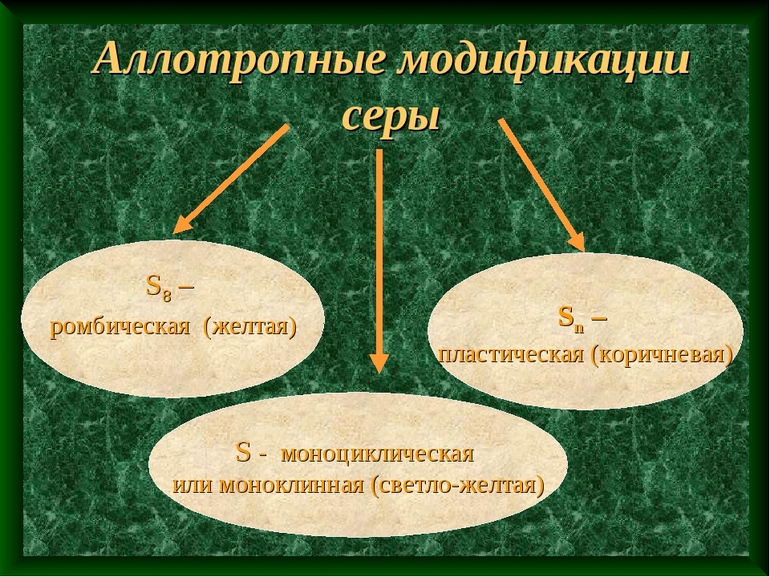
Большое число аллотропных модификаций, второе место после углерода. Основные модификации: ромбическая, моноклинная и пластическая сера. Водород может существовать в виде орто- и пара-водорода.
Известно 11 аллотропных модификаций фосфора. Основные модификации: белый, красный и чёрный фосфор. Белый фосфор ядовит, светится в темноте, способен самовоспламеняться, красный фосфор не ядовит, не светится в темноте, сам по себе не воспламеняется.
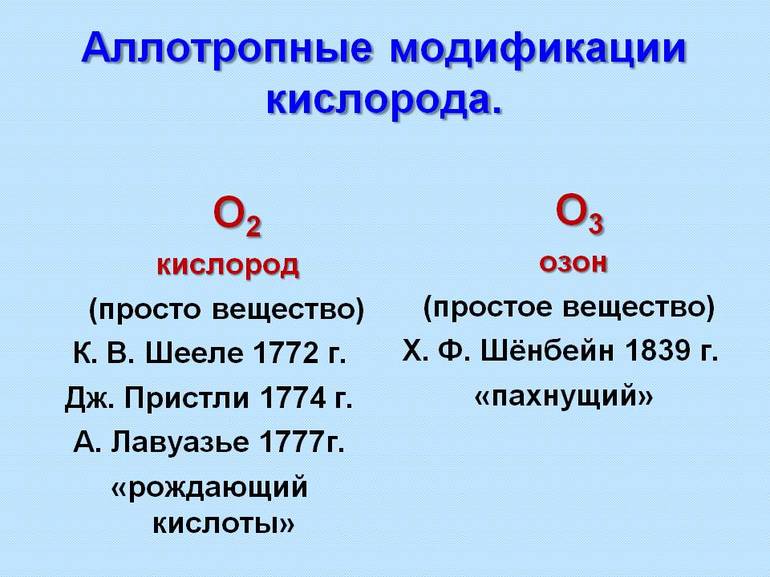
Две аллотропные модификации: О2 - кислород и О3 - озон. Кислород бесцветен, не имеет запаха; озон имеет выраженный запах, имеет бледно-фиолетовый цвет, он более бактерициден.
Аллотропные модификации серы
Существование аллотропных модификаций серы связано с её способностью образовывать устойчивые гомоцепи - S - S -. Устойчивость цепей объясняется тем, что связи - S - S - оказываются прочнее, чем связь в молекуле S2. Гомоцепи серы имеют зигзагообразную форму, поскольку в их образовании принимают участие электроны взаимно перпендикулярных р-орбиталей.
Существует три аллотропные модификации серы: ромбическая, моноклинная и пластическая. Ромбическая и моноклинная модификации построены из циклических молекул S8, размещенных по узлам ромбической и моноклинной решеток.
Молекула S8 имеет форму короны, длины всех связей - S - S - равны 0, 206 нм и углы близки к тетраэдрическим 108°.
В ромбической сере наименьший элементарный объем имеет форму прямоугольного параллелепипеда, а в случае моноклинной серы элементарный объем выделяется в виде скошенного параллелепипеда.
Кристалл ромбической серы
Кристалл моноклинной серы
Пластическая модификация серы образована спиральными цепями из атомов серы с левой и правой осями вращения. Эти цепочки скручены и вытянуты в одном направлении (рис.).
При комнатной температуре устойчива ромбическая сера. При нагревании она плавится, превращаясь в желтую легкоподвижную жидкость, при дальнейшем нагревании жидкость загустевает, так как в ней образуются длинные полимерные цепочки. При медленном охлаждении расплава образуются темно-желтые игольчатые кристаллы моноклинной серы, а если вылить расплавленную серу в холодную воду, получится пластическая сера - резиноподобная структура, состоящая из полимерных цепочек. Пластическая и моноклинная сера неустойчивы и самопроизвольно превращаются в ромбическую.
Подобные документы
Аллотропические модификации серы: ромбическая, пластическая, моноклинная. Их свойства, особенности. Ромбическая сера с наименьшим элементарным объемом в форме параллелепипеда. Моноклинная расплавленная сера из циклических молекул в форме желтой жидкости.
презентация [1,3 M], добавлен 20.02.2011
Химические и физические свойства серы. История открытия вещества. Основные месторождения самородной серы, способы получения и применение, пожароопасные свойства. Взаимодействие серы с кислородом, аллотропные модификации. Особенности плавления серы.
презентация [1,7 M], добавлен 12.01.2012
Характеристика строения атома, аллотропии, способа получения, окислительных и восстановительных свойств серы. Исследование истории открытия химических элементов теллура, полония, селена, физических свойств и работы с ними, основных областей применения.
презентация [4,4 M], добавлен 27.11.2011
Исследование химических свойств серы. Изучение истории названия и открытия элемента третьего периода периодической системы. Описания реакций с металлами, неметаллами и сложными веществами. Основные способы добычи серных руд. Аллотропные модификации серы.
презентация [6,3 M], добавлен 23.02.2013
Переход аллотропной модификации. Электрические, магнитные, оптические, физико-механические, термические свойства алмаза. Изучение структуры графита, его антифрикционные и химические свойства. Образование, применение озона и кислорода. Аллотропия углерода.
Кристаллизация металлов
Если взять большой кристалл ( существуют методы выращивания крупных кристаллов), вырезать из него несколько одинаковых по размеру, но различно ориентированных образцов и испытать их свойства, можно иногда наблюдать значительную разницу в свойствах отдельных образцов. Например, при испытании различных образцов из кристалла меди относительное удлинение изменяется от 10 до 55 %, а предел прочности -от 140 до 350 МПа. Это свойство кристаллов называютанизотропностью.
Анизотропность кристаллов определяется характером расположения атомов в кристаллической решетке.
Аморфные тела изотропны, т. е. все их свойства одинаковы во всех направлениях; излом аморфного тела всегда имеет неправильную, искривленную, так называемую раковистую форму.
Металлы, затвердевшие в обычных условиях, состоят из множества кристаллов, кристаллическая решетка которых по-разному ориентирована, поэтому свойства литого металла приблизительно одинаковы по всем направлениям; это называют квазиизотропностью.
Аллотропия металлов. Аллотропия металлов (или полиморфизм)-свойство перестраивать решетку при определенных температурах в процессе нагрева и охлаждения - присуща многим металлам (железу, марганцу, никелю, олову, титану, ванадию и др.). Каждое аллотропическое превращение происходит при определенной температуре (например, одно из превращений железа происходит при температуре 911 о С, ниже которой! атомы составляют решетку центрированного куба, а выше — решетку гранецентрированного куба).
Структура, имеющая ту или иную решетку, называется аллотропической формой или модификацией. Различные модификации обозначают греческими буквами α, β, γ и т. д., причем буквой α обозначают модификацию, существующую при температурах ниже первого аллотропического превращения. Аллотропические превращения сопровождаются отдачей (уменьшением) или поглощением (увеличением) энергии.
Кристаллизацией называется образование кристаллов в металлах и сплавах при переходе из жидкого состояния в твердое (первичная кристаллизация), а также перекристаллизация в твердом состоянии (вторичная кристаллизация) при их охлаждении. К вторичной кристаллизации относятся перекристаллизация из одной модификации в другую (полиморфные превращения), распад твердых растворов, распад или образование химических соединений.
Пространственные кристаллические решетки образуются в металле при переходе его из жидкого состояния в твердое. Этот процесс называется кристаллизацией. Превращения, связанные с кристаллизацией, в значительной степени определяют свойства металлов. Впервые процессы кристаллизации были изучены в 1878 г. Д. К. Черновым. Сущность кристаллизации состоит в следующем: в жидком металле атомы непрерывно движутся, по мере понижения температуры движение замедляется, атомы сближаются и группируются в кристаллы, которые называют центрами кристаллизации. Далее к этим центрам присоединяются вновь образующиеся кристаллы. Одновременно появляются новые центры. Таким образом, кристаллизация состоит из двух стадий: образования центров кристаллизации и роста кристаллов вокруг этих центров.
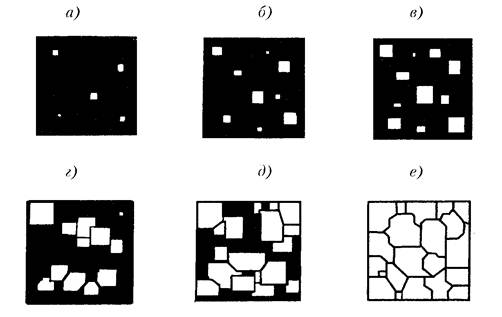
На рис. 3 показан механизм кристаллизации. Первоначально рост кристаллов не встречает препятствий (рис. 3, а - в) и они сохраняют правильность строения решетки. При дальнейшем росте кристаллы сталкиваются (рис. 3, г - е ) и образовавшиеся группы кристаллы имеют уже неправильную форму, но сохраняют правильность решетки внутри каждого кристалла. Такие кристаллы называют зернамиили кристаллитами На рис. 3, е приведены границы зерен различных размеров.
Процесс кристаллизации металла представляют в виде кривых в координатах температура - время, которые автоматически вычерчиваются самописцем, связанным с термоэлектрическим пирометром. Пирометр представляет собой милливольтметр 2 (рис. 4), подключенный к термопаре. Термопару 3 (две разнородные проволоки, спаянные концами) погружают в расплавленный металл 4. Возникающий при этом термоток пропорционален температуре металла, стрелка милливольтметра отклоняется, указывая эту температуру по шкале 1.Температура, соответствующая какому-либо превращению в металле, называется критической точкой.
Аллотропия - это. Понятие, причины и примеры аллотропии
Химия изучает свойства и строение простых веществ. В большинстве своем они остаются неизменными в любых ситуациях. Однако есть ряд элементов, способных менять свои свойства в различных своих состояниях. Такое явление называется аллотропией. Знание о поведении элементов, подверженных аллотропии, расширяет понимание устройства мира и поведения в нем веществ и элементов.
Определение
Аллотропия - это возможность элемента трансформироваться в другой. В некоторых случаях даже в два или три. Если переводить название термина с греческого языка, то аллотропия - это "другое свойство". То есть буквальный перевод раскрывает сущность явления.
Виды аллотропии

Аллотропия, свойственная некоторым веществам, условно делится на два вида - по составу и по строению. В первом случае различно число атомов в молекуле. Во втором - строение кристаллической решетки.
В химии аллотропия - это изменение вещества независимо от того, жидкое оно, твердое или газообразное. Единственное отступление от терминологии появляется в работе с твердыми веществами, их строение сложнее, для их трансформации используется слово "полиморфизм", в переводе с греческого означающее "многообразный".
Каким веществам свойственна аллотропия
Не все вещества способны преобразоваться из сложных в простые даже под действием температур или других воздействий. Это может происходить только с теми из них, у которых есть способность к образованию гомоцепных структур или хорошо окисляющихся. Именно поэтому аллотропия веществ свойственна неметаллам. Хотя справедливости ради следует сказать, что есть металлы, способные преобразовываться в простые элементы, но это, скорее, полуметаллы.
Примеры аллотропии
Для понимания процесса существует ряд примеров преобразования вещества, причем оно бывает обратимым и необратимым. То есть вещество может после воздействия на него температуры или давления вернуться к первоначальному состоянию. Но бывает так, что оно остается в видоизмененном состоянии. Например, ромбическая сера - при нагревании ее до температуры 95,5 градуса по Цельсию она преобразуется в моноклинную форму. При снижении температуры до 95,5 градуса наступает обратное преобразование - из моноклинной формы в ромбическую.
Другой пример аллотропии - это изменение белого фосфора в черный. В данном случае для проведения преобразования требуется температура в 200 градусов по Цельсию и давление в 1,25 г Па. При воздействии тех же температур и давления на преобразованный черный фосфор он не сможет вернуться к первоначальному состоянию.
Как уже упоминалось, явление аллотропии свойственно и некоторым металлам. Но из-за сложности их структуры переходы из одного в другое состояние могут чередоваться. Например, в нормальных условиях белое олово является пластичным металлом, но при нагревании его при температуре 173 градуса по Цельсию оно перестраивает свою кристаллическую решетку до очень хрупкого состояния, а при снижении температуры до 13 градусов кристаллическая решетка принимает вид кубической алмазоподобной и делает вещество порошкообразным.
Модификации неметаллов

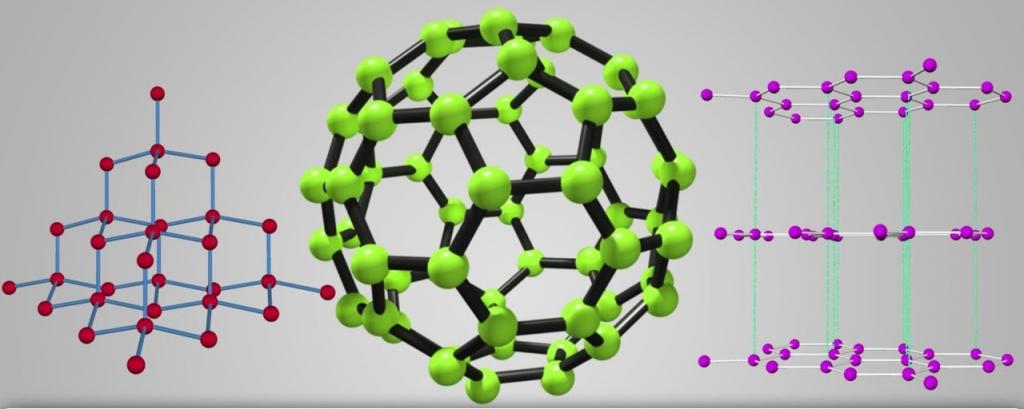
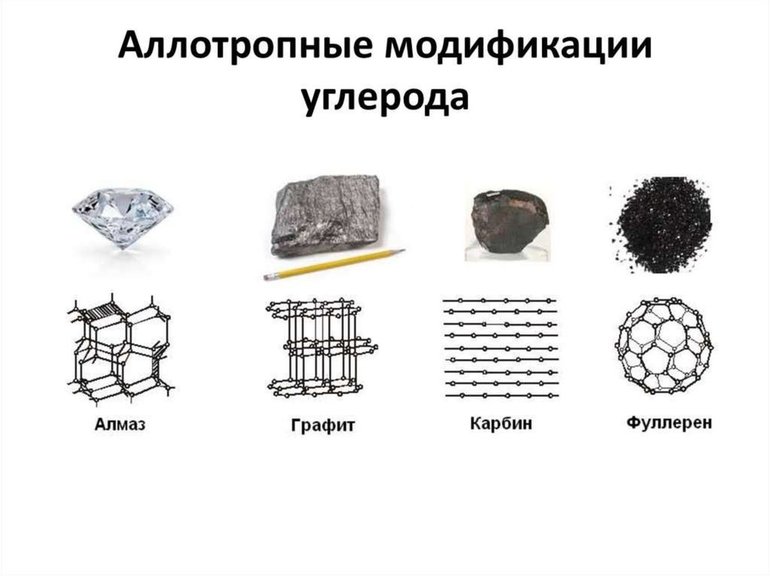
Самыми яркими и многообразными физическими свойствами аллотропии обладает углерод. Он способен перерождаться в самое большое количество аллотропных форм, причем с различными не только свойствами, но и строением кристаллической решетки. Взять, например, графит и алмаз. Формы одного вещества, но с разными строениями кристаллических решеток – графит чуть плотнее порошка, а алмаз - самое крепкое вещество на земле. И это уже не говоря об углеродных нанотрубках, лонсдейлите, фуллерене, карбине и других формах углерода.
Аллотропия характерна для серы. В нормальных условиях структура вещества моноклинная, а под воздействием температур может преобразоваться в пластическую и следом за этим в ромбовидную.
Фосфор способен изменяться в 11 форм. Причем 3 из них - белый, черный, красный - даже встречаются в природе, остальные можно получить искусственным путем. Отличается одна форма вещества от другой количеством атомов в молекуле. Различными цветами в химии представлен селен. Он также бывает серный, черный и красный.
Очень известная аллотропия - это кислород. Он видоизменяется до озона под действием температуры или электрического тока. Известный пример природного воздействия – молния. Во время разряда электрического поля кислород превращается в озон.
Модификации полуметаллов

Бор - это полуметалл, встречающийся в природе в аморфной и кристаллической форме. Но у него есть еще 10 известных науке форм.
Аморфным и кристаллическим бывает кремний. Сурьма в четырех формах по своей структуре представляется металлом, и в трех она аморфная, аллотропная.
Как и в случае с фосфором или селеном, мышьяк бывает серый или черный, в зависимости от формы – полимер или неметаллическая структура.
Модификации металлов

Самым широким спектром форм среди металлов обладает железо. В первом виде феррита, с характерной объемно-центрированной кубической кристаллической решеткой, железо способно существовать в температурных пределах от 0 до 769 градусов по Цельсию. Имеет свойства ферромагнетиков.
Второй тип феррита существует при температурах в диапазоне 769-917 градусов по Цельсию. Отличается объемно-центрированной кубической кристаллической решеткой. Магнетические свойства проявляет как парамагнетик.
Третий тип железа называется аустенит, характерен гранецентрированной кубической кристаллической решеткой. Способен существовать только при температурах от 917 до 1394 градусов по Цельсию. Магнитных свойств не имеет.
Четвертый тип железа возникает при температурах свыше 1397 градусов по Цельсию. Магнитных свойств не имеет, характерен объемно-центрированной кубической кристаллической решеткой.
Другой металл, имеющий несколько типов преобразования, - это олово. В аллотропной форме может существовать в виде порошка с кристаллической решеткой, подобной алмазной. Это так называемое серое олово. Есть и более привычная форма металла – белое олово. Оно встречается в виде пластичного метала серебряного цвета. Третья форма характерна тугоплавкостью, так как обладает ромбической кристаллической решеткой, называется она гамма-оловом.
Заключение

Все металлы, полуметаллы и неметаллы различных аллотропных типов с характерным строением кристаллических решеток, массой, количеством и зарядом протонов и нейтронов могут встречаться в природе в чистом, натуральном виде или получаются только в лаборатории. В обычных условиях они не сохраняют своей стабильности. Все это говорит о многообразии химических элементов и перспективах открытий новых доселе неизвестных науке форм и типов веществ. Такие исследования ведут к развитию всех отраслей жизнедеятельности человека.
Аллотропные модификации - определение, характеристика и примеры
Свойства материалов в большинстве случаев отличаются постоянством, но ряд веществ меняет характеристики, в зависимости от состояния. Аллотропия в химии — это нахождение одного простого элемента в двух формах состояния, которые различаются кристаллическим строением. Аллотропные модификации выражают взаимное термодинамическое превращение между фазами вещества.
Общее понятие
Аллотропия проявляется, благодаря разному составу микрочастиц простой материи и координируется вариантом размещения молекул и атомов в кристаллической решетке. Вещество кристаллизуется в нескольких модификациях, при этом два параметра простой ячейки совпадают. Изменение состояния происходит из-за отличия третьего показателя, который учитывает расстояние между сопредельными слоями.
Явление часто обнаруживается в структурах, которые равнозначны гексагональному и кубическому расположению атомов. Соседняя атомная среда представляет эквивалентное окружение, а различия проявляются на удаленных сферах. Энергетические характеристики решеток приблизительно равны, поэтому физические свойства разных состояний одного элемента остаются похожими.
Первые примеры аллотропных модификаций показал шведский минералог и химик Берцелиус середине XIX века для выделения различных форм нахождения элемента. Через 2 десятка лет была принята гипотеза итальянского химика А. Авогадро о многоатомных молекулах и стало видно, что от строения частиц зависит проявление элемента в материи. Например, О3 — озон, а О2 — кислород.
В 1912 году ученые определили, что различия в структуре простых элементов, например, фосфора или углерода, относятся к первопричинам существования двух и более состояний. В настоящее время аллотропией называется видоизменение простых материй, независимо от агрегатного вида. Изменения в твердых состояниях сложных и простых веществ имеет название полиморфизма. Два определения совпадают, если речь идет о простых материалах в твердом виде (железо, сера в кристаллах, фосфор).
Реорганизация веществ
Продолжаются открытия видов простых материалов, способных к аллотропии, несмотря на то, что список образовательных веществ уже превышает 400 материалов. Типы химических связей в элементарных частицах зависят от строения атома, вместе эти характеристики определяют возможность вещества образовывать разные аллотропные формы.
Компоненты, которые могут изменять показатель координационного числа и стадии окисления, образовывают большее количество аллотропных состояний. Важным фактором разнообразия форм является способность элемента к образованию гомоцепных решеток (состоящих из однотипных атомов).
Преобразование простых элементов
Более выраженными являются аллотропные модификации неметаллов, но среди веществ этой группы имеются исключения, например, благородные газы и галогены. Некоторые состояния отличаются температурной стабильностью, другие характеризуются фазовой динамикой. Такие различия объясняются затратами некоторой энергии при изменении кристаллической решетки в результате плавления.
Примеры реорганизации неметаллов:
- Водород. Может быть в форме пара- и ортоводорода на молекулярном уровне. В первой макромолекуле отмечаются антипараллельные импульсные моменты электронов, а в частицах второго типа проявляются параллельные ядерные спины.
- Углерод. Элемент встречается в виде графена, алмаза, нанотрубок, графита, лонсдейлита и др. Точное количество состояний не поддается учету из-за того, что существует большое многообразие связей атомов друг с другом. Нанотрубки и фуллерены относятся к наиболее многочисленным структурам.
- Фосфор. Вещество насчитывает 11 видов аллотропных форм. Черный, белый и красный фосфор относятся к основным модификациям. Первый вид включается в группу инертных и токопроводящих материалов. Белый фосфор отсвечивает в темноте, ядовит и способен к самостоятельному возгоранию. Красный вид не опасен для человека, не воспламеняется и не светится в сумраке.
- Кислород. В природе бывает в виде озона с ярко выраженным запахом слабо фиолетового цвета или в форме кислорода, который не пахнет и без видимого колера.
- Селен. Представлен в двух видах. Первый — черный селен, второй — серый полимер.
- Сера. По количеству аллотропных состояний находится на 2 месте после углерода. Распространенными видами является моноклинная, пластическая и ромбическая сера.
Разные состояния одного компонента обозначаются строчными литерами греческой латиницы для написания в формулах. Низкотемпературные формы отмечаются буквой α, следующие состояния по показателям обозначаются β и дальше по такому принципу.
Модификации полупроводников
К этой группе относятся элементы, располагающиеся в таблице на переходе от металлов к неметаллам. У материалов присутствует кристаллическая ковалентная решетка, чаще они характеризуются проводимостью по типу металлов. Иногда материалы работают как полупроводники.
Примеры трансформации неметаллов:

- Бор. Существует в природе в кристаллической и аморфной форме, первый тип имеет черный, а второй — бурый колер. Наука знает о более 10 аллотропных состояний бора, которые встречаются в тетрагональном и ромбическом соединении. В некоторых модификациях имеется несколько открытых слоев, образующих бесконечное строение.
- Кремний. Свойства кристаллической формы обусловлены алмазоподобной атомной решеткой, выделяется моно- и поликристаллический кремний. В природе встречается в виде песка, кварцита, полевого шпата, силикатов.
- Мышьяк. Распространены 3 основные аллотропные формы. Серый полимер относится к классу полуметаллов, желтый мышьяк входит в группу неметаллов, черный вид по структуре напоминает красный фосфор.
- Германий. Существует в форме полуметалла с кристаллической решеткой по типу алмаза и в фазе металла с токопроводящими качествами.
- Сурьма. Известно 4 модификации материала в форме металлов, из которых наиболее стабильной является серебристо-белое вещество с голубым оттенком. Аморфные аллотропии существуют в виде желтой, взрывчатой и черной сурьмы.
- Полоний. Находится в 2 металлических разновидностях. Низкотемпературная форма отличается кубическим строением решетки, высокотемпературный вид имеет ромбическую структуру.
К особенностям относится слабое сочетание зоны проводимости и валентной области. Это обеспечивает электропроводность до того времени, пока температура не снизится до 0ºС. Нагревание способствует увеличению электронных дырок (обладателей тока), но видоизменение идет слабо. Положительные квазичастицы в полуметаллах активно двигаются при малой полезной массе. По этой причине материалы больше других веществ подходят для изготовления фазовых переходов в магнитных полях большой силы, наблюдения квантовых и классических размерных эффектов.
Особенности видоизменения металлов
Металлы образовывают различные состояния при увеличении давления или в случае технологической обработки. Аллотропной модификацией металлов называется возможность материала в твердой форме образовывать различные виды кристаллических решеток. Процесс перехода от одной структуры к другой рассматривается в виде превращения.
Обследование структуры производится способом микроанализа, делается ультразвуковая, магнитная и рентгеновская дефектоскопия.
Микроанализ проводится на основе снятия микрошлифов, которые перед исследованием полируются до блеска. Вывод о структуре делается после рассмотрения срезов под микроскопом после травления. Шлифы показывают границы зерен из-за неодинаковой обработки основного слоя и рельефных выступов. Анализ выявляет форму и размеры частиц, инородные включения.
Рентген дает понятие об атомном строении материала, типе кристаллической структуры, дефектах решеток. Для исследования используется свойство рядов отражать гамма-лучи. При магнитном способе поверхность металла намагничивается и покрывается железным порошком. После размагничивания слой показывает очертания решетки.
Ультразвук применяется для эффективного обнаружения качественного преобразования металла в требуемую аллотропную модификацию. Волновое излучение распространяется внутрь и отражается от элементов решетки.
При нагревании металлов в процессе превращения поглощается тепло, при этом изменение решеточной конструкции происходит при одной и той же температуре. Аллотропным модификациям подвергаются многие металлы, например, титан, железо, олово и др. Железо при нагревании до +1390ºС характеризуется гранецентрированной решеткой. Повышение температуры до +1540ºС ведет к перестройке до центрировано-кубической структуры.
Аллотропные модификации металлов:

Определенные свойства твердых элементов зависят не только от строения решетки и дефектов, но и от структуры микрочастиц, их состава, размера и формы. Конструкция кристаллов оказывает влияние на физические характеристики тела и предопределяет пределы деформационной пластики, твердость материала.
Обратимые и непоправимые переходы
В случае изменения температурных показателей и параметров давления твердые материалы переходят из одной структуры в другую без перемены количественного состава элементов. Предпосылками является подвижность частиц решетки и перенос некоторого количества вещества, вызванный дефектами строения твердого состояния.
Примеры переходов:
- энантиотропные преобразования (обратимые);
- монотропные видоизменения (необратимые).

Проводят разработанную методику трехфазной реакции для направленного получения требуемой решеточной структуры. Выбор нагревательного режима и продолжительность повышения температуры ускоряет рост кристаллов до больших зерен, что улучшает качество. Изменение способа обработки направляется иногда на снижение активности катализаторов в результате процесса рекристаллизации.
Энантиотропное видоизменение возникает при нулевой температуре и выбранном давлении. Иногда аллотропное преобразование относится к необратимым и одно из состояний материала является неустойчивым в термическом плане. Эта фаза сохраняется на всем температурном интервале от абсолютного нуля и называется монотропным. При получении серого олова из белого происходит обратимое преобразование, а превращение алмаза в графит становится необратимым.

Отличие этих типов превращений — в технологических особенностях проведения. Энантиотропные переходы модификации А чаще получаются методом постепенного охлаждения сплава. Сначала масса кристаллизуется в виде состояния Б, которое затем видоизменяется в устойчивую фазу к низким температурам.
При монотропном переходе в случае охлаждения сплава образуется только вещество в состоянии А. Требуется особый технологический режим со строгим дозированием понижения температуры и давления для получения модификации Б. Примером служит получение стабильного черного фосфора из белого путем нагревания до + 200ºС и повышения давления до 1,25 ГПа. После помещения полученного образца в нормальные условия обратного преобразования не происходит.
Читайте также:
