Простое вещество металл у элемента
Обновлено: 17.05.2024
Урок - путешествие. Открытый урок на семинар по активизации познавательной деятельности учащихся на уроках химии.
| Вложение | Размер |
|---|---|
| chistovik_otkrytogo_uroka.docx | 45.71 КБ |
Подтяните оценки и знания с репетитором Учи.ру
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Урок-путешествие: Металлы - простые вещества
Эпиграф : «Металлом называется твердое, непрозрачное и светлое тело, которое в огне плавится и холодное ковать можно». М.В.Ломоносов.
Вид урока : изучение нового материала
Познакомиться со строением и общими свойствами металлов, исходя из их положения в периодической системе;
Обобщить и расширить знания учащихся об общих и отличительных физических свойствах металлов;
Обобщить знания учащихся о распространении металлов в окружающей среде;
Расширить и углубить знания учащихся о роли металлов в организме и жизни человека;
Формирование знаний учащихся об основах здоровья на основе интеграции химических и валеологических знаний;
Развивать память, речь, логическое мышление; расширение кругозора и повышение интереса к изучению химии;
Формирование у учащихся устойчивой мотивации к познанию;
«Знания без воспитания – меч в руках сумасшедшего» (Д.И.Менделеев).
Использую технологию групповой работы, развивать самостоятельность целеустремленность учащихся;
1) Задания – инструкции для проведения лабораторных опытов "Физические свойства металлов"
2) наборы металлов и неметаллов для проведения лабораторных опытов "Физические свойства металлов"
3) ПСХЭ Д.И.Менделеева;
5) Компьютер, мультимедийный проектор, Презентация
Ребята , сегодня мы с вами будем изучать тему без знаний которой не обходятся люди многих профессий: врачи, фармацевты, биологи, химики, физики, минерологи, геологи, агрономы, ветеринары, инженеры, повара, и список этот можно продолжать до бесконечности.
Вы не догадались, о чем пойдет речь? Тогда отгадайте ребусы, ответы будут темой сегодняшнего урока.
3. Этап усвоения новых знаний
Задумывались ли вы когда– нибудь о том, какими материалами человек пользуется чаще всего? Давайте оглянемся вокруг. Мебель в классе деревянная держится на металлических шурупах. К каждой парте подведена вода, которая течёт по металлическим трубам. Краны в классе, детали компьютера, провода по которым течет электрический ток металлические.
Из металла сделаны ложки, ножи ,вилки, кастрюли, сковородки, детали телевизоров и, автомобили. Кроме того, металлы входят в состав живых организмов.
Знания о металлах имеют огромное значение для каждого из нас. Дело в том, что здоровье человека напрямую зависит от наличия или отсутствия в нашем организме некоторых металлов. В крови человека найдено 76 химических элементов из них 62 металла. К металлам – “ элементам жизни” относят 10 химических элементов металлов - K, Na, Mg, Ca, Fe, Mn, Co, Cu, Zn,Мо Значение их огромно.
При недостатке ионов Na + появляется головная боль, потеря памяти, а при избытке – развивается гипертония.
Са - участвует в свёртываемости крови ,способствует росту зубов, образованию молока у кормящих женщин, входит в состав скелета.
Недостаток К - приводит к аритмии,
Zn - к повреждению кожи, нарушению волосяного покрова, замедлению полового созревания ,
Mg – к повышению возбудимости, а избыток Mg вызывает депрессивное состояние.
Говорить об этом можно много, но переходим к теме.
Таблица 1 с образование
Перед вами периодическая таблица. Из 110 элементов представленных в ней 88 приходится на долю металлов. Если провести диагональ В – At, то в левом нижнем углу мы видим, располагаются только металлические элементы. За пределами этой диагонали есть еще металлы – это элементы побочных подгрупп.
2.Изучение нового материала.
ПУТЕШЕСТВИЕ В СТРАНУ ЗНАНИЙ 25 мин
В древности было известно людям только 7 металлов. Их считали посланниками космоса на Земле и связывали с планетами, приписывали чудодейственные свойства.
Представляю подборку интересных фактов о золоте и обо всем, что с ним связано. Но сначала небольшая сценка
Сценка (профессор и студент)
Профессор спрашивает студента:
- Если бы вам предложили ум или золото, что бы вы выбрали?
- Конечно, золото.
- А я ум, и знаете почему?
- Знаю, каждый берет то, чего ему не хватает.
А теперь 7 фактов о золоте!
Слово «gold» появилось из Индо-Европейского корня «желтый», отражающий наиболее заметную характеристику этого металла. Этот факт находит свое отражение в том, что произношение слова золота gold на разных языках похоже, например Gold (по-английски), Gold (по-немецки), Guld (по-датски), Gulden (по-голландски), Gull (по-норвежски) и Kulta (по-фински).
В конце XVIII века модно было украшать зубы золотыми коронками, которые ставили на совершенно здоровые зубы. Это требовала не только мода. Наличие блестящих зубов должно было подчеркнуть и высокое положение хозяина.
Если сплавить воедино весь мировой запас золота, который составляет 32 тыс. тонн, то в результате получится куб со стороной лишь в 12 метров
Кусочек золота размером со спичечный коробок можно раскатать в лист площадью в теннисный корт.
В Таджикистане гражданским чиновникам запрещено иметь золотые зубы.
Абсолютно чистое золото очень мягкое, его можно мять руками
В ЮАР добывается почти 2/3 всего мирового золота
Учитель : Самый большой смородок,котырый был найден весил 112 кг.
Знания, получаемые в школе по химии, мы не часто используем в повседневной жизни. Но именно химия может стать источником знаний о нашем здоровье. Благодаря химии, мы узнаем, как вещества влияют на процессы жизнедеятельности организма, жизнь в целом, что полезно человеку и в каких количествах, что вредно и до какой степени.
Организм человека – это сложная химическая система, которая не может функционировать самостоятельно, без взаимосвязи с окружающей средой. Трудно представить, но наше самочувствие, настроение, аппетит зависят от. металлов. В таблице Д.И.Менделеева трудно найти химический элемент – металл, который был бы не связан с нашей жизнью.
Серебро пользовалось особым уважением в средние века. Алхимики считали, что серебро входит в число семи металлов, которые они наделяли целительной силой. Серебро использовали для лечения эпилепсии, невралгии, холеры, гнойных ран. В водах священной индийской реки Ганга повышено содержание серебра. Высокие дезинфицирующие свойства серебра превосходят такие же свойства карболки, хлорной извести. Специально приготовленное серебро применяется при головных болях, потере голоса у певцов, страхах, головокружении.
Наиболее эффективно и безопасно действует серебро в сверхмалых дозах. В нашей стране оно существует в виде препарата «Серебряный дождь». Лечебное действие этого препарата наблюдают при поражении голосовых связок, возникающих в результате перегрузок у певцов, лекторов и учителей.
Во время вторжения войска Александра Македонского в IV в. до н. э. в Индию на берегах р. Инд в войске разразилась эпидемия желудочно-кишечных заболеваний. Но она не затронула ни одного военачальника. Оказалось, что простые воины пользовались оловянной посудой, а их командиры – серебряной. Невесомых количеств растворенного серебра оказалось достаточно для дезинфекции воды и пищи.
Учитель: Самый большой смородок,котырый был найден весил 13,5 тонн.
3.Экспериментальная (выполняют в парах лабораторную работу)
Сегодня нам необходимо также познакомиться с физическими свойствами металлов. На с.69 черным шрифтом выделены основные свойства.
Вам даны вещества: Определите какие из них металлы, а какие неметаллы. Работаете по
Урок развития критического мышления "Металлы — простые вещества"
Цель технологии развития критического мышления – научить ученика самостоятельно мыслить, осмысливать, структурировать и передавать информацию, чтобы другие узнали о том, что новое он открыл для себя.
Задача учителя – найти современные формы, методы и приемы обучения и воспитания молодежи на уроках, активизировать познавательные способности, развивать творческий потенциал каждого обучающегося.
Выделяют три основных этапа в применении технологии развития критического мышления: вызов, осмысление, рефлексию.
Первый этап – вызов. С этого этапа начинается урок. Задачи: актуализировать и обобщить имеющиеся у учащихся знания по данной теме, вызвать интерес к изучаемой теме, мотивировать учебную деятельность и побудить к активной работе обучающихся.
Второй этап – осмысление. Школьники получают новую информацию, осмысливают ее, соотносят с уже имеющимися знаниями.
Третий этап – рефлексия. Это целостное обобщение полученной информации, формирование собственного отношения к изучаемому материалу, приемов работы, которые ориентированы на создание условий для развития каждого обучающегося.
Оборудование: лист учета знаний, дидактические карточки, таблица “Химическая связь”, рисунки планет элементов, изделия из алюминия: фольга, ложка, проволока, пластина, часть рамы; металлический натрий, вода, коллекция “Металлы”, медная катушка, серебряная монета, консервная банка, припой, оловянные солдатики, градусник, ребус, черный ящик: металлический натрий, медная проволока, алюминиевый провод, серебряное кольцо, оловянный солдатик; корзина.
Дидактические задачи: актуализация знаний, которые необходимо обобщить, формирование мотивации к работе в школе и дома.
Познание начинается с удивления.
Может ли гореть вода? (Демонстрация опыта.) 2Na + 2 H2 O → 2 Na OH + H2 ↑
Какова причина этого явления?
Ответ находится в этом черном ящике.
Прием “Черный ящик”. Нужно разгадать загадку, если ответ верный, то достать из ящика предмет.
1. Красит пламя в желтый цвет, в воду кинь – его уж нет.
Если затрудняетесь ответить, от поможет отгадать загадку ребус:2. Иду на мелкую монету, в колоколах люблю звенеть.
Мне ставят памятник за это, и знают: имя мое … (Cu)
3. Главное ребята, вес удельный мой,
Потому в дюралях я главный составной,
Назван я “крылатым”, так как самолеты
Надежно, легко отправляю в полеты. (Al.)
4. Оно обеззараживает воду, убивает вредные микроорганизмы,
используется для изготовления зеркал (Ag.)
5. Какое вещество “болеет чумой”? (Олово.)
Поможет ответить на вопрос – ребус:
Что такое “оловянная чума”? Это мы узнаем при изучении нового материала.
Что объединяет все эти предметы? (Это металлы.)
Прием “Корзина понятий, предметов”. Сложите в корзину металлы, составьте рассказ, свяжите эти предметы из металлов в единое целое, используйте знания физики, жизненный опыт.
Тема урока “Простые вещества – металлы”.
Прием “А знаете ли вы, что …”
Цезий – один из активных металлов, плавится в руке, а Hg – плавится при температуре – 39 0 . Самым пластичным из драгоценных металлов является – золото. 1гр можно вытянуть в проволоку длинной 2 км или изготовить очень тонкий лист в 200 раз тоньше человеческого волоса. В земной коре его приблизительно 100 – 150 млрд.т, в1 м3 морской воды содержится 5,5 мг золота (500 млн.т – в мировом океане).
В 1872 году был найден в Австралии самый большой самородок золота весом 260 кг.
Алюминиевая посуда в XIX веке считалось признаком большого достатка.
В 1854 году 1 кг Al стоил 1200 руб., в 270 раз дороже серебра, ценился дороже золота.
Царская семья получила в подарок набор столовых алюминиевых приборов, которыми пользовались довольно долго во время торжественных обедов, когда все придворные пользовались “дешевыми” приборами из серебра и золота.
Менделееву была вручена в награду алюминиевая чаша.
II стадия: осмысления.
Дидактическая задача: организация работы по освоению материала, формирование коммуникативной компетенции.
Какую мы цель поставим? Что должны знать и уметь?
Знать положение элементов металлов в Периодической системе и особенности строения их атомов, уметь объяснять общие физические свойства металлов строением металлической кристаллической решетки.
Работа с Периодической системой. Ребята изучают положение элементов металлов, отмечают, что находятся в 1–3 группах, поэтому на внешнем энергетическом уровне находится от 1 до 3 электронов, отмечают закономерности изменения их свойств в Периодической системе.
Прием “Взаимоопрос”. Двое учащихся читают текст, останавливаясь после каждого абзаца, и по очереди задают друг другу вопросы по прочитанному материалу. Из истории металлов. Уже с глубокой древности человеку были известны 7 металлов: золото, серебро, олово, железо, ртуть, свинец, медь.
Эти элементы можно назвать доисторическими, так как они применялись человеком еще до изобретения письменности. Астрологи того времени утверждали, что каждой планете на небе соответствует свой металл на Земле, например, красноватому Марсу – гремящее в боях железо. Каждая планета издревле обозначалась особым знаком. Этими же знаками обозначали и “родственные” этим планетам металлы.
Семь металлов создал свет по числу семи планет.
Формирование внимания. Посмотрите на рисунок 41, запомните обозначение химических элементов алхимиками. Через 2 минуты воспроизведите изученное, проверьте себя по рисунку.
Работа с опорным конспектом. Изучить физические свойства металлов, вспомнив известные понятия (строение атома, металлическая связь, металлическая кристаллическая решетка).
Агрегатное состояние: твердые, жидкость (Hg )
t плавления: t ниже 1000 о С – легкоплавкие (галлий, цезий); t выше 1000 о С – тугоплавкие (вольфрам).
Твердость: мягкие – щелочные металлы, свинец; твердые – хром, титан, молибден.
Плотность металлов: Д (лития) = 0,53 г / см 3 – легкий, если меньше 5 г/ см 3
Д (осмия) = 22,6 г / см 3 – тяжелый, если больше 5 г / см 3
Электро- и теплопроводность:
Хорошие проводники: Ag , Cu , Au , Al , Fe, благодаря наличию свободных электронов.
Худшие проводники: Hg, Pb, W
Ковкость, пластичность, прочность : Au , Ag , Cu , Sn , Fe , Al
Металлический блеск и высокая отражательная способность: Au , Hg , Ag , Cu
Цвет: серый цвет и непрозрачность.
Прием “Совместный поиск”. Работа в группе. Лабораторный опыт “Изучение физических свойств металлов” (инструктаж по технике безопасности).
Работа в паре по актуализации знаний о металлической связи и кристаллической решетки.
Ответьте на вопросы: (изложите свою точку зрения соседу по парте).
1) Какие особенности металлической кристаллической решетки объясняют физические свойства металлов?
2) Что такое атом-ион, относительно свободные электроны?
Прием “Пометки на полях”. Индивидуальная работа. Уяснить нахождение металлов в природе. Для этого изучить опорный конспект и таблицу “Роль металлов в организме человека”.Этот методический прием известен как инсерт. Он позволяет учащемуся отслеживать свое понимание прочитанного текста. Учитель знакомит школьников с рядом маркировочных знаков и предлагает им по мере чтения ставить их карандашом на полях:
√ – информация, которая уже известна ученику;
+ – новая информация. Ученик ставит этот знак только в том случае, если он впервые встречается с прочитанным текстом;
? – сведения, оставшиеся непонятными ученику, требующие дополнительной информации, вызывающие желание узнать подробности.
Запомни: это интересно и полезно знать. Все металлы чрезвычайно важны, проблемы со здоровьем возникают как при недостатке, так и при избытке. Ионы Na регулируют содержание воды, передачу нервных импульсов. Их недостаток приводит к головной боли , слабости и слабой памяти, избыток – к повышению давления, сердечным заболеваниям. Специалисты по питанию рекомендуют употребление не более 5 г. поваренной соли в сутки.
Рассказ учителя. Способность атомов одного химического элемента образовывать несколько простых веществ называют аллотропией. Превращение металлического олова в порошкообразное получило образное название “оловянная чума”.
Прием “Составление кластера”. Смысл этого приема заключается в попытке систематизировать имеющиеся знания по применению металлов.
Кластер – это графическая организация материала по применению алюминия, используя оборудование к уроку.
Прием “Озвучь картину, фотографию”. Озвучьте применение металлов в имеющемся оборудовании: градусник, электрическая лампочка, медная катушка, консервная банка.
Озвучьте фотографию. Бронза служила не только войне, но и искусству, увековечила память исторических деятелей. “Медный всадник” – памятник Петру I, А.С. Пушкин писал:
“Кумир с простертою рукой
Сидел на бронзовом коне”.
Дидактическая задача: организация обсуждения результатов работы, формирование осознания перспектив развития полученных знаний, проверка полученных знаний.
1. Привести примеры нестандартных способов применения алюминия.
2. Найдите соответствие между свойствами и названием металла.
| 1 электропроводный 2 тугоплавкий 3 тяжелый 4 пластичный 5 жидкий 6 мягкий | 1 вольфрам 2 ртуть 3 золото 4 литий 5 серебро 6 осмий. |
Самопроверка по коду: 1 – 5, 2 – 1, 3 – 6, 4 – 3, 5 – 2, 6 – 4.
3. Установите правильную последовательность.
1. Смена веков в человеческой истории:
1 – бронзовый,
2 – каменный,
3 – железный,
4 – медный.
2. Увеличение электропроводности:
1 – медь,
2 – алюминий,
3 – серебро,
4 – золото.
3. Увеличение пластичности:
1 – серебро,
2 – медь,
3 – золото,
4 – железо.
Взаимопроверка по коду: 1) 2, 4, 1, 3. 2) 2, 4, 1, 3. 3) 3, 1. 2,4.
4. Переставить буквы так, чтобы получились название планеты и металла.
Самопроверка по коду:
5. Ответьте на проблемный вопрос начала урока: Что такое “оловянная чума”?
6. Конкурс эрудитов. (Учащиеся отвечают по желанию.)
1. Какой металл и почему стал причиной гибели одной из арктических экспедиций?
2. Почему медь называют “музыкальным” металлом?
3. Чем объясняются пластичность, электропроводность и блеск металлов?
4. Какое воздействие металлов на живые организмы?
7. “Загадочная пауза”.
1. Самый распространенный в земной коре металл? (Алюминий.)
2. Металл, обнаруженный в упавших метеоритах? (Железо.)
3. В название какого металла входит название игры? (Золото.)
4. Какой металл А.Е. Ферсман назвал “металлом консервной банки”? (Олово.)
5. Элемент – гигант. (Титан.)
6. Какой металл входит в состав крови? (Железо.)
7. Какой металл плавится от теплоты человеческой руки? (Галлий.)
8. Самый активный металл. (Франций.)
9. Какой металл “состоит из водорослей”? (Платина.)
10. Какой металл назван в честь России? (Рутений.)
8. Диктант. Верные и неверные утверждения (+ или -)
1. Натрий встречается в природе в свободном виде.
2. Алюминий – легкий металл.
3. Железо входит в состав гемоглобина.
4. Ионы натрия и калия не входят в состав организма человека.
5. Атомы металлов отдают электроны, превращаются в положительные ионы.
Самопроверка по коду: 1 –, 2 +, 3 +, 4 –, 5 +.
9. Тест. Выпишите номер правильного ответа
1. Простое вещество – металл у элемента: 1) Ar ; 2) As; 3) C; 4)Ag.
2. Нехарактерное свойство для металлов:
1) пластичность,
2) ковкость,
3) хрупкость.
4) блеск.
3. При комнатной температуре жидкий металл: 1) Zn; 2)AI; 3)Ag; 4)Hg
4. Наиболее пластичный металл:
1) Fe; 2)Au; 3)Cu; 4) Cr
5. В каком ряду элементов свойства металлов усиливаются?
1) Al, Mg, Na; 2)Sr, Ca, Mg; 3)K, Mn, Rb; 4) Cs, Ba, Al.
1. Простое вещество – металл у элемента:
1) Hg; 2)He; 3) S; 4)Ne
1) электропроводность.
2) тягучесть,
3) теплопроводность,
4) прозрачность.
3. Наиболее тугоплавкий металл:
1) Au; 2) Al; 3)W; 4) Fe
4. Наиболее электропроводный металл:
1) Ag; 2) Al; 3) Fe; 4) Zn
5. Электронная формула 1s22s22p63s1:
1)Fe; 2)Na; 3)Cu; 4) Cr
Самопроверка по коду: I вариант: 1 – 4, 2 – 3, 3 – 4, 4 – 2, 5 – 1. II вариант: 1 – 1, 2 – 4, 3 – 3, 4 – 1, 5 – 2.
III стадия: рефлексия.
10. Написать синквейн со словом “Алюминий”.
11. Оцените свою работу на уроке. Подсчитайте общее количество баллов и поставьте отметку в зачетный лист.
12. Игра светофор. Поднимите бумажную полоску: – Красная – мне работалось легко, интересно; желтая -при работе затруднялся, зеленая – было не интересно.
Простые и сложные вещества

Из этой статьи вы узнаете, какие вещества называются простыми, а какие сложными, в чем их различия и особенности строения.
О чем эта статья:
Прежде чем переходить к понятиям простых и сложных веществ и к их строению, давайте вспомним, что такое химический элемент.
Химический элемент — это группа атомов с одинаковым зарядом ядра, который обусловливает его (элемента) химические свойства.
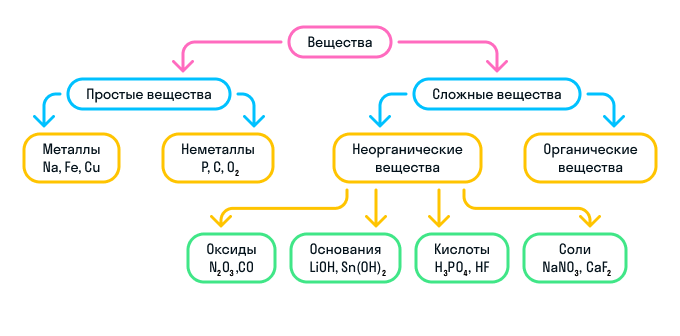
В зависимости от того, как соединяются друг с другом химические элементы, выделяют два типа веществ: простые и сложные.
Что такое простые вещества
Простые вещества — это вещества, образованные атомами только одного типа химического элемента. Например: H2, Na, P, Al.
Простые вещества делятся на два типа: металлы и неметаллы.
Металлы
Имеют общие между собой физические свойства. Обладают металлическим блеском, высокой тепло- и электропроводностью, твердые (за исключением ртути), пластичные и ковкие.
К простым веществам — металлам относятся: Na, Ca, Fe и т. д.
Почти все металлы имеют немолекулярное строение, т. е. состоят из атомов или ионов.
Неметаллы
Среди неметаллов выделить общие физические свойства практически невозможно. Они могут находиться в разных агрегатных состояниях, обладать различным цветом и т. д.
К простым веществам — неметаллам относятся: P, C, F2 и т. д.
Большинство неметаллов имеют молекулярное строение, т. е. состоят из молекул. При этом молекулы могут быть:
одноатомные: He, Si, Ar и другие;
двухатомные: F2, O2, H2, N2, Cl2, Br2, I2. Эти простые вещества всегда пишутся с индексом 2, их необходимо запомнить;
трехатомные — например, молекула озона O3;
и другие многоатомные.
Некоторые неметаллы имеют немолекулярное (атомное) строение: красный фосфор, кремний, алмаз и графит.
Металлы и неметаллы сильно отличаются друг от друга физическими и химическими свойствами.
При этом запоминать, к какому типу относится то или иное вещество, не нужно, достаточно посмотреть в таблицу Менделеева:
Проведите диагональ от 5-го до 85-го номера химических элементов.
Все химические элементы, находящиеся ниже и левее проведенной диагонали, образуют простые вещества — металлы (кроме водорода).
Выше диагонали химические элементы, находящиеся в главных подгруппах, образуют простые вещества — неметаллы, а в побочных — металлы.
Например, фосфор (порядковый номер — 15) расположен в таблице Менделеева выше диагонали и в главной подгруппе V группы. Значит, простое вещество фосфор — неметалл.
В большинстве случаев названия химического элемента и простого вещества совпадают. Поэтому необходимо научиться различать характеристики простого вещества и химического элемента.
Характеристика химического элемента
Характеристика простого вещества
Расположение в периодической системе (атомный номер, номер группы или периода)
Относительная атомная масса
Строение атома (число электронов, протонов или нейтронов, количество заполненных энергетических уровней)
Распространенность в природе
Содержание в соединении (например, в растительных белках или аминокислотах)
Значения электроотрицательности, сродства к электрону, энергии ионизации
Как правило, когда мы характеризуем простое вещество, то говорим о его физических или химических свойствах:
Влияние на живой организм
Температуры кипения и плавления
Взаимодействие с другими веществами
Содержание в каких-либо смесях веществ (например, газов)
Аллотропия
Аллотропия — это возможность образования химическим элементом нескольких простых веществ, которые отличаются друг от друга строением и свойствами.
Образующиеся простые вещества называют аллотропными модификациями.
Аллотропия характерна для следующих химических элементов:
углерод (алмаз, графит, графен, углеродные нанотрубки, фуллерен и другие);
фосфор (красный, белый и черный);
кислород (кислород и озон);
кремний (аморфный и кристаллический);
Рассмотрим две аллотропные модификации углерода:


The image 1 is a derivative of "Crystal" by manfredxy on Envato Elements.
The image 2 is a derivative of "Rough Graphite rock" by vvoennyy on Envato Elements.
Алмаз — бесцветное прозрачное вещество. Является одним из самых твердых веществ. Не проводит электрический ток.
Графит представляет собой вещество серо-черного цвета, обладает металлическим блеском. Имеет высокую тепло- и электропроводность.
Что такое сложные вещества
Сложные вещества — это вещества, образованные атомами нескольких химических элементов.
Например, молекула HNO3 состоит из одного атома водорода, одного атома азота и трех атомов кислорода.
К сложным веществам в химии относятся две большие группы веществ: неорганические и органические.
Неорганические вещества
Неорганические вещества делятся на 4 вида:
Оксиды — вещества, молекулы которых состоят из двух химических элементов, один из которых — кислород в степени окисления −2.
Основания — вещества, молекулы которых состоят из катиона металла и гидроксильной группы (—OH).
Кислоты — вещества, молекулы которых состоят из катиона водорода (H+), способного замещаться атомом металла, и кислотного остатка.
Соли — вещества, состоящие из катиона металла и кислотного остатка.
Кратко о классификации веществ можно узнать из схемы:
Номенклатура неорганических веществ
Названия простых веществ чаще всего совпадают с названием химического элемента, а для сложных веществ существует два вида номенклатуры: тривиальная и систематическая.
В тривиальной номенклатуре вещества названы в соответствии с их особенностями, например специфическим запахом или окраской.
В систематической номенклатуре название зависит от вида неорганического вещества.
Оксиды
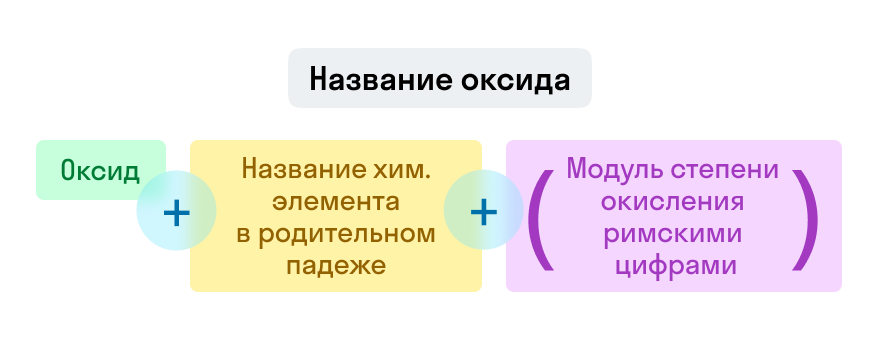
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три;
Na2O — оксид натрия. Читается: натрий два о.
Основания
Примеры названий гидроксидов:
Fe(OH)3 — гидроксид железа (III). Читается: феррум о аш трижды;
NaOH — гидроксид натрия. Читается: натрий о аш.
Соли
Примеры названий солей:
KNO3 — нитрат калия. Читается: калий эн о три;
AlCl3 — хлорид алюминия. Читается: алюминий хлор три.
Кислоты
Названия кислот, кислотных остатков и их формулы необходимо выучить, они приведены в таблице ниже.
Химические свойства металлов

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
Cu, Hg, Ag, Pt, Au
Восстановительная способность металлов в свободном состоянии
Возрастает справа налево
Взаимодействие металлов с кислородом
Быстро окисляются при обычной температуре
Медленно окисляются при обычной температуре или при нагревании
Взаимодействие с водой
Выделяется водород и образуется гидроксид
При нагревании выделяется водород и образуются оксиды
Водород из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с концентрированными азотной и серной кислотами
С кислотами не реагируют, растворяются в царской водке
Взаимодействие с солями
Не могут вытеснять металлы из солей
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей
Взаимодействие с оксидами
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов
Металлы-простые вещества
методическая разработка по химии (8 класс) на тему
Читайте также:
