Раствор металлического железа это
Обновлено: 15.05.2024
Металлургия — это наука о промышленных способах получения металлов. Различают черную и цветную металлургию.
Черная металлургия — это производство железа и его сплавов (сталь, чугун и др.).
Цветная металлургия — производство остальных металлов и их сплавов.
Широкое применение находят сплавы металлов. Наиболее распространенные сплавы железа — чугун и сталь.
Чугун — это сплав железа, в котором содержится 2-4 масс. % углерода, а также кремний, марганец и небольшие количества серы и фосфора.
Сталь — это сплав железа, в котором содержится 0,3-2 масс. % углерода и небольшие примеси других элементов.
Легированные стали — это сплавы железа с хромом, никелем, марганцем, кобальтом, ванадием, титаном и другими металлами. Добавление металлов придает стали дополнительные свойства. Так, добавление хрома придает сплаву прочность, а добавление никеля придает стали пластичность.
Основные стадии металлургических процессов:
- Обогащение природной руды (очистка, удаление примесей)
- Получение металла или его сплава.
- Механическая обработка металла
1. Нахождение металлов в природе
Большинство металлов встречаются в природе в виде соединений. Наиболее распространенный металл в земной коре — алюминий. Затем железо, кальций, натрий и другие металлы.
2. Получение активных металлов
Активные металлы (щелочные и щелочноземельные) классическими «химическими» методами получить из соединений нельзя. Такие металлы в виде ионов — очень слабые окислители, а в простом виде — очень сильные восстановители, поэтому их очень сложно восстановить из катионов в простые вещества. Чем активнее металл, тем сложнее его получить в чистом виде — ведь он стремится прореагировать с другими веществами.
Получить такие металлы можно, как правило, электролизом расплавов солей, либо вытеснением из солей другими металлами в жестких условиях.
Натрий в промышленности получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl = 2Na + Cl2
Калий получают пропусканием паров натрия через расплав хлорида калия при 800°С:
KCl + Na = K↑ + NaCl
Литий можно получить электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl = 2Cs + CaCl2
Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:
Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
Барий получают из оксида восстановлением алюминием в вакууме при 1200 °C:
4BaO+ 2Al = 3Ba + Ba(AlO2)2
Алюминий получают электролизом раствора оксида алюминия Al2O3 в криолите Na3AlF6:
3. Получение малоактивных и неактивных металлов
Металлы малоактивные и неактивные восстанавливают из оксидов углем, оксидом углерода (II) СО или более активным металлом. Сульфиды металлов сначала обжигают.
3.1. Обжиг сульфидов
При обжиге сульфидов металлов образуются оксиды:
2ZnS + 3O2 → 2ZnO + 2SO2
Металлы получают дальнейшим восстановлением оксидов.
3.2. Восстановление металлов углем
Чистые металлы можно получить восстановлением из оксидов углем. При этом до металлов восстанавливаются только оксиды металлов, расположенных в ряду электрохимической активности после алюминия.
Например , железо получают восстановлением из оксида углем:
2Fe2O3 + 6C → 2Fe + 6CO
ZnO + C → Zn + CO
Оксиды металлов, расположенных в ряду электрохимической активности до алюминия, реагируют с углем с образованием карбидов металлов:
CaO + 3C → CaC2 + CO
3.3. Восстановление металлов угарным газом
Оксид углерода (II) реагирует с оксидами металлов, расположенных в ряду электрохимической активности после алюминия.
Например , железо можно получить восстановлением из оксида с помощью угарного газа:
3.4. Восстановление металлов более активными металлами
Более активные металлы вытесняют из оксидов менее активные. Активность металлов можно примерно оценить по электрохимическому ряду металлов:
Восстановление металлов из оксидов другими металлами — распространенный способ получения металлов. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Алюмотермия – это восстановление металлов из оксидов алюминием.
Например : алюминий восстанавливает оксид меди (II) из оксида:
3CuO + 2Al = Al2O3 + 3Cu
Магниетермия – это восстановление металлов из оксидов магнием.
CuO + Mg = Cu + MgO
Железо можно вытеснить из оксида с помощью алюминия:
При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
Активные металлы вытесняют менее активные из растворов их солей.
Например , при добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
Медь покроется белыми кристаллами серебра.
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
3.5. Восстановление металлов из оксидов водородом
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Как правило, взаимодействие оксидов металлов с водородом протекает в жестких условиях – под давлением или при нагревании.
CuO + H2 = Cu + H2O
4. Производство чугуна
Чугун получают из железной руды в доменных печах.
Печь последовательно загружают сверху шихтой, флюсами, коксом, затем снова рудой, коксом и т.д.

1- загрузочное устройство, 2 — колошник, 3 — шахта, 4 — распар, 5 — горн, 6 — регенератор
Доменная печь имеет форму двух усеченных конусов, соединенных основаниями. Верхняя часть доменной печи — колошник, средняя — шахта, а нижняя часть — распар.
В нижней части печи находится горн. Внизу горна скапливается чугун и шлак и отверстия, через которые чугун и шлак покидают горн: чугун через нижнее, а шлак через верхнее.
Наверху печи расположено автоматическое загрузочное устройство. Оно состоит из двух воронок, соединенных друг с другом. Руда и кокс сначала поступают в верхнюю воронку, а затем в нижнюю.
Из нижней воронки руда и кокс поступают в печь. во время загрузки руды и кокса печь остается закрытой, поэтому газы не попадают в атмосферу, а попадают в регенераторы. В регенераторах печной газ сгорает.
Шихта — это железная руда, смешанная с флюсами.
Снизу в печь вдувают нагретый воздух, обогащенный кислородом, кокс сгорает:
Образующийся углекислый газ поднимается вверх и окисляет кокс до оксида углерода (II):
CO2 + С = 2CO
Оксид углерода (II) (угарный газ) — это основной восстановитель железа из оксидов в данных процессах. Последовательность восстановления железа из оксида железа (III):
Последовательность восстановления оксида железа (III):
FeO + CO → Fe + CO2
Суммарное уравнение протекающих процессов:
При этом протекает также частичное восстановление примесей оксидов других элементов (кремния, марганца и др.). Эти вещества растворяются в жидком железе.
Чтобы удалить из железной руды тугоплавкие примеси (оксид кремния (IV) и др.). Для их удаления используют флюсы и плавни (как правило, известняк CaCO3 или доломит CaCO3·MgCO3). Флюсы разлагаются при нагревании:
и образуют с тугоплавкими примесями легкоплавкие вещества (шлаки), которые легко можно удалить из реакционной смеси:
Соединения железа. Железо: физические и химические свойства
Первые изделия из железа и его сплавов были найдены при раскопках и датируются примерно 4 тысячелетием до нашей эры. То есть еще древние египтяне и шумеры использовали метеоритные месторождения данного вещества, чтобы изготовлять украшения и предметы быта, а также оружие.

Сегодня соединения железа различного рода, а также чистый металл - это самые распространенные и применяемые вещества. Не зря XX век считался железным. Ведь до появления и широкого распространения пластика и сопутствующих материалов именно это соединение имело для человека решающее значение. Что представляет собой данный элемент и какие вещества образует, рассмотрим в данной статье.
Химический элемент железо
Если рассматривать строение атома, то в первую очередь следует указать его местоположения в периодической системе.
- Порядковый номер - 26.
- Период - четвертый большой.
- Группа восьмая, подгруппа побочная.
- Атомный вес - 55,847.
- Строение внешней электронной оболочки обозначается формулой 3d 6 4s 2 . - Fe.
- Название - железо, чтение в формуле - "феррум".
- В природе существует четыре стабильных изотопа рассматриваемого элемента с массовыми числами 54, 56, 57, 58.
Химический элемент железо имеет также около 20 различных изотопов, которые не отличаются стабильностью. Возможные степени окисления, которые может проявлять данный атом:
Важное значение имеет не только сам элемент, но и его различные соединения и сплавы.
Физические свойства
Как простое вещество, железо физические свойства имеет с ярко выраженным металлизмом. То есть это серебристо-белый с серым оттенком металл, обладающий высокой степенью ковкости и пластичности и высокой температурой плавления и кипения. Если рассматривать характеристики более подробно, то:
- температура плавления - 1539 0 С;
- кипения - 2862 0 С;
- активность - средняя;
- тугоплавкость - высокая;
- проявляет ярко выраженные магнитные свойства.
В зависимости от условий и различных температур, существует несколько модификаций, которые образует железо. Физические свойства их различаются от того, что разнятся кристаллические решетки.
- Альфа-форма, или феррит, существует до температуры в 769 0 С.
- От 769 до 917 0 С - бета-форма.
- 917-1394 0 С - гамма-форма, или аустенит.
- Свыше 1394 0 С - сигма-железо.

Все модификации имеют различные типы строения кристаллических решеток, а также отличаются магнитными свойствами.
Химические свойства
Как уже упоминалось выше, простое вещество железо проявляет среднюю химическую активность. Однако в мелкодисперсном состоянии способно самовоспламеняться на воздухе, а в чистом кислороде сгорает сам металл.
Коррозионная способность высокая, поэтому сплавы данного вещества покрываются легирующими соединениями. Железо способно взаимодействовать с:
- кислотами;
- кислородом (в том числе воздухом);
- серой;
- галогенами;
- при нагревании - с азотом, фосфором, углеродом и кремнием;
- с солями менее активных металлов, восстанавливая их до простых веществ;
- с острым водяным паром;
- с солями железа в степени окисления +3.
Очевидно, что, проявляя такую активность, металл способен образовывать различные соединения, многообразные и полярные по свойствам. Так и происходит. Железо и его соединения чрезвычайно разнообразны и находят применение в самых разных отраслях науки, техники, промышленной деятельности человека.
Распространение в природе
Природные соединения железа встречаются довольно часто, ведь это второй по распространенности элемент на нашей планете после алюминия. При этом в чистом виде металл встречается крайне редко, в составе метеоритов, что говорит о больших его скоплениях именно в космосе. Основная же масса содержится в составе руд, горных пород и минералов.

Если говорить о процентном содержании рассматриваемого элемента в природе, то можно привести следующие цифры.
- Ядра планет земной группы - 90%.
- В земной коре - 5%.
- В мантии Земли - 12%.
- В земном ядре - 86%.
- В речной воде - 2 мг/л.
- В морской и океанской - 0,02 мг/л.
Самые распространенные соединения железа формируют следующие минералы:
- магнетит;
- лимонит или бурый железняк;
- вивианит;
- пирротин;
- пирит;
- сидерит;
- марказит;
- леллингит;
- миспикель;
- милантерит и прочие.
Это еще далеко не полный список, ведь их действительно очень много. Кроме того, широко распространены различные сплавы, которые создаются человеком. Это тоже такие соединения железа, без которых сложно представить современную жизнь людей. К ним относятся два основных типа:
Также именно железо является ценной добавкой в составе многих никелевых сплавов.
Соединения железа (II)
К таковым относятся такие, в которых степень окисления образующего элемента равна +2. Они достаточно многочисленны, ведь к ним можно отнести:
- оксид;
- гидроксид;
- бинарные соединения;
- сложные соли;
- комплексные соединения.
Формулы химических соединений, в которых железо проявляет указанную степень окисления, для каждого класса индивидуальны. Рассмотрим наиболее важные и распространенные из них.
- Оксид железа (II). Порошок черного цвета, в воде не растворяется. Характер соединения - основный. Способен быстро окисляться, однако и восстанавливаться до простого вещества может также легко. Растворяется в кислотах, образуя соответствующие соли. Формула - FeO.
- Гидроксид железа (II). Представляет собой белый аморфный осадок. Образуется при реакции солей с основаниями (щелочами). Проявляет слабые основные свойства, способен быстро окисляться на воздухе до соединений железа +3. Формула - Fe(OH)2.
- Соли элемента в указанной степени окисления. Имеют, как правило, бледно-зеленую окраску раствора, хорошо окисляются даже на воздухе, приобретая темно-бурый цвет и переходя в соли железа 3. Растворяются в воде. Примеры соединений: FeCL2, FeSO4, Fe(NO3)2.

Практическое значение среди обозначенных веществ имеют несколько соединений. Во-первых, хлорид железа (II). Это главный поставщик ионов в организм человека, больного анемией. Когда такой недуг диагностируется у пациента, то ему прописывают комплексные препараты, в основе которых лежит рассматриваемое соединение. Так происходит восполнение дефицита железа в организме.
Во-вторых, железный купорос, то есть сульфат железа (II), вместе с медным используется для уничтожения сельскохозяйственных вредителей на посевах. Метод доказывает свою эффективность уже не первый десяток лет, поэтому очень ценится садоводами и огородниками.
Соль Мора
Это соединение, которое представляет собой кристаллогидрат сульфата железа и аммония. Формула его записывается, как FeSO4*(NH4)2SO4*6H2O. Одно из соединений железа (II), которое получило широкое применение на практике. Основные области использования человеком следующие.
- Фармацевтика.
- Научные исследования и лабораторные титриметрические анализы ( для определения содержания хрома, перманганата калия, ванадия).
- Медицина - как добавка в пищу при нехватке железа в организме пациента.
- Для пропитки деревянных изделий, так как соль Мора защищает от процессов гниения.
Есть и другие области, в которых находит применение это вещество. Название свое оно получило в честь немецкого химика, впервые обнаружившего проявляемые свойства.
Вещества со степенью окисления железа (III)
Свойства соединений железа, в которых оно проявляет степень окисления +3, несколько отличны от рассмотренных выше. Так, характер соответствующего оксида и гидроксида уже не основный, а выраженный амфотерный. Дадим описание основным веществам.
- Оксид железа (III). Порошок мелкокристаллический, красно-бурого цвета. В воде не растворяется, проявляет свойства слабо кислотные, больше амфотерные. Формула: Fe2O3.
- Гидроксид железа (III). Вещество, выпадающее в осадок при действии щелочами на соответствующие соли железа. Характер его выраженный амфотерный, цвет буро-коричневый. Формула: Fe(OH)3.
- Соли, в состав которых входит катион Fe 3+ . Таких выделено множество, за исключением карбоната, так как происходит гидролиз и выделяется углекислый газ. Примеры формул некоторых солей: Fe(NO3)3, Fe2(SO4)3, FeCL3, FeBr3 и прочие.

Среди приведенных примеров с практической точки зрения важное значение имеет такой кристаллогидрат, как FeCL3*6H2O, или шестиводный хлорид железа (III). Его применяют в медицине для остановки кровотечений и восполнения ионов железа в организме при анемии.
Девятиводный сульфат железа (III) используется для очистки питьевой воды, так как ведет себя как коагулянт.
Соединения железа (VI)
Формулы химических соединений железа, где оно проявляет особую степень окисления +6, можно записать следующим образом:
Все они имеют общее название - ферраты - и обладают схожими свойствами (сильные восстановители). Также они способны обеззараживать и обладают бактерицидным действием. Это позволяет использовать их для обработки питьевой воды в промышленных масштабах.
Комплексные соединения
Очень важными в аналитической химии и не только являются особые вещества. Такие, которые образуются в водных растворах солей. Это комплексные соединения железа. Наиболее популярные и хорошо изученные из них следующие.
- Гексацианоферрат (II) калия K4[Fe(CN)6]. Другое название соединения - желтая кровяная соль. Используется для качественного определения в растворе иона железа Fe 3+ . В результате воздействия раствор приобретает красивую ярко-синюю окраску, так как формируется другой комплекс - берлинская лазурь KFe 3+ [Fe 2+ (CN)6]. Издревле использовалась как краситель для ткани.
- Гексацианоферрат (III) калия K3[Fe(CN)6]. Другое название - красная кровяная соль. Используется как качественный реагент на определение иона железа Fe 2+ . В результате образуется синий осадок, имеющий название турнбулева синь. Также использовалась, как краситель для ткани.

Железо в составе органических веществ
Железо и его соединения, как мы уже убедились, имеют большое практическое значение в хозяйственной жизни человека. Однако, помимо этого, его биологическая роль в организме не менее велика, даже наоборот.
Существует одно очень важное органическое соединение, белок, в состав которого входит данный элемент. Это гемоглобин. Именно благодаря ему происходит транспорт кислорода и осуществляется равномерный и своевременный газообмен. Поэтому роль железа в жизненно важном процессе - дыхании - просто огромна.

Всего внутри организма человека содержится около 4 грамм железа, которое постоянно должно пополняться за счет потребляемых продуктов питания.
Как получают и из чего делают железо (сталь)?
Железо и стали на его основе используются повсеместно в промышленности и обыденной жизни человека. Однако мало кто знает, из чего делают железо, вернее, как его добывают и преобразовывают в сплав стали.
Популярное заблуждение
Для начала определимся с понятиями, поскольку люди часто путаются и не совсем понимают, что такое железо вообще. Это химический элемент и простое вещество, которое в чистом виде не встречается и не используется. А вот сталь – это сплав на основе железа. Она богата на различные химические элементы, а также содержит углерод в своем составе, который необходим для придания прочности и твердости.

Следовательно, не совсем правильно рассуждать о том, из чего делают железо, так как оно представляет собой химический элемент, который есть в природе. Человек из него делает сталь, которая в дальнейшем может использоваться для изготовления чего-либо: подшипников, кузовов автомобилей, дверей и т. д. Невозможно перечислить все предметы, которые из нее производятся. Итак, ниже мы не будем разбирать, из чего делают железо. Вместо этого поговорим о преобразовании этого элемента в сталь.
Добыча
В России и мире существует множество карьеров, где добывают железную руду. Это огромные и тяжелые камни, которые достаточно сложно достать из карьера, так как они являются частью одной большой горной породы. Непосредственно на карьерах в горную породу закладывают взрывчатку и взрывают ее, после чего огромные куски камней разлетаются в разные стороны. Затем их собирают, грузят на большие самосвалы (типа БелАЗ) и везут на перерабатывающий завод. Из этой горной породы и будет добываться железо.

Иногда, если руда находится на поверхности, то ее вовсе необязательно подрывать. Ее достаточно расколоть на куски любым другим способом, погрузить на самосвал и увезти.
Производство
Итак, теперь мы понимаем, из чего делают железо. Горная порода является сырьем для его добычи. Ее отвозят на перерабатывающее предприятие, загружают в доменную печь и нагревают до температуры 1400-1500 градусов. Эта температура должна держаться в течение определенного времени. Содержащееся в составе горной породы железо плавится и приобретает жидкую форму. Затем его остается разлить в специальные формы. Образовавшиеся шлаки при этом отделяют, а само железо получается чистым. Затем агломерат подают в бункерные чаши, где он продувается потоком воздуха и охлаждается водой.

Есть и другой способ получения железа: горную породу дробят и подают на специальный магнитный сепаратор. Так как железо имеет способность намагничиваться, то минералы остаются на сепараторе, а вся пустая порода вымывается. Конечно, чтобы железо превратить в металл и придать ему твердую форму, его необходимо легировать с помощью другого компонента – углерода. Его доля в составе очень мала, однако именно благодаря нему металл становится высокопрочным.
Стоит отметить, что в зависимости от объема добавляемого в состав углерода сталь может получаться разной. В частности, она может быть более или менее мягкой. Есть, например, специальная машиностроительная сталь, при изготовлении которой к железу добавляют всего 0,75 % углерода и марганец.

Теперь вы знаете, из чего делают железо и как его преобразовывают в сталь. Конечно, способы описаны весьма поверхностно, но суть они передают. Нужно запомнить, что из горной породы делают железо, из чего далее могут получать сталь.
Производители
На сегодняшний день в разных странах есть крупные месторождения железной руды, которые являются базой для производства мировых запасов стали. В частности, на Россию и Бразилию приходится 18 % мирового производства стали, на Австралию – 14 %, Украину – 11 %. Самыми крупными экспортерами является Индия, Бразилия, Австралия. Отметим, что цены на металл постоянно меняются. Так, в 2011 году стоимость одной тонны металла составляла 180 долларов США, а к 2016 году была зафиксирована цена в 35 долларов США за тонну.
Заключение
Теперь вы знаете, из чего состоит железо (имеется в виду металл) и как его производят. Применение этого материала распространено во всем мире, и его значение практически невозможно переоценить, так как используется он в промышленных и бытовых отраслях. К тому же экономика некоторых стран построена на базе изготовления металла и его последующего экспорта.
Мы рассмотрели, из чего состоит сплав. Железо в его составе смешивается с углеродом, и подобная смесь является основной для изготовления большинства известных металлов.
Железо сернокислое: состав, формула, свойства, назначение и применение

Поскольку сернокислое железо является простым в получении и доступным химическим веществом, оно широко используется в самых разных сферах. В быту - это известный железный купорос, распространенный в садоводстве. Если говорить о применении в крупных масштабах, то его используют не только в аграрной отрасли, но и в промышленности.
Что это за вещество?
Железо сернокислое - это неорганическое вещество, соединение серной кислоты и железной соли, бесцветное, непрозрачное, без запаха. Кристаллогидраты имеют бледный голубовато-зеленый цвет, прозрачные, тетрагидраты (FeSO4·4Н2О) отличаются зеленым окрасом, а моногидраты(FeSO4·Н2О) - бесцветные. На вкус вещество - резко вяжущее, с металлическим привкусом. Из названия понятно, что оно имеет сильную кислотную составляющую, молярная масса реактива равна 151 г/моль. Формула сернокислого железа - FeSO4.
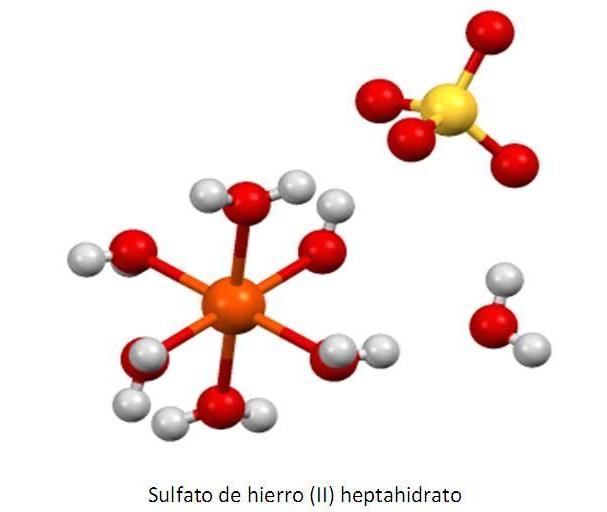
На воздухе вещество выветривается, теряя в процессе кристаллизационную жидкость. Соединение быстро растворяется в воде при температуре 20 °С. Токсичность его сравнительно небольшая. Из жидких смесей способность кристаллизоваться имеет только голубовато-зеленый гептагидрат, больше известный как железный купорос (FeSO4·7Н2О). Благодаря его свойствам вещество применяют на уроках химии, показывая учащимся, как в течение короткого времени из него можно вырастить необычные кристаллы.
Свойства
Сульфат железа выделяют из жидких смесей при положительных температурах от 1,82 до 56,8 градусов в виде железного купороса. Насыщенный раствор получают смешиванием 100 мл воды и 26,6 г безводного двухвалентного железа при 20 °C, а 54,4 г - при 56 °C. Железо сернокислое (II) под воздействием кислорода имеет свойство окисляться, переходя в III форму. При нагреве до температуры более 480 °С начинает разлагаться.

Одно из важнейших его свойств заключается в его необходимости человеческому организму для поддержания активной жизнедеятельности. В натуральном виде элемент содержится во многих продуктах питания: яблоках, орехах, гранатах, гречневой крупе, говяжьей печени.
Получение вещества
Сернокислый аммоний железа добывают путем воздействия разбавленным раствором серной кислоты на железный лом. В промышленных масштабах его получают в результате травления различных железных материалов, проволоки и т.д. Также вещество является побочным продуктом при производстве оксида титана из такого элемента, как ильменит.
Сернокислое железо встречается в природе и в чистом виде. Геологи знают его как минерал под названием мелантерит.
Применение в промышленности
Сульфат железа – соединение, с которым зачастую приходится иметь дело металлургам, поскольку оно является побочным продуктом на многих производствах подобного типа.

Вполне естественно, что применить ресурс намного выгоднее и удобнее для предприятия, чем утилизировать. К примеру, железный купорос используют как подкормку для многих садовых культур. Он находится на особом счету у дачников.
В масштабах промышленности сернокислая соль железа широко используется в текстильном производстве. Раствор на ее основе дает возможность окрашивать ткани в черный цвет. Наверное, у каждого человека дома есть одна или несколько вещей, обработанных при помощи красителя, созданного на основе железного купороса. Не многим известно, что это вещество применяется для производства чернил для ручек.
Применение в медицине
Это незаменимое средство для терапии железодефицитной анемии у взрослых и детей. На его основе производят таблетки, жидкие препараты, капсулы, которые находятся в свободном доступе и отпускаются без рецепта врача.

Здесь стоит отметить, что железо - это один из главнейших компонентов, входящих в состав гемоглобина, имеет жизненно-важное значение для человека. В случаях получения сильных травм и крупной кровопотери железосодержащие препараты назначаются в обязательном порядке. Самые распространенные из них: «Гемофер», «Мальтофер», «Сорбифер Дурулес», «Ферлатум» и другие. Нередко их совмещают с витамином С в качестве мощного антиоксиданта.
Применение в сельском хозяйстве
Железо сернокислое нашло свое применение и в сельском хозяйстве. Особенно широко у аграриев используется железный купорос как фунгицид для борьбы с многочисленными грибковыми заболеваниями, которым подвержены растения. Более того, им дезинфицируют стены подвалов и овощехранилищ.

Раствор железа сернокислого закисного на постоянной основе применяется для обработки семян. Таким способом исключается их заражение вредоносными микроорганизмами, увеличивается всхожесть и исключается инфицирование других культур. Важно отметить неоспоримую пользу сульфата железа, как эффективного удобрения для определенного вида почв и сельскохозяйственных культур.
Применение в садоводстве
Это одна из важнейших отраслей сельского хозяйства, поэтому железо сернокислое используется здесь довольно широко. Главными способами применения являются санитарная обработка помещений, профилактическая пропитка древесины от домового грибка, побелка молодых насаждений в весенний период.

Наилучшим образом железный купорос подходит для защиты цветов и садовых культур от вредителей. Для этого растения опрыскивают готовым раствором на основе железа, которые, вдобавок, начинают пышнее цвести. То есть, вещество служит также питательной прикормкой. При этом стоит знать, что в него нельзя добавлять известь, разрешен только медный купорос.
Для достижения лучшего результата необходимо вносить в почву минеральные внекорневые удобрения в виде водного раствора (5 г на ведро воды). Такая подкормка благоприятно отразится на урожайности, например, клубники и смородины. Не менее эффективно использовать его в сочетании с компостом. Дозировка в этом случае должна составлять 100 г на ведро органики. Подкармливая таким способом огородные культуры, по осени можно собрать богатый урожай, который по объему будет значительно больше того, что был выращен без удобрения.
Применение в виноградарстве
Многие дачники пытаются разводить виноградные культуры на придомовом участке. При этом кустарник хорошо плодоносит не только в южных регионах страны, но и в средней полосе. Если обеспечить ему должный уход, можно собрать неплохой урожай. Главный секрет опытных садоводов заключается в опрыскивании по осени виноградников железным купоросом. С его помощью можно противостоять атаке вредоносных бактерий и разного рода микроорганизмов. Не стоит жалеть питательного раствора сульфата железа, необходимо опрыскивать им лозу достаточно сильно, а также обрабатывать почву вокруг виноградного куста, поскольку в ней могут плодиться вредители.
Эффективно применение железного купороса для виноградника также и весной. Такая подкормка позволит растению легче переносить возможные заморозки. Кроме того, обработка раствором слегка затормозит рост почек. Именно поэтому важно проводить опрыскивание до появления первых листьев. Кроме того, при попадании на них жидкого раствора с высокой концентрацией образуются ожоги.
Перед высадкой черенков в землю их также не лишним будет смочить раствором железного купороса. Готовят его тем же способом, что и для опрыскивания. Такая обработка позволит обрезкам быстрее прижиться и прорасти. Состав сохраняет свои полезные свойства в течение трех месяцев со дня приготовления.
Опрыскивание деревьев
Опытные дачники считают эту манипуляцию важной процедурой. Они отмечают, что перед опрыскиванием садовых культур важно правильно приготовить раствор железного купороса, избегая слишком сильной концентрации.
В качестве профилактики и борьбы с вредоносными насекомыми, мхом и различными видами лишайника готовят 5 % состав (в ведре воды растворяют 500 г вещества). Опрыскивание проводят дважды в год, ранней весной и осенью после сбора урожая. Для обработки кустарниковых и косточковых культур придерживаются того же графика, однако, концентрация в этом случае должна быть меньше (300 г вещества на 10 литров воды).

Для химиков и технологов сернокислое железо - одно из многочисленных химических соединений, которое можно получить искусственным путем. Для человека, далекого от этой науки, железный купорос – это средство, помогающее решать насущные бытовые вопросы в саду и огороде, строительстве, медицине.
В статье рассмотрено получение и применение сульфата железа в промышленности и для жизнеобеспечения людей в быту, описано его использование для терапии некоторых заболеваний у детей и взрослых. Также дано подробное описание применения этого вещества в садоводстве.
Читайте также:
