Растворимость металлов друг в друге
Обновлено: 18.05.2024
Растворимость одного вещества в другом – свойство, присущее всем веществам. Растворимость может быть неограниченной и крайне малой, что зависит от термодинамических свойств растворяемого вещества и растворителя. Даже при чрезвычайно малой растворимости одного вещества в другом всегда осуществляется переход веществ через поверхность их контакта.
Любой металл растворяется в воде, однако растворимость металлов изменяется в очень широких пределах. Например, щелочные металлы бурно взаимодействуют с водой, при этом выделяется из воды водород и образуется раствор гидроксида.
Серебро практически не реагирует с водой, тем не менее процесс перехода частиц серебра в воду происходит, и получается лечебная «серебряная вода». Таким образом, одни металлы хорошо растворяются в воде, другие – крайне плохо. Ответ на вопрос, чем обусловлена различная растворимость металлов в воде, дает область химической науки – электрохимия.
Ниже мы поговорим об особой группе электрохимических реакций, протекающих на границе раздела фаз, в частности металл–вода (или раствор соли металла). Эти реакции характеризуются переносом заряда (электронов) и вещества через границу раздела фаз твердое вещество–жидкость.
Вы знаете, что металл проводит ток благодаря тому, что в его кристаллической решетке есть свободные (точнее, слабо связанные с атомами) электроны. А это означает, что в кристаллической решетке имеется некоторое количество положительно заряженных ионов металла.
Если металлическую пластинку, например медную, погрузить в воду или раствор соли меди, то из слоя металла, находящегося на границе с водой, положительно заряженные ионы Cu 2+ начнут переходить в воду. Из-за этого пластинка приобретает отрицательный заряд. Между отрицательно заряженной пластинкой и перешедшими в раствор положительно заряженными ионами возникает электростатическое притяжение, что препятствует дальнейшему переходу ионов в раствор, т.е. процесс растворения металла прекращается. Подойдя к поверхности пластинки, принимают от нее электроны и, переходя в нейтральное состояние, осаждаются. Через некоторое время устанавливается состояние динамического равновесия, при котором скорость перехода ионов из металла в раствор равна скорости их осаждения на металле. На рис. 8.5 ион металла для простоты изображен негидратированным.
При контакте металла с водой или раствором соли металла жидкая и кристаллическая фазы приобретают на границе раздела противоположные заряды, в результате чего на межфазной границе образуется двойной электрический слой и возникает разность электрических потенциалов. Равновесие между металлом, жидкой фазой и двойным электрическим слоем полностью подчиняется всем положениям смещения химического равновесия. На рис. 8.5 двойной электрический слой изображен в виде двух плотных слоев электронов и катионов. В действительности каждый слой распространяется по обе стороны от места контакта металла с водой, и постепенно количество электронов и катионов в слоях понижается.
Равновесие между ионами раствора и металлом выражается уравнением
Cu 2+ (р-р) + 2е = Сu (кр.).
В уравнении равновесия электрохимической реакции, принимаемые электроны обычно записывают в левой части уравнения, перед знаком равенства. Соблюдение этого правила крайне важно, т.к. по таким уравнениям можно предсказывать направление электродных процессов.
Посмотрите на написанное уравнение – это уравнение окислительно-востановительной реакции! Поэтому все, что вы знаете об окислительно-восстановительных реакциях, следует использовать и для этих реакций.
Система, состоящая из проводника электрического тока и раствора (или расплава) электролита, в который погружен проводник, называется электродом. Так, медная пластинка, погруженная в водный раствор сульфата меди CuSО4, – типичный электрод.
Состояние равновесия электродного процесса определяется электродным потенциалом Е, представляющим собой разность потенциалов двух фаз на границе металл–электролит. Непосредственно измерить абсолютное значение электродного потенциала нельзя, но его можно сравнить с потенциалами других электродов (при стандартных условиях).
На медном электроде (медь–раствор с концентрацией ионов Cu 2+ , равной 1 моль/л) при разомкнутой гальванической цепи устанавливается равновесие, характеризующееся стандартным электродным потенциалом, равным 0,34. В:
Cu 2+ + 2e = Cu , E = 0,34 В.
Положительное значение потенциала этой электродной реакции означает, что реакция может проходить самопроизвольно (при наличии второго электрода, поставляющего электроны), т.е. ионы меди могут переходить в металлическую медь (медь будет осаждаться на электроде).
Хотя, разумеется, знак заряда электрода не зависит от способа написания уравнения электродного процесса, при его записи в противоположном направлении знак потенциала необходимо изменить на противоположный.
Стандартный потенциал цинкового электрода равен –0,76 В:
Zn 2+ + 2e = Zn, E = –0,76 B.
Отрицательное значение электродного потенциала цинка свидетельствует о невозможности прохождения реакции по этому уравнению. Самопроизвольно проходит процесс в противоположном направлении:
Zn – 2e = Zn 2+ , E = 0,76 B.
Уравнение этой реакции показывает, что цинк может «растворяться» в кислотах, или, более правильно, цинк реагирует с ионами водорода и образуются ионы цинка и газообразный водород.
Если расположить стандартные электродные потенциалы металлов в порядке уменьшения их отрицательного значения и повышения положительного, т.е. в порядке возрастания их электродных потенциалов, то получится ряд стандартных электродных потенциалов.
Чем более отрицателен (менее положителен) электродный потенциал, тем выше способность металла посылать ионы в раствор и тем сильнее проявляет себя металл как восстановитель. Металлический литий – самый сильный восстановитель среди металлов, а металлическое золото в данном перечне уравнений реакций – самый слабый восстановитель.
Все металлы, расположенные в этом списке выше водорода, т.е. имеющие отрицательное значение электродного потенциала, растворяются в растворах кислот с концентрацией ионов водорода
1 моль/л. Если электродный потенциал металла имеет положительный знак, то металл не растворяется в растворах кислот с Эти правила можно не запоминать, лучше запомнить общий подход (уже вам известный) к определению направления окислительно-восстановительной реакции в гальваническом элементе.
Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически.
Большая Энциклопедия Нефти и Газа
Торопить женщину - то же самое, что пытаться ускорить загрузку компьютера. Программа все равно должна выполнить все очевидно необходимые действия и еще многое такое, что всегда остается сокрытым от вашего понимания. Законы Мерфи (еще. )
Взаимная растворимость - металл
Взаимная растворимость металлов не является обратимым свойством. Из этого обобщения имеются исключения, тем не менее оно является все же полезным правилом. Приводимые ниже цифры, взятые из значительно более подробных данных Юм-Розери, дают некоторое представление о поразительной разнице в растворимости в тех случаях, когда размеры атомов благоприятствуют растворимости. [1]
Взаимная растворимость металлов А и В часто увеличивается с ростом температуры. Если быстро охладить однофазный твердый раствор А - В, равновесный при некоторой температуре TI Гкомн, то образуется пересыщенный твердый раствор. Выдержка закаленного сплава при комнатной или повышенной температуре Т2 ( ТКОМН Т2Тг) приводит к изменению его механических и физических свойств вследствие структурных изменений. Этот процесс называется старением и широко используется как один из весьма эффективных способов обработки сплавов. Старение при комнатной температуре называется естественным, при повышенной - искусственным. [2]
Взаимная растворимость металлов в твердом состоянии зависит от следующих условий. [3]
На взаимную растворимость металлов , кроме геометрического фактора ( близкие размеры атомов), большое влияние оказывает валентный фактор - разница валентности элементов, образующих систему, а также химическая природа атомов. Чем более электроотрицателен один из компонентов и более электроположителен другой, тем больше вероятность образования химического соединения, а не твердого раствора. [4]
Между величинами взаимной растворимости металлов Д руг в друге пет однозначного соответствия. Юм-Розерл обнаружил, что при прочих равных условиях металл с более низкой валентностью растворяет в себе значительно больше мет ал. Несмотря на то что из этого правила возможны исключения, оно бывает полезно. Приведенные - ниже значения, являющиеся частью намного более полных данных Юм-Розери, дают некоторое представление об относительно-резком различии растворимостей даже в тех случаях, когда размерный фактор достаточно благоприятен. [5]
При наличии взаимной растворимости металлов соединение их хорошо осуществляется сваркой плавлением, а также и сваркой давлением в твердом состоянии. [6]
При отсутствии взаимной растворимости металлов в системе вольфрам-медь оба металла растворимы в никеле, вследствие чего при определенных соотношениях компонентов можно получить, используя методы металлокерамики, тройные сплавы с высоким содержанием вольфрама ( напр. Сплавы обладают большой плотностью ( 16), повышенной коррозионной стойкостью и высоким коэфф. Применяются в атомной и авиационной технике, приборостроении и др. областях. [7]
При отсутствии взаимной растворимости металлов в системе вольфрам-медь оба металла растворимы в никеле, вследствие чего при определенных соотношениях компонентов можно получить, используя методы металлокерамики, тройные сплавы с высоким содержанием вольфрама ( напр. Сплавы обладают большой плотностью ( - 16), повышенной коррозионной стойкостью и высоким коэфф. Применяются в атомной и авиационной технике, приборостроении и др. областях. [8]
В связи с тем что взаимная растворимость металлов ( и полуметаллов) в жидком состоянии часто бывает ограниченной и поскольку после завершения взаимодействия основных компонентов металл-растворитель должен быть удален из образовавшегося соединения, применение этого метода ограничено соединениями, практически индифферентными по отношению к тому растворителю, который, применяется для удаления третьего металла. Таким растворителем служит преимущественно разб. В большинстве случаев прз растворении не удается избежать некоторых потерь выделяемого соединения. Этот метод применяется в основном при получении силицидов, бо-ридов, фосфидов н полуметаллов, например GaSe, GaTe, особенно в виде монокристаллов. Другими успешно применяемыми металлами-растворителями являются свинец, алюминий, магний, медь и серебро. Благодаря иногда весьма значительным различиям в растворимости металлов-реагентов в металле-растворителе часто удается, варьируя количества реагентов, получать в расплаве металла-растворителя вполне определенное бинарное соединение из нескольких возможных в данной системе. Как металл-растворитель можно рассматривать и ртуть при образовании амальгам ( см. ниже разд. [9]
При наличии той или иной степени взаимной растворимости металлов , определяемой типом диаграммы фазового состояния, соединение их путем сварки плавлением, а равно и в твердом состоянии осуществить всегда возможно. Наиболее благоприятные результаты получаются при сварке металлов, образующих непрерывный ряд твердых растворов. Сварка металлов с ограниченной растворимостью более сложна. [10]
При наличии той или иной степени взаимной растворимости металлов , определяемой типом диаграммы фазового состояния, соединение их путем сварки плавлением, а равно и в твердом состоянии осуществить всегда возможно. Наиболее благоприятные результаты получаются при сварке металлов, образующих непрерывный ряд твердых растворов. Сварка металлов с ограниченной растворимостью более сложна. [11]
Ошибочно причислять к КМ гомогенные сплавы со взаимной растворимостью металлов ( например, Ni-Си) и плакированные металлы [19] или любые слоистые ( сэндвич) и сотовые структуры, как и многослойные покрытия или изделия с покрытием, поскольку отдельные компоненты таких систем во многих случаях проявляют только свои индивидуальные свойства, несмотря на то что между ними существует межфазная граница. Сотовые и слоистые системы [24] следует рассматривать скорее как композиционные конструкции, а не материалы. Слоистые системы можно условно причислить к композиционным материалам в тех случаях, когда при эксплуатации и наличии диффузии или при малых толщинах пластин одна из них может образовать непрерывную фазу во всем объеме материала. [12]
Определенных данных о существовании особой сингулярной суб-окисной фазы между металлическим цирконием и Zr02 не имеется, однако взаимная растворимость металла и двуокиси при высокой температуре значительна. [13]
Исследованиями, выполненными методами термического 1, микроструктурного [1-3, 5], рентгеновского [2] и термодинамического анализов [4, 6], согласно установлено образование индием и цинком диаграммы состояния эвтектического типа с небольшой взаимной растворимостью металлов в твердом состоянии. [14]
Если сплавляемые элементы принадлежат к разным ( притом, достаточно далеким) группам Периодической системы, взаимодействие между разнородными атомами будет иное, чем взаимодействие между атомами одного и того же элемента; энергия смешения будет велика и взаимная растворимость металлов будет ограничена. [15]
Считаем, что взаимная растворимость металлов Л и В в твердом состоянии не изменяется в зависимости от температуры. Поэтому линии DE и PF расположены вертикально. Кристаллизация начинается в точке / с выпадения кристаллов а-раствора концентрации а. При температуре Т2, соответствующей точке 2, сплав / состоит из кристаллов а состава с и жидкости состава Ь, Перитек-тическое превращение происходит при пересечении линии DPC диаграммы. В точке 3 состав твердых кристаллов определяется точкой D, а жидкости - точкой С. [17]
Считаем, что взаимная растворимость металлов А и В в твердом состоянии не изменяется в зависимости от температуры. Поэтому линии DE и PF расположены вертикально. [18]
По-видимому, нет металлов, абсолютно не растворимых друг в друге в твердом состоянии. Но в тех случаях, когда взаимная растворимость металлов не превышает сотых долей процента, принято считать, что они нерастворимы друг в друге. [20]
По-видимому, нет металлов, абсолютно нерастворимых друг в друге в твердом состоянии. Но в тех случаях, когда взаимная растворимость металлов не превышает сотых долей процента, принято считать, что они нерастворимы друг в друге. [22]
По-видпмому, нет металлов, абсолютно нерастворимых друг в друге в твердом состоянии. Но в тех случаях, когда взаимная растворимость металлов не превышает сотых долей процента, принято считать, что они нерастворимы друг в друге. [24]
По-видимому, нет металлов, абсолютно нерастворимых друг в друге в твердом состоянии. Но в тех случаях, когда взаимная растворимость металлов не превышает сотых долей процента, принято считать, что они нерастворимы друг в друге. [26]
Сульфиды меди и серебра детально изучены, так как они являются основой руд этих металлов. Переработка руд требует тщательного исследования диаграмм плавкости систем металл - сульфид металла, позволяющих выяснить взаимную растворимость металла в сульфиде и сульфида в металле при разных температурах. [27]
Что касается подбора сочетаний металлов, обеспечивающих сопротивляемость изнашиванию, установлено, что желательно подбирать пары трущихся материалов из взаимно нерастворимых материалов и учитывать тот факт, чтобы хотя один из металлов принадлежал подгруппе В периодической таблицы [ 10, стр. Причина этого состоит в том, что число локальных соединений, образующихся в результате схватывания, зависит от взаимной растворимости металлов , а прочность этих соединений - от характеристик межатомных связей в металлах. Для металлов подгруппы В характерны слабые непрочные ковалентные связи. [29]
В самом деле, взаимно нерастворимые в твердом состоянии металлы не свариваются и не склонны к схватыванию, например, серебро, индий, свинец, висмут. Однако почти нерастворимый в железе кадмий сваривается с ним и, тем не менее, отличается хорошими антифрикционными свойствами. Критерий взаимной растворимости металлов в твердом состоянии для оценки их антифрикционных свойств является недостаточным не только потому, что известны противоречащие ему факты, но и вследствие того, что в реальных условиях не меньшую роль играют и другие показатели. Способность к схватыванию и степень повреждаемости поверхности при схватывании определяется скоростью образования защитных окисных пленок, их износостойкостью и сопротивлением их продавли-ванию в основной материал. Свариваемость титана со сталью объясняется не только их взаимной растворимостью, но и свойствами окис-ной пленки. [30]
Поведение в жидком состоянии
Для классификации металлов не существует единой системы. Все традиционные виды классификации металлов по группам основаны на практической необходимости, конкретных технических задачах и на специальных, важных для того или иного случая свойствах: по плавкости, например, различают легко-, средне- и тугоплавкие металлы, а по плотности одни металлы (с р до 5 г/см 3 ) относятся к легким, а другие (с р более 5 г/см 3 ) — к тяжелым; по технологическим качествам и назначению выделяют конструкционные металлы, упругие и твердые.
В ювелирном деле металлы в зависимости от степени их окисляемости на воздухе принято разделять на благородные и неблагородные. Последние по внешнему виду делятся на цветные (Сu и ее сплавы) и белого цвета (Sn, Zn, Sb, Bi, Pb и их сплавы). Необходимо, однако, сказать, что такого рода классификация, хотя она и порождена многолетней практикой, не может считаться однозначно последовательной. Теперь, например, известно, что благородные металлы не так стойки к окислению, как утверждалось ранее, а цветные сплавы золота не относятся к цветным металлам, даже когда, к примеру, в сплаве Аи 333 медь доминирует по содержанию; нейзильбер же белого цвета является цветным металлом.
Принято говорить: «украшение из драгоценного металла» и «подлинное или настоящее украшение», что, разумеется, неправильно. Любое высокохудожественное украшение остается всегда таковым, из какого бы металла при этом оно не было сделано.
Сплав представляет собой смесь двух или нескольких металлов или металла с неметаллами. Он образуется посредством совместного плавления различных компонентов, в исключительных случаях — диффузии твердых, жидких или газообразных веществ в металл. Эти смеси также имеют металлические свойства. Варьируя компонентами, их количеством, можно не только изменить свойства металлов, придав им совершенно новые качества, но и снизить их стоимость.
При расплавлении металлов наблюдаются следующие их возможные взаимодействия:
Полная нерастворимость. В этом случае в расплавленном состоянии взаимная растворимость компонентов отсутствует; металлы, в зависимости от их плотности, располагаются друг над другом отчетливо различающимися слоями (и при литье они затвердели бы в кокиле тоже раздельно).
Полная растворимость. В данном случае, независимо от соотношения компонентов, они, растворяясь, образуют однородный расплав, исходные металлы в котором уже неразличимы, что, кстати, и является главным условием
получения пригодного для использования сплава.
Образование сплава из однородного расплава (схема): 1 — однородный твердый раствор; 2 — образование ограниченного твердого раствора; 3 — гетерогенная смесь кристаллов.
Ограниченная растворимость. В расплаве одного металла растворяется только ограниченное количество другого, избыток же выделяется в расплаве в виде слоя нерастворившегося компонента. В качестве примера возьмем систему Ag-Ni, когда в расплаве никеля растворяется до 2% серебра, а в жидком серебре растворяется до 0,4% никеля. Если же доля присадочного металла оказывается выше, то расплав получается состоящим как бы из двух, расположенных друг над другом слоев. К примеру, расплав Ag-Ni, содержащий 50% серебра, состоял бы из слоя никеля с 2% серебра и слоя серебра с 0,4% никеля.
Однородные (гомогенные) твердые растворы. Если исходные металлы имеют одинаковую по строению кристаллическую решетку и приблизительно одинаковые по величине атомы, то их полная растворимость может сохраниться и в твердом состоянии, так как кристаллическую решетку образуют совместно атомы обоих металлов, а компоненты сплава в кристаллите находятся в таком же соотношении, как и во всем сплаве, почему, собственно, микрошлиф сплава Au-Ag или Au-Cu схож с микрошлифом чистого металла.
Гетерогенная смесь кристаллов. Если компоненты по своему строению различны, то в процессе перехода из жидкого состояния в твердое единый расплав распадается и образующиеся при этом кристаллические решетки состоят только из одного вида атомов, а кристаллиты — из одного из исходных компонентов. Такая форма абсолютной нерастворимости встречается на практике очень редко.
Образование твердых растворов с ограниченной растворимостью. В то время как компоненты в жидком состоянии образуют абсолютно однородный расплав, при их затвердевании возникает твердый раствор, в котором преобладает один тип металла, а в кристаллическую решетку этого металла внедряется ограниченное количество атомов другого металла. Такие сплавы встречаются довольно часто и имеют большое значение на практике, так как их свойства особенно сильно отличаются от свойств чистых металлов, например в системе Ag-Cu.
Интерметаллические соединения (металлиды). В их кристаллической решетке содержатся атомы исходных металлов в количественном соотношении, выраженном целыми числами, что на практике отображается записями типа AuCu, Au2Cu3, на первый взгляд напоминающими химические формулы .молекул, в действительности здесь указывается на количественное соотношение компонентов сплава. При целочисленных соотношениях атомы в кристаллической решетке располагаются в упорядоченном виде таким образом, что, например, атомы одного металла занимают углы кубической ячейки, а атомы другого размещаются в ее центре. Кроме расположения атомов в элементарной ячейке, имеет значение и упорядоченность занимаемых ими мест в кристаллической решетке, которая называется сверхструктурой. Могут образовываться очень сложные кристаллические структуры, значительно отличающиеся от кристаллических решеток чистых металлов, и компоненты которых могут находиться в таких количественных соотношениях, как, например, Cu,Znfi и CiL.SrL. Все металлиды— твердые, хрупкие и почти не поддаются обработке давлением.
Кристаллические решетки
Зонке (1879 г.), Чермак, Шенфлис, Федоров (1891 г.) и другие показали геометрически, что все кристаллические формы можно представить как результат распределения точек (мельчайших вещественных частиц) в пространстве по законам симметрии; получающиеся конфигурации они назвали кристаллическими решетками.
Распределяя согласно элементам симметрии точки в пространстве, они получили 230 комбинаций, 230 кристаллических решеток, которые соответствуют всем встречающимся в природе кристаллическим формам.
Последующее исследование кристаллов с помощью лучей Рентгена немецким ученым Лауэ (1912 г.) подтвердило те предположения и выводы, которые были сделаны косвенным путем. Были получены прямые доказательства существования атомов, ионов и способов их расположения в пространстве.
Рис.6. Схематическое изображение осей кристаллов и граней
Кристаллические решетки, как выяснилось, делятся на следующие группы: атомные, ионные, молекулярные и металлические.
Атомные решетки. Каждое узловое место в атомной решетке занято нейтральным атомом. Примером может служить кристаллическая решетка аргона, приведенная на рисунке 7.
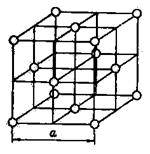
Рис. 7. Кристаллическая решетка аргона
Ионные решетки. Каждое узловое место в ионной решетке занято ионом. Примеры ионных решеток приведены на рисунках 8 и 9. На рис. 8, а показана кристаллическая решетка Na + Cl - , на рис. 8,6 — решетка CsJ; на рис. 9 приведена кристаллическая решетка CaF2.
Кристаллическая решетка Na + Cl - типична для бинарных электролитов, состоит из двух центрированных в гранях решеток, вдвинутых одна в другую на ½ длины ребра куба. Одна решетка — катиона Na + , другая такая же—аниона С1 - .
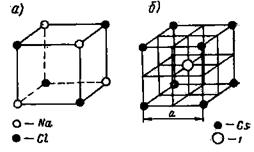
Рис. 8. Кристаллическая решетка NaCl и CsJ
Кристаллическая решетка Cs + J - представляет собой сочетание двух простых кубических решеток: решетки иона Cs + и решетки иона J - , вдвинутых одна в другую так, что в центре куба находится ион йода, а в углах — ионы Cs + . Эта решетка центрирована в пространстве так, что в центре куба находится анион, а в углах —катионы.
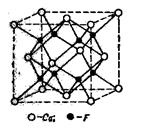
Рис. 9. Кристаллическая решетка CaF2
Кристаллическая решетка Ca 2+ F2 - типична для многих тройных электролитов. Здесь ионы Са 2+ образуют кристаллическую, центрированную в гранях, решетку, ионы же F - расположены в серединах восьми маленьких кубов, на которые может быть разложен большой куб.
В ионных кристаллических решетках отдельные места могут занимать сложные и комплексные ионы. Примеры: решетка нитрата натрия Na + NO3 - (pис 9, а) и решетка гексахлороплатината калия K + [PtCl6] 2- (рис. 10,б). Здесь отдельные места занимают ионы: Na + , К + , NO3 - , [PtCl6] 2- .
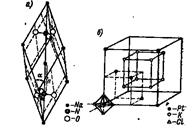
Рис. 10. Кристаллическая решетка нитрата натрия и гексахлороплатината калия.
В кристаллической решетке нитрата натрия каждый ион NO3 - занимает одно место, причем в центре тетраэдра — атом азота N +5 , а в углах — атомы кислорода О; атомы сближены друг с другом и составляют прочную, крепко стянутую группу.
Такую же группу представляет собой прочный комплексный ион [PtCl6] 2- . Пространственно он построен так: в центре октаэдра — ион Pt 4+ , а в углах — ионы С1 - .
Ионы [PtCl6] 2- занимают углы кубической, центрированной в гранях, кристаллической решетки. Ионы К + составляют куб.
Молекулярные решетки. В молекулярных решетках отдельные места занимают молекулы. Примером молекулярных решеток соединений, которые рассматриваются в неорганической химии, могут служить кристаллические решетки окиси алюминия (рис. 11, а) и двуокиси углерода СО2 (рис. 11,6). В кристаллической решетке окиси алюминия Аl2Оз углы ромба с длиной ребра αo = 5,12А занимают близко расположенные друг к другу группы атомов, образующие нейтральную молекулу.
В кристаллической, центрированной в гранях, решетке двуокиси углерода отдельные места занимают нейтральные молекулы СО2, очень сближенные группы из трех атомов С и 2О, сгруппированные так, как это показано на рис.11.
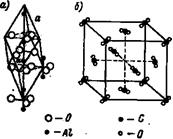
Рис. 11. Кристаллическая решетка окиси алюминия и двуокиси углерода СО2
Металлические решетки. Металлические решетки характеризуются особыми свойствами, отличающими их от других типов кристаллических решеток. В узлах металлических решеток находятся не атомы, а положительные ионы. Внешние электроны атомов металлов свободно мигрируют внутри кристаллической решетки, переходя от одного иона к другому, т. е. ведут себя подобно молекулам газа, поэтому всю совокупность электронов в кристаллической решетке металлов называют электронным газом.
Рис. 12. Кристаллическая решетка металлического натрия
Таким образом, металлическую решетку можно рассматривать как ионную решетку, находящуюся в «атмосфере» электронного газа из внешних электронов. Такова, например, решетка металлического натрия (рис. 12). Характерные свойства металлов — электропроводность и теплопроводность, в частности, зависят от передвижения электронов внутри решетки. Под воздействием внешнего электрического поля валентные электроны, число которых у атомов металлов невелико (1, 2 или 3), перемещаются в направлении поля, создавая электрическую проводимость.
СПЛАВЫ
Для изготовления оборудования в различных отраслях современной промышленности используются самые разнообразные материалы, как природные, так и созданные руками человека. Однако основа современной техники — машины и механизмы — изготовляются в основном из металлических материалов — металлов, сплавов металлов друг с другом и с некоторыми неметаллами, прежде всего с углеродом. Это связано с тем, что из всех видов материалов металлические материалы обладают наиболее ценными механическими свойствами. Кроме того, металлические материалы очень многочисленны и разнообразны по своим свойствам.

В жидком состоянии большинство металлов растворяются друг в друге и образуют однородный жидкий сплав. При кристаллизации из расплавленного состояния различные металлы ведут себя по-разному. Основными случаями являются при этом следующие:
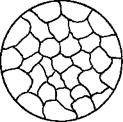
1. В твердом состоянии сплавляемые металлы не растворяются и химически не взаимодействуют друг с другом. При этих условиях сплав представляет собою механическую смесь и состоит из кристаллитов одного и другого компонентов, отчетливо выявляемых на микрошлифе (рис. 13).
2. Сплавляемые металлы взаимодействуют друг с другом, образуя химическое соединение.
3. При кристаллизации из расплава растворимость металлов друг в друге сохраняется. Образуются однородные кристаллы. В этом случае твердая фаза носит название твердого раствора (рис. 14). При этом для одних металлов их взаимная растворимость в твердом состоянии неограниченна, другие же растворимы друг в друге лишь до определенных концентраций.
Читайте также:
