Растворимость металлов в воде
Обновлено: 04.10.2024
а) Хорошо растворяется в соляной кислоте. Медленно растворяется в концентрированной и разбавленной HNO3 н разбавленной Н2SO4.
б) Алюминий и его сплавы хорошо растворяются в концентрированных растворах едких щелочей (20—40% NaOH или KОН).
Бериллий
Хорошо растворяется в соляной и серной кислотах, а также в азотной кислоте при нагревании. Холодная азотная кислота пассивирует металл вследствие образования пленки окиси бериллия.
Растворяется в кислотах-окислителях: в концентрированных азотной и серной, а также в хлорной при нагревании до белого дыма. Сплавляется с едкими щелочами, образуя метабораты.
Ванадий
Растворяется на холоду в «царской водке» и в азотной кислоте. При нагревании растворяется в концентрированной серной и плавиковой кислотах. Сплавляется со щелочами, образуя соли ванадиевой кислоты (ванадаты). Нерастворим в разбавленных серной и соляной кислотах.
Висмут
Хорошо растворяется в разбавленной азотной кислоте, в смеси азотной и соляной кислот, в горячей концентрированной серной кислотах. Нерастворим в разбавленных соляной и серной кислотах.
Вольфрам
Нерастворим в серной и соляной кислотах. Концентрированная азотная кислота и «царская водка» окисляют вольфрам с поверхности, переводя его в нерастворимую вольфрамовую кислоту. Растворяется в смеси плавиковой и азотной кислот. Растворим в смесях кислот, содержащих фосфорную кислоту, вследствие образования комплексной вольфрамо-фосфорной кислоты H7[P(W2O7)6]*xH2O
Растворяется в насыщенном растворе щавелевой кислоты в присутствии перекиси водорода. Сплавляется со щелочами или Na2CO3 в присутствии окислителей (например, КСlO3) с образованием солей вольфрамовой кислоты.
Гафний
Германий
Хорошо растворяется в «царской водке», а также в щелочном растворе перекиси водорода. Кислоты на германий действуют слабо; в азотной кислоте образуется гидрат двуокиси германия.
Железо
Легко растворяется в азотной кислоте, разбавленной серной, а также в соляной кислоте. Чистейшее железо растворяется в азотной кислоте, но не растворяется в соляной.
Золото
Индий
Легко растворяется в соляной кислоте, медленно — в серной, с трудом в концентрированной азотной кислоте.
Кадмий
Растворяется в горячей разбавленной азотной кислоте. Плохо растворяется в разбавленной соляной и серной кислотах; растворение ускоряется в присутствии перекиси водорода.
Кобальт
Растворяется в разбавленной азотной кислоте, а также в разбавленной соляной и серной кислотах. Концентрированные серная и азотная кислоты пассивируют кобальт.
Лантан
Магний
Легко растворяется во всех разбавленных кислотах, в т. ч. и в уксусной. Растворяется в концентрированных растворах хлорида аммония.
Марганец
Растворяется в разбавленных азотной, соляной и серной кислотах с образованием солей двухвалентного марганца (Мn 2+ ). В концентрированной серной кислоте растворяется с выделением SO2
Легко растворяется в азотной кислоте. Нерастворима в соляной и в разбавленной серной кислотах. Концентрированная серная кислота растворяет медь при нагревании до паров Н2SO4. Соляная кислота растворяет медь в присутствии окислителей (например, Fe 3+ , Н2О2, НNО3 и т. д.).
Молибден
Легко растворяется в «царской водке» и в смеси плавиковой и азотной кислот. Растворяется в концентрированной серной кислоте при нагревании до паров Н2SO4. В разбавленной соляной кислоте растворяется при нагревании очень медлепно.
Сплавляется со щелочами в присутствии окислителей. Концентрированная азотная кислота пассивирует молибден.
Мышьяк
Растворяется в смеси азотной и соляной кислот, в концентрированной серной кислоте при нагревании до паров Н2SO4. Нерастворим в соляной и разбавленной серной кислотах.
Никель
Растворяется в разбавленной азотной кислоте. В концентрированной азотной кислоте пассивируется и не растворяется. Плохо растворяется в разбавленных соляной и серной кислотах.
Ниобий
Нерастворим в «царской водке» и концентрированной азотной кислоте. Растворяется в плавиковой кислоте с добавкой азотной кислоты. Концентрированная серная кислота с добавкой (NH4)2SO4 или К2SO4 растворяет ниобий при нагревании до паров Н2SO4. Сплавляется со щелочами, образуя солн-ниобаты.
Олово
Растворяется в соляной кислоте и в смеси соляной и азотной кислот. Растворяется в концентрированной серной кислоте при нагревании. В азотной кислоте образуется нерастворимый осадок метаоловянной кислоты H2SnO3
Платина
Рений
Растворяется в азотной кислоте с образованием раствора рениевой кислоты. Концентрированная серная кислота при нагревании медленно растворяет рений. Соляная и разбавленная серная кислоты очень медленно растворяют его.
Ртуть
Хорошо растворяется в азотной кислоте, а также в концентрированной серной при нагревании. Нерастворима в соляной кислоте и в разбавленной серной.
Свинец
Хорошо растворяется в разбавленной азотной кислоте. Соляная и серная кислоты растворяют свинец лишь при нагревании. Растворяется в уксусной кислоте.
Селен
Растворяется в азотной кислоте с образованием растворимой селенистой кислоты H2SeO3. Растворяется также в «царской водке».
Серебро
Легко растворяется в азотной кислоте; при нагревании растворяется в концентрированной серной кислоте. Нерастворимо в соляной, а также на холоду в серной кислотах.
Сурьма
Растворяется в концентрированной серной кислоте при нагревании до паров Н2SO4, в смеси азотной и соляной кислот, в смеси азотной кислоты с винной.
Таллий
Легко растворяется в азотной кислоте. В серной кислоте растворяется труднее, в соляной — плохо вследствие образования малорастворимого хлорида одновалентного таллия.
Тантал
Нерастворим в «царской водке» и в азотной кислоте. На него не действует плавиковая кислота (в отсутствие платины). Концентрированная серная кислота лишь при нагревании действует на металл. Растворяется в плавиковой кислоте с добавкой азотной. Металл сплавляется со щелочами, образуя танталаты.
Теллур
Растворяется в азотной кислоте с образованием растворимой теллуристой кислоты H2TeO3. Растворим в «царской водке», в концентрированной серной кислоте, в растворах NaOH и KCN.
Титан
Растворяется в разбавленной 1 : 1 соляной и разбавленной 1 : б серной кислотах с образованием солей трех валентного титана фиолетового цвета. Очень легко растворяется в разбавленной плавиковой кислоте и в смеси плавиковой и азотной кислот.
Азотная кислота пассивирует титан вследствие образования нерастворимой метатитановой кислоты. Такой пассивированный титан плохо растворяется в соляной и серной кислотах.
Торий
Легко растворяется в концентрированной соляной кислоте и в смеси соляной и азотной кислот. Одна азотная кислота пассивирует металл.
Растворяется в разбавленных серной и соляной кислотах, а также в хлорной кислоте. Азотная кислота на холоду пассивирует уран (при растворении образуется нитрат уранила UO2(NO3)2 ).
Легко растворяется в соляной и хлоркой кислотах, а также в разбавленной серной кислоте. В азотной кислоте хром с поверхности пассивируется, и дальнейшее растворение его протекает крайне медленно.
Церий
Цирконий
Растворяется в «царской водке» и плавиковой кислоте, а также в смеси плавиковой и азотной кислот. Медленно растворяется в серной и концентрированной соляной кислоте. Устойчив к действию 5%-ной соляпой кислоты даже при нагревапии.
Легко переводится в раствор мокрым сплавлением (на 10 мл концентрированной Н2SO4 добавляют 3 грамма K2SO4).
--> Растворимость металлов в различных жидкостях. Ртуть Хорошо растворяется в азотной кислоте, а также в концентрированной серной при нагревании. Нерастворима в соляной кислоте и в разбавленной серной. | растворимость, металл, химия, кислота
УЧЕБНАЯ КНИГА ПО ХИМИИ
Продолжение. См. № 4–14, 16–28, 30–34, 37–44, 47, 48/2002;
1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23,
24, 25-26, 27-28, 29, 30, 31, 32, 35, 36, 37, 39, 41, 42, 43, 44, 46, 47/2003;
1, 2, 3, 4, 5, 7, 11, 13, 14, 16, 17, 20, 22, 24, 29, 30, 31/2004
§ 8.2. Реакции на границе металл–раствор
Можно ли, опустив в морскую воду монету, соединенную с проволокой, получить после кораблекрушения электроэнергию для маленького транзисторного приемника? Почему железо ржавеет, а золото не ржавеет? Почему золото – очень дорогой металл, а железо сравнительно недорогой? Обо всем этом вы узнаете, прочитав этот раздел учебника.
Растворимость одного вещества в другом – свойство, присущее всем веществам. Растворимость может быть неограниченной и крайне малой, что зависит от термодинамических свойств растворяемого вещества и растворителя. Даже при чрезвычайно малой растворимости одного вещества в другом всегда осуществляется переход веществ через поверхность их контакта.
Любой металл растворяется в воде, однако растворимость металлов изменяется в очень широких пределах. Например, щелочные металлы бурно взаимодействуют с водой, при этом выделяется из воды водород и образуется раствор гидроксида.
Серебро практически не реагирует с водой, тем не менее процесс перехода частиц серебра в воду происходит, и получается лечебная «серебряная вода». Таким образом, одни металлы хорошо растворяются в воде, другие – крайне плохо. Ответ на вопрос, чем обусловлена различная растворимость металлов в воде, дает область химической науки – электрохимия.
Ниже мы поговорим об особой группе электрохимических реакций, протекающих на границе раздела фаз, в частности металл–вода (или раствор соли металла). Эти реакции характеризуются переносом заряда (электронов) и вещества через границу раздела фаз твердое вещество–жидкость.
Вы знаете, что металл проводит ток благодаря тому, что в его кристаллической решетке есть свободные (точнее, слабо связанные с атомами) электроны. А это означает, что в кристаллической решетке имеется некоторое количество положительно заряженных ионов металла.
Если металлическую пластинку, например медную, погрузить в воду или раствор соли меди, то из слоя металла, находящегося на границе с водой, положительно заряженные ионы Cu 2+ начнут переходить в воду (рис. 8.5). Из-за этого пластинка приобретает отрицательный заряд. Между отрицательно заряженной пластинкой и перешедшими в раствор положительно заряженными ионами возникает электростатическое притяжение, что препятствует дальнейшему переходу ионов в раствор, т.е. процесс растворения металла прекращается.
Рис. 8.5.
Образование двойного электрического слоя
на границе металл–вода (раствор)
Одновременно развивается противоположный процесс: ионы меди из раствора, подойдя к поверхности пластинки, принимают от нее электроны и, переходя в нейтральное состояние, осаждаются. Через некоторое время устанавливается состояние динамического равновесия, при котором скорость перехода ионов из металла в раствор равна скорости их осаждения на металле. На рис. 8.5 ион металла для простоты изображен негидратированным.
При контакте металла с водой или раствором соли металла жидкая и кристаллическая фазы приобретают на границе раздела противоположные заряды, в результате чего на межфазной границе образуется двойной электрический слой и возникает разность электрических потенциалов. Равновесие между металлом, жидкой фазой и двойным электрическим слоем полностью подчиняется всем положениям смещения химического равновесия. На рис. 8.5 двойной электрический слой изображен в виде двух плотных слоев электронов и катионов. В действительности каждый слой распространяется по обе стороны от места контакта металла с водой, и постепенно количество электронов и катионов в слоях понижается.
Равновесие между ионами раствора и металлом выражается уравнением
Cu 2+ (р-р) + 2е = Сu (кр.).
В уравнении равновесия электрохимической реакции принимаемые электроны обычно записывают в левой части уравнения, перед знаком равенства. Соблюдение этого правила крайне важно, т.к. по таким уравнениям можно предсказывать направление электродных процессов.
Посмотрите на написанное уравнение – это уравнение окислительно-востановительной реакции! Поэтому все, что вы знаете об окислительно-восстановительных реакциях, следует использовать и для этих реакций.
Система, состоящая из проводника электрического тока и раствора (или расплава) электролита, в который погружен проводник, называется электродом. Так, медная пластинка, погруженная в водный раствор сульфата меди CuSО4, – типичный электрод.
Состояние равновесия электродного процесса определяется электродным потенциалом Е, представляющим собой разность потенциалов двух фаз на границе металл–электролит. Непосредственно измерить абсолютное значение электродного потенциала нельзя, но его можно сравнить с потенциалами других электродов (при стандартных условиях).
На медном электроде (медь–раствор с концентрацией ионов Cu 2+ , равной 1 моль/л) при разомкнутой гальванической цепи устанавливается равновесие, характеризующееся стандартным электродным потенциалом, равным 0,34 В:
Cu 2+ + 2e = Cu, E = 0,34 В.
Положительное значение потенциала этой электродной реакции означает, что реакция может проходить самопроизвольно (при наличии второго электрода, поставляющего электроны), т.е. ионы меди могут переходить в металлическую медь (медь будет осаждаться на электроде).
Хотя, разумеется, знак заряда электрода не зависит от способа написания уравнения электродного процесса, при его записи в противоположном направлении знак потенциала необходимо изменить на противоположный.
Стандартный потенциал цинкового электрода равен –0,76 В:
Zn 2+ + 2e = Zn, E = –0,76 B.
Отрицательное значение электродного потенциала цинка свидетельствует о невозможности прохождения реакции по этому уравнению. Самопроизвольно проходит процесс в противоположном направлении:
Zn – 2e = Zn 2+ , E = 0,76 B.
Уравнение этой реакции показывает, что цинк может «растворяться» в кислотах, или, более правильно, цинк реагирует с ионами водорода и образуются ионы цинка и газообразный водород.
Если расположить стандартные электродные потенциалы металлов в порядке уменьшения их отрицательного значения и повышения положительного, т.е. в порядке возрастания их электродных потенциалов, то получится ряд стандартных электродных потенциалов (в обычных учебниках химии называемый по-старому рядом напряжений металлов или неправильно – рядом активностей металлов):
Укажите в уравнениях реакций вещества, играющие роль окислителя и восстановителя. Найдите электродный потенциал, не относящийся к стандартным условиям.
Чем более отрицателен (менее положителен) электродный потенциал, тем выше способность металла посылать ионы в раствор и тем сильнее проявляет себя металл как восстановитель. Металлический литий – самый сильный восстановитель среди металлов, а металлическое золото в данном перечне уравнений реакций – самый слабый восстановитель. (Окислители или восстановители ионы Li + и Au 3+ и какой из них сильнее?)
Все металлы, расположенные в этом списке выше водорода, т.е. имеющие отрицательное значение электродного потенциала, растворяются в растворах кислот с концентрацией ионов водорода
1 моль/л. Если электродный потенциал металла имеет положительный знак, то металл не растворяется в растворах кислот с Эти правила можно не запоминать, лучше запомнить общий подход (уже вам известный) к определению направления окислительно-восстановительной реакции в гальваническом элементе.
Будет ли железо растворяться в соляной кислоте? Выпишем электродные потенциалы железа и водорода (в 1М растворе кислоты, т.е. при концентрации ионов водорода 1 моль/л):
Из этих двух реакций в написанном направлении будет протекать только та, у которой большая способность отдавать электроны, т.е. большее отрицательное значение электродного потенциала. Поэтому металлическое железо будет отдавать электроны, а ионы водорода их принимать:
Химические свойства металлов

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
Cu, Hg, Ag, Pt, Au
Восстановительная способность металлов в свободном состоянии
Возрастает справа налево
Взаимодействие металлов с кислородом
Быстро окисляются при обычной температуре
Медленно окисляются при обычной температуре или при нагревании
Взаимодействие с водой
Выделяется водород и образуется гидроксид
При нагревании выделяется водород и образуются оксиды
Водород из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с концентрированными азотной и серной кислотами
С кислотами не реагируют, растворяются в царской водке
Взаимодействие с солями
Не могут вытеснять металлы из солей
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей
Взаимодействие с оксидами
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов
Кристаллическая решетка

У каждого вещества есть набор физических свойств. Например, соли легко растворяются в воде и проводят электрический ток, а металлы имеют характерный блеск и ковкость. Такие характеристики зависят от строения вещества — от его кристаллической решетки. В этом материале мы расскажем о видах кристаллических решеток и о том, какие свойства придает веществу каждая из них.
11 класс, ЕГЭ/ОГЭ
Что такое кристаллическая решетка
Как известно, все вещества состоят из частиц — атомов, которые могут располагаться хаотично или в определенном порядке. У аморфных веществ частицы расположены беспорядочно, а у кристаллических они образуют определенную структуру. Эта структура называется кристаллической решеткой. Она определяет такие характеристики вещества, как твердость, хрупкость, температура кипения и/или плавления, пластичность, растворимость, электропроводность и т. д.
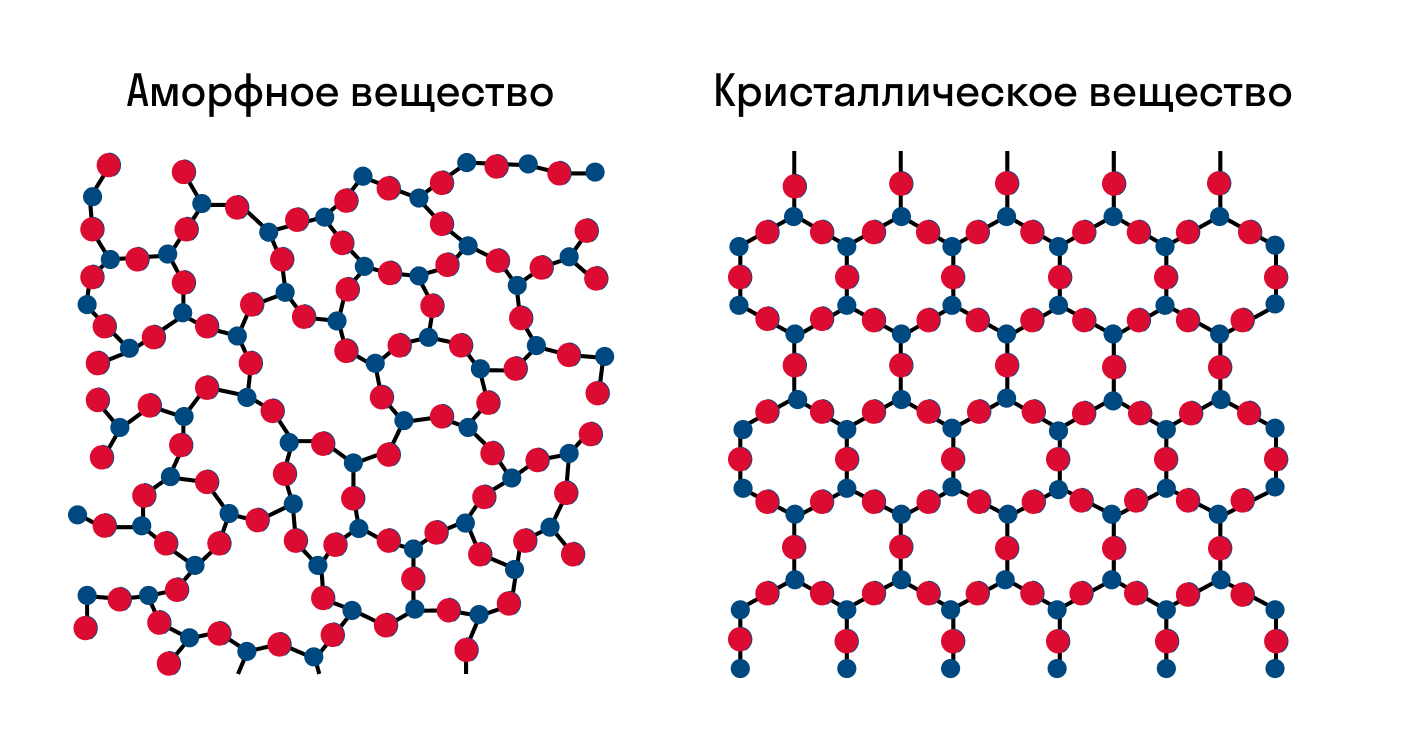
Кристаллическая решетка — это внутренняя структура кристалла, порядок взаимного расположения атомов, ионов или молекул. Точки, в которых находятся эти частицы, называются узлами решетки.
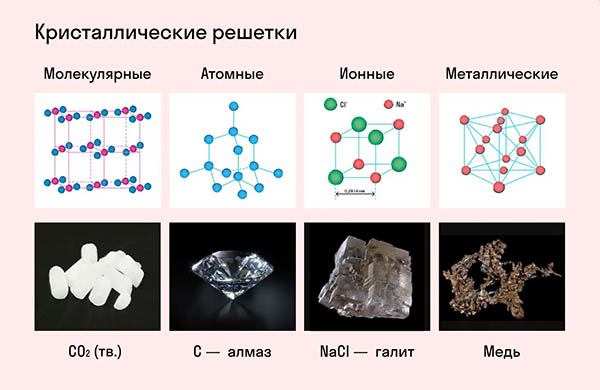
Частицы удерживаются на своих местах благодаря химическим связям между ними. В зависимости от того, какой вид связи удерживает атомы или ионы данного вещества, в химии выделяют основные типы кристаллических решеток:
атомная (ковалентные связи),
молекулярная (ковалентные связи и притяжение между молекулами),
металлическая (металлические связи),
ионная (ионные связи).
Не путайте эти два понятия — кристаллическая решетка и химическая связь. Тип решетки говорит о том, как расположены атомы/ионы в молекуле вещества, а тип связи — по какому принципу они между собой взаимодействуют.
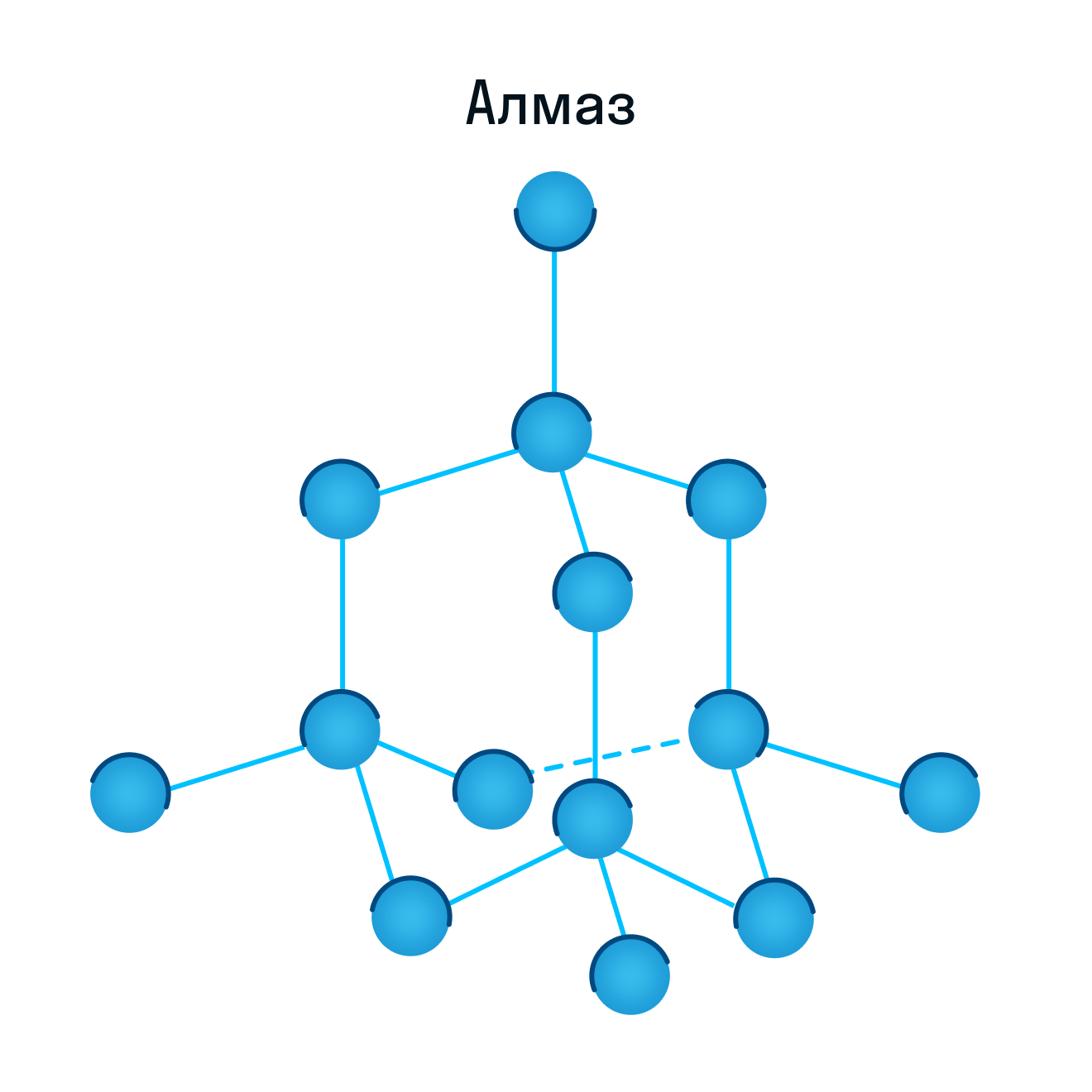
Атомная кристаллическая решетка
Согласно своему названию, атомная кристаллическая решетка — это структура, в узлах которой расположены атомы. Они взаимодействуют с помощью ковалентных связей, то есть один атом отдает другому свободный электрон или же электроны из разных атомов образуют общую пару. В кристаллах с атомной решеткой частицы прочно связаны, что обуславливает ряд физических характеристик.
Свойства веществ с атомной решеткой:
неспособность к растворению в воде,
высокая температура кипения и плавления.
К примеру, атомную кристаллическую решетку имеет алмаз — самый твердый минерал в мире.
Другие примеры: германий Ge, кремний Si, нитрид бора BN, карборунд SiC.
Если нужно рассказать о свойствах веществ с атомной кристаллической решеткой, достаточно вспомнить песок и перечислить его характеристики.
Молекулярная кристаллическая решетка
Как и в предыдущей группе, в этой находятся вещества с ковалентными связями между атомами. Но физические характеристики этих веществ совершенно иные — они легко плавятся, превращаются в жидкость, растворяются в воде. Почему так происходит? Все дело в том, что здесь кристаллы строятся не из атомов, а из молекул.
Молекулярная кристаллическая решетка — это структура, в узлах которой находятся не атомы, а молекулы.
Внутри молекул атомы имеют прочные ковалентные связи, но сами молекулы связаны между собой слабо. Поэтому кристаллы таких веществ непрочные и легко распадаются.
Молекулярная кристаллическая решетка характерна для воды. При комнатной температуре это жидкость, но стоит нагреть ее до температуры кипения (которая сравнительно низка), как она тут же начинает превращаться в пар, т. е. переходит в газообразное состояние.
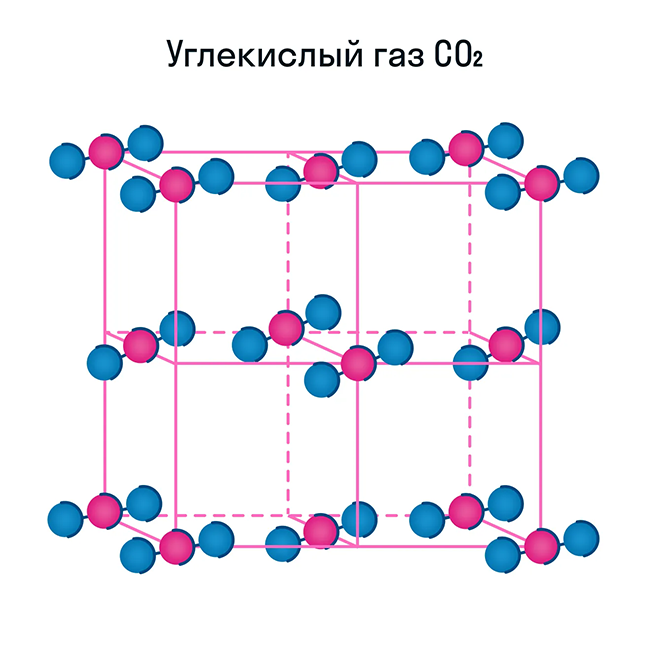
Некоторые молекулярные вещества — например, сухой лед CO2, способны преобразоваться в газ сразу из твердого состояния, минуя жидкое (данный процесс называется возгонкой).
Свойства молекулярных веществ:
у некоторых — наличие запаха.
Помимо воды к веществам с молекулярной кристаллической решеткой относятся аммиак NH3, гелий He, радон Rn, йод I, азот N2 и другие. Все благородные газы — молекулярные вещества. Также к этой группе принадлежит и большинство органических соединений (например, сахар).
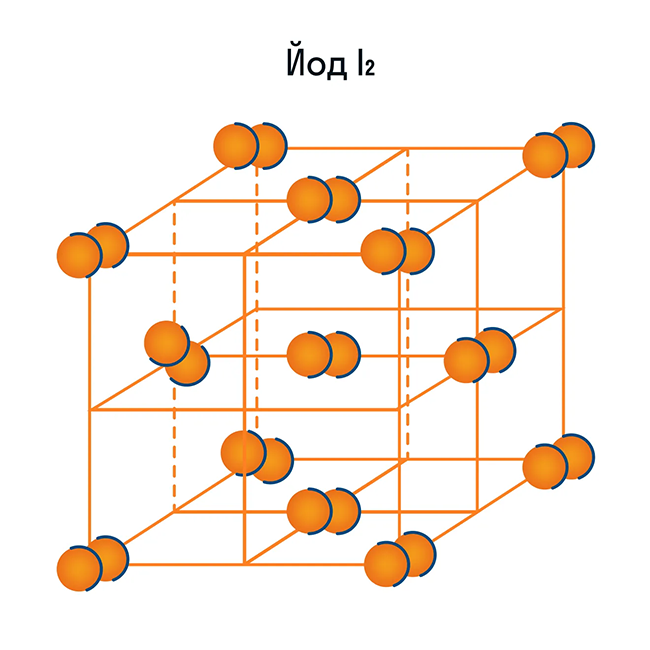
Ионная кристаллическая решетка
Как известно, при ионной химической связи один атом отдает другому ионы и приобретает положительный заряд, в то время как принимающий атом заряжается отрицательно. В итоге появляются разноименно заряженные ионы, из которых и состоит структура кристалла.
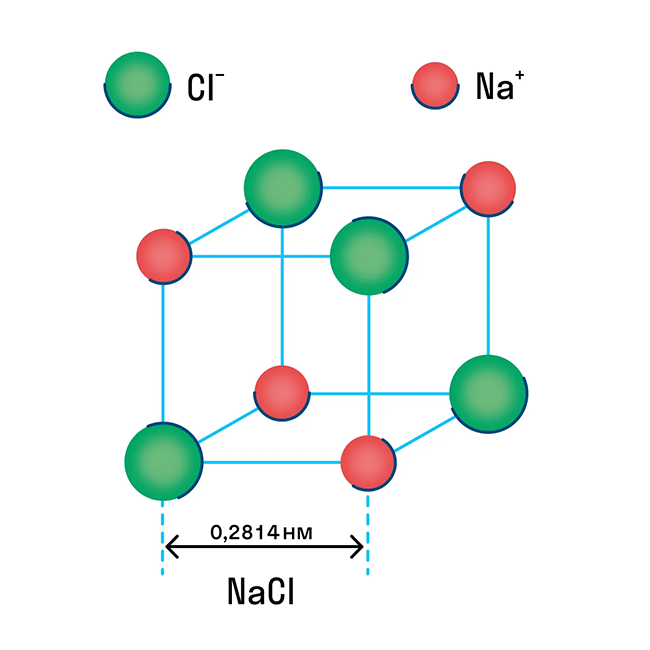
Ионная решетка — это кристаллическая структура, в узловых точках которой находятся ионы, связанные взаимным притяжением.
Ионную кристаллическую решетку имеют практически все соли, типичным представителем можно считать поваренную соль NaCl. О ней стоит вспомнить, если нужно перечислить физические характеристики этой группы. Также ионную решетку имеют щелочи и оксиды активных металлов.
Свойства веществ с ионной структурой:
способность растворяться в воде.
Примеры веществ с ионной кристаллической решеткой: оксид кальция CaO, оксид магния MgO, хлорид аммония NH4Cl, хлорид магния MgCl2, оксид лития Li2O и другие.
Металлическая кристаллическая решетка
Для начала вспомним, как проходит металлическая химическая связь. В молекуле металла свободные отрицательно заряженные электроны перемещаются от одного иона к другому и соединяются с некоторыми из них, а после отрываются и мигрируют дальше. В результате получается кристалл, в котором ионы превращаются в атомы и наоборот.
Металлическая кристаллическая решетка — это структура, которая состоит из ионов и атомов металла, а между ними свободно передвигаются электроны. Как несложно догадаться, она характерна лишь для металлов и сплавов.
Свободные электроны, мигрирующие между узлами решетки, образуют электронное облако, которое под воздействием электротока приходит в направленное движение. Это объясняет такое свойство металлов, как электрическая проводимость.
В химии типичным примером вещества, которое имеет металлическую кристаллическую решетку, считается медь. Она очень ковкая, пластичная, имеет высокую тепло- и электропроводность. Впрочем, все металлы ярко демонстрируют эти характеристики, поэтому назвать физические свойства данной группы несложно.
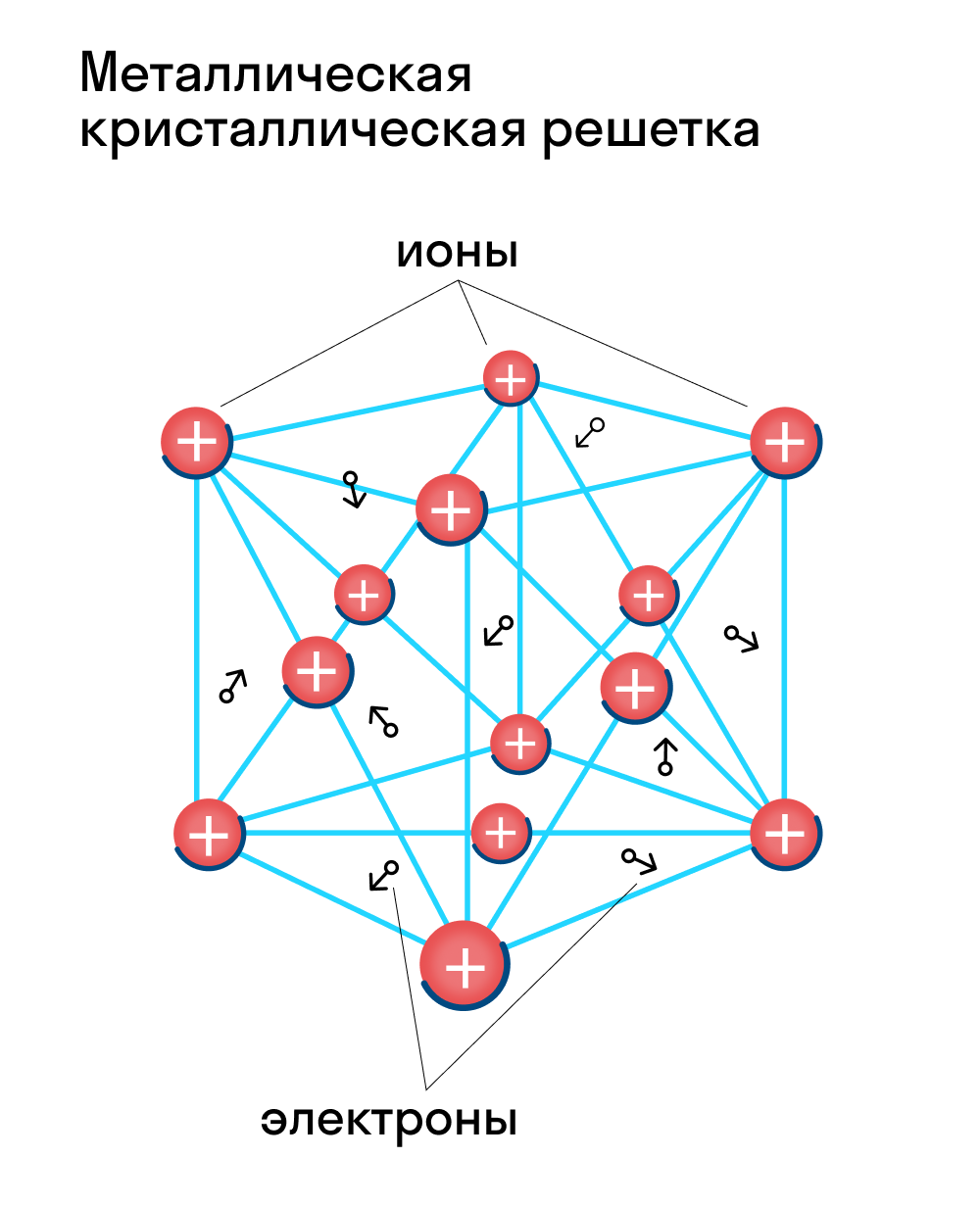
Свойства веществ с металлической кристаллической решеткой:
При этом температура плавления веществ может существенно различаться. Например, у ртути это −38,9°С, а у бериллия целых +1287°С.
Подведем итог: о характеристиках разных типов кристаллических решеток расскажет таблица.
Читайте также:
