Реакция с солями тяжелых металлов
Обновлено: 05.07.2024
В связи с ухудшением экологической обстановки испытанию на соли тяжелых металлов уделяется особое внимание. Особенно важно оно для ЛРС. Определение основано на реакции ионов тяжелых металлов с сульфидом натрия. Известно, что при этом образуется черный осадок или бурое окрашивание.
Открываемые примеси - соли свинца, олова, сурьмы, кадмия, никеля, таллия и др.
Исходное вещество - ацетат свинца Pb(CH3COO)2·3H2O. Основной реактив – раствор сульфида натрия. Среда – уксуснокислая.
Pb(CH3COO)2 + Na2S 3COOH
В эталоне – заметное буроватое окрашивание, в исследуемом растворе – черный осадок или бурое окрашивание.
Реакции обнаружения мышьяка
Источником этой примеси может быть аппаратура, исходное сырье, растворители, используемые при производстве ЛП.
В ГФ Х1 описано 2 метода определения этой примеси.
Метод 1. Реакция Зангера-Блека применяется, если в статье нет специальных указаний.
Метод основан на восстановлении соединений мышьяка водородом в момент выделения (металлическим цинком в среде разведенной хлористоводородной кислоты или серной) до мышьяковистого водорода (арсина). Арсин проходя через бумажку, обработанную с дихлоридом ртути (II) с образует соединения окрашенные в зависимости от концентрации арсина в оранжевый или жёлтый цвет, а после обработки этой бумажки раствором калия йодида - в буровато-коричневый. Применение калия йодида позволяет повысить чувствительность реакции.
Исходное вещество – мышьяка (III) оксид As2О3, навеску предварительно растворяют в 0,1 М растворе натрия гидроксида и нейтрализуют 0,05 М раствором серной кислоты. Основной реактив – дихлорид ртути, дополнительный реактив – калия йодид.
Навеску ЛВ предварительно обрабатывают: неорганические – хлористоводородной кислотой разведенной или неорганические - пергидролем.
As2O3 + 6Zn + 12HCl 3 ↑ + 6ZnCl2 + 3H2O
AsH3 + HgCl2 2(HgCl) + HCl
AsH3 + 2HgCl2 2 + 2HCl
AsH3 + 3HgCl2 3 +3HCl
AsH3 + As(HgCl)3 2Hg3 ↓+ 3HCl
Метод 1 не применяется в случае присутствия наряду с мышьяком селена, теллура и в соединениях содержащих сурьму, висмут, ртуть, серебро, сульфиды и сульфиты. В этом случае в статье ГФ дается указание об использовании метода 2.
Метод основан на восстановлении соединений мышьяка с фосфорноватистой кислотой в присутствии хлористоводородной кислоты при нагревании до металлического мышьяка. В зависимости от концентрации в исследуемом растворе – бурый осадок или бурое окрашивание. В эталоне – бурое окрашивание. Фосфорноватистая кислота получается при взаимодействии основного реактива – гипофосфита натрия и хлористоводородной кислоты разведенной:
NaH2PO2 + HCl 3PO2 + NaCl
As2O3 + 3H3PO2 3PO3
As2O5 + 5H3PO2 2As↓+ 5H3PO3
Перечисленные испытания на примеси являются общими для большинства препаратов и дают лишь косвенную оценку степени очистки вещества.
Таким образом, можно сделать вывод, что существуют 2 группы примесей, отношение к которым определяется степенью их опасности для здоровья человека. Это влияющие на фармакологический эффект (их не должно быть в препарате) и не влияющие, свидетельствующие о степени очистки.
8. Приготовление эталонных растворов для определения общих примесей (8 примесей). Исходные вещества и растворители для приготовления эталона. Реактивы для определения каждого из ионов. Правила определения допустимых и недопустимых примесей.
При проведении испытаний на общие примеси используют химические реакции и систему эталонных растворов. Благодаря эталонным растворам ускоряется исследование и увеличивается точность (относительная ошибка метода ± 10 %).
ГФ использует 2 основных способа определения содержания примесей:
- эталонный(если установлена ФС ПДК, например, в препарате «Меди сульфат» хлоридов должно быть не более 0,005%) и
- безэталонный(если примеси не должно быть).
Эталон – это образец, содержащий определенное, точно известное количество открываемой примеси, которое является пределом ее содержания, применяющийся для определения присутствия примесей в ЛП и приблизительной оценки их количества.
Химические свойства солей

Впервые школьники знакомятся с химическими свойствами солей в 8 классе, и для понимания дальнейшего материала без этой темы никуда. Наша статья поможет освежить знания перед контрольной или экзаменом: вспомним, какие бывают соли и как они образуются, рассмотрим типичные реакции с ними.
О чем эта статья:
Соли — это сложные вещества, в состав которых входят катионы металла и анионы кислотного остатка. Иногда в состав солей входят водород или гидроксид-ион.
Классификация и номенклатура солей
Так как соли — это продукт полного или частичного замещения металлом атома водорода в кислоте, по составу их можно классифицировать следующим образом.
Кислые соли
Образованы неполным замещением атомов водорода на металл в кислоте.
В наименованиях кислых солей указывают количество водорода приставками «гидро-» или «дигидро-», название кислотного остатка и название металла. Если металл имеет переменную валентность, то в скобках указывают валентность.
Примеры кислых солей и их наименования:
LiHCO3 — гидрокарбонат лития,
NaHSO4 — гидросульфат натрия,
NaH2PO4 — дигидрофосфат натрия.
Средние соли
Образованы полным замещением атомов водорода в кислоте на металл.
Наименования средних солей складываются из названий кислотного остатка и металла. При необходимости указывают валентность.
Примеры средних солей с названиями:
CuSO4 — сульфат меди (II),
CaCl2 — хлорид кальция.
Основные соли
Продукт неполного замещения гидроксогрупп на кислотный остаток.
В наименованиях основных солей указывают количество гидроксид-ионов приставкой «гидроксо-» или «дигидроксо-», название кислотного остатка и название металла с указанием валентности.
Пример: Mg(OH)Cl — гидроксохлорид магния.
Двойные соли
В состав входят два разных металла и один кислотный остаток.
Наименование складывается из названия аниона кислотного остатка и названий металлов с указанием валентности (если металл имеет переменную валентность).
Примеры двойных солей и их наименования:
KNaSO4 — сульфат калия-натрия,
Смешанные соли
Содержат один металл и два разных кислотных остатка.
Наименования смешанных солей складываются из названия кислотных остатков (по усложнению) и названия металла с указанием валентности (при необходимости).
Примеры смешанных солей с наименованиями:
CaClOCl — хлорид-гиполхорит кальция,
PbFCl — фторид-хлорид свинца (II).
Комплексные соли
Образованы комплексным катионом или анионом, связанным с несколькими лигандами.
Называют комплексные соли по схеме: координационное число + лиганд с окончанием «-о» + комплексообразователь с окончанием «-ат» и указанием валентности + внешняя сфера, простой ион в родительном падеже.
Пример: K[Al(OH)4] — тетрагидроксоалюминат калия.
Гидратные соли
В состав входит молекула кристаллизационной воды.
Число молекул воды указывают численной приставкой к слову «гидрат» и добавляют название соли.
Пример: СuSO4∙5H2O — пентагидрат сульфата меди (II).
Получение солей
Получение средних солей
Средние соли можно образовать в ходе следующих реакций:
Так получают только соли бескислородных кислот.
Металл, стоящий левее H2 в ряду активности, с раствором кислоты:
Mg + 2HCl = MgCl2 + H2
Металл с раствором соли менее активного металла:
Основный оксид + кислотный оксид:
Основный оксид и кислота:
Основание с кислотным оксидом:
Основание с кислотой (реакция нейтрализации):
Взаимодействие соли с кислотой:
Взаимодействие возможно, если одним из продуктов реакции будет нерастворимая соль, вода или газ.
Реакция раствора основания с раствором соли:
Взаимодействие растворов двух солей с образованием новых солей:
Получение кислых солей
Кислые соли образуются при взаимодействии:
Кислот с металлами:
Кислот с оксидами металлов:
Гидроксидов металлов с кислотами:
Кислот с солями:
Аммиака с кислотами:
Получение кислых солей возможно, если кислота в избытке.
Также кислые соли образуются в ходе реакции основания с избытком кислотного оксида:
Получение основных солей
Взаимодействие кислоты с избытком основания:
Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов:
Взаимодействие солей слабых кислот со средними солями:
Получение комплексных солей
Реакции солей с лигандами:
Получение двойных солей
Двойные соли получают совместной кристаллизацией двух солей:
Химические свойства средних солей
Растворимые соли являются электролитами, следовательно, могут распадаться на ионы. Средние соли диссоциируют сразу:
Нитраты разлагаются в зависимости от активности металла соли:
| Металл | Левее Mg, кроме Li | От Mg до Cu | Правее Cu |
| Продукты | MeNO3 + O2 | MexOy + NO2 + O2 | Me + NO2 + O2 |
| Пример | 2NaNO3 = 2NaNO2 + O2 | 2Cu(NO3)2 = 2CuO + 4NO2 + O2 | 2AgNO3= 2Ag + 2NO2 + O2 |
Соли аммония разлагаются с выделением азота или оксида азота (I), если в составе анион, проявляет окислительные свойства. В остальных случаях разложение солей аммония сопровождается выделением аммиака:
Взаимодействие солей с металлами:
Более активные металлы вытесняют менее активные металлы из растворов солей.
Некоторые соли подвержены гидролизу:
Обменные реакции соли и кислоты, соли с основаниями и взаимодействие солей с солями:
Окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона:
Химические свойства кислых солей
Диссоциация. Кислые соли диссоциируют ступенчато:
Термическое разложение с образованием средней соли:
Взаимодействие солей со щелочью. В результате образуется средняя соль:
Химические свойства основных солей
Реакции солей с кислотами — образование средней соли:
Диссоциация — так же как и кислые соли, основные соли диссоциируют ступенчато.
Химические свойства комплексных солей
Избыток сильной кислоты приводит к разрушению комплекса и образованию двух средних солей и воды:
Недостаток сильной кислоты приводит к образованию средней соли активного металла, амфотерного гидроксида и воды:
Взаимодействие слабой кислоты с солью образует кислую соль активного металла, амфотерный гидроксид и воду:
При действии углекислого или сернистого газа получаются кислая соль активного металла и амфотерный гидроксид:
Реакция солей, образованных сильными кислотами с катионами Fe3+, Al3+ и Cr3+, приводит к взаимному усилению гидролиза. Продукты реакции — два амфотерных гидроксида и соль активного металла:
Разлагаются при нагревании:
Вопросы для самопроверки
С чем взаимодействуют средние соли?
Назовите типичные реакции солей.
Из предложенного списка солей выберите те, которые не реагируют с цинком: нитрит калия, бромид железа, карбонат цезия, сульфат меди.
Химические свойства металлов

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
Cu, Hg, Ag, Pt, Au
Восстановительная способность металлов в свободном состоянии
Возрастает справа налево
Взаимодействие металлов с кислородом
Быстро окисляются при обычной температуре
Медленно окисляются при обычной температуре или при нагревании
Взаимодействие с водой
Выделяется водород и образуется гидроксид
При нагревании выделяется водород и образуются оксиды
Водород из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с концентрированными азотной и серной кислотами
С кислотами не реагируют, растворяются в царской водке
Взаимодействие с солями
Не могут вытеснять металлы из солей
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей
Взаимодействие с оксидами
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов
Реакция №3 «Осаждение солями тяжелых металлов»
Для обнаружения и изучения химического состава белков существует две группы реакций: цветные и реакции осаждения.
Цветные реакции
Цветные реакции применяются для установления белковой природы вещества, идентификации белков и определения их аминокислотного состава в различных биологических жидкостях. В клинической лабораторной практике эти методы используются для определения количества белка в плазме крови, аминокислот в моче и крови, для выявления наследственных или приобретенных нарушений обмена веществ у новорожденных.
Реакция №1 «Биуретовая реакция на пептидную связь»
Принцип: в основе биуретовой реакции лежит способность пептидных связей (-СО-NH-) образовывать с сульфатом меди в щелочной среде окрашенные комплексные соединения, интенсивность окраски которых зависит от длины полипептидной цепи. Раствор белка дает сине-фиолетовое окрашивание.
Реактивы: 1) яичный белок, 1% раствор (белок куриного яйца фильтруют через марлю и разводят дистиллированной водой 1:10); 2) гидроокись натрия, 10% раствор; 3) сульфат меди, 1% раствор.
Ход определения: в пробирку вносят 5 капель раствора яичного белка, 3 капли гидроокиси натрия и 1 каплю сульфата меди, перемешивают. Содержимое пробирки приобретает сине-фиолетовое окрашивание.
Реакция №2 «Нингидриновая реакция»
Принцип: сущность реакции состоит в образовании соединения, окрашенного в сине-фиолетовый цвет, состоящего из нингидрина и продуктов гидролиза аминокислот. Эта реакция характерна для аминогрупп в α-положении, которые присутствуют в природных аминокислотах и белках.
Реактивы: 1) яичный белок, 1% раствор; 2) нингидрин, 0,5% водный раствор.
Ход определения: в пробирку вносят 5 капель раствора яичного белка, добавляют 5 капель раствора нингидрина и нагревают до кипения. Развивается розово-фиолетовое окрашивание, переходящее с течением времени в сине-фиолетовое.
Реакция №3 «Ксантопротеиновая реакция»
Принцип: при добавлении к раствору белка концентрированной азотной кислоты и нагревании появляется желтое окрашивание, которое в присутствии щелочи переходит в оранжевое. Сущность реакции заключается в нитровании бензольного кольца циклических аминокислот азотной кислотой с образованием нитросоединений, выпадающих в осадок. Реакция выявляет наличие в белке циклических аминокислот (фенилаланин, тирозин, триптофан).
Реактивы: 1) яичный белок, 1% раствор; 2) концентрированная азотная кислота; 3) гидроокись натрия, 10% раствор.
Ход определения: к 5 каплям раствора яичного белка добавляют 3 капли азотной кислоты и (осторожно!) нагревают. Появляется осадок желтого цвета. После охлаждения добавляют (желательно на осадок) 10 капель раствора гидроокиси натрия, появляется оранжевое окрашивание.
Реакция №4 «Реакция Адамкевича»
Принцип: аминокислота триптофан в кислой среде, взаимодействуя с альдегидами кислот, образует продукты конденсации красно-фиолетового цвета.
Реактивы: 1) неразбавленный яичный белок; 2) концентрированная (ледяная) уксусная кислота; 3) концентрированная серная кислота.
Ход определения: к одной капле белка прибавляют 10 капель уксусной кислоты. Наклонив пробирку, осторожно по стенке добавляют каплями около 0,5 мл серной кислоты так, чтобы жидкости не смешивались. При стоянии пробирки на границе жидкостей появляется красно-фиолетовое кольцо.
Реакция №5 «Реакция Фоля»
Принцип: аминокислоты, содержащие сульфгидрильные группы – SH, подвергаются щелочному гидролизу с образованием сульфида натрия Na2S. Последний, взаимодействуя с плюмбитом натрия (образуется в ходе реакции между ацетатом свинца и гидроокисью натрия), образует осадок сульфида свинца PbS черного или бурого цвета.
Реактивы: 1) яичный белок, 1% раствор; 2) реактив Фоля (к 5% раствору ацетата свинца прибавляют равный объем 30% раствора гидроокиси натрия до растворения образовавшегося осадка).
Ход определения: к 5 каплям раствора яичного белка прибавляют 5 капли реактива Фоля и кипятят 2-3 минуты. После отстаивания 1-2 минут появляется черный или бурый осадок.
Реакции осаждения
Белки в растворе и соответственно в организме сохраняются в нативном (природном) состоянии за счет факторов устойчивости, к которым относятся заряд белковой молекулы и гидратная (водная) оболочка вокруг нее. Удаление этих факторов приводит к склеиванию молекул и выпадению их в осадок. Осаждение белков может быть обратимым и необратимым в зависимости от состава реактивов и условий реакций. В клинической лабораторной практике реакции осаждения используют для выделения альбуминовой и глобулиновой фракций (групп) белков плазмы крови, количественной характеристики их устойчивости в плазме, обнаружения белков в биологических жидкостях и освобождения от них с целью получения безбелкового раствора.
Обратимое осаждение
Под действием факторов осаждения белки выпадают в осадок, но после прекращения действия (удаления) этих факторов белки вновь переходят в растворимое состояние и приобретают свои нативные свойства. Одним из видов обратимого осаждения белков является высаливание.
Реакция №1 «Высаливание»
Принцип: насыщенным раствором сульфата аммония осаждается альбуминовая фракция белков, полунасыщенным раствором сульфата аммония – глобулиновая фракция.
Сущность реакции заключается в дегидратации (обезвоживании) молекул белка.
Реактивы:1) неразбавленный яичный белок; 2) насыщенный раствор сульфата аммония; 3) гидроокись натрия, 10% раствор; 4) сульфат меди, 1% раствор; 5) сульфат аммония в порошке; 6) дистиллированная вода.
Ход определения: в пробирку наливают 30 капель неразведенного яичного белка и добавляют равное количество насыщенного раствора сульфата аммония. Содержимое пробирки перемешивают. Получают полунасыщенный раствор сульфата аммония, при этом глобулиновая фракция белка осаждается, а альбуминовая остается в растворе. Через 5 минут осадок отфильтровывают, на фильтре остается глобулиновая фракция, а в фильтрате – альбуминовая. Осадок с фильтрата снимают стеклянной палочкой и переносят в пробирку, куда добавляют несколько капель воды, пока не растворится осадок. Наличие в растворе белка можно доказать с помощью биуретовой реакции, которая будет положительной.
В пробирку с фильтратом добавляют порошок сульфата аммония до полного насыщения раствора, т.е. до тех пор, пока не прекратится растворение соли. При этом выпадает осадок – альбумины. Его отфильтровывают, осадок с фильтра снимают стеклянной палочкой, растворяют водой и проводят биуретовую реакцию.
Необратимое осаждение
Необратимое осаждение белков связано с глубокими нарушениями структуры белков (вторичной и третичной) и потерей ими своих нативных свойств, т.е. денатурацией. Такие изменения белков можно вызывать кипячением, действием концентрированных растворов минеральных и органических кислот, солями тяжелых металлов и т.д.
Реакция №2 «Осаждение при кипячении»
Принцип: белки являются термолабильными соединениями и при нагревании свыше 50-60 0 С денатурируются. Сущность тепловой денатурации заключается в разрушении гидратной оболочки, разрыве стабилизирующих белковую молекулу связей и развертывании белковой молекулы. Наиболее полное и быстрое осаждение происходит в изоэлектрической точке (когда заряд молекулы равен нулю), поскольку при этом частицы белка наименее устойчивы. Белки, обладающие кислыми свойствами, осаждаются в слабокислой среде, а белки с основными свойствами – в слабощелочной. В сильнокислых или сильнощелочных растворах денатурированный при нагревании белок в осадок не выпадает, т.к. его частицы перезаряжаются и несут в первом случае положительный, а во втором – отрицательный заряд, что повышает их устойчивость в растворе.
Реактивы: 1) яичный белок, 1% раствор; 2) уксусная кислота, 1% и 10% растворы; 3) гидроокись натрия, 10% раствор.
Ход определения: в 4 пронумерованные пробирки приливают по 10 капель раствора яичного белка. Затем 1-ю пробирку нагревают до кипения, при этом раствор белка мутнеет, но так как частицы денатурированного белка несут заряд, они в осадок не выпадают. Это связано с тем, что яичный белок имеет кислые свойства (изоэлектрическая точка его рН 4,8) и в нейтральной среде заряжен отрицательно. Во 2-ю пробирку добавляют 1 каплю 1% раствора уксусной кислоты и нагревают до кипения. Белок выпадает в осадок, так как его раствор приближается к изоэлектрической точке и белок теряет заряд (один из факторов устойчивости белка в растворе). В 3-ю пробирку добавляют 1 каплю 10% уксусной кислоты и нагревают до кипения. Осадка не образуется, так как в сильнокислой среде частицы белка приобретают положительный заряд (сохраняется один из факторов устойчивости белка в растворе). В 4-ю пробирку добавляют 1 каплю раствора гидроокиси натрия и нагревают до кипения. Осадок не образуется, поскольку в щелочной среде отрицательный заряд частиц белка увеличивается.
Реакция №3 «Осаждение солями тяжелых металлов»
Принцип: белки при взаимодействии с солями свинца, меди, ртути, серебра и других тяжелых металлов денатурируются и выпадают в осадок. Однако при избытке некоторых солей наблюдается растворение первоначально образовавшегося осадка. Это связано с накоплением ионов металла на поверхности денатурированного белка и появлением положительного заряда на белковой молекуле.
Реактивы: 1) яичный белок, 1% раствор; 2) сульфат меди, 10% раствор; 3) ацетат свинца, 5% раствор, 4) нитрат серебра, 5% раствор.
Ход определения: в 3 пронумерованные пробирки вносят по 5 капель раствора яичного белка. В 1-ю пробирку добавляют 1 каплю сульфата меди. Во 2-ю пробирку добавляют 1 каплю ацетата свинца. В 3-ю пробирку добавляют 1 каплю нитрата серебра. Во всех пробирках выпадает осадок. Затем в первую пробирку добавляют 10 капель сульфата меди и во вторую пробирку добавляют 10 капель ацетата свинца и наблюдают растворение осадка. В третью пробирку вносят 10 капель нитрата серебра – растворение осадка нет.
Реакция образования солей с ионами тяжелых металлов
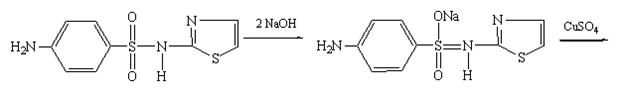
Методика: 0,1 г сульфацетамида натрия растворяют в 3 мл воды, добавляют 1 мл раствора сульфата меди, образуется рсадок голубовато-зеленого цвета, который не меняется при стоянии (отличие от других сульфаниламидов).
Методика: 0,1 г сульфадимезина взбалтывают с 3 мл 0,1 М раствора гидроксида натрия в течение 1-2 минут и фильтруют, к фильтрату прибавляют 1 мл раствора сульфата меди. Образуется осадок желтовато-зеленого цвета, быстро переходящий в коричневый (отличие от других сульфаниламидов).
Аналогично проводят реакции идентификации других сульфаниламидов. Цвет образующегося осадка у сульфатиазола (норсульфазола) грязно-фиолетовый; у этазола - травянисто-зеленый, переходящий в черный; у салазопиридазина - зеленый.
Реакция минерализации
Вещества, имеющие сульфамидную группу, минерализуются кипячением в кислоте азотной концентрированной до кислоты серной, которую обнаруживают по выпадению белого осадка после добавления раствора хлорида бария:
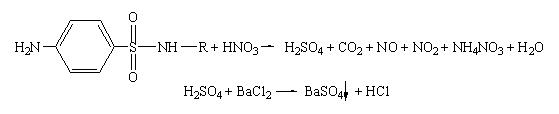
Методика:0,1 г вещества (сульфаниламида) осторожно (под тягой)кипятят 5-10 минут в 5 мл кислоты азотной концентрированной. Затем раствор охлаждают, осторожно вливают в5 мл воды, перемешивают и добавляют раствор хлорида бария. Выпадает белый осадок.
19. ИДЕНТИФИКАЦИЯ СЕРЫ. ВКЛЮЧЕННОЙ В ГЕТЕРОЦИКЛ
Гетероциклически связанная сера при термическом разложении выделяется в виде сероводорода, который можно обнаружить по запаху или с помощью ацетата свинца.
Лекарственные вещества, содержащие серу, включенную в гетероцикл:
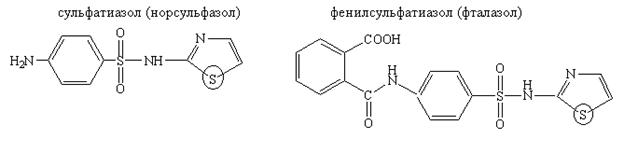
Методика:Впробирку или фарфоровую чашку помещают 0,01 г сульфатиазола и нагревают до образования бурого плава. Одновременно ощущается запах сероводорода.
20. ИДЕНТИФИКАЦИЯ ГАЛОГЕНУГЛЕРОДНОЙ ГРУППЫ
Атомы галогена ворганических веществах связаны с углеродом ковалентной связью, поэтому их обнаруживают после минерализации (термическое разложение, кипячение с кислотой серной концентрированной или сплавление со щелочью).
Идентификация ковалентно связанного йода
Лекарственные вещества, содержащие ковалентно связанный йод:
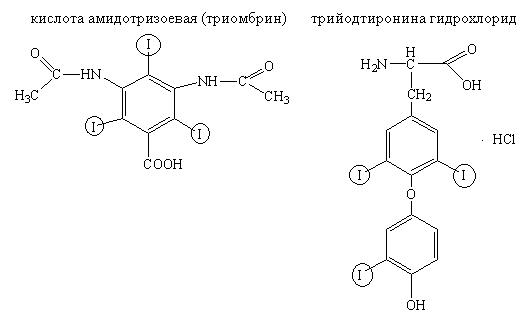
Йодсодержащие органические соединения при нагревании в сухой пробирке или с кислотой серной концентрированной выделяют молекулярный йод (фиолетовые пары):
20.2. Реакция восстановительной минерализации цинковой пылью в щелочной среде
Лекарственные вещества, содержащие ковалентно связанный бром:
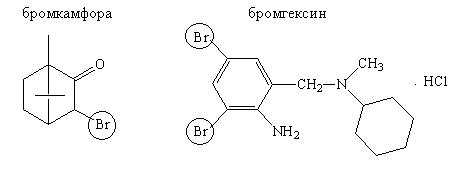
При кипячении галогенсодержащего вещества в растворе гидроксида натрия в присутствии цинковой пыли происходит перевод ковалентно связанного галогена в ионизированное состояние. Затем галогенид щелочного металла идентифицируется соответствующими реакциями:
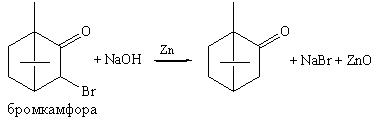

Методика:0,1 г вещества (бромкамфора и др.) кипятят с2 мл раствора гидроксида натрия и 2 г цинковой пыли в течение 3 минут, охлаждают и фильтруют. К фильтрату прибавляют разведенной хлористоводородной кислоты, 1 мл раствора хлорамина и 1 мл хлороформа. Хлороформный слой окрашивается в желто-бурый цвет.
21. ИДЕНТИФИКАЦИЯ СОЕДИНЕНИЙ, СОДЕРЖАЩИХ ДВОЙНУЮ СВЯЗЬ
Соединения, имеющие в углеродной цепи одну или несколько двойных связей ( ).
Лекарственные вещества, содержащие двойную связь:
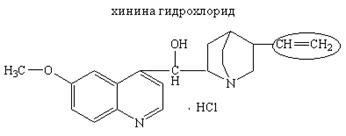
Лекарственные вещества, содержащие двойную связь, способны присоединять галогены:
Методика: Около 0,005 г хинина сульфата или гидрохлорида растворяют в 5 мл воды и прибавляют по каплям бромную воду, которая обесцвечивается.
22. ИДЕНТИФИКАЦИЯ АНИОНОВ ОРГАНИЧЕСКИХ КИСЛОТ
Определение аиетат-иона
Лекарственные вещества, содержащие ацетат-ион:
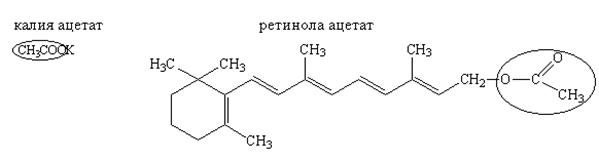
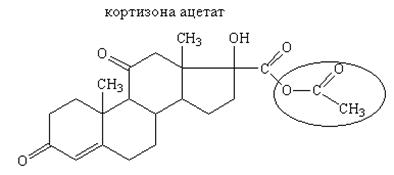
Лекарственные вещества, представляющие собой сложные эфиры спиртов и уксусной кислоты (ретинола ацетат, токоферола ацетат, кортизона ацетат и др.), при нагревании в щелочной или кислой среде гидролизуются с образованием спирта и уксусной кислоты или ацетата натрия:
© 2014-2022 — Студопедия.Нет — Информационный студенческий ресурс. Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав (0.009)
Читайте также:
