Реакция сложных эфиров с активными металлами
Обновлено: 03.05.2024
где R – углеводородный радикал, который может быть разной степени насыщенности, например, предельный или ароматический.
Группу –СНО называют альдегидной.
Кетоны – органические соединения, в молекулах которых содержится карбонильная группа, соединенная с двумя углеводородными радикалами. Общую формулу кетонов можно записать как:
где R и R’ – углеводородные радикалы, например, предельные (алкилы) или ароматические.
Гидрирование альдегидов и кетонов
Альдегиды и кетоны могут быть восстановлены водородом в присутствии катализаторов и нагревании до первичных и вторичных спиртов соответственно:
Окисление альдегидов
Альдегиды легко могут быть окислены даже такими мягкими окислителями, как гидроксид меди и аммиачный раствор оксида серебра.
При нагревании гидроксида меди с альдегидом происходит исчезновение изначального голубого окрашивания реакционной смеси, при этом образуется кирпично-красный осадок оксида одновалентной меди:
В реакции с аммиачным раствором оксида серебра вместо самой карбоновой кислоты образуется ее аммонийная соль, поскольку находящийся в растворе аммиак реагирует с кислотами:
Кетоны в реакцию с гидроксидом меди (II) и аммиачным раствором оксида серебра не вступают. По этой причине эти реакции являются качественными на альдегиды. Так реакция с аммиачным раствором оксида серебра при правильной методике ее проведения приводит к образованию на внутренней поверхности реакционного сосуда характерного серебряного зеркала.
Очевидно, что если мягкие окислители могут окислить альдегиды, то само собой это могут сделать и более сильные окислители, например, перманганат калия или дихромат калия. При использовании данных окислителей в присутствии кислот образуются карбоновые кислоты:
Химические свойства карбоновых кислот
Карбоновыми кислотами называют производные углеводородов, содержащие одну или несколько карбоксильных групп.
Карбоксильная группа:
Как можно видеть, карбоксильная группа состоит из карбонильной группы –С(О)- , соединенной с гидроксильной группой –ОН.
В связи с тем, что к гидроксильной группе непосредственно прикреплена карбонильная, обладающая отрицательным индуктивным эффектом связь О-Н является более полярной, чем в спиртах и фенолах. По этой причине карбоновые кислоты обладают заметно более выраженными, чем спирты и фенолы, кислотными свойствами. В водных растворах они проявляют свойства слабых кислот, т.е. обратимо диссоциируют на катионы водорода (Н+) и анионы кислотных остатков:
Реакции образования солей
С образованием солей карбоновые кислоты реагируют с:
1) металлами до водорода в ряду активности:
3) основными и амфотерными оксидами:
4) основными и амфотерными гидроксидами металлов:
5) солями более слабых кислот – карбонатами и гидрокарбонатами, сульфидами и гидросульфидами, солями высших (с большим числом атомов углерода в молекуле) кислот:
Систематические и тривиальные названия некоторых кислот и их солей представлены в следующей таблице:
| Формула кислоты | Название кислоты тривиальное/систематическое | Название соли тривиальное/систематическое |
| HCOOH | муравьиная/ метановая | формиат/ метаноат |
| CH3COOH | уксусная/ этановая | ацетат/ этаноат |
| CH3 CH2COOH | пропионовая/ пропановая | пропионат/ пропаноат |
| CH3 CH2 CH2COOH | масляная/ бутановая | бутират/ бутаноат |
Следует помнить и обратное: сильные минеральные кислоты вытесняют карбоновые кислоты из их солей как более слабые:
Реакции с участием ОН группы
Карбоновые кислоты вступают в реакцию этерификации с одноатомными и многоатомными спиртами в присутствии сильных неорганических кислот, при этом образуются сложные эфиры:
Данного типа реакции относятся к обратимым, в связи с чем с целью смещения равновесия в сторону образования сложного эфира их следует осуществлять, отгоняя более летучий сложный эфир при нагревании.
Обратный реакции этерификации процесс называют гидролизом сложного эфира:
Необратимо данная реакция протекает в присутствии щелочей, поскольку образующаяся кислота реагирует с гидроксидом металла с образованием соли:
Реакции замещения атомов водорода в углеводородном заместителе
При проведении реакций карбоновых с хлором или бромом в присутствии красного фосфора при нагревании происходит замещение атомов водорода при α-атоме углерода на атомы галогена:
В случае большей пропорции галоген/кислота может произойти и более глубокое хлорирование:
Реакции разрушения карбоксильной группы (декарбоксилирование)
Особые химические свойства муравьиной кислоты
Молекула муравьиной кислоты, несмотря на свои малые размеры, содержит сразу две функциональные группы:
В связи с этим она проявляет не только свойства кислот, но также и свойства альдегидов:
При действии концентрированной серной кислоты муравьиная кислота разлагается на воду и угарный газ:
Сложные эфиры: способы получения и свойства
Сложные эфиры: способы получения, химические и физические свойства, строение.
| Сложные эфиры – это органические вещества, в молекулах которых углеводородные радикалы соединены через карбоксильную группу -СОО-, а именно R1-COOH-R2. |
Общая формула предельных сложных эфиров: СnH2nO2
Классификация сложных эфиров
По числу карбоксильных групп:
- сложные эфиры многоатомных спиртов — содержат две и более карбоксильные группы -СОО-.
| Например, тристеарат глицерина |

- Сложные эфиры многоосновных органических кислот.
Например, общая формула сложных эфиров двухосновных карбоновых кислот CnH2n-2O4
Номенклатура сложных эфиров
В названии сложного эфира сначала указывают алкильную группу, связанную с кислородом, затем кислоту, заменяя суффикс в названии кислоты (-овая кислота) на суффикс -оат.
| Название сложного эфира | Тривиальное название | Формула эфира |
| Метилметаноат | Метилформиат | HCOOCH3 |
| Этилметаноат | Этилформиат | HCOOC2H5 |
| Метилэтаноат | Метилацетат | CH3COOCH3 |
| Этилэтаноат | Этилацетат | CH3COOC2H5 |
| Пропилэтаноат | Пропилацетат | CH3COOCH2CH2CH3 |
Химические свойства сложных эфиров
. 1. Гидролиз
| Сложные эфиры устойчивы в нейтральной среде, но легко разлагаются при нагревании в присутствии кислот или в присутствии щелочей. |
В присутствии кислот гидролиз сложных эфиров протекает как реакция, обратная этерификации. при гидролизе сложных эфиров образуются спирты и карбоновые кислоты.
R-COO-R’ + H2O = R-COOH + R’-OH
Например , при гидролизе метилацетата образуются уксусная кислота и метанол.

При щелочном гидролизе сложных эфиров образуются соли карбоновых кислот и спирты.
Например , при щелочном гидролизе этилформиата образуются этанол и формиат натрия:

При щелочном гидролизе этилацетата образуются ацетат и этанол:

Щелочной гидролиз сложных эфиров — реакция, имеющая промышленное значение. Гидролиз жиров в присутствии оснований — древнейший способ получения мыла. Первые способы получения мыла связаны со смешиванием жира с золой. Один из основных компонентов животного жира — тристеарат глицерина. В щелочной среде тристеарат глицерина разлагается на глицерин и соль стеариновой кислоты:

2. Переэтерификация
Переэтерификация — это реакция превращения одного сложного эфира в другой под действием соответствующих спиртов в присутствии катализатора (кислоты или основания)
R-COO-CH3 + R’-OH = R-COOR’ + CH3-OH
3.Восстановление сложных эфиров
Сложные эфиры восстанавливаются с разрывом связи С-О карбоксильной группы. При этом образуется смесь спиртов.
| Например, этилбензоат восстанавливается литийалюминийгидридом до бензилового спирта и этанола |
Получение сложных эфиров
1. Этерификация карбоновых кислот спиртами
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.

| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |

2. Соли карбоновых кислот с галогеналканами
При взаимодействии солей карбоновых кислот с галогеналканами образуются сложные эфиры.
Реакция сложных эфиров с активными металлами
Большинство реакций сложных эфиров связано с нуклеофильной атакой по карбонильному атому углерода и замещением алкоксигруппы.
1. Реакция гидролиза (омыления)
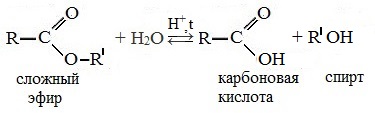
Сложные эфиры легко гидролизуются (омыляются) на исходный спирт и кислоту водой (обратимо) или щелочами (необратимо, так как образующаяся карбоновая кислота превращается в соль).
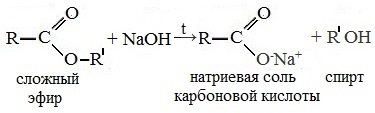
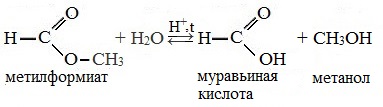
Реакция этерификации в условиях кислотного катализа обратима. Обратный процесс – расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта – называют гидролизом сложного эфира.
Гидролиз в присутствии щелочи протекает необратимо (т.к. образующийся отрицательно заряженный карбоксилат-анион RCOO – не вступает в реакцию с нуклеофильным реагентом – спиртом).
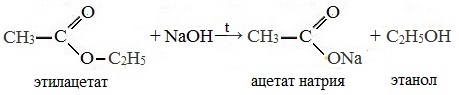
Эта реакция называется омылением сложных эфиров (по аналогии со щелочным гидролизом сложноэфирных связей в жирах при получении мыла).
2. Реакция присоединения
Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт, способны к реакциям присоединения.
3. Реакция гидрирования (восстановления)
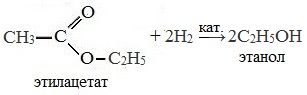
Восстановление сложных эфиров водородом приводит к образованию двух спиртов:
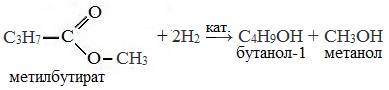
4. Реакция образования амидов
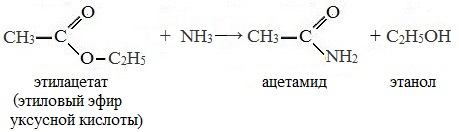
Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты:
5. Реакция горения

Горение сложных эфиров происходит с образованием углекислого газа и воды:
Многоатомные спирты по химическим свойствам сходны с одноатомными спиртами. Однако в химических свойствах многоатомных спиртов есть особенности, обусловленные присутствием в молекуле двух и более гидроксильных групп.
Если в многоатомных спиртах ОН-группы находятся при соседних атомах углерода, то вследствие взаимного влияния этих групп (–I-эффект одной ОН-группы по отношению к другой), разрыв связи О-Н происходит легче, чем в одноатомных спиртах.
Кислотные свойства
1. С щелочными металлами
Многоатомные спирты с ОН-группами у соседних атомов углерода (этиленгликоль, глицерин и т.п.) вследствие взаимного влияния атомов (-I-эффект ОН-групп) являются более сильными кислотами, чем одноатомные спирты. Они образуют соли не только в реакциях с активными металлами, но и под действием их гидроксидов.
Видеоопыт «Взаимодействие глицерина с металлическим натрием»
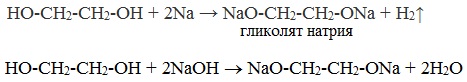
2. С гидроксидом меди(II) — качественная реакция!
Наличие нескольких ОН-групп в молекулах многоатомных спиртов обусловливает увеличение подвижности и способности к замещению гидроксильных атомов водорода по сравнению с одноатомными спиртами. Поэтому, в отличие от алканолов, многоатомные спирты взаимодействуют с гидроксидами тяжелых металлов (например, с гидроксидом меди (II) Cu (OH)2).
Продуктами этих реакций являются комплексные («хелатные») соединения, в молекулах которых атом тяжелого металла образует как обычные ковалентные связи Ме–О за счет замещения атомов водорода ОН-групп, так и донорно-акцепторные связи Ме←О за счет неподеленных пар атомов кислорода других ОН-групп.
При взаимодействии многоатомного спирта с гидроксидом меди (II) в щелочной среде образуется темно-синий раствор (гликолят меди и глицерат меди). Эта реакция является качественной реакцией на многоатомные спирты.
Видеоопыт «Взаимодействие многоатомных спиртов с гидроксидом меди (II)»
Гликолят меди
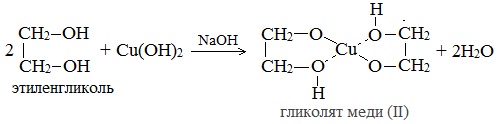
Глицерат меди
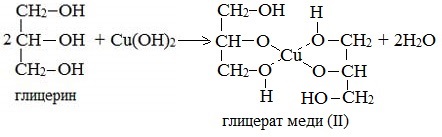
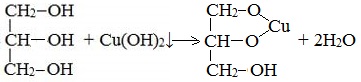
По аналогии с алкоголятами соли двухатомных спиртов называются гликолятами, а трехатомных — глицератами.
Многоатомные спирты с несоседними ОН-группами подобны по свойствам одноатомным спиртам (не проявляется взаимное влияние групп ОН).
Основные свойства
1. С галогенводородными кислотами
При взаимодействии этиленгликоля с галогеноводородами (НСl, HBr) одна гидроксильная группа замещается на галоген:
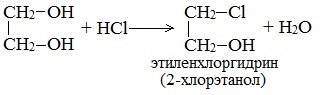
Вторая гидроксогруппа замещается труднее, под действием РСl5.
2. Реакция этерификации (с органическими и неорганическими кислотами)
Многоатомные спирты взаимодействуют с органическими и неорганическими кислотами с образованием сложных эфиров.
С карбоновыми кислотами глицерин образует сложные эфиры – жиры и масла.
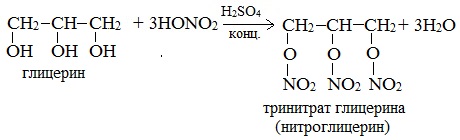
При взаимодействии глицерина с азотной кислотой в присутствии концентрированной серной кислоты образуется нитроглицерин (тринитрат глицерина):
Тринитрат глицерина (тривиальное название – нитроглицерин) – тяжелая маслянистая жидкость, известное взрывчатое вещество (взрывается от легкого сотрясения и нагревания). И одновременно лекарственный препарат (спиртовые растворы его не взрываются): 1% спиртовой раствор нитроглицерина применяется в медицине в качестве средства расширяющего сосуды сердца.
3. Окисление
Видеоопыт «Взаимодействие глицерина с кристаллическим перманганатом калия»
Какая разница между третичным и трехатомным спиртом?
Третичным называется спирт, в котором функциональная группа -ОН связана с третичным атомом углерода. Трехатомным называют спирт, в котором имеется три функциональных группы – ОН.
3.5. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола.
В зависимости от типа углеводородного радикала, а также в некоторых случаях особенностей прикрепления группы -ОН к этому углеводородному радикалу соединения с гидроксильной функциональной группой разделяют на спирты и фенолы.
Спиртами называют соединения, в которых гидроксильная группа соединена с углеводородным радикалом, но не присоединена непосредственно к ароматическому ядру, если таковой имеется в структуре радикала.
Если в структуре углеводородного радикала содержится ароматическое ядро и гидроксильная группа, при том соединена непосредственно с ароматическим ядром, такие соединения называют фенолами.
Почему же фенолы выделяют в отдельный от спиртов класс? Ведь, например, формулы
очень похожи и создают впечатление веществ одного класса органических соединений.
Однако непосредственное соединение гидроксильной группы с ароматическим ядром существенно влияет на свойства соединения, поскольку сопряженная система π-связей ароматического ядра сопряжена также и с одной из неподеленных электронных пар атома кислорода. Из-за этого в фенолах связь О-Н более полярна по сравнению со спиртами, что существенно повышает подвижность атома водорода в гидроксильной группе. Другими словами, у фенолов значительно ярче, чем у спиртов выражены кислотные свойства.
Химические свойства спиртов
Одноатомные спирты
Реакции замещения
Замещение атома водорода в гидроксильной группе
1) Спирты реагируют со щелочными, щелочноземельными металлами и алюминием (очищенным от защитной пленки Al2O3), при этом образуются алкоголяты металлов и выделяется водород:
Образование алкоголятов возможно только при использовании спиртов, не содержащих растворенной в них воды, так как в присутствии воды алкоголяты легко гидролизуются:
2) Реакция этерификации
Реакцией этерификации называют взаимодействие спиртов с органическими и кислородсодержащими неорганическими кислотами, приводящее к образованию сложных эфиров.
Такого типа реакции являются обратимыми, поэтому для смещения равновесия в сторону образования сложного эфира, реакцию желательно проводить при нагревании, а также в присутствии концентрированной серной кислоты как водоотнимающего агента:
Замещение гидроксильной группы
1) При действии на спирты галогеноводородных кислот происходит замещение гидроксильной группы на атом галогена. В результате такой реакции образуются галогеналканы и вода:
2) При пропускании смеси паров спирта с аммиаком через нагретые оксиды некоторых металлов (чаще всего Al2O3) могут быть получены первичные, вторичные или третичные амины:
Тип амина (первичный, вторичный, третичный) будет в некоторой степени зависеть от соотношения исходного спирта и аммиака.
Реакции элиминирования (отщепления)
Дегидратация
Дегидратация, фактически подразумевающая отщепление молекул воды, в случае спиртов различается на межмолекулярную дегидратацию и внутримолекулярную дегидратацию.
При межмолекулярной дегидратации спиртов одна молекула воды образуется в результате отщепления атома водорода от одной молекулы спирта и гидроксильной группы — от другой молекулы.
В результате этой реакции образуются соединения, относящиеся к классу простых эфиров (R-O-R):
Внутримолекулярная дегидратация спиртов протекает таким образом, что одна молекула воды отщепляется от одной молекулы спирта. Данный тип дегидратации требует несколько более жестких условий проведения, заключающихся в необходимости использования заметно более сильного нагревания по сравнению с межмолекулярной дегидратацией. При этом из одной молекулы спирта образуется одна молекула алкена и одна молекула воды:
Поскольку молекула метанола содержит только один атом углерода, для него невозможна внутримолекулярная дегидратация. При дегидратации метанола возможно образование только простого эфира (CH3-O-CH3).
Нужно четко усвоить тот факт, что в случае дегидратации несимметричных спиртов внутримолекулярное отщепление воды будет протекать в соответствии с правилом Зайцева, т.е. водород будет отщепляться от наименее гидрированного атома углерода:
Дегидрирование спиртов
а) Дегидрирование первичных спиртов при нагревании в присутствии металлической меди приводит к образованию альдегидов:
б) В случае вторичных спиртов аналогичные условия приведут у образованию кетонов:
в) Третичные спирты в аналогичную реакцию не вступают, т.е. дегидрированию не подвергаются.
Реакции окисления
Горение
Спирты легко вступают в реакцию горения. При этом образуется большое количество тепла:
Неполное окисление
Неполное окисление первичных спиртов может приводить к образованию альдегидов и карбоновых кислот.
В случае неполного окисления вторичных спиртов возможно образование только кетонов.
Неполное окисление спиртов возможно при действии на них различных окислителей, например, таких, как кислород воздуха в присутствии катализаторов (металлическая медь), перманганат калия, дихромат калия и т.д.
При этом из первичных спиртов могут быть получены альдегиды. Как можно заметить, окисление спиртов до альдегидов, по сути, приводит к тем же органическим продуктам, что и дегидрирование:
Следует отметить, что при использовании таких окислителей, как перманганат калия и дихромат калия в кислой среде возможно более глубокое окисление спиртов, а именно до карбоновых кислот. В частности, это проявляется при использовании избытка окислителя при нагревании. Вторичные спирты могут в этих условиях окислиться только до кетонов.
ПРЕДЕЛЬНЫЕ МНОГОАТОМНЫЕ СПИРТЫ
Замещение атомов водорода гидроксильных групп
Многоатомные спирты так же, как и одноатомные реагируют со щелочными, щелочноземельными металлами и алюминием (очищенным от пленки Al2O3); при этом может заместиться разное число атомов водорода гидроксильных групп в молекуле спирта:
2. Поскольку в молекулах многоатомных спиртов содержится несколько гидроксильных групп, они оказывают влияние друг на друга за счет отрицательного индуктивного эффекта. В частности, это приводит к ослаблению связи О-Н и повышению кислотных свойств гидроксильных групп.
Большая кислотность многоатомных спиртов проявляется в том, что многоатомные спирты, в отличие от одноатомных, реагируют с некоторым гидроксидами тяжелых металлов. Например, нужно запомнить тот факт, что свежеосажденный гидроксид меди реагирует с многоатомными спиртами с образованием ярко-синего раствора комплексного соединения.
Так, взаимодействие глицерина со свежеосажденными гидроксидом меди приводит к образованию ярко-синего раствора глицерата меди:
Данная реакция является качественной на многоатомные спирты. Для сдачи ЕГЭ достаточно знать признаки этой реакции, а само уравнение взаимодействия уметь записывать необязательно.
3. Так же, как и одноатомные спирты, многоатомные могут вступать в реакцию этерификации, т.е. реагируют с органическими и кислородсодержащими неорганическими кислотами с образованием сложных эфиров. Данная реакция катализируется сильными неорганическими кислотами и является обратимой. В связи с этим при осуществлении реакции этерификации образующийся сложный эфир отгоняют из реакционной смеси, чтобы сместить равновесие вправо по принципу Ле Шателье:
Если в реакцию с глицерином вступают карбоновые кислоты с большим числом атомов углерода в углеводородном радикале, получающиеся в результате такой реакции, сложные эфиры называют жирами.
В случае этерификации спиртов азотной кислотой используют так называемую нитрующую смесь, представляющую собой смесь концентрированных азотной и серной кислот. Реакцию проводят при постоянном охлаждении:
Сложный эфир глицерина и азотной кислоты, называемый тринитроглицерином, является взрывчатым веществом. Кроме того, 1%-ный раствор данного вещества в спирте обладает мощным сосудорасширяющим действием, что используется при медицинских показаниях для предотвращения приступа инсульта или инфаркта.
Замещение гидроксильных групп
Реакции данного типа протекают по механизму нуклеофильного замещения. К взаимодействиям такого рода относится реакция гликолей с галогеноводородами.
Так, например, реакция этиленгликоля с бромоводородом протекает с последовательным замещением гидроксильных групп на атомы галогена:
Химические свойства фенолов
Как уже было сказано в самом начале данной главы, химические свойства фенолов заметно отличаются от химических свойств спиртов. Связано это с тем, что одна из неподеленных электронных пар атома кислорода в гидроксильной группе сопряжена с π-системой сопряженных связей ароматического кольца.
Реакции с участием гидроксильной группы
Кислотные свойства
Фенолы являются более сильными кислотами, чем спирты, и в водном растворе в очень небольшой степени диссоциированы:
Большая кислотность фенолов по сравнению со спиртами в плане химических свойств выражается в том, что фенолы, в отличие от спиртов, способны реагировать со щелочами:
Однако, кислотные свойства фенола выражены слабее, чем даже у одной из самых слабых неорганических кислот – угольной. Так, в частности, углекислый газ, при пропускании его через водный раствор фенолятов щелочных металлов, вытесняет из последних свободный фенол как еще более слабую, чем угольная, кислоту:
Очевидно, что любой другой более сильной кислотой фенол также будет вытесняться из фенолятов:
3) Фенолы являются более сильными кислотами, чем спирты, а спирты при этом реагируют с щелочными и щелочноземельными металлами. В связи с этим очевидно, что и фенолы будут реагировать с указанными металлами. Единственное, что в отличие от спиртов, реакция фенолов с активными металлами требует нагревания, так как и фенолы, и металлы являются твердыми веществами:
Реакции замещения в ароматическом ядре
Гидроксильная группа является заместителем первого рода, и это значит, что она облегчает протекание реакций замещения в орто- и пара-положениях по отношению к себе. Реакции с фенолом протекают в намного более мягких условиях по сравнению с бензолом.
Галогенирование
Реакция с бромом не требует каких-либо особых условий. При смешении бромной воды с раствором фенола мгновенно образуется белый осадок 2,4,6-трибромфенола:
Нитрование
При действии на фенол смеси концентрированных азотной и серной кислот (нитрующей смеси) образуется 2,4,6-тринитрофенол – кристаллическое взрывчатое вещество желтого цвета:
Реакции присоединения
Поскольку фенолы являются ненасыщенными соединениями, возможно их гидрирование в присутствии катализаторов до соответствующих спиртов:
Читайте также:
