Самые сильные металлические свойства
Обновлено: 13.05.2024
Презентация на тему: " У какого элемента самые сильные металлические свойства? У какого элемента самые сильные неметаллические свойства? Как определить, главная или побочная." — Транскрипт:
1 У какого элемента самые сильные металлические свойства? У какого элемента самые сильные неметаллические свойства? Как определить, главная или побочная подгруппа? У какого элемента самая большая электроотрицательность? У какого элемента самый большой радиус атома? у франция у фтора у франция если под верхним элементом - главная
2 У какого элемента оксид и гидроксид проявляют самые сильные основные свойства? У какого элемента оксид и гидроксид проявляют самые сильные кислотные свойства? Какой элемент образует самую сильную бескислородную кислоту? Как определить металл/неметалл? у франция у хлора астат металлы – ниже диагонали B-At + все элементы побоч. подгрупп
3 Перечислите простые вещества, существующие в виде двухатомных (7 веществ) и трехатомных молекул (1 вещество) H2N2O2O3H2N2O2O3 F 2 Cl 2 Br 2 I 2
Похожие презентации
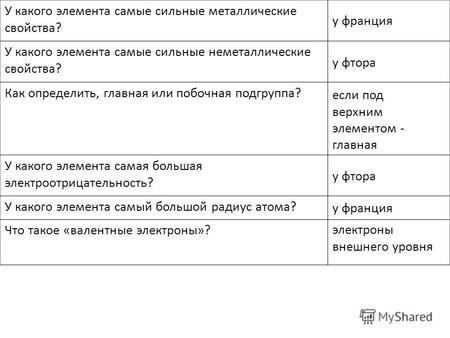
У какого элемента самые сильные металлические свойства? У какого элемента самые сильные неметаллические свойства? Как определить, главная или побочная.
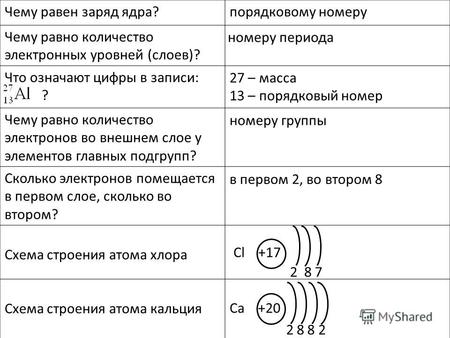
Чему равен заряд ядра? Чему равно количество электронных уровней (слоев)? Что означают цифры в записи: ? Чему равно количество электронов во внешнем слое.
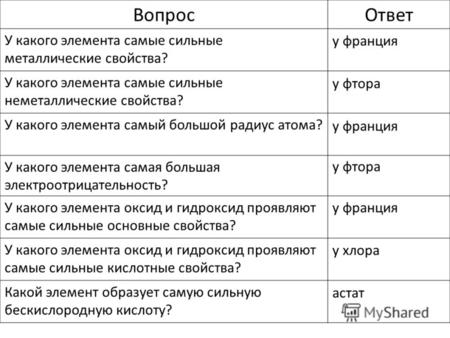
ВопросОтвет У какого элемента самые сильные металлические свойства? У какого элемента самые сильные неметаллические свойства? У какого элемента самый большой.

2) C B Li 3) Bе Mg Ca 4) Р Si Al А2. Изменение свойств от металлических к неметаллическим происходит в ряду 1) Mg Al Si Демо-версия, 2008.

Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева.
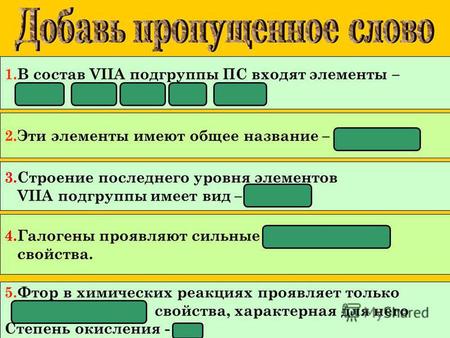
1.В состав VΙΙА подгруппы ПС входят элементы – фтор, хлор, бром, йод, астат. 2.Эти элементы имеют общее название – галогены. 3.Строение последнего уровня.

Генетическая связь между основными классами неорганических соединений.

ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ - НЕМЕТАЛЛЫ. Положение неметаллов в периодической таблице В С N O F Si P S Cl Si P S Cl As Se Br As Se Br Te I Te I At At неМе>> В.

Неметаллы: атомы и простые вещества Кислород, озон, воздух МОУ Навлинская СОШ 1 Учитель химии Кожемяко Г.С.

Строение атома Si + 14 ) ) ) 2 e 8e 4e --- ЗАПОМНИ. Порядковый номер - заряд ядра (число протонов) периода – число электронных уровней(слоёв) Если элемент.

Электроотрицательность химических элементов. Виды химической связи.

ЕГЭ Неметаллические(окислительные) свойства и ЭО элементов возрастают, так как увеличивается число внешних электронов и уменьшается радиус атомов Значительно.
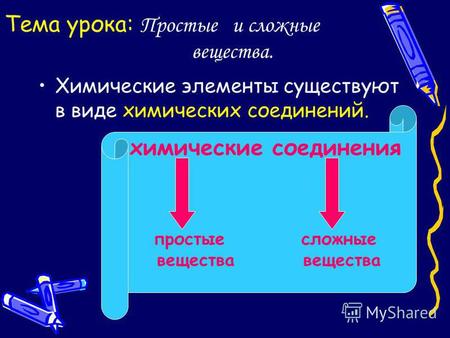
Тема урока: Простые и сложные вещества. Химические элементы существуют в виде химических соединений. химические соединения простые сложные вещества вещества.

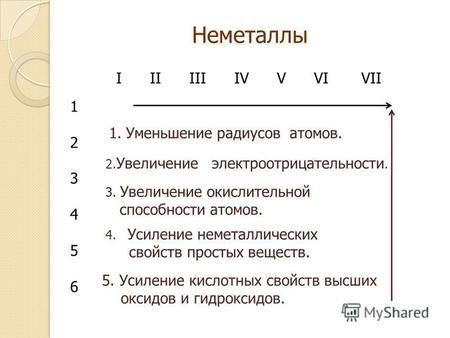
НЕМЕТАЛЛЫ ПОЛОЖЕНИЕ НЕМЕТАЛЛОВ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ Если провести диагональ от бора к астату, то неметаллы будут находиться справа от диагонали. Всего.

Неметаллы Общая характеристика неметаллов Химические элементы МеталлыНеметаллы Положение в Периодической системе Особенности строения атомов 1. Количество.

Презентация к уроку по химии (8 класс) на тему: Презентация по теме "Неметаллы"

ХАРАКТЕРИСТИКА ЭЛЕМЕНТА ПО ПОЛОЖЕНИЮ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ.

Периодический закон. Периодическая система химических элементов.
Методическая разработка по химии (11 класс) на тему: презентация к уроку по теме "Галогены" 9 класс
Усиление металлических и неметаллических свойств в таблице
Периодическая таблица Дмитрия Ивановича Менделеева очень удобна и универсальна в своём использовании. По ней можно определить некоторые характеристики элементов, и что самое удивительное, предсказать некоторые свойства ещё неоткрытых, не обнаруженных учёными, химических элементов (например, мы знаем некоторые свойства предполагаемого унбигексия, хотя его ещё не открыли и не синтезировали).
Что такое металлические и неметаллические свойства
Эти свойства зависят от способности элемента отдавать или притягивать к себе электроны. Важно запомнить одно правило, металлы – отдают электроны, а неметаллы – принимают. Соответственно металлические свойства – это способность определённого химического элемента отдавать свои электроны (с внешнего электронного облака) другому химическому элементу. Для неметаллов всё в точности наоборот. Чем легче неметалл принимает электроны, тем выше его неметаллические свойства.
Металлы никогда не примут электроны другого химического элемента. Такое характерно для следующих элементов;
- натрия;
- калия;
- лития;
- франция и так далее.
С неметаллами дела обстоят похожим образом. Фтор больше всех остальных неметаллов проявляет свои свойства, он может только притянуть к себе частицы другого элемента, но ни при каких условиях не отдаст свои. Он обладает наибольшими неметаллическими свойствами. Кислород (по своим характеристикам) идёт сразу же после фтора. Кислород может образовывать соединение с фтором, отдавая свои электроны, но у других элементов он забирает отрицательные частицы.
Список неметаллов с наиболее выраженными характеристиками:
Неметаллические и металлические свойства объясняются тем, что все химические вещества стремятся завершить свой энергетический уровень. Для этого на последнем электронном уровне должно быть 8 электронов. У атома фтора на последней электронной оболочке 7 электронов, стремясь завершить ее, он притягивает ещё один электрон. У атома натрия на внешней оболочке один электрон, чтобы получить 8, ему проще отдать 1, и на последнем уровне окажется 8 отрицательно заряженных частиц.
Благородные газы не взаимодействуют с другими веществами именно из-за того, что у них завершён энергетический уровень, им не нужно ни притягивать, ни отдавать электроны.

Как изменяются металлические свойства в периодической системе
Периодическая таблица Менделеева состоит из групп и периодов. Периоды располагаются по горизонтали таким образом, что первый период включает в себя: литий, бериллий, бор, углерод, азот, кислород и так далее. Химические элементы располагаются строго по увеличению порядкового номера.
Группы располагаются по вертикали таким образом, что первая группа включает в себя: литий, натрий, калий, медь, рубидий, серебро и так далее. Номер группы указывает на количество отрицательных частиц на внешнем уровне определённого химического элемента. В то время, как номер периода указывает на количество электронных облаков.
Металлические свойства усиливаются в ряду справа налево или, по-другому, ослабевают в периоде. То есть магний обладает большими металлическими свойствами, чем алюминий, но меньшими, нежели натрий. Это происходит потому, что в периоде количество электронов на внешней оболочке увеличивается, следовательно, химическому элементу сложнее отдавать свои электроны.
В группе все наоборот, металлические свойства усиливаются в ряду сверху вниз. Например, калий проявляется сильнее, чем медь, но слабее, нежели натрий. Объяснение этому очень простое, в группе увеличивается количество электронных оболочек, а чем дальше электрон находится от ядра, тем проще элементу его отдать. Сила притяжения между ядром атома и электроном в первой оболочке больше, чем между ядром и электроном в 4 оболочке.
Сравним два элемента – кальций и барий. Барий в периодической системе стоит ниже, чем кальций. А это значит, что электроны с внешней оболочки кальция расположены ближе к ядру, следовательно, они лучше притягиваются, чем у бария.
Сложнее сравнивать элементы, которые находятся в разных группах и периодах. Возьмём, к примеру, кальций и рубидий. Рубидий будет лучше отдавать отрицательные частицы, чем кальций. Так как он стоит ниже и левее. Но пользуясь только таблицей Менделеева нельзя однозначно ответить на этот вопрос сравнивая магний и скандий (так как один элемент ниже и правее, а другой выше и левее). Для сравнения этих элементов понадобятся специальные таблицы (например, электрохимический ряд напряжений металлов).

Как изменяются неметаллические свойства в периодической системе
Неметаллические свойства в периодической системе Менделеева изменяются с точностью до наоборот, нежели металлические. По сути, эти два признака являются антагонистами.
Неметаллические свойства усиливаются в периоде (в ряду справа налево). Например, сера способна меньше притягивать к себе электроны, чем хлор, но больше, нежели фосфор. Объяснение этому явлению такое же. Количество отрицательно заряженных частиц на внешнем слое увеличивается, и поэтому элементу легче закончить свой энергетический уровень.
Неметаллические свойства уменьшаются в ряду сверху вниз (в группе). Например, фосфор способен отдавать отрицательно заряженные частицы больше, чем азот, но при этом способен лучше притягивать, нежели мышьяк. Частицы фосфора притягиваются к ядру лучше, чем частицы мышьяка, что даёт ему преимущество окислителя в реакциях на понижение и повышение степени окисления (окислительно-восстановительные реакции).
Сравним, к примеру, серу и мышьяк. Сера находится выше и правее, а это значит, что ей легче завершить свой энергетический уровень. Как и металлы, неметаллы сложно сравнивать, если они находятся в разных группах и периодах. Например, хлор и кислород. Один из этих элементов выше и левее, а другой ниже и правее. Для ответа придётся обратиться к таблице электроотрицательности неметаллов, из которой мы видим, что кислород легче притягивает к себе отрицательные частицы, нежели хлор.

Периодическая таблица Менделеева помогает узнать не только количество протонов в атоме, атомную массу и порядковый номер, но и помогает определить свойства элементов.
Видео
Видео поможет вам разобраться в закономерности свойств химических элементов и их соединений по периодам и группам.
Поставь лайк, это важно для наших авторов, подпишись на наш канал в Яндекс.Дзен и вступай в группу Вконтакте
У какого элемента самые сильные металлические свойства? У какого элемента самые сильные неметаллические свойства? Как определить, главная или побочная. - презентация
1 У какого элемента самые сильные металлические свойства? У какого элемента самые сильные неметаллические свойства? Как определить, главная или побочная подгруппа? У какого элемента самая большая электроотрицательность? У какого элемента самый большой радиус атома? Что такое «валентные электроны»? у франция у фтора у франция если под верхним элементом - главная электроны внешнего уровня
2 У какого элемента оксид и гидроксид проявляют самые сильные основные свойства? У какого элемента оксид и гидроксид проявляют самые сильные кислотные свойства? Какой элемент образует самую сильную бескислородную кислоту (водородное соединение)? Как определить металл/неметалл? Перечислите простые вещества, существующие в виде двухатомных (7 веществ) и трехатомных молекул (1 вещество) у франция у хлора астат металлы – ниже диагонали B-At + все элементы побоч. подгрупп H2N2O2O3H2N2O2O3 F 2 Cl 2 Br 2 I 2


12.08.2015 А 2. Периодическая система. Разработано учителем химии МОБУ «Лицей 5» г. Оренбурга 9 класс Подготовка к ГИА.

Характеристика элемента Составьте характеристику элемента ….. по следующему плану:

Презентация к уроку по химии (9 класс) на тему: Общая характеристика галогенов на основе положения химических элементов в периодической системе

Характеристика свойств атомов и их соединений по положению в ПСХЭ.

Общая характеристика элементов VII группы главной подгруппы (Галогены)
Подбираем похожую презентацию.
ВопросОтвет У какого элемента самые сильные металлические свойства? У какого элемента самые сильные неметаллические свойства? У какого элемента самый большой.
ВопросОтвет У какого элемента самые сильные металлические свойства? У какого элемента самые сильные неметаллические свойства? У какого элемента самый большой. - презентация
Презентация на тему: " ВопросОтвет У какого элемента самые сильные металлические свойства? У какого элемента самые сильные неметаллические свойства? У какого элемента самый большой." — Транскрипт:
1 ВопросОтвет У какого элемента самые сильные металлические свойства? У какого элемента самые сильные неметаллические свойства? У какого элемента самый большой радиус атома? У какого элемента самая большая электроотрицательность? У какого элемента оксид и гидроксид проявляют самые сильные основные свойства? У какого элемента оксид и гидроксид проявляют самые сильные кислотные свойства? Какой элемент образует самую сильную бескислородную кислоту? у франция у фтора у франция у фтора у франция у хлора астат

Периодический закон и периодическая таблица Дмитрия Ивановича Менделеева Домашнее задание § 2 9 стр 24 (письменно)

Оксиды. Оксиды Это сложные вещества, состоящие из 2 элементов, один из которых- кислород. Общая формула XO.

Щелочноземельные металлы. Общая характеристика Щелочноземельные металлы: Be, Mg, Ca, Sr, Ba, Ra. Элементы II группы главной подгруппы. S – элементы. Имеют.

б) Состав атома P + = 7 (порядковый номер) ē = P + = 7 n 0 = Ar - = 14-7=7.

Тест в формате ГИА 1. Два неспаренных электрона на внешнем электронном уровне находится у атома: 1)натрия 3) фтора 2) алюминия 4) серы Три электрона на.

Как плавиковая кислота разъедает стекло. Выполнил: Бойко Станислав Игоревич Руководитель: Володина Наталья Юрьевна Экзаменационный проект.

Подготовка к контрольной работе «Строение атома. Периодический закон»

Периодический закон и периодическая система химических элементов Д.И. Менделеева. Строение атома.
Периодический закон и периодическая таблица Дмитрия Ивановича Менделеева Домашнее задание § 2 9 стр 24 (письменно)
Читайте также:
