Самый сильный восстановитель из металлов
Обновлено: 04.10.2024
АВосстановитель Это вещество, которое выполняет функцию восстановления окислителя в реакции восстановления оксида. Восстановители являются донорами электронов по своей природе, обычно это вещества с самым низким уровнем окисления и с большим количеством электронов.
Существует химическая реакция, в которой степень окисления атомов меняется. Эти реакции включают процесс восстановления и процесс дополнительного окисления. В этих реакциях один или несколько электронов от одной молекулы, атома или иона передаются другой молекуле, атому или иону. Это включает производство реакции восстановления оксида.
Во время процесса восстановления оксида тот элемент или соединение, которое теряет (или отдает) свой электрон (или электроны), называется восстановителем, в отличие от того окислителя, который является рецептором электронов. Тогда говорят, что восстановители восстанавливают окислитель, а окислитель окисляет восстановитель.
Лучшие или самые сильные восстановители - это те, которые имеют наибольший атомный радиус; то есть они имеют большее расстояние от ядра до окружающих его электронов.
Восстановителями обычно являются металлы или отрицательные ионы. Обычные восстановители включают аскорбиновую кислоту, серу, водород, железо, литий, магний, марганец, калий, натрий, витамин С, цинк и даже экстракт моркови.
Что такое восстановители?
Как уже упоминалось, восстановители отвечают за восстановление окислителя, когда происходит реакция восстановления оксида.
Простая и типичная реакция окислительно-восстановительной реакции - это реакция аэробного клеточного дыхания:
В этом случае, когда глюкоза (C6ЧАС12ИЛИ6) реагирует с кислородом (O2), глюкоза ведет себя как восстановитель, отдавая электроны кислороду, то есть он окисляется, а кислород становится окислителем.
В органической химии лучшими восстановителями считаются те реагенты, которые обеспечивают водород (H2) к реакции. В этой области химии под реакцией восстановления понимается добавление водорода к молекуле, хотя приведенное выше определение (реакции восстановления оксида) также применимо.
Факторы, определяющие силу восстановителя
Чтобы вещество считалось «сильным», предполагается, что это молекулы, атомы или ионы, которые более или менее легко теряют свои электроны.
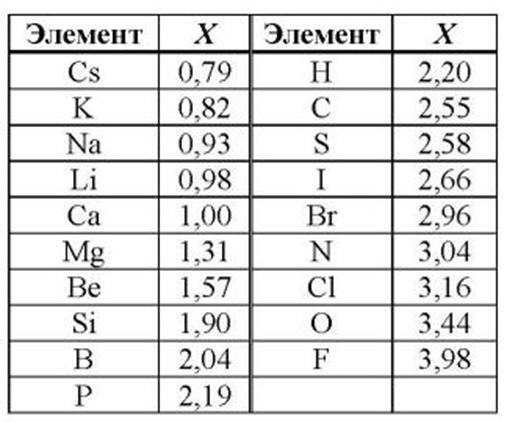
Для этого существует ряд факторов, которые необходимо учитывать, чтобы распознать силу, которую может иметь восстановитель: электроотрицательность, атомный радиус, энергия ионизации и потенциал восстановления.
Электроотрицательность
Электроотрицательность - это свойство, которое описывает тенденцию атома притягивать к себе пару связанных электронов. Чем выше электроотрицательность, тем большую силу притяжения атом оказывает на окружающие его электроны.
В периодической таблице электроотрицательность увеличивается слева направо, поэтому щелочные металлы являются наименее электроотрицательными элементами.
Атомное радио
Это свойство измеряет количество атомов. Это типичное или среднее расстояние от центра атомного ядра до границы окружающего электронного облака.
Это свойство неточно - и, кроме того, в его определении участвуют несколько электромагнитных сил, - но известно, что это значение уменьшается слева направо в периодической таблице и увеличивается сверху вниз. Вот почему считается, что щелочные металлы, особенно цезий, имеют более высокий атомный радиус.
Энергия ионизации
Это свойство определяется как энергия, необходимая для удаления наименее связанного электрона из атома (валентного электрона) с образованием катиона.
Говорят, что чем ближе электроны к ядру окружающего атома, тем выше энергия ионизации атома.
Энергия ионизации увеличивается слева направо и снизу вверх в периодической таблице. Опять же, металлы (особенно щелочные) обладают меньшей энергией ионизации.
Потенциал снижения
Это мера тенденции химического вещества получать электроны и, следовательно, уменьшаться. Каждый вид обладает внутренним восстановительным потенциалом: чем выше потенциал, тем выше его сродство к электронам, а также его способность к снижению.
Восстанавливающие агенты - это вещества с самым низким потенциалом восстановления из-за их низкого сродства к электронам.
Более сильные восстановители
С учетом факторов, описанных выше, можно сделать вывод, что для поиска «сильного» восстановителя требуется атом или молекула с низкой электроотрицательностью, большим атомным радиусом и низкой энергией ионизации.
Как уже упоминалось, щелочные металлы обладают этими характеристиками и считаются сильнейшими восстановителями.
С другой стороны, литий (Li) считается самым сильным восстановителем, поскольку он имеет самый низкий восстановительный потенциал, в то время как молекула LiAlH4 он считается самым сильным восстановителем из всех, потому что он обладает этой и другими желаемыми характеристиками.
Примеры реакций с восстановителями
В повседневной жизни существует множество примеров уменьшения ржавчины. Некоторые из наиболее представительных подробно описаны ниже:
Пример 1
Реакция сгорания октана (основного компонента бензина):
Можно увидеть, как октан (восстановитель) отдает электроны кислороду (окислителю), образуя в больших количествах диоксид углерода и воду.
Пример 2
Гидролиз глюкозы - еще один полезный пример обычного восстановления:
C6ЧАС12ИЛИ6 + 2ADP + 2P + 2NAD + → 2 канала3КОКОС2H + 2ATP + 2NADH
В этой реакции молекулы НАД (рецептор электронов и окислитель в этой реакции) отбирают электроны у глюкозы (восстановителя).
Электрохимический ряд активности металлов
Электрохимический ряд активности (ряд напряжений, ряд стандартных электродных потенциалов) металлов — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ 0 , отвечающих полуреакции восстановления катиона металла Me n+ : Me n+ + nē → Me
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительные реакциях в водных растворах.
Содержание
История
Последовательность расположения металлов в порядке изменения их химической активности в общих чертах была известна уже алхимикам [1] . Процессы взаимного вытеснения металлов из растворов и их поверхностное осаждение (например, вытеснение серебра и меди из растворов их солей железом) рассматривались как проявление трансмутации элементов.
Поздние алхимики вплотную подошли к пониманию химической стороны взаимного осаждения металлов из их растворов. Так, Ангелус Сала в работе «Anatomia Vitrioli» (1613) пришёл к выводу, что продукты химических реакций состоят из тех же «компонентов», которые содержались в исходных веществах. Впоследствии Роберт Бойль предложил гипотезу о причинах, по которым один металл вытесняет другой из раствора на основе корпускулярных представлений [2] .
В 1793 году Алессандро Вольта, конструируя гальванический элемент («Вольтов столб»), установил относительную активность известных тогда металлов: Zn, Pb, Sn, Fe, Cu, Ag, Au. «Сила» гальванического элемента оказывалась тем больше, чем дальше стояли друг от друга металлы в этом ряду («ряд напряжений»). Однако Вольта не связал этот ряд с химическими свойствами металлов.
В 1798 году Иоганн Вильгельм Риттер указал, что ряд Вольта эквивалентен ряду окисления металлов (т. е. последовательности уменьшения их сродства с кислородом). Таким образом, Риттер высказал гипотезу о возникновении электрического тока вследствие протекания химической реакции [3] .
В эпоху становления классической химии способность элементов вытеснять друг друга из соединений стала важным аспектом понимания реакционной способности. Й. Берцелиус на основе электрохимической теории сродства построил классификацию элементов, разделив их на «металлоиды» (сейчас применяется термин «неметаллы») и «металлы» и поставив между ними водород.
Не отрицая значительных заслуг Бекетова в становлении современных представлений об ряде активности металлов, следует считать ошибочным бытующее в отечественной популярной и учебной литературе представление о нём как единственном создателе этого ряда. [5] [6] .
Многочисленные экспериментальные данные, полученные в конце XIX века, опровергали гипотезу Бекетова. Так, Уильям Одлинг описал множество случаев «обращения активности». Например, медь вытесняет олово из концентрированного подкисленного раствора SnCl2 и свинец — из кислого раствора PbCl2; она же способна к растворению в концентрированной соляной кислоте с выделением водорода. Медь, олово и свинец находятся в ряду правее кадмия, однако могут вытеснять его из кипящего слабо подкисленного раствора CdCl2.
Бурное развитие теоретической и экспериментальной физической химии указывало на иную причину различий химической активности металлов. С развитием современных представлений электрохимии (главным образом в работах Вальтера Нернста) стало ясно, что эта последовательность соответствует «ряду напряжений» – расположению металлов по значению стандартных электродных потенциалов. Таким образом, вместо качественной характеристики — «склонности» металла и его иона к тем или иным реакциям — Нерст ввёл точную количественную величину, характеризующую способность каждого металла переходить в раствор в виде ионов, а также восстанавливаться из ионов до металла на электроде, а соответствующий ряд получил название ряда стандартных электродных потенциалов.
Теоретические основы
Значения электрохимических потенциалов являются функцией многих переменных и поэтому обнаруживают сложную зависимость от положения металлов в периодической системе. Так, окислительный потенциал катионов растёт с увеличением энергии атомизации металла, с увеличением суммарного потенциала ионизации его атомов и с уменьшением энергии гидратации его катионов.
В самом общем виде ясно, что металлы, находящиеся в начале периодов характеризуются низкими значениями электрохимических потенциалов и занимают места в левой части ряда напряжений. При этом чередование (щелочных и щёлочноземельных металлов отражает явление диагонального сходства. Металлы, расположенные ближе к серединам периодов, характеризуются большими значениями потенциалов и занимают места в правой половине ряда. Последовательное увеличение электрохимического потенциала (от −3,395 В у пары Eu 2+ /Eu [источник не указан 228 дней] до +1,691 В у пары Au + /Au) отражает уменьшение восстановительной активности металлов (свойство отдавать электроны) и усиление окислительной способности их катионов (свойство присоединять электроны). Таким образом, самым сильным восстановителем является металлический европий, а самым сильным окислителем — катионы золота Au + .
В ряд напряжений традиционно включается водород, поскольку практическое измерение электрохимических потенциалов металлов производится с использованием стандартного водородного электрода.
Практическое использование ряда напряжений
Ряд напряжений используется на практике для сравнительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе:
Восстанавливающие агенты, какие, самые сильные, примеры
восстановитель представляет собой вещество, которое выполняет функцию восстановления окислителя в реакции восстановления оксида. Восстанавливающие агенты по своей природе являются донорами электронов, обычно это вещества с самым низким уровнем окисления и большим количеством электронов..
Существует химическая реакция, в которой степень окисления атомов изменяется. Эти реакции включают процесс восстановления и дополнительный процесс окисления. В этих реакциях один или несколько электронов молекулы, атома или иона переносятся в другую молекулу, атом или ион. Это включает производство реакции восстановления оксида.

Во время процесса восстановления оксида тот элемент или соединение, которое теряет (или жертвует) свой электрон (или электроны), называется восстановителем, в отличие от того окислителя, который является электронным рецептором. Затем говорят, что восстановители восстанавливают окислитель и что окислитель окисляет восстановитель.
Лучшими или сильными восстановителями являются те, которые имеют более высокий атомный радиус; то есть они имеют большее расстояние от своего ядра до электронов, которые окружают.
Восстановителями обычно являются металлы или отрицательные ионы. Обычные восстановители включают аскорбиновую кислоту, серу, водород, железо, литий, магний, марганец, калий, натрий, витамин С, цинк и даже экстракт моркови..
- 1 Какие восстановители??
- 2 Факторы, которые определяют прочность восстановителя
- 2.1 электроотрицательность
- 2.2 Атомное радио
- 2.3 Энергия ионизации
- 2.4 Сокращение потенциала
- 4.1 Пример 1
- 4.2 Пример 2
- 4.3 Пример 3
Какие восстановители??
Как уже упоминалось, восстановители ответственны за восстановление окислителя, когда происходит реакция восстановления оксида.
Простая и типичная реакция окисления-восстановления - это аэробное дыхание клеток:
В этом случае, где глюкоза (с6H12О6) реагирует с кислородом (ИЛИ2), глюкоза действует как восстановитель, высвобождая электроны в кислород, то есть окисляется, а кислород становится окислителем..
В органической химии лучшими восстановителями считаются те реагенты, которые обеспечивают водород (H2) к реакции. В этой области химии реакция восстановления относится к добавлению водорода в молекулу, хотя приведенное выше определение (реакции восстановления оксида) также применимо.
Факторы, определяющие прочность восстановителя
Ожидается, что для вещества, считающегося "сильным", это молекулы, атомы или ионы, которые более или менее легко отсоединяются от своих электронов..
Для этого существует ряд факторов, которые необходимо учитывать для определения силы, которую может иметь восстановитель: электроотрицательность, атомный радиус, энергия ионизации и восстановительный потенциал..
электроотрицательность
Электроотрицательность - это свойство, которое описывает тенденцию атома привлекать пару электронов, связанных с самим собой. Чем выше электроотрицательность, тем больше сила притяжения, оказываемая атомом на окружающие его электроны.
Атомное радио
Это свойство, которое измеряет количество атомов. Это относится к типичному или среднему расстоянию от центра атомного ядра до границы окружающего его электронного облака..
Это свойство не является точным - и, кроме того, в его определении участвуют несколько электромагнитных сил, но известно, что это значение уменьшается слева направо в периодической таблице и увеличивается сверху вниз. Вот почему щелочные металлы, особенно цезий, имеют более высокий атомный радиус..
Энергия ионизации
Говорят, что чем ближе электроны к ядру окружающего атома, тем больше энергия ионизации атома.
Энергия ионизации увеличивается слева направо и снизу вверх в периодической таблице. Опять же, металлы (особенно щелочные) имеют более низкую энергию ионизации.
Потенциал снижения
Это мера тенденции химического вида получать электроны и, следовательно, быть уменьшенным. Каждый вид обладает собственным потенциалом восстановления: чем больше потенциал, тем больше его сродство с электронами, а также их способность уменьшаться.
Восстанавливающие агенты - это вещества с меньшим восстановительным потенциалом из-за их низкого сродства с электронами..
Сильные восстановители
С помощью факторов, описанных выше, можно сделать вывод, что для поиска «сильного» восстановителя требуется атом или молекула с низкой электроотрицательностью, большим атомным радиусом и низкой энергией ионизации..
Как уже упоминалось, щелочные металлы имеют эти характеристики и считаются сильнейшими восстановителями.
С другой стороны, литий (Li) считается самым сильным восстановителем, поскольку он имеет самый низкий восстановительный потенциал, в то время как молекула LiAlH4 он считается самым сильным восстановителем из всех, для этого и других желаемых характеристик.
Есть много случаев уменьшения ржавчины в повседневной жизни. Вот некоторые из наиболее представительных:
Пример 1
Реакция горения октана (основного компонента бензина):
Можно наблюдать, как октан (восстановитель) отдает электроны кислороду (окислителю), образуя двуокись углерода и воду в больших количествах..
Пример 2
Гидролиз глюкозы является еще одним полезным примером общего восстановления:
В этой реакции молекулы NAD (электронный рецептор и окислитель в этой реакции) забирают электроны из глюкозы (восстановитель).
Ряд активности металлов
![Ряд активности металлов]()
Химия
Что же из себя представляет ряд активности металлов давайте разбираться. Металлы — группа химических элементов, обладающих сходными свойствами. Среди них — электропроводность, пластичность, температурная зависимость сопротивления. По виду металлы можно отличить по характерному блеску, который так и назвали — металлический. Но химические свойства элементов отличаются в зависимости от строения их молекул и кристаллической решетки. Особенно ярко отличия проявляются по отношению взаимодействия с кислотами и щелочами. Всего на данный момент насчитывается 96 металлов. Общие свойства металлов показаны в таблице:
![ряд реактивности металлов]()
Все металлы в той или иной степени являются восстановителями, то есть, отдают электроны при течении окислительно-восстановительных реакций. Таблица электроотрицательности металлов показывает, какой металл является наиболее активным восстановителем. Если цифра напротив элемента больше 2, то это окислитель с характерными свойствами и выходит из ряда металлов, проявляя типичные свойства неметалла.
![Таблица электроотрицательности металлов]()
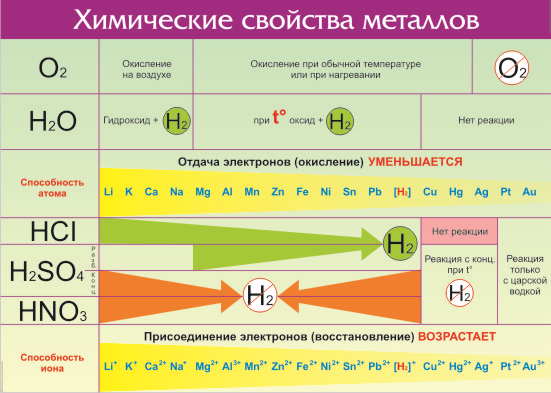
Электрохимический ряд активности металлов показывает, какие из металлов более активные, какие менее. Расположение элементов в горизонтальном ряду слева направо показывает направление снижения восстановительной способности и возрастание окислительной.
Восстановительная способность — свойство отдавать электроны в химических реакциях с водными растворами солей и щелочей.
Окислительная способность — свойство присоединять электроны в реакциях с теми же веществами.
![электрохимический ряд напряжений металлов]()
Металлы в правой стороне более слабые восстановители, они вытесняются при реакциях с солевыми растворами металлами, расположенными левее. Пример реакции — Zn + Cu 2+ → Zn 2+ + Cu, которая протекает только в одном направлении. Цинк вытесняет медь, реагируя с водным раствором любой соли меди. Цинковая пластинка, при этом, растворяется, а медная восстанавливается.
Такую последовательность элементов еще называют ряд напряженности металлов, или ряд Бекетова. На всех вариантах записи ряда можно заметить, что последовательность металлов разделена знаком водорода (гидрогена), который металлом никак не является. Это своеобразный маркер, показывающий, что стоящие левее металлы вытесняют водород из водных растворов кислот, не обладающих окислительными свойствами. Некоторые металлы, например, литий, кальций, барий и остальные, стоящи до алюминия, вытесняют водород и при реакции с водой.
2Al +3H2SO4 = Al2(SO4)3 + 3H2↑
Fe + 2HCl = FeCl2 + H2↑
Стоящие правее знака водорода металлы с кислотами-неокислителями не взаимодействуют при нормальных условиях.
Шкала активности металлов широко используется для практических целей, например, в гальванике. Если электроды сделаны из разных металлов, то разрушаться будет тот, который стоит левее. Чем больше промежуток между металлами в ряду, тем активнее проходит процесс коррозии.
Например, метод оцинковки позволяет защитить железо именно потому, что цинк находится левее железа в ряду активности. Пока он не разрушится, то ржавчина на железе не появится. При электролизе, расположенные за водородом металлы осаживаются на катоде, а самые активные, занимающее места до алюминия, выделить из солевых растворов в не получится при нормальных температуре и давлении.
Малоактивные металлы, так называемые переходные элементы с электроотрицательностью в пределах 1,5 – 2. Это:
- Ртуть;
- Олово;
- Серебро;
- Никель;
- Рений;
- Медь;
- Марганец и еще несколько элементов.
К металлам средней активности относятся элементы с числом электроотрицательности от 1 до 1,5. В эту группу входят такие известные элементы, как магний, плутоний, неодим, кальций. Остальные элементы обладают высокой химической активностью. Лидирует в этом списке Франций, который практически не встречается в чистом виде. Из более известных можно назвать калий и натрий, которые приходится хранить в керосине, чтобы они не взаимодействовали с водой и воздухом. Если извлечь их из керосина, то металлы практически мгновенно сгорают.
Реакции кальция и натрия с водой при комнатной температуре выглядят так:
2Na + 2H2O = 2NaOH + H2↑
Сa + 2H2O = Сa(OH)2 + H2↑Стоящие в ряду электронапряжения металлов правее элементы тоже взаимодействуют с водой, но реакция протекает при более высокой температуре с образованием оксида и водорода.
3Fe + 4H2O = Fe3O4 + 4H2↑
Если вступает в реакцию металл и неметалл, то электрический ряд напряжений металлов тоже дает возможность заранее узнать, в каком направлении будет протекать реакция. Скорость реакции зависит как от восстановительной активности металла, так и от окислительных свойств неметалла. Стоящие до водорода металлы реагируют с кислородом уже при комнатной температуре, некоторые — достаточно бурно, например, литий и кальций.
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO.
При таком взаимодействии образуются оксиды. Менее активные металлы, например железо, реагируют с кислородом спокойнее, а некоторые, например, золото и серебро, платина не окисляются вовсе, благодаря чему получили определение благородных.
С хлором реагируют практически все активные металлы с выделением теплоты.
2Fe + 3Cl2 = 2FeCl3
Также выделяется теплота при реакции активных металлов с серой, но начинается она при нагревании. После начала реакции нагрев не нужен — образовавшегося тепла достаточно для поддержания реакции.
2Al + 3S = Al2S3
Внимательно изучив ряд металлов, несложно определить тип реакции при контакте с другими элементами в зависимости от места в последовательности. Также легко назвать основные характеристики металла, как химического элемента, и возможность его использования на практике.
Химические свойства металлов
![Химические свойства металлов]()
Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
20 декабря 2021
· Обновлено 20 декабря 2021
Ждём вас 8 октября в 13:00. Вместе с педагогами, психологами и другими экспертами в образовании и воспитании ответим на главные вопросы мам и пап.
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
![Схема взаимодействия металлов с сернистой кислотой]()
![Схема взаимодействия металлов с азотной кислотой]()
Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
![Практикующий детский психолог Екатерина Мурашова]()
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Читайте также: