Сао металл или нет
Обновлено: 08.05.2024
оксид кальция (CaO) является неорганическим соединением, которое содержит кальций и кислород в ионных формах (не путать с пероксидом кальция, CaO2). Это известно во всем мире как известь, слово, которое обозначает любое неорганическое соединение, которое содержит карбонаты, оксиды и гидроксиды кальция, а также другие металлы, такие как кремний, алюминий и железо..
Этот оксид (или известь) также в разговорной речи называют негашеной или гашеной известью, в зависимости от того, гидратирована она или нет. Известь является оксидом кальция, а гашеная известь - его гидроксидом. В свою очередь, известняк (известняк или затвердевшая известь) на самом деле является осадочной породой, состоящей в основном из карбоната кальция (CaCO3).
Это один из крупнейших природных источников кальция и является сырьем для производства оксида кальция. Как получается этот оксид? Карбонаты подвержены термическому разложению; нагревание карбонатов кальция при температуре выше 825 ° С, что приводит к образованию извести и углекислого газа.
Вышеприведенное утверждение можно описать следующим образом: CaCO3(s) → CaO (s) + CO2(G). Поскольку земная кора богата известняком и кальцитом, а в океанах и на пляжах имеются многочисленные морские раковины (сырье для производства оксида кальция), оксид кальция является относительно дешевым реагентом.
- 1 Формула
- 2 Структура
- 3 свойства
- 3.1 Растворимость
- 4.1 В качестве раствора
- 4.2 При производстве очков
- 4.3 В майнинге
- 4.4 Как средство для удаления силикатов
формула
Химическая формула оксида кальция - СаО, в котором кальций подобен кислотному иону (акцептору электронов) Са 2+ , и кислород в качестве основного иона (донора электронов) ИЛИ 2-- .
Почему кальций имеет +2 заряда? Потому что кальций принадлежит к группе 2 периодической таблицы (г-н Бекамбара) и имеет только два валентных электрона, доступных для образования связей, которые уступают атому кислорода.
структура
![]()
На верхнем изображении представлена кристаллическая структура (типа драгоценной соли) для оксида кальция. Объемные красные сферы соответствуют ионам Ca 2+ и белые сферы с ионами O 2- .
В этом кубическом кристаллическом расположении каждый ион Са 2+ окружен шестью ионами O 2- , закупорены в октаэдрических отверстиях, оставленных между ними большими ионами.
Эта структура максимально выражает ионный характер этого оксида, хотя заметное различие радиусов (красная сфера больше, чем белая) придает более слабую кристаллическую ретикулярную энергию по сравнению с MgO.
свойства
Физически это кристаллическое белое твердое вещество без запаха и с сильными электростатическими взаимодействиями, которые ответственны за его высокие температуры плавления (2572 ° C) и кипения (2850 ° C). Кроме того, он имеет молекулярную массу 55,958 г / моль и интересную способность быть термолюминесцентным.
Это означает, что кусок оксида кальция, подверженный воздействию пламени, может сиять интенсивным белым светом, известным на английском языке под названием центр внимания, или по-испански, легкий кальций. Ионы Са 2+ , при соприкосновении с огнем они вызывают красноватое пламя, как показано на следующем изображении.
растворимость
CaO является основным оксидом, который обладает сильным сродством к воде в той степени, в которой он поглощает влагу (это гигроскопичное твердое вещество), и немедленно реагирует с образованием гашеной извести или гидроксида кальция:
Эта реакция является экзотермической (выделяет тепло) из-за образования твердого тела с более сильными взаимодействиями и более стабильной кристаллической решеткой. Тем не менее, реакция является обратимой, если Ca (OH) нагревается2, обезвоживание и освещение гашеной извести; затем лайм "возрождается".
Полученный раствор является очень основным, и если он насыщен оксидом кальция, он достигает рН 12,8.
Кроме того, он растворим в глицерине и в растворах кислоты и сахара. Поскольку это основной оксид, он, естественно, имеет эффективные взаимодействия с кислотными оксидами (SiO2, в2О3 и вера2О3, например) растворим в их жидких фазах. С другой стороны, он нерастворим в спиртах и органических растворителях.
приложений
CaO широко используется в промышленности, а также для синтеза ацетилена (CH≡CH), для извлечения фосфатов из сточных вод и в реакции с диоксидом серы из газообразных отходов..
Другие применения оксида кальция описаны ниже:
Как ступка
Если оксид кальция смешан с песком (SiO2) и вода спекается с песком и медленно реагирует с водой с образованием гашеной извести. В свою очередь, СО2 воздуха растворяется в воде и вступает в реакцию с солью с образованием карбоната кальция:
CaCO3 Это более стойкое и более твердое соединение, чем CaO, в результате чего раствор (предыдущая смесь) затвердевает и фиксирует кирпичи, блоки или керамику между ними или на желаемой поверхности..
В производстве очков
Основным сырьем для производства стекол являются оксиды кремния, которые смешивают с известью, карбонатом натрия (Na2Колорадо3) и другие добавки, которые затем подвергают нагреванию, в результате чего получается стеклообразное твердое вещество. Это твердое вещество впоследствии нагревается и выдувается в любых фигурах.
В горном деле
Гашеная известь занимает больший объем, чем негашеная, благодаря взаимодействиям водородных связей (О-Н-О). Это свойство используется, чтобы разбить камни изнутри.
Это достигается путем наполнения их компактной смесью извести и воды, которая герметизирована, чтобы сосредоточить ее тепло и экспансивную силу в породе..
Как средство для удаления силикатов
CaO сплавляется с силикатами с образованием коалесцирующей жидкости, которая затем извлекается из сырья определенного продукта..
Например, железные руды являются сырьем для производства металлического железа и стали. Эти минералы содержат силикаты, которые являются нежелательными примесями для процесса и устраняются только что описанным способом..
Наночастицы оксида кальция
Оксид кальция можно синтезировать в виде наночастиц, варьируя концентрации нитрата кальция (Са (NO3)2) и гидроксид натрия (NaOH) в растворе.
Эти частицы являются сферическими, основными (а также твердыми на макроуровне) и имеют большую площадь поверхности. Следовательно, эти свойства выгодны каталитическим процессам. Что? В настоящее время следствие отвечает на этот вопрос.
Эти наночастицы были использованы для синтеза замещенных органических соединений, полученных из пиридинов, при разработке новых лекарств для проведения химических превращений, таких как искусственный фотосинтез, для очистки воды от тяжелых и вредных металлов, а также для фотокаталитические агенты.
Наночастицы могут быть синтезированы на биологической подложке, такой как листья папайи и зеленый чай, для использования в качестве антибактериального средства..
Основные оксиды, перечень, список, физические и химические свойства
![Основные оксиды]()
Основные оксиды, перечень, список, физические и химические свойства.
![]()
![]()
Основные оксиды – солеобразующие оксиды металлов, которым соответствуют основания. Как правило, металлы в них проявляют степень окисления +1 или +2.
Основные оксиды:
В свою очередь оксидами называют неорганические химические соединения, состоящие из двух химических элементов, одним из которых является кислород. Кислород в оксидах проявляет степень окисления -2. Все оксиды делятся на солеобразующие и несолеобразующие.
К солеобразующим оксидам помимо основных оксидов также относят кислотные и амфмотерные оксиды. Соответственно кислотным оксидам соответствуют кислоты, амфотерным оксидам – амфотерные основания.
К основным оксидам относятся оксиды щелочных и щёлочноземельных металлов, а также оксиды переходных металлов в низших степенях окисления.
Какие оксиды основные? Список, примеры и перечень основных оксидов:
Название оксида: Химическая формула: Оксид бария BaO Оксид калия K2O Оксид кальция CaO Оксид лития Li2 O Оксид магния MgO Оксид меди II CuO Оксид натрия Na2O Оксид ртути II HgO Физические свойства основных оксидов:
Общим физическим свойством для всех основных оксидов является то, что они представляют собой твердые вещества. В то время как другие: внешний вид, цвет, плотность, температуры плавления и кипения, молярная масса, твердость и пр. различаются.
Название оксида: Химическая формула: Внешний вид: Оксид бария BaO бесцветные кристаллы Оксид калия K2O твердое бесцветное или бледно-желтое вещество Оксид кальция CaO белое кристаллическое вещество Оксид лития Li2 O бесцветные кристаллы Оксид магния MgO твердое белое вещество Оксид меди II CuO твердое черное вещество Оксид натрия Na2O бесцветные кристаллы Оксид ртути II HgO твердое вещество красного или желто-оранжевого цвета Получение основных оксидов:
Основные оксиды получаются в результате:
- 1. окисления металлов кислородом (кроме благородных):
2Сa + О2 → 2CaО (t = 300 o C);
- 2. термического разложения гидроксидов:
Ba(OH)2 → BaO + H2О (t = 780-800 o C);
Сa(OH)2 → СaO + H2О (t = 520-580 o C);
- 3. термического разложения солей:
BaCO3 → BaO + CO2 (t = 1000-1450 o C);
MgCO3 → MgО + СО2 (t > 650 o C);
Химические свойства основных оксидов. Химические реакции основных оксидов:
Для основных оксидов характерны следующие общие химические реакции:
1. взаимодействие с водой.
В реакцию с водой вступают не все основные оксиды, а только оксиды наиболее активных металлов, которые расположены в главных подгруппах первой и второй групп периодической таблицы химических элементов Д.И. Менделеева (натрий, калий, кальций, барий и др.).
В результате взаимодействия основных оксидов с водой образуются основания.
MgО + Н2О → Mg(ОН)2 (t = 100-125 o C);
2. взаимодействие с кислотными оксидами.
В результате химической реакции основных оксидов с кислотными оксидам образуется соль.
CaО + SiО2 → CaSiО3 (t = 1100-1200 o C);
MgО + SiО2 → MgSiО3 (t = 1100-1200 o C);
3. взаимодействие с кислотами.
В результате химической реакции основных оксидов с кислотами образуется соль и вода.
Аналогично проходят реакции основных оксидов и с другими кислотами.
4. взаимодействие с амфотерными оксидами.
В результате химической реакции основных оксидов с амфотерными оксидам образуется соль.
BaO + ZnO → BaZnO2 (t = 1100 o C);
BaO + SnO → BaSnO2 (t = 1000 o C);
5. восстановление до простых веществ:
BaO + Be → Ba + BeO (t = 270 o C);
3BaO + 2Al → 3Ba + Al2O3 (t = 1200 o C);
2Al + 4BaO → Ba(AlO2)2 + 3Ba (t = 1100-1200 o C);
2Al + 4BaO → BaAl2O4 + 3Ba (t = 1100-1200 o C);
3BaO + Si → 2Ba + BaSiO3 (t = 1200 o C);
4CaО + 2Al → 2Ca + Ca(AlO2)2 (t = 1200 o C);
Li2O + Mg → 2Li + MgO (t > 800 o C);
2Li2O + Si → 4Li + SiO2 (t = 1000 o C);
2MgО + Si → 2Mg + SiО2;
MgО + 2K → Mg + K2О;
MgО + Са → Mg + СаО (t = 1300 o C);
CuО + H2 → Cu + H2О (t = 300 o C);
CuО + С → Cu + СО (t = 1200 o C);
3CuО + 2Al → 3Cu + Al2О3 (t = 1000-1100 o C).
6. взаимодействие с галогеноводородами (бромоводородом, йодоводородом и пр.).
В результате химической реакции основных оксидов с галогеноводородами образуется соль и вода.
Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (107 240)
- Экономика Второй индустриализации России (103 688)
- Этилен (этен), получение, свойства, химические реакции (30 343)
- Программа искусственного интеллекта ЭЛИС (30 335)
- Метан, получение, свойства, химические реакции (27 148)
- Крахмал, свойства, получение и применение (26 881)
- Природный газ, свойства, химический состав, добыча и применение (25 805)
- Целлюлоза, свойства, получение и применение (25 506)
- Пропилен (пропен), получение, свойства, химические реакции (24 242)
- Прямоугольный треугольник, свойства, признаки и формулы (24 179)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Оксид кальция, характеристика, свойства и получение, химические реакции
![Оксид кальция]()
Оксид кальция, характеристика, свойства и получение, химические реакции.
Оксид кальция – неорганическое вещество, имеет химическую формулу CaO.
Краткая характеристика оксида кальция:
Оксид кальция – неорганическое вещество, порошок от белого до бледно-жёлтого цвета либо бесцветные кристаллы. Не имет запаха.
Так как валентность кальция равна двум, то оксид кальция содержит один атом кислорода и один атом кальция.
Химическая формула оксида кальция CaO.
Оксид кальция широко известен как негашёная известь .
Оксид кальция в воде не растворяется, а вступает в реакцию с ней. Практически не растворяется в этаноле. Не растворяется в диэтиловом эфире.
Оксид кальция относится к высокотоксическим веществам. Класс опасности 2. Это едкое вещество, особенно опасен при смешивании с водой .
Препарат в виде пыли и капель взвеси раздражает слизистые оболочки органов дыхания, попадая на кожу, вызывает тяжелые ожоги, особенно сильно действует на слизистую оболочку глаз.
Предельно допустимая концентрация в воздухе рабочей зоны производственных помещений – 3 мг/м 3 .
При работе с препаратом следует применять индивидуальные средства защиты (респираторы, защитные очки, резиновые перчатки), а также соблюдать меры личной гигиены. Не допускать попадания препарата на слизистые оболочки и на кожу.
Помещения, в которых проводятся работы с препаратом, должны быть оборудованы общей приточно-вытяжной вентиляцией, а места наибольшего пыления – укрытиями с местной вытяжной вентиляцией. Испытания препарата в лабораториях следует проводить в вытяжном шкафу.
При проведении анализа окиси кальция с использованием горючего газа следует соблюдать меры противопожарной безопасности.
См. ГОСТ 8677-76 Реактивы. Кальция оксид. Технические условия (с Изменением N 1).
Физические свойства оксида кальция:
Наименование параметра: Значение: Химическая формула CaO Синонимы и названия иностранном языке calcium oxide (англ.)
известь негашеная (рус.)
кальция окись (рус.)Тип вещества неорганическое Внешний вид порошок от белого до бледно-жёлтого цвета либо бесцветные кристаллы, без запаха Цвет бесцветный, от белого до бледно-жёлтого Вкус —* Запах не имеет Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) твердое вещество Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м 3 3370 Плотность (состояние вещества – твердое вещество, при 20 °C), г/см 3 3,37 Температура кипения, °C 2850 Температура плавления, °C 2570 Температура возгонки (сублимации), °C не имеет Температура разложения, °C не имеет Молярная масса, г/моль 56,0774 Получение оксида кальция:
Оксид кальция получается в результате следующих химических реакций:
- 1. путем термического разложения известняка:
Это промышленный способ получения оксида кальция. Технологически данный процесс в промышленности реализуют в специальных шахтных печах .
- 2. путем сжигания кальция на воздухе:
2Сa + О2 → 2CaО (t = 300 o C).
- 3. путем термического разложения гидроксида кальция:
Сa(OH)2 → СaO + H2О (t = 520-580 o C).
- 4. путем термического разложения нитрата кальция:
Химические свойства оксида кальция. Химические реакции оксида кальция:
Оксид кальция относится к основным оксидам.
Химические свойства оксида кальция аналогичны свойствам основных оксидов других металлов . Поэтому для него характерны следующие химические реакции:
1. реакция оксида кальция с хлором:
В результате реакции образуется хлорид кальция и кислород.
2. реакция оксида кальция с кремнием:
2CaO + 5Si → 2CaSi2 + SiO2 (t = 1300 o C).
В результате реакции образуется силицид кальция и оксид кремния .
3. реакция оксида кальция с углеродом:
CaО + 3С → CaС2 + СО (t = 1900-1950 o C);
2CaO + 5C → 2CaC2 + CO2 (t = 700 o C).
В результате реакции образуется карбид кальция и оксид углерода .
4. реакция оксида кальция с алюминием :
В результате реакции образуется кальций и соответственно алюминат кальция, оксид алюминия-кальция и алюмината трикальция.
5. реакция оксида кальция с водой:
Оксид кальция реагирует с водой , образуя гидроксид кальция. Процесс имеет название «гашение извести». Химическая реакция происходит с выделением энергии (тепла).
6. реакция оксида кальция с оксидом углерода (углекислым газом):
Оксид кальция реагирует с углекислым газом (являющийся кислотным оксидом), образуя соль – карбонат кальция.
7. реакция оксида кальция с оксидом серы :
Оксид серы также является кислотным оксидом. В результате реакции образуется соответственно соль – в первом случае – сульфит кальция, во втором случае – сульфат кальция.
8. реакция оксида кальция с оксидом кремния:
CaО + SiО2 → CaSiО3 (t = 1100-1200 o C).
Оксид кремния также является кислотным оксидом. В результате реакции образуется соль – силикат кальция.
9. реакция оксида кальция с оксидом фосфора :
Оксид фосфора также является кислотным оксидом. В результате реакции образуется соль соответственно: метафосфат кальция, фосфат кальция и дифосфата кальция.
Аналогично проходят реакции оксида кальция и с другими кислотными оксидами.
10. реакция оксида кальция с оксидом алюминия :
Оксид алюминия является амфотерным оксидом. Это значит, что как амфотерный оксид оксид алюминия проявляет свойства как кислотных, так и основных соединений. В результате реакции образуется соль – алюминат кальция.
11. реакция оксида кальция с оксидом марганца :
Оксид алюминия является амфотерным оксидом. Это значит, что как амфотерный оксид оксид алюминия проявляет свойства как кислотных, так и основных соединений. В результате реакции образуется соответственно: соль – манганит кальция либо оксид марганца-кальция.
Аналогично проходят реакции оксида кальция и с другими амфотерными оксидами.
12. реакция оксида кальция с оксидом свинца :
В результате реакции образуется соль – плюмбит кальция. Реакция протекает при сплавлении реакционной смеси.
Аналогично проходят реакции оксида кальция и с другими оксидами.
13. реакция оксида кальция с тетраоксидом диазота:
Реакция идет в жидком тетраоксиде диазота. В результате реакции образуются оксид азота (III) и соль – нитрат кальция.
14. реакция оксида кальция с плавиковой кислотой:
В результате химической реакции получается соль – фторид кальция и вода.
15. реакция оксида кальция с азотной кислотой:
В результате химической реакции получается соль – нитрат кальция и вода .
Аналогично проходят реакции оксида кальция и с другими кислотами.
16. реакция оксида кальция с бромистым водородом (бромоводородом):
В результате химической реакции получается соль – бромид кальция и вода .
17. реакция оксида кальция с йодоводородом:
В результате химической реакции получается соль – йодид кальция и вода .
Применение и использование оксида кальция:
Оксид кальция используется в производстве строительных материалов, в качестве пищевой добавки E-529.
оксид кальция реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида кальция
реакции с оксидом кальцияКАЛЬЦИЯ ОКСИД
СаО, бесцв. кристаллы с кубич. решеткой ( а =0,4812 нм, z = 4, пространств. группа Fm3m); т. пл. 2627 °С, т. кип. 2850 °С; плотн. 3,37 г/см 3 ; С° з 42,05 Дж/(моль. К); DH 0 обр -635,09 кДж/моль, DH 0 пл 52 кДж/моль; S 0 298 38,10 Дж/(моль. К). Техн. продукт наз. негашеной известью. Энергично взаимод. с водой, образуя гидроксид Са (ОН) 2 (техн. продукт -гашеная известь, пушонка), метанолом (при 80 °С) и глицерином (при 100°С). При нагр. реагирует с SiO 2 , Al 2 O 3 , Fe 2 O 3 и др. оксидами. С к-тами образует соли. Восстанавливается до металла натрием, К, Mg, Al и др. при высокой т-ре. С Сl 2 и Вr 2 образует соотв. СаСl 2 и СаВr 2 . При нагр. реагирует также с S, Р, С и др. элементами. К. о. получают обжигом известняка при 900-1000 °С, особо чистый - разложением Ca(NO 3 ) 2 . Применяют для получения вяжущих материалов, хлорной извести, соды, гидроксида, карбида и др. соед. Са; в качестве флюса в металлургии; как катализатор в орг. синтезе. Гидроксид Са(ОН) 2 - бесцв. кристаллы с гексагон. решеткой ( а = 0,35853 нм, с =0,4895 нм, z= 1, пространств. группа Известь. Лит.: Рипан Р., Четяну И., Неорганическая химия, пер. с рум., т. 1, М., 1971. с. 202-05. В. П. Данилов.
Химическая энциклопедия. — М.: Советская энциклопедия . Под ред. И. Л. Кнунянца . 1988 .
Полезное
Смотреть что такое "КАЛЬЦИЯ ОКСИД" в других словарях:
Кальция оксид — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
КАЛЬЦИЯ ОКСИД — СаО, бесцветные кристаллы. Технический продукт (известь негашеная) порошкообразный. Энергично реагирует с водой с выделением большого количества тепла (процесс гашения): СаО + Н2О = Са(ОН)2. Применяют в строительстве, в химической промышленности … Большой Энциклопедический словарь
кальция оксид — CaO, бесцветные кристаллы. Технический продукт (известь негашёная) порошкообразный. Энергично реагирует с водой с выделением большого количества тепла (процесс гашения): СаО+Н2О=Ca(ОН)2. Применяют в строительстве, в химической промышленности,… … Энциклопедический словарь
кальция оксид — kalcio oksidas statusas T sritis chemija formulė CaO atitikmenys: angl. burnt lime; calcium oxide; calx; caustic lime; lime; quicklime rus. жженая известь; кальция оксид; негашеная известь; обожженная известь ryšiai: sinonimas – degtos kalkės… … Chemijos terminų aiškinamasis žodynas
КАЛЬЦИЯ ОКСИД — СаО, бесцв. кристаллы. Техн. продукт (известь негашёная) порошкообразный. Энергично реагирует с водой с выделением большого кол ва теплоты (процесс гашения): СаО+ Н2О = Са(ОН)2. Применяют в стр ве, в хим. пром сти, металлургии, с. х ве, при… … Естествознание. Энциклопедический словарь
Оксид кальция — Общие … Википедия
Оксид кальция(II) — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
Оксид кальция (II) — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
Кальция окись — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
КАЛЬЦИЯ ГИДРОКСИД — см. Кальция оксид, Известь … Химическая энциклопедия
Оксид кальция
![]()
Негашёная известь – это оксид кальция. Его получают в лабораториях и промышленным путём из природных материалов. Вещество активно используется в строительстве и промышленности.
Физические свойства
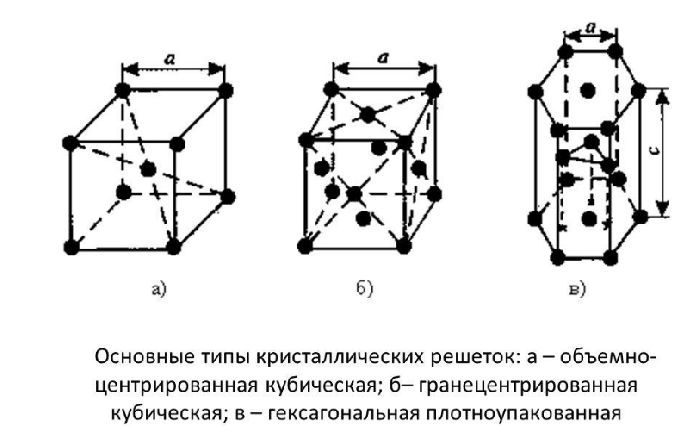
Оксид кальция – неорганическое кристаллическое вещество в виде белого или серо-белого порошка без запаха и вкуса. Твёрдое вещество кристаллизуется в кубические гранецентрированные кристаллические решётки по типу хлорида натрия (NaCl).
![Кубические гранецентрированные кристаллические решётки]()
Рис. 1. Кубические гранецентрированные кристаллические решётки.
Общее описание вещества представлено в таблице.
Признак
Значение
Формула соединения оксид кальция
В глицерине. В этаноле не растворяется, с водой образует гидроксид
Химическая связь в кристалле
Оксид кальция – едкое вещество, относящееся ко второму классу опасности. Агрессивные свойства проявляет при взаимодействии с водой, образуя гашёную известь.
![Порошок оксида кальция]()
Рис. 2. Порошок оксида кальция.
Получение
Оксид кальция также называют жжёной известью из-за способа получения. Получают негашёную известь путём нагревания и разложения известняка – карбоната кальция (CaCO3).
Реакция получения оксида кальция из известняка выглядит следующим образом:
Кроме того, негашёную известь можно получить двумя способами:
- из простых веществ, наращивая оксидный слой на металле –
Реакции протекают при высоких температурах. Температура сожжения известняка – 900-1200°C. При 200-300°C на поверхности металла начинает образовываться оксид. Для разложения солей и гидроксида необходима температура в 500-600°C.
Химические свойства
Оксид кальция является высшим оксидом и максимально проявляет окислительные свойства. Соединения взаимодействует с неорганическими веществами и свободными галогенами. Основные химические свойства оксида приведены в таблице.
Реакции
Что образуется
Молекулярное уравнение
Образуется гидроксид (гашёная известь). Реакция протекает бурно с выделением тепла
Растворяется, образуя соли
С оксидами неметаллов (кислотными остатками)
С углеродом при нагревании
Образуется карбид кальция
CaO + 3С → СаС2 + CO
Восстанавливает кальций. Образуется оксид алюминия
Применение
Оксид используется в пищевой промышленности в качестве:
- улучшителя муки и хлеба;
- пищевой добавки Е529;
- регулятора кислотности;
- питательной среды для дрожжей;
- катализатора гидрогенизации (присоединения водорода) жиров.
Кроме того, негашёная известь применяется в химической и строительной промышленности для производства различных веществ:
Что мы узнали?
Читайте также: